低分子质量壳寡糖对蛋鸡生产性能、蛋品质、血清生化指标、盲肠微生物数量及脾脏白细胞介素-2、肿瘤坏死因子-α基因表达的影响
孟 晓 王纪亭* 万文菊 王红卫 刘含亮 孙敏敏(.山东农业大学动物科技学院,泰安7000;.泰山医学院,泰安7000)
低分子质量壳寡糖对蛋鸡生产性能、蛋品质、血清生化指标、盲肠微生物数量及脾脏白细胞介素-2、肿瘤坏死因子-α基因表达的影响
孟 晓1王纪亭1*万文菊2王红卫1刘含亮1孙敏敏1
(1.山东农业大学动物科技学院,泰安271000;2.泰山医学院,泰安271000)
本试验旨在研究饲粮中添加不同水平的低分子质量(1 000 u)壳寡糖对蛋鸡生产性能、蛋品质、血清生化指标、盲肠微生物数量以及脾脏白细胞介素-2(IL-2)和肿瘤坏死因子-α(TNF-α)基因表达的影响。选取体重和产蛋率相近的58周龄海兰褐壳蛋鸡600只,随机分为4组,每组5个重复,每个重复30只。对照组饲喂基础饲粮,试验组分别饲喂在基础饲粮中添加300、600、900 mg/kg壳寡糖的试验饲粮。预试期为7 d,正试期为42 d。结果表明:1)添加300、600和900 mg/kg壳寡糖组的产蛋率分别比对照组提高了4.52%(P<0.05)、2.99%(P>0.05)和4.08%(P>0.05)。2)试验第3、6周末,添加600和900 mg/kg壳寡糖组的鸡蛋哈夫单位分别比对照组提高了6.87%、6.69%和6.47%、6.60%(P<0.05)。3)与对照组相比,饲粮添加600、900 mg/kg壳寡糖显著降低了血清葡萄糖、胆固醇含量和谷草转氨酶活性(P<0.05)。4)与对照组相比,饲粮添加600、900 mg/kg壳寡糖显著提高了盲肠双歧杆菌和乳酸杆菌的数量(P<0.05),显著降低了盲肠金黄色葡萄球菌的数量(P<0.05)。5)与对照组相比,饲粮添加300、600 mg/kg壳寡糖显著提高了脾脏IL-2 mRNA表达水平(P<0.05),饲粮添加600 mg/kg壳寡糖显著提高了脾脏TNF-α mRNA表达水平(P<0.05)。由此可见,饲粮中添加不同水平的壳寡糖,提高了蛋鸡的产蛋率和哈夫单位,调节了肠道微生物菌群,增强了蛋鸡的免疫力,适宜壳寡糖添加水平为600 mg/kg。
蛋鸡;壳寡糖;生产性能;肠道微生物菌群;白细胞介素-2;肿瘤坏死因子-α
全球日益增长的抗生素使用禁令和有效疫苗的缺乏迫使动物生产商寻求安全的疾病管理措施。益生菌、益生元、合生元、植物提取物、酸化剂、免疫增强剂等,已经在一定程度上得到了广泛应用[1]。因此,作为益生元的各种寡糖正在被添加到畜禽饲粮中,用以提高动物的健康、生产性能和免疫力,调节动物肠道菌群[2]。某些寡糖被认为是益生元的复合物,这些寡糖在消化道前段未被水解,而是顺利进入后肠并改变了结肠的菌群结构[3]。壳寡糖是壳聚糖或几丁质经过酶解或水解的降解产物。壳聚糖及其衍生物已显示出不同的功能特性,使得它们可以在食品[4]、农业[5]和环境保护[6]等领域中进行使用。聚合度小于20和平均分子质量小于3 900 u的壳聚糖称为壳寡糖[7]。不像壳聚糖,壳寡糖由于其短链的长度和游离的D-氨基葡萄糖单位的缘故,而使得其易溶于水[8]。壳寡糖由于其在中性pH下的低黏度和较高的溶解度,吸引了许多研究人员的兴趣。
最近的研究关注于壳寡糖的健康益处,壳寡糖具有多种有益的生物学效应包括降低血液胆固醇水平、降血压、抗感染、控制关节炎、促进钙的吸收以及提高抗肿瘤活性。Pangestuti等[9]研究发现,分子质量小于1 000 u的壳寡糖表现出了强有力的抗炎活性,在脂多糖(LPS)诱导BV2小胶质细胞的丝裂原活化蛋白激酶(MAPK)信号通路中,壳寡糖导致了促炎介质的衰减。Mei等[10]研究发现,给小鼠注射壳寡糖后,可以有效抵抗由环磷酰胺引起的免疫抑制,可以有效提高动物全身的免疫反应以及调节免疫细胞的功能。Li等[11]研究发现,壳寡糖可以有效调节肉鸡的盲肠微生物菌群,并且提高机体免疫功能。Rozeboom等[12]研究发现,饲粮添加壳寡糖提高了猪的养分消化率。但是,有关壳寡糖在蛋鸡上的应用研究还很有限,关于低分子质量壳寡糖在蛋鸡上的研究更为有限。Yan等[13]研究报道,蛋鸡饲粮中添加壳寡糖,提高了鸡蛋产量、鸡蛋的质量以及蛋鸡的免疫力。因此,本研究在前期的不同分子质量壳寡糖对蛋鸡的应用研究基础上,又选择低分子质量(1 000 u)壳寡糖,研究其对蛋鸡生产性能、蛋品质、血清生化指标、盲肠微生物数量以及脾脏白细胞介素-2(IL-2)和肿瘤坏死因子-α(TNF-α)基因表达的影响。
1 材料与方法
1.1 壳寡糖
试验用壳寡糖是从虾蟹壳中提取获得的,从某公司购得,其脱乙酰度大于90%,分子质量为1 000 u,水溶性为99%。
1.2 试验设计和饲粮
试验选取体重相近、生产性能良好的58周龄海兰褐壳蛋鸡600只,随机分为4组,每组5个重复,每个重复10个笼子,每个笼子饲养3只蛋鸡。每个重复分别置于立体笼的上、下层进行饲养,以消除由于蛋鸡所在笼层不同而造成的影响。试验蛋鸡饲养于密闭蛋鸡舍,保持每日16 h的恒定光照,保证通风和室温20~23 ℃。对照组饲喂基础饲粮,试验组饲喂在基础饲粮中分别添加300、600、900 mg/kg壳寡糖的饲粮。基础饲粮组成及营养水平见表1。各组饲粮均以粉料形式饲喂。所有饲养笼子都配备了乳头饮水器和料槽,试验期饲养管理按常规进行,实行自由采食和饮水。预试期为7 d,正试期为42 d。

表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供 The premix provided the following per kg of the diet:VA 7 000 IU,VD32 500 IU,VE 30 mg,VK3l mg,VB11.5 mg,VB24 mg,VB62 mg,VB120.02 mg,烟酸 niacin 30 mg,叶酸 folic acid 0.55 mg,泛酸 pantothenic acid 10 mg,生物素 biotin 0.16 mg,氯化胆碱 chloride choline 400 mg,Cu 20 mg,Fe 70 mg,Mn 100 mg,Zn 70 mg,10.4 mg,Se 0.5 mg。
2)代谢能为计算值,其余为实测值。ME was a calculated value, while the others were measured values.
1.3 检测指标
1.3.1 生产性能
试验期内,每天记录各重复的蛋鸡产蛋量、蛋重等数据。记录每周各重复蛋鸡的总采食量,用以计算各组蛋鸡的平均日采食量、产蛋率、平均蛋重及料蛋比[14]。
1.3.2 蛋品质
试验第3、6周末,以重复为单位随机抽取7枚鸡蛋,每组35枚,进行蛋品质测定,主要测定哈夫单位、蛋黄比重、蛋白高度、蛋壳厚度和蛋壳强度。
计算公式:
蛋黄比例(%)=(蛋黄重/蛋重)×100;
Hu=100×lg(H-1.7×W0.37+7.6)。
式中:Hu为哈夫单位;H为蛋白高度;W为蛋重。
蛋白高度:采用鸡蛋多层次测定仪(EMT-5200)测定,单位为mm。
蛋壳强度:采用蛋壳硬度测定仪测定(ROBOTMATION公司,型号efg-0503,日本),单位为kg/cm2。
蛋壳厚度:测量蛋的钝端、尖端和中间的蛋壳厚度后取平均值,精确到0.01 mm。
1.3.3 血清生化指标
试验结束后,以重复为单位随机抽取3只鸡,每组15只,早晨空腹采血,翅下静脉采血3 mL,45°角静置30 min后3 000 r/min离心10 min,取上清制备待测血清样品,保存于-20 ℃冰箱。采用7020全自动血液生化仪测定血清中总蛋白、葡萄糖、胆固醇、甘油三酯含量及谷丙转氨酶、谷草转氨酶活性,试剂盒购自南京建成生物工程研究所。
1.3.4 盲肠微生物数量
试验结束后,以重复为单位随机抽取3只鸡称重后屠宰,取盲肠结扎后保存,用于测定盲肠中双歧杆菌、乳酸杆菌、大肠杆菌及金黄色葡萄球菌的数量。在超净工作台取盲肠内容物1 g加入9 mL磷酸盐缓冲液(PBS),经振荡器振荡5 min后,离心10 min (1 000 r/min),取上清液并10倍梯度稀释。取10-2、10-3和10-4稀释度的菌液各0.02 mL分别接种于大肠杆菌和金黄色葡萄球菌的选择性培养基(麦康凯培养基,青岛高科园海博生物技术有限公司),取10-5、10-6和10-7稀释度的菌液各0.02 mL分别接种于双歧杆菌和乳酸杆菌的选择性培养基[亚硫酸铋琼脂(BS)培养基,青岛高科园海博生物技术有限公司]。每个稀释度各接种3个平皿,双歧杆菌在37 ℃下厌氧培养72 h,乳酸杆菌在37 ℃下厌氧培养48 h,大肠杆菌和金黄色葡萄球菌在37 ℃下需氧培养24 h后分别进行菌落计数。计数方法:从平板上的菌落数推测出每克样品中的菌落数量。
每克样品中的菌落数量=(平均菌落数/
涂布的稀释液体体积)×稀释倍数。
1.3.5 脾脏IL-2和TNF-α mRNA的表达水平
试验结束后,以重复为单位随机抽取3只鸡称重后屠宰,分离脾脏称重,并计算其与体重的相对重量即为脾脏指数。脾脏保存于液氮中。取保存的脾脏组织50 mg,剪碎后放入盛有1 mL Trizol(Invitrogen Reagent)的离心管中,按照Trizol试剂盒说明书提取总RNA。将提取的总RNA沉淀用焦磷酸二乙酯(DEPC)水溶解后,在紫外分光光度计下测定RNA的吸光度(OD)260/280值,测得的数值在1.8~2.0说明提取的总RNA质量较好,将提取的总RNA放入-80 ℃冰箱中保存备用。总RNA用DNase Ⅰ去除基因组DNA后,取1 μg,使用Prime ScriptTMRT试剂盒(TaKaRa)反转录为cDNA,cDNA保存于-20 ℃冰箱中备用。
根据GenBank上鸡β-肌动蛋白(β-actin,登录号为L08165)、TNF-α(登录号为AY765397)、IL-2(登录号为AY510091)的基因序列设计引物,引物由上海生工生物工程技术有限公司合成。实时荧光定量PCR的引物序列如表2。


表2 荧光定量PCR的引物序列
1.4 数据处理与分析
试验数据采用SAS 9.3软件进行统计分析,以平均值±标准差表示。采用SAS 9.3软件的单因素方差分析(one-way ANOVA),对试验数据进行处理和统计学分析,P<0.05水平为差异显著。
2 结 果
2.1 低分子质量壳寡糖对蛋鸡生产性能的影响
低分子质量壳寡糖对蛋鸡的料蛋比、产蛋率、平均日采食量及平均蛋重的影响见表3。整个试验期,添加300、600和900 mg/kg壳寡糖组的产蛋率分别比对照组提高了4.52%(P<0.05)、2.99%(P>0.05)和4.08%(P>0.05)。各组的料蛋比、平均日采食量和平均蛋重差异均不显著(P>0.05)。
2.2 低分子质量壳寡糖对蛋鸡蛋品质的影响
低分子质量壳寡糖对鸡蛋的哈夫单位、蛋黄比例、蛋白高度、蛋壳厚度以及蛋壳强度的影响见表4。试验第3、6周末,添加600和900 mg/kg壳寡糖组的鸡蛋哈夫单位分别比对照组提高了6.87%、6.69%和6.47%、6.60%(P<0.05)。试验第3、6周末,添加900 mg/kg壳寡糖组的鸡蛋蛋黄比例分别比对照组降低了7.10%和7.26%(P<0.05)。各组鸡蛋的蛋白高度、蛋壳厚度和蛋壳强度均无显著差异(P>0.05)。

表3 低分子质量壳寡糖对蛋鸡生产性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.3 低分子质量壳寡糖对蛋鸡血清生化指标的影响
低分子质量壳寡糖对蛋鸡血清生化指标的影响见表5。与对照组相比,添加600和900 mg/kg壳寡糖组的血清葡萄糖含量分别降低了17.44%和21.36%(P<0.05),添加300、600和900 mg/kg壳寡糖组的血清胆固醇含量分别降低了10.28%、10.83%和12.92%(P<0.05),添加600和900 mg/kg壳寡糖组的血清谷草转氨酶活性分别显著降低了10.66%和8.29%(P<0.05)。各组血清中的总蛋白、甘油三酯含量以及谷丙转氨酶活性均无显著差异(P>0.05)。
2.4 低分子质量壳寡糖对蛋鸡脾脏指数和盲肠微生物数量的影响
低分子质量壳寡糖对蛋鸡脾脏指数和盲肠微生物数量的影响见表6。各组的脾脏指数无显著差异(P>0.05)。与对照组相比,添加300、600和900 mg/kg壳寡糖组的盲肠双歧杆菌数量分别提高了11.68%、8.09%和8.86%(P<0.05),添加600和900 mg/kg壳寡糖组的盲肠乳酸杆菌数量分别提高了9.97%和13.59%(P<0.05),添加300、600和900 mg/kg壳寡糖组的盲肠金黄色葡萄球菌分别降低了10.49%、12.08%和15.67%(P<0.05)。各组盲肠大肠杆菌数量无显著差异(P>0.05)。
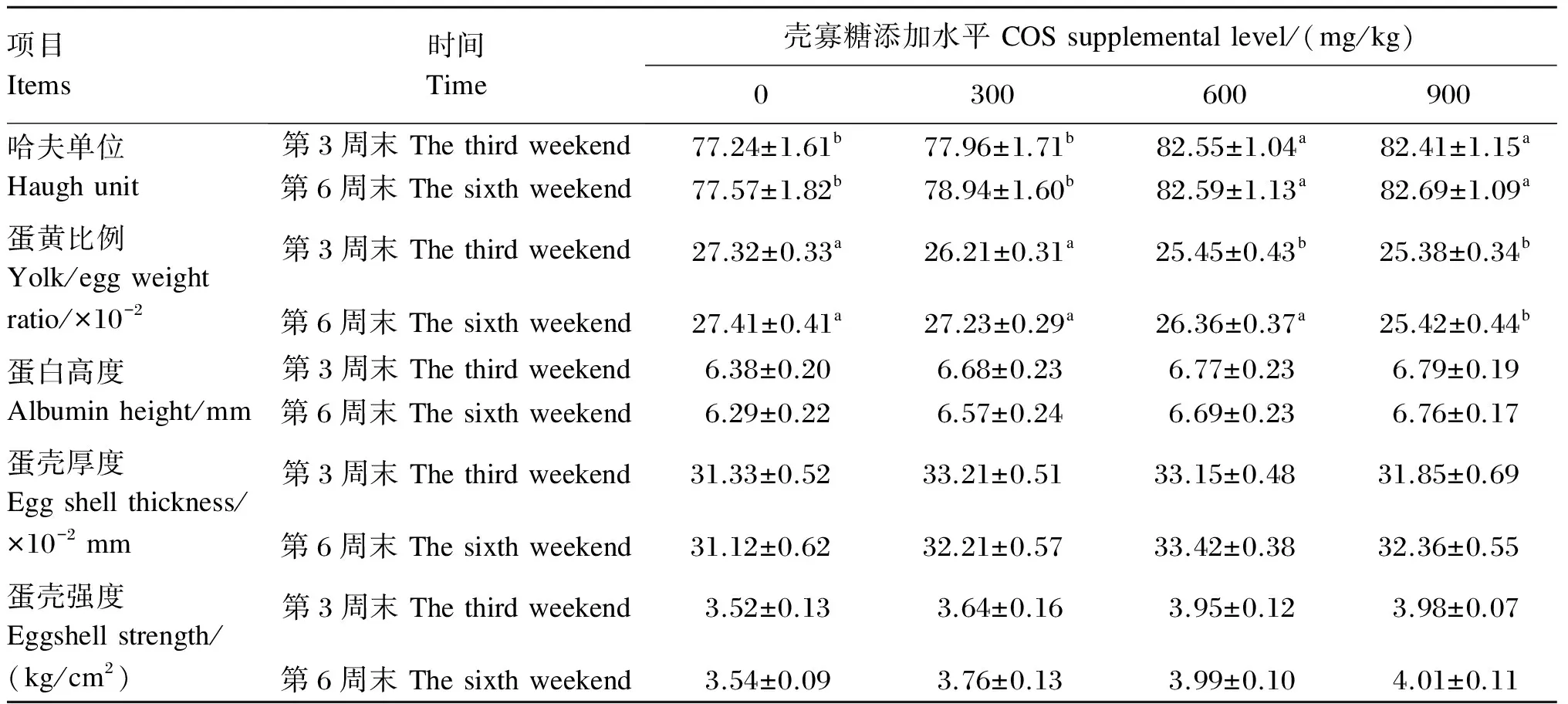
表4 低分子质量壳寡糖对蛋鸡蛋品质的影响

表5 低分子质量壳寡糖对蛋鸡血清生化指标的影响

表6 低分子质量壳寡糖对蛋鸡脾脏指数和盲肠微生物数量的影响
2.5 低分子质量壳寡糖对蛋鸡脾脏TNF-α和IL-2 mRNA表达水平的影响
低分子质量壳寡糖对蛋鸡脾脏TNF-α和IL-2 mRNA表达水平的影响见表7。与对照组相比,添加300和600 mg/kg壳寡糖组显著提高了蛋鸡脾脏IL-2 mRNA表达水平(P<0.05),添加600 mg/kg壳寡糖组显著提高了蛋鸡脾脏TNF-α mRNA表达水平(P<0.05)。

表7 低分子质量壳寡糖对蛋鸡脾脏TNF-α和IL-2 mRNA表达水平的影响
3 讨 论
3.1 低分子质量壳寡糖对蛋鸡生产性能和蛋品质的影响
近年来,各种低聚糖作为益生元被添加到畜禽饲粮中以提高动物的生长性能、增强机体的免疫能力以及调节肠道菌群[2]。以往的研究表明,壳寡糖具有抗真菌[16]和抗微生物活性[8],改善了雄性肉鸡肠道的健康[11],可促进营养物质的消化率,改善生长性能。在本研究中,饲粮添加壳寡糖提高了鸡蛋的生产性能,这可能是由于壳寡糖改善了饲粮干物质和蛋白质消化率的缘故。本研究结果与Meng等[17]在蛋鸡上的研究结果一致,但是与Yan等[13]的研究结果相异。Chen等[18]的研究也报道,在断奶仔猪饲粮种添加壳寡糖提高了饲粮干物质和氮的消化率。此外,饲粮添加甘露寡糖显著提高了肉种鸡的产蛋性能[19],由于壳寡糖与甘露寡糖的结构相似性,从而可以推断壳寡糖也是有益于家禽生产的。生产性能改善的原因已被归因于甘露寡糖具有维持肠道健康和抑制吸附病原菌的能力。因此,我们推断壳寡糖也具有类似的作用。然而,关于壳寡糖在蛋鸡上的应用研究似乎有限,需要进一步的研究以证明壳寡糖在蛋鸡上的应用效果。哈夫单位常用来测量鸡蛋的蛋白质量[20]和判断鸡蛋的新鲜度[21]。本研究结果显示,饲粮添加600或900 mg/kg的低分子质量壳寡糖显著提高了鸡蛋的哈夫单位,同时,也提高了鸡蛋的蛋白高度,结果表明壳寡糖对于改善鸡蛋的新鲜度发挥了作用。
3.2 低分子质量壳寡糖对蛋鸡血清生化指标的影响
血清生化指标常被用来估测动物对各种益生素的反应。本研究结果显示,饲粮添加600和900 mg/kg壳寡糖显著降低了蛋鸡血清葡萄糖含量和谷草转氨酶的活性,降低了血清胆固醇和甘油三酯的含量。本研究结果与Sugano等[22]的研究结果一致。此前的研究也证明壳聚糖具有降脂作用[23]。然而,壳寡糖降低胆固醇的作用机制是有争议的[24-25]。壳寡糖降低胆固醇的重要机制可能是通过结合胆汁酸以减少脂质在肠道中的吸收,导致胆固醇的降低并诱导肝脏合成新的胆汁酸。
3.3 低分子质量壳寡糖对蛋鸡盲肠微生物数量的影响
肠道微生物菌群对于免疫系统的成熟和正常肠道形态的发育是至关重要的。微生物菌群增强了肠黏膜的屏障功能,减少病原微生物对黏膜的附着,可减少过敏原进入细胞的入口。低聚糖通常被定义为益生元,可以选择性地刺激促进动物机体健康的细菌的生长[26]。Liu等[27]的研究表明,饲粮补充壳寡糖可以提高断奶仔猪肠道的乳酸杆菌和降低粪便中大肠杆菌的数量。本研究结果表明,蛋鸡饲粮中添加600或900 mg/kg壳寡糖提高了蛋鸡盲肠双歧杆菌和乳酸杆菌的数量,降低了金黄色葡萄球菌的数量。No等[28]报道,壳寡糖对革兰氏阳性菌(如金黄色葡萄球菌)普遍表现出比革兰氏阴性菌(大肠杆菌)更强的杀菌作用。壳寡糖很容易抑制金黄色葡萄球菌的生长,而对于大肠杆菌则很困难[29]。本研究结果与前人的研究结果一致,但是对于壳寡糖抗微生物活性的原因知之甚少。一个可能的解释是,壳寡糖结构中的氨基葡萄糖单体基团上的正电荷允许与微生物细胞膜上的负电荷相互作用,导致细胞内成分的损失[30];另一个可能的解释是,通过提高双歧杆菌和乳酸杆菌的数量而间接造成对金黄色葡萄球菌的竞争排斥。
3.4 低分子质量壳寡糖对蛋鸡脾脏TNF-α和IL-2 mRNA表达水平的影响
壳寡糖作为免疫促进剂一般被定义为复合物,这些复合物与吞噬细胞或淋巴细胞的细胞表面受体蛋白特异性结合,通过细胞因子的协同激活动物的非特异性免疫系统,从而刺激有效免疫应答的产生[31]。在这个过程中,被激活的巨噬细胞释放细胞因子如TNF-α、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和干扰素-γ(IFN-γ),在一氧化氮和一氧化氮合成酶的帮助下,抑制多种肿瘤细胞和微生物的生长[16]。IL-2是由激活的T细胞分泌的,它具有强大的T细胞生长因子活性,包括淋巴细胞的复制、成熟和分化,被广泛认为是T细胞依赖的免疫反应的关键细胞因子[32]。TNF-α是由活化的T细胞分泌用以增加肠道通透的[1]。早在20世纪70年代初首次报道了壳寡糖的抗肿瘤活性[33]。这种抗肿瘤活性主要归因于其氨基基团所持有的阳离子性能,后来,壳寡糖的分子质量大小被认为对于其抗肿瘤活性起着重要的作用[34]。研究发现,壳寡糖的抗肿瘤作用是由于其提高了动物自然杀伤细胞的活性[35]。本研究结果显示,饲粮中添加600 mg/kg的低分子质量壳寡糖显著提高了蛋鸡脾脏IL-2和TNF-α mRNA表达水平,表明低分子质量壳寡糖能够提高蛋鸡脾脏IL-2和TNF-α的分泌。IL-2和T淋巴细胞之间具有互作效应[32],成熟T淋巴细胞的增加使得能够分泌更多的细胞因子,同时,IL-2和TNF-α含量的增加又可以提高T淋巴细胞的增殖。Deng等[36]的研究结果表明,饲粮添加壳寡糖(平均分子质量为1 500 u)促进了肉鸡主要免疫器官的增重,提高了免疫球蛋白M(IgM)分泌,刺激巨噬细胞释放IL-1β、IL-6和TNF-α,从而提高了肉鸡机体免疫力。同时,Walsh等[37]在断奶仔猪上的研究也发现,高分子质量(5~10 ku、10~50 ku、50~100 ku)的壳寡糖没有显著影响胃肠道细胞因子TNF-α、IL-6、白细胞介素-8(IL-8)和白细胞介素-10(IL-10)的表达。
4 结 论
饲粮添加低分子质量壳寡糖提高了蛋鸡产蛋率和哈夫单位,提高了盲肠双歧杆菌和乳酸杆菌的数量,减少了盲肠金黄色葡萄球菌的数量,提高了脾脏IL-2和TNF-α mRNA表达水平。综合本试验各项指标,建议饲粮低分子质量壳寡糖添加水平为600 mg/kg。
[1] ABU ELALA N M,RAGAA N M.Eubiotic effect of a dietary acidifier (potassium diformate) on the health status of culturedOreochromisniloticus[J].Journal of Advanced Research,2015,6(4):621-629.
[2] LEMIEUX F M,SOUTHERN L L,BIDNER T D.Effect of mannan oligosaccharides on growth performance of weanling pigs[J].Journal of Animal Science,2003,81(10):2482-2487.
[3] BIGGS P,PARSONS C M,FAHEY G C.The effects of several oligosaccharides on growth performance,nutrient digestibilities,and cecal microbial populations in young chicks[J].Poultry Science,2007,86(11):2327-2336.
[4] SHAHIDI F,ARACHCHI J K V,JEON Y J.Food applications of chitin and chitosans[J].Trends in Food Science & Technology,1999,10(2):37-51.
[5] YAMADA A,SHIBUYA N,KODAMA O,et al.Induction of phytoalexin formation in suspension-cultured rice cells byN-acetyl-chitooligosaccharides[J].Bioscience, Biotechnology, and Biochemistry,1993,57(3):405-409.
[6] PENICHE-COVAS C,ALVAREZ L W,ARGÜELLES-MONAL W.The adsorption of mercuric ions by chitosan[J].Journal of Applied Polymer Science,1992,46(7):1147-1150.
[7] MOURYA V K,INAMDAR N N,CHOUDHARI Y M.Chitooligosaccharides:synthesis,characterization and applications[J].Polymer Science Series A,2011,53(7):583-612.
[8] JEON Y J,SHAHIDI F,KIM S K.Preparation of chitin and chitosan oligomers and their applications in physiological functional foods[J].Food Reviews International,2000,16(2):159-176.
[9] PANGESTUTI R,BAK S S,KIM S K.Attenuation of pro-inflammatory mediators in LPS-stimulated BV2 microglia by chitooligosaccharides via the MAPK signaling pathway[J].International Journal of Biological Macromolecules,2011,49(4):599-606.
[10] MEI Y X,CHEN H X,ZHANG J,et al.Protective effect of chitooligosaccharides against cyclophosphamide-induced immunosuppression in mice[J].International Journal of Biological Macromolecules,2013,62:330-335.
[11] LI X J,PIAO X S,KIM S W,et al.Effects of chito-oligosaccharide supplementation on performance,nutrient digestibility,and serum composition in broiler chickens[J].Poultry Science,2007,86(6):1107-1114.
[12] ROZEBOOM D W,SHAW D T,TEMPELMAN R J,et al.Effects of mannan oligosaccharide and an antimicrobial product in nursery diets on performance of pigs reared on three different farms[J].Journal of Animal Science,2005,83(11):2637-2644.
[13] YAN L,LEE J H,MENG Q W,et al.Evaluation of dietary supplementation of delta-aminolevulinic acid and chito-oligosaccharide on production performance,egg quality and hematological characteristics in laying hens[J].Asian-Australasian Journal of Animal Sciences,2010,23(8):1028-1033.
[14] NORTH M O.Breeder management[M]//NORTH M O.Commercial chicken production manual.Westport,Connecticut:The Avi. Publishing Company Inc.,1984:240-243,298-321.
[15] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod[J].Methods,2001,25(4):402-408.
[16] HIGUCHI M,HIGASHI N,TAKI H,et al.Cytolytic mechanisms of activated macrophages.Tumor necrosis factor andL-arginine-dependent mechanisms act synergistically as the major cytolytic mechanisms of activated macrophages[J].The Journal of Immunology,1990,144(4):1425-1431.
[17] MENG Q W,YAN L,AO X,et al.Effects of chito-oligosaccharide supplementation on egg production,nutrient digestibility,egg quality and blood profiles in laying hens[J].Asian-Australasian Journal of Animal Sciences,2010,23(11):1476-1481.
[18] CHEN Y J,KIM I H,CHO J H,et al.Effects of chitooligosaccharide supplementation on growth performance,nutrient digestibility,blood characteristics and immune responses after lipopolysaccharide challenge in weanling pigs[J].Livestock Science,2009,124(1/2/3):255-260.
[19] STANLEY V G,SEFTON A E.Egg and serum cholesterol as influenced by mannan oligosaccharide and aflatoxin[M]//SIM J S,NAKAI S,GUENTER W.Egg nutrition and biotechnology.Wallingford:CABI Publishing,1999:441-443.
[20] WILLIAMS K C.Some factors affecting albumen quality with particular reference to Haugh unit score[J].World’s Poultry Science Journal,1992,48(1):5-16.
[21] EISEN E J,BOHREN B B,MCKEAN H E.The Haugh unit as a measure of egg albumen quality[J].Poultry Science,1962,41(5):1461-1468.
[22] SUGANO M,WATANABE S,KISHI A,et al.Hypocholesterolemic action of chitosans with different viscosity in rats[J].Lipids,1988,23(3):187-191.
[23] KANAUCHI O,DEUCHI K,IMASATO Y,et al.Mechanism for the inhibition of fat digestion by chitosan and for the synergistic effect of ascorbate[J].Bioscience, Biotechnology, and Biochemistry,1995,59(5):786-790.
[24] TANAKA Y,TANIOKA S I,TANAKA M,et al.Effects of chitin and chitosan particles on BALB/c mice by oral and parenteral administration[J].Biomaterials,1997,18(8):591-595.
[26] GIBSON G R,ROBERFROID M B.Dietary modulation of the human colonic microbiota:introducing the concept of prebiotics[J].The Journal of Nutrition,1995,125(6):1401-1412.
[27] LIU P,PIAO X S,KIM S W,et al.Effects of chito-oligosaccharide supplementation on the growth performance,nutrient digestibility,intestinal morphology,and fecal shedding ofEscherichiacoliandLactobacillusin weaning pigs[J].Journal of Animal Science,2008,86(10):2609-2618.
[28] NO H K,PARK N Y,LEE S H,et al.Antibacterial activity of chitosans and chitosan oligomers with different molecular weights[J].International Journal of Food Microbiology,2002,74(1/2):65-72.
[29] CHAE S Y,JANG M K,NAH J W.Influence of molecular weight on oral absorption of water soluble chitosans[J].Journal of Controlled Release,2005,102(2):383-394.
[30] LIU H,DU Y M,WANG X H,et al.Chitosan kills bacteria through cell membrane damage[J].International Journal of Food Microbiology,2004,95(2):147-155.
[31] LAMBRECHT B,GONZE M,MORALES D,et al.Comparison of biological activities of natural and recombinant chicken interferon-gamma[J].Veterinary Immunology and Immunopathology,1999,70(3/4):257-267.
[32] MALEK T R,BAYER A L.Tolerance,not immunity,crucially depends onIL-2[J].Nature Reviews Immunology,2004,4(9):665-674.
[33] MUZZARELLI R A A.Chitin[M].Oxford:Pergamon Press,1977.
[34] QIN C Q,DU Y M,XIAO L,et al.Enzymic preparation of water-soluble chitosan and their antitumor activity[J].International Journal of Biological Macromolecules,2002,31(1/2/3):111-117.
[35] MAEDA Y,KIMURA Y.Antitumor effects of various low-molecular-weight chitosans are due to increased natural killer activity of intestinal intraepithelial lymphocytes in sarcoma 180-bearing mice[J].The Journal of Nutrition,2004,134(4):945-950.
[36] DENG X Z,LI X J,LIU P,et al.Effect of chito-oligosaccharide supplementation on immunity in broiler chickens[J].Asian-Australasian Journal of Animal Sciences,2008,21(11):1651-1658.
[37] WALSH A M,SWEENEY T,BAHAR B,et al.The effect of chitooligosaccharide supplementation on intestinal morphology,selected microbial populations,volatile fatty acid concentrations and immune gene expression in the weaned pig[J].Animal,2012,6(10):1620-1626.
*Corresponding author, associate professor, E-mail: jtwang@sdau.edu.cn
(责任编辑 武海龙)
Effects of Low Molecular Weight Chitooligosaccharides on Performance, Egg Quality, Serum Biochemical Indices, Cecal Microbial Number and Gene Expressions of Interleukin-2 and Tumor Necrosis Factor-α in Spleen of Laying Hens
MENG Xiao1WANG Jiting1*WAN Wenju2WANG Hongwei1LIU Hanliang1SUN Minmin1
(1.CollegeofAnimalScienceandTechnology,ShandongAgriculturalUniversity,Tai’an271000,China; 2.Departmentof
BasicMedicine,TaishanMedicalCollege,Tai’an271000,China)
This experiment was conducted to study the effects of dietary supplemented different levels low molecular weight (1 000 u) chitooligosaccharides (COS) on performance, egg quality, serum biochemical indices, cecal microbial number and gene expressions of interleukin-2 (IL-2) and tumor necrosis factor-α (TNF-α) in spleen of laying hens. A total of 600 Hy-line brown laying hens (58 weeks of age) with the similar body weight and egg production rate were randomly assigned to 4 groups with 5 replicates per group and 30 hens per replicate. Hens in the control group were fed a basal diet, and the others in the experimental groups were fed the basal diet supplemented with 300, 600 and 900 mg/kg COS, respectively. The preliminary period lasted for 7 days and the formal period lasted for 42 days. The results showed as follows: 1) compared with the control group, the supplementation of 300, 600 and 900 mg/kg COS group improved egg production rate by 4.52% (P<0.05), 2.99% (P>0.05) and 4.08% (P>0.05), respectively. 2) Compared with the control group, the supplementation of 600 and 900 mg/kg COS group improved Haugh units by 6.87%, 6.69% and 6.47%, 6.60% at third and sixth weeks end of the experiment (P<0.05), respectively. 3) Compared with the control group, dietary ssupplementation of 300 and 600 mg/kg COS significantly decreased the glucose, triglyceride contents and glutamic-oxalacetic transaminase activity in serum (P<0.05). 4) Compared with the control group, dietary supplementation of 600 and 900 mg/kg COS significantly increased the cecalBifidobacteriaandLactobacillinumber (P<0.05), and significantly decreased the cecalS.aureus. number (P<0.05). 5) Compared with the control group, dietary supplementation of 300 and 600 mg/kg COS significantly increased the mRNA expression level ofIL-2 in spleen (P<0.05), and dietary supplementation of 600 mg/kg COS significantly increased the mRNA expression level ofTNF-α in spleen (P<0.05). In conclusion, dietary supplementation of different levels COS increase egg production rate and Haugh unit, modulate the cecal microbial community, boost the immune ability of laying hens. The recommended COS supplemental level is 600 mg/kg.[ChineseJournalofAnimalNutrition, 2017, 29(5):1590-1599]
laying hens; chitooligosaccharides; egg production; intestinal microbial community;IL-2;TNF-α
10.3969/j.issn.1006-267x.2017.05.018
2016-11-01
动物营养国家重点实验室开放课题项目(2004DA125184F1008)
孟 晓(1988—),男,山东滕州人,硕士研究生,研究方向为动物营养与饲料科学。E-mail: mengxxfresh@163.com
*通信作者:王纪亭,副教授,硕士生导师,E-mail: jtwang@sdau.edu.cn
S831
A
1006-267X(2017)05-1590-10

