新生儿坏死性小肠结肠炎腹部B超表现与临床转归的关系
陈 薇
西安工会医院特诊科,陕西 西安 710100
新生儿坏死性小肠结肠炎腹部B超表现与临床转归的关系
陈 薇
西安工会医院特诊科,陕西 西安 710100
目的 探讨新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis, NEC)腹部B超表现预测临床转归的应用价值。方法 选取2013年7月-2015年1月西安工会医院收治的NEC患儿共63例,根据修正Bell-NEC分级诊断标准分为疑似组(42例)及确诊组(21例),并根据临床转归分为内科治疗组(40例)及手术组(23例)。比较患儿腹部B超与X线平片的阳性检出率、准确度、特异度、灵敏度。结果 以上全部63例患者,第1次腹部超声阳性检出率(73.8%)及12 h后复查阳性检出率(79.3%)均高于X线平片(68.9%、71.4%),差异有统计学意义(P<0.05)。比较腹部B超第1次检查与复查灵敏度、特异度、准确度,差异有统计学意义(P<0.05)。在确诊组,腹部超声对肠壁积气(preumatosis vntestinalis, PI)、门静脉积气(portal venous gas, PVG)的检出率要高于X线平片,差异有统计学意义(P<0.05)。腹部超声显示肠管扩张、肠壁增厚及腹腔积液(透声差)在手术组的发生率要高于内科治疗组,差异有统计学意义(P<0.05)。腹部X线平片显示肠管扩张多见于手术组,差异有统计学意义(P<0.05)。结论 腹部B超对PVG、肠管扩张检出率高于X线平片,且腹部超声无放射性损伤,可以反复检查,能直视肠道蠕动及腹腔液体等,在NEC早期诊断中,较X线平片诊断结果更确切。超声显示肠管扩张、肠壁增厚及腹腔积液在手术组的发生率高,多预示临床转归不良。其结果可以作为预测临床转归的参考指标。
坏死性小肠结肠炎;超声检查;X线;早产;新生儿
新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis, NEC)[1]是新生儿所特有的较为常见的重症疾病之一,在临床非常多见且难于根除,一直是新生儿领域研究的重点之一。国内外报道[2-4]均以早产儿和极低体质量新生儿。早诊断、早治疗是提高患儿生存率的关键。但该病因缺乏特异性检查手段在临床诊断上较为困难,目前国内外诊断NEC均根据修正的Bell分级法评价患儿病情严重程度。但Bell分级法所依赖的X线腹部平片结合临床症状,常迟于NEC临床表现。X线所示的肠壁扩张等征象均为动力性肠梗阻,缺乏特异性。目前X线腹部平片与超声检查(ultrasonography, US)均为临床常用影像学检查手段。近年来,随着超声检查探头分辩率的提高,能清楚地显示患儿小肠肠壁不同层次结构及门静脉及对于气体具有高度敏感性和特异性等优势,国内外均展开了经腹部超声结合NEC临床症状表现用于早期NEC临床诊断的广泛研究[5-7]。发现符合NEC的声像图表现,对于预测病情进展迅速、症状表现多样的NEC的临床转归,具有重要临床应用价值,但目前这方面研究文献还较为少见。本研究旨在通过分析NEC的腹部B超表现,探讨其与NEC的临床转归关系。
1 资料与方法
1.1 一般资料 收集西安工会医院于2013年7月-2015年7月收治的63例NEC患儿。以上患儿均据修正的Bell NEC分级标准[8]予以确诊,并据此分为疑似组(42例)与确诊组(21例),且均行US及X线片检查,按其临床转归为分为内科治疗组(40例)与手术组(23例),内科治疗组行保守治疗,手术组行手术治疗。男37例,女26例,年龄3h~30 d,以上患儿早产儿占76.9%,极低体质量患儿占62.5%。临床症状:腹胀59例,呕吐54例,腹泻42例,便血38例,发热5例,嗜睡4例,拒奶1例。
1.2 纳入及排除标准 纳入标准[9]:临床首发症状均表现为腹胀,并伴有特异性消化系统表现如便血、呕吐、腹泄之其中1项或多项,以及非特异性表现如纳差、血压下降、精神萎靡等表现的新生儿。排除标准[10]:12 h内腹胀消失,肠道畸形(肠道梗阻及不全梗阻)、以及严重败血症或严重新生儿持续性肺动脉高压(persistent pulmonary hypertension of the new-born, PPHN)合并NEC的患儿。
1.3 检查方法
1.3.1 经腹部B超检查:患儿均取仰卧位,采用PHILIPS iU22 、GE LOGIQ s6及ALOKA alO彩色多普勒超声诊断仪经腹多切面扫查腹腔,线阵探头频率10~13 MHz。于扫查中动态观察肠管形态、肠壁回声,对肠壁有无增厚(< 3 mm为正常新生儿肠壁厚度) ,肠壁秸膜下或浆膜下是否出现气体回声,肠腔有无扩张积液,腹腔有无积液,门静脉是否积气等征象予以重点观察。检查过程中同时还应注意将探头适当加压,纵向和横向仔细扫查患儿腹部,以避免出现积气伪像,并动态观察积气来源,以鉴别管壁积气和管腔积气。
1.3.2 X线检查:患儿均取正侧位检查,主要观察肠壁有无增厚、是否积气以及门静脉是否积气等异常情况。
1.4 诊断标准
1.4.1 腹部B超诊断标准:以肠壁增厚、肠壁积气(preumatosis intestinalis, PI)、门静脉积气(portal venous gas, PVG)3项中可出现其中1项即判定为阳性结果,以上3项均未见则判定为阴性结果。(1)肠壁增厚:其病理改变部位以小肠壁增厚为主,>3.0 mm即视为肠壁增厚;(2)PI:超声可见散点状气体回声或颗粒状气体回声于肠壁黏膜下,线状或短条状高回声则于浆膜下可见,积气较多则可见肠壁为点状或颗粒状高回声环绕,声像图表现为半圆形或圆形图像;(3)PVG:可见气泡样或串环样高回声高回声光点于门静脉主干或分支内,同时或分别可见高回声光斑或条片状高回声于肝实质门静脉分支内。
1.4.2 X线诊断标准:以正侧位片可见肠壁增厚、PI、PVG其中一项可见即判定为阳性结果,以上均未见则判为阴性结果。
1.5 统计学处理 采用SPSS 19.0统计分析软件进行数据统计分析。采用诊断性检验方法,以灵敏度、特异度、准确度及ROC曲线评估,ROC曲线下面积(AUC)>0.5有统计学意义。
2 结果
2.1 治疗结果及临床转归 63例患儿中,总治愈率为76.2%(48/63)。40例经保守治疗作为内科治疗组,23例经保守治疗24~48 h无效转行手术治疗作为手术组。40例内科治疗组患儿中,治愈率为97.5%(39/40),仅1例经治疗42 h后需行手术治疗,家属拒绝,患儿因出现腹膜炎、休克及多脏器功能衰竭死亡,死亡率为2.5%(1/40),23例手术组患儿中,治愈率为73.9%(17/23),且预后良好,6例治疗过程中家属放弃治疗而死亡,其中4例于手术中发现全肠坏死而死亡,2例死于术后严重腹膜炎,死亡率为26.1%(6/23)。
2.2 腹部B超及X线平片检查情况 腹部B超及X线平片检查情况 63例NEC患儿中,腹部B超阳性检出率为79.3%(50/63),患儿声像图表现为65.1%(41/63)出现多发肠壁增厚,增厚部位以小肠为主,小肠壁厚度均﹥3 mm,并可伴腹腔积液征象,其中49.2%(31/63)出现PI,22.2%(14/63)可见PVG。X线平片阳性检出率为55.6%(45/63),X线平片表现:57.1(36/63)出现肠壁增厚,增厚部位以小肠为主,小肠壁厚度均﹥3 mm,其中34.9%(22/63)出现PI;14.3%(9/63)可见PVG。US对PI阳性检出率高于X线平片(P<0.05)。腹部超声典型声像图表现,如图1所示。
表1 腹部超声及X线平片检查结果
Tab 1 The result of abdominal ultrasound and X-ray plain film

组别腹部超声例数肠壁增厚PIPVG合计X线平片例数肠壁增厚PIPVG合计疑似组40261652940249324确诊组231815921231213611合计6341311450633622935
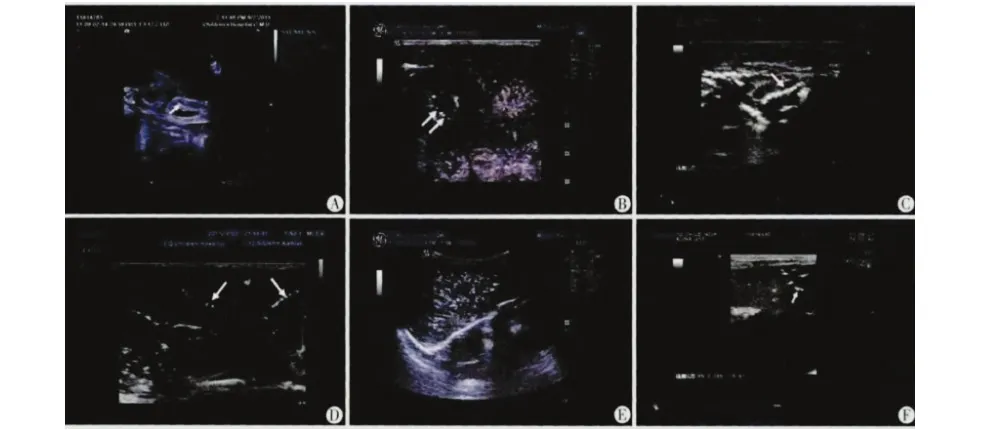
图1 NEC 患儿肠壁及门静脉的超声表现 A:肠壁声像表现(↑:示增厚肠壁);B:肠壁和膜下极少量积气声像表现(↑:示点状强回声积气);C:肠壁和膜下少量积气声像表现(↑:示颗粒状强回声积气);D: 肠壁和膜下多发积气声像表现(↑:示多发强回声积气,点状及颗粒状高回声环绕肠壁);E: 门静脉分支内多发积气声像表现[↑:示广泛积气(串珠样高回声光区)];F:门脉分支内散在积气声像表现(↑:示高回声光斑)
Fig 1 NEC children with intestinal wall and the sonographic appearances of the portal vein A: intestinal wall audio-visual performance (↑: bowel wall thickening); B: the intestinal wall and membrane under tiny pneumatosis audio-visual performance (↑: dot strong echo pneumatosis); C: the intestinal wall and membrane under a small amount of pneumatosis audio-visual performance (↑: granular strong echo pneumatosis); D: the intestinal wall and membrane under multiple pneumatosis audio-visual performance (↑: multiple strong echo pneumatosis, dot and granular high echo around the intestinal wall); E: portal vein branch within multiple pneumatosis audio-visual performance [↑: widely pneumatosis (beaded high light area)]; F: the branch of portal vein in scattered pneumatosis audio-visual performance (↑: high echo intensity)
2.3 腹部超声与X线平片诊断性检验比较 第1次腹部超声检查的ROC曲线见图2。复查腹部超声检查的ROC曲线见图3。第1次检查腹部B超与复查腹部超声检查的诊断灵敏度、特异度、准确度均明显高于X线平片,详见表2。
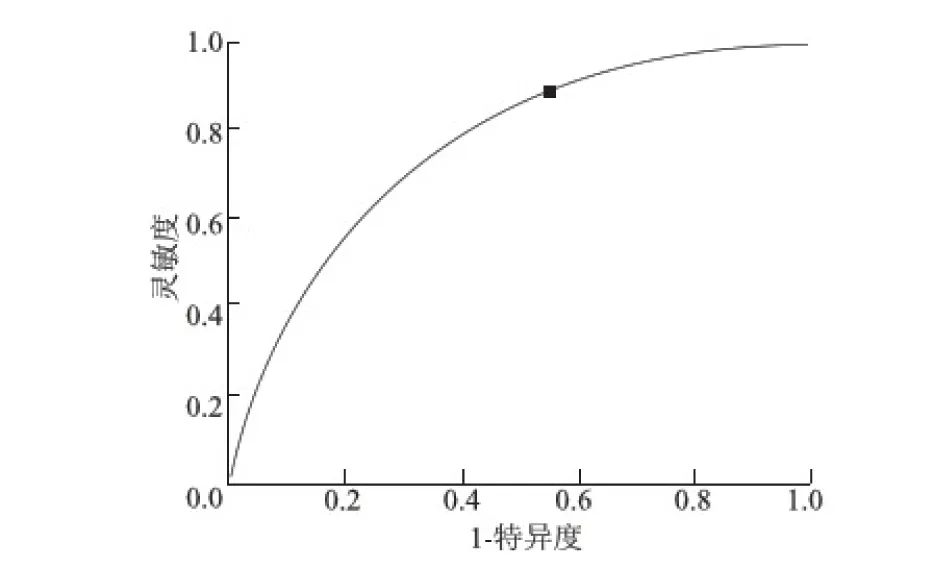
图2 第1次腹部B超检查的ROC曲线
2.4 腹部B超与临床转归的关系 63例NEC患儿,内科治疗组与手术组比较,经腹部超声检出的肠管扩张、肠壁增厚及腹腔积液(透声差)在外科组的发生率要高于内科治疗组,差异有统计学意义(RR=2.2, 95%CI: 1.33~3.35;RR=2.5, 95%CI: 1.25~4.71;RR=19.6, 95%CI: 2.59~148.19)。腹部平片显示肠管扩张多见于手术组,与内科治疗组比较差异有统计学意义(RR=1.9, 95%CI:1.14~3.12)。

图3 复查腹部B超的ROC曲线
表2 腹部超声与X线平片诊断性检验比较(%)
Tab 2 Comparison of diagnostic test between abdominal ultrasound and X-ray plain film(%)

组别第1次检查灵敏度特异度准确度AUC95%CI12h后复查灵敏度特异度准确度AUC95%CIUS90.554.966.70.7270.622~0.83188.745.074.20.6680.554~0.783X线78.741.355.267.322.763.5
3 讨论
NEC是新生儿重症疾病之一,发病急,病情进展迅速,亦是导致新生儿死亡的重要原因之一,在早产儿与极低体质量出生儿中发病率较高。窒息、缺氧、感染、高渗喂养、红细胞增多症及先天性畸形等多因素均可导致NEC发生[11]因而NEC是不成熟的胃肠道对多种有害因素的一种综合反应。也有学者进一步提出[12],肠道缺血和细菌入侵是导致肠坏死和肠穿孔的病主要病因。小肠肠壁病理改变可能是NEC早期病理基础,在其迅速进展期,肠道节段性坏死,是其显著特征,临床多见回肠和空回肠坏死,在严重病情中,还常可见除十二指肠外的全长肠道坏死。NEC早期的临床症状所出现的腹胀、呕吐、便血等典型胃肠道反应以及病情严重时全身非特异性败血症,在NEC患儿中均可发现,但并非NEC的特异性表现,仅凭临床症状,难以确诊。对于缺乏典型症状体征及影像学依据的患儿,尤为困难。早期NEC难于诊断和选择合适的治疗方案,也是影响NEC临床转归的关键因素。
目前,NEC常用的影像学检查为X线平片与腹部超声。但腹部X线平片诊断早期可疑NEC缺乏特异性,且X线腹部平片表现,迟于临床症状出现。而在NEC的Ⅱ期及Ⅲ期出现的肠穿孔等,也并非为NEC的特异性表现,据此判断临床转归亦较困难。有研究[12]表明,腹部超声结合NEC临床表现,诊断早期可疑NEC的主要优势为发现符合NEC早期病理异常的声像图。有研究[13]认为,超声对于气体的高度敏感性和特异性,有助于NEC的早期诊断,且NEC的腹部超声表现,对NEC的临床转归可能存在重要应用价值。
众多研究[14-16]表明,NEC的危险因素与肠壁增厚、PI、PVG、腹腔游离气体有关。早期NEC受肠壁缺血及细菌入侵影响,致肠壁黏膜屏障破坏,腔内气体渗入肠壁间质,形成PI,气体再进一步经肠壁间质进入肠壁小静脉,经肠系膜血管回流至门脉系统,形成PVG。因而,PI的微量改变,可提示NEC早期肠壁即已受病变侵袭,肠壁增厚示肠壁受炎症破坏肿胀所致,进而形成肠壁扩张。而门静脉积气则为一过性气体,在肠壁发生积气异常时,经肠系膜血管进入门静脉,因而可间接反映NEC所致的小肠间壁病理改变。这可能是早期NEC的基本病理改变特点。肠壁增厚、PI、PVG是检测阳性NEC的重要指标。以往X线腹部平片检查,因缺乏敏感性和特异性,常未能发现PI、PVG,而为腹部超声所发现,有文献[17]报道证实,经腹部超声可探测到直径<1 mm的气泡,无疑,这有助于诊断早期可疑NEC。对尽快选择合适治疗方案、预测临床转归具有重要意义,腹部超声具有的主要优势为:对诊断早期NEC能提供实时、动态图像,能清楚显示小肠肠壁各层结构及门静脉系统;腹部超声表现的声像图正是以小肠肠壁增厚为基础,对PI、PVG具有高度敏感性和特异性;腹部超声能发现X线腹部平片未能发现的NEC早期PI、PVG[18]。
本研究中,检测出阳性NEC 50例,其中包括肠壁增厚、PI、PVG。阳性检出率均高于腹部X线平片。其原因可能为:(1)腹部超声超声的主要优势在于能清晰地显示小肠肠壁各层次结构及门静脉系统,对于气体的高度敏感性与特异性,因而能发现肠壁微量积气及门静脉微小气泡。(2)腹部超声对于气体具有高度敏感性和特异性:对进入小肠肠壁间质的气体及进入门静脉的气体,气流与血液间巨大的声阻抗差,使得超声能早于其他影像学手段发现肠壁微量积气及小静脉积气。(3)当肠壁微量积气、PVG未被其他影像学手段发现时,超声波高度的敏感性及特异性,先于其他影像学手段发现,这对于可疑NEC的诊断尤为重要。
本组患儿病例中,经腹部B超发现的肠壁扩张、肠壁增厚及腹腔积液(透声差)在手术组的发生率要高于内科治疗组,腹部X线平片检测出的肠壁扩张多见于手术组,提示腹部B超发现的肠壁扩张、肠壁增厚、腹腔积液多临床转归不良。研其原因,可能与NEC病情进展迅速,在发现肠道扩张、肠壁增厚及腹腔积液时,多已为病情严重期有关,PVG可间接反映肠壁病理改变,因此,并一定非要经手术治疗,只有肠穿孔、腹膜炎才为NEC的绝对手术指征。本组患儿中,内科治疗组多以PI、PVG为主,经保守治疗,仅1例24~48 h治疗无效需转手术治疗为家属拒绝死亡外,余皆预后良好。其原因可能在于,早期可疑NEC是以小肠为主的肠壁病理改变为基础,而对气体具有高灵敏性和特异性的腹部超声发现PI、PVG,可能均为早期NEC病理特点,因而,经保守治疗,也多能治愈,预后良好。提示经腹部超声发现的PI、PVG多预后良好。因而,NEC的腹部B超表现,对于预测NEC的临床转归具有重要临床意义,可以用来随访临测NEC病情变化。
在这里,需要指出的是,亦非所有的PI、PVG均能单独或同时为腹部超声所能检测到,但经腹部B超检查,均可出现。本组研究患儿中,即有7例第1次腹部超声检查未检出,复查时检出阳性。因而,在临床上还需其他影像学检查手段辅助检查。B超伪像的存在也在一定程度影响NEC的阳性检出率[19-21]。临床上必须对是否为PI还是肠腔积气加以鉴别。因超声不具有幅射性,可以反复无创检查,超声目前已成为NEC临床重要的影像学检查手段。
总之,超声重要的优势在于腹部B超表现,诊断早期可疑NEC,具有重要意义,较X线平片能更为敏感地检测出NEC早期的PI,可发现腹腔积液,测量肠壁厚度,并且能反复无创安全检查,因此NEC的腹部超声表现对于NEC的早期诊断及预测临床转归均具有重要临床价值。
[1]杨磊, 徐巍, 李永伟, 等. 腹部超声在新生儿坏死性小肠结肠炎诊断及病情评估中的价值[J]. 中国当代儿科杂志, 2016, 18(2):108-112. Yang L, Xu W, Li YW, et al. Value of abdominal ultrasound in thediagnosis of neonatal necrotizing enterocolitis and evaluation of disease severity [J]. Chin J Contemp Pediatr, 2016, 18(2): 108-112.
[2]Hull MA, Fisher JG, Gutierrez IM, et al. Mortality and management of surgical necrotizing enterocolitis in very low birth weight neonates: a prospective cohort study [J]. J Am Coll Surg, 2014, 218(6): 1148-1155.
[3]Hull MA, Fisher JG, Gutierrez IM, et al. Mortality and management of surgical necrotizing enterocolitis in very low birth weight neonates: a prospective cohort study [J]. J Am Coll Surg, 2014, 218(6): 1148-1155.
[4]Zhang LJ, Pei YF, Wei CL, et al. To study the diagnosis of abdominal X-ray and ultrasound about necrotizing enterocolitis [J]. Chinese Journal of Birth Health & Heredity, 2014, 25(1): 33-39.
[6]Garbi-Goutel A, Brévaut-Malaty V, Panuel M, et al. Prognostic value of abdominal sonography in necrotizing enterocolitis of premature infants born before 33 weeks gestational age [J]. J Pediatr Surg, 2014, 49(4): 508-513.
[7]于论, 孙斌, 缪珀, 等. 82例新生儿坏死性小肠结肠炎预后危险因素分析[J]. 中国当代儿科杂志, 2013, 15(12): 1082-1085. Yu L, Sun B, Liao B, et al. Risk factors for prognosis of neonatal necrotizing enterocolitis: an analysis of 82 cases [J]. Chin J Contemp Pediatr, 2013, 15(12): 1082-1085.
[8]黄国盛. 早产儿坏死性小肠结肠炎危险因素及预防[J]. 广西医科大学学报, 2013, 30(02):290-292:1090-1092.
[9]张连军, 裴玉芳, 魏春雷, 等. 腹部X线和彩超对新生儿坏死性小肠结肠炎诊断的研究[J]. 中国优生与遗传杂志, 2014, 21(8): 81-82. Zhang LJ, Pei YF, Wei CL, et al. To study the diagnosis of abdominal X-ray and ultrasound about necrotizing enterocolitis [J]. Chinese Journal of Birth Health & Heredity, 2014, 21(8): 81-82.
[10]余珍珠, 黄惠君, 刘晓红, 等. 新生儿坏死性小肠结肠炎80例临床分析[J]. 中华围产医学杂志, 2014, 17(1).
[11]唐维兵, 刘翔, 耿其明, 等. 新生儿坏死性小肠结肠炎的手术指征探讨[J]. 中华小儿外科杂志, 2015, 36(2): 100-104. Tang WB, Liu X, Geng QM, et al. Indications of surgical treatment for necrotizing enterocolitis [J]. Chin J Pediatr Surg, 2015, 36(2): 100-104.
[12]Moon CJ, Lim GY, Kim SY, et al. Usefulness of abdominal sonography in accurate diagnosis for necrotizing enterocolitis [J]. 2015, 22(2): 92.
[13]Kamali K, Hosseini SR, Ardakani SM, et al. Complementory value of sonography in early evaluation of necrotizing enterocolitis [J]. Pol J Radiol, 2015, 80: 317-323.
[14]陈新亚. 腹部超声对新生儿坏死性小肠结肠炎的诊断价值及与转归的关系[D]. 吉林大学, 2015.
[15]刘皎然. 新生儿坏死性小肠结肠炎超声表现1例[J]. 临床超声医学杂志, 2013, 15(11):808-808.
[16]张悦, 高红霞, 易彬, 等. 腹部B超在新生儿坏死性小肠结肠炎诊断中的价值[J]. 中国新生儿科杂志, 2014, 29(6): 398-401. Zhang Y, Gao HX, Yi B, et al. The value of abdominal ultrasound in the diagnosis of neonatal necrotizing enterocolitis [J]. Chinese Journal of Neonatology, 2014, 29(6): 398-401.
[17]王家蓉, 余加林, 李广红, 等. 新生儿坏死性小肠结肠炎影像学与临床相关性的回顾分析[J]. 中华儿科杂志, 2013, 51(5): 331-335. Wang JR, Yu JL, Li GH, et al. Imaging assessment of neonatal necrotizing enterocolitis [J]. Chin J Pediatr, 2013, 51(5): 331-335.
[18]邓博引, 何华云, 余国容, 等. 新生儿坏死性小肠结肠炎的腹片评分研究[J]. 临床放射学杂志, 2014, 33(6): 912-915. Deng BY, He HY, Yu GR, et al. The study of radiographic duke abdominal assessment scale in neonatal necrotizing enterocolitis [J]. Journal of Clinical Radiology, 2014, 33(6): 912-915.
[19]Franco A, Ramji FG. Utility of abdominal sonography to diagnose necrotizing enterocolitis [J]. European Journal of Radiology Extra, 2008, 65(1): 13-16.
[20]McCarron A. Abdominal sonography in the evaluation of necrotizing enterocolitis [J]. Ultrasound Q, 2014, 30(3): 202-204.
[21]Kim SH, Park JH, Moon CJ, et al. Presentation Time of Necrotizing Enterocolitis Diagnosed by Sonography according to Gestational Age [J]. Neonatal Medicine, 2015, 22(1).
Relationship between abdominal ultrasound and clinical outcome in neonatal necrotizing enterocolitis
CHEN Wei
Department of Special Clinic, Xi’an Union Hospital, Xi’an 710100, China
Objective To investigate the value of abdominal ultrasound in predicting the clinical outcome of neonatal necrotizing enterocolitis (NEC).Methods Sixty-three NEC patients were selected from Jul. 2013 to Jan. 2015 in Xi’an Union Hospital. According to the revised Bell-NEC grading diagnosis standard, all patients were divided into suspected period group (42 cases) and the diagnosis period group (21 cases); according to the clinical outcome, all patients were divided into internal medicine cure group (40 cases) and surgical group (23 cases). Abdominal ultrasound and the positive rate of X-ray plain film, accuracy, specific, sensitivity degrees were compared.Results In all 63 patients, the positive rates of abdominal ultrasound at the first time and after 12 hours review were higher than X-ray plain film (73.8%vs68.9%, 79.3%vs71.4%), there was statistically significant (P<0.05). The sensitivity, specificity, accuracy and sensitivity were statistically significant between the first time and 12 hours review of abdominal lutrasound (P<0.05). In diagnosis period group, detection rates of pneumatosis intestinalis (PI), portal venous gas (PVG) of abdominal ultrasound were higher than abdominal plain film (P<0.05). Abdominal ultrasonography showed that incidences of blind expansion, bowel wall thickening and peritoneal effusion (acoustic) in surgical group were higher than those in internal medicine cure group (P<0.05). Abdominal plain film showed the incidence of blind expansion in surgical group was higher (P<0.05).Conclusion Abdominal ultrasound for detection of PVG, bowel expansion is superior to X-ray plain film, and it has no radioactive injury, abdominal ultrasound in the early diagnosis of NEC is more accurate than the X-ray plain film. Ultrasound shows that incidences of blind expansion, bowel wall thickening and peritoneal effusion in the surgical group are high, and poor clinical outcome. The result can be used as reference predictor of clinical outcomes.
Necrotizing enterocolitis; Ultrasonic examination; X-ray; Preterm birth; The newborn
陈薇,主治医师,E-mail: chenweitgyx@163.com
10.3969/j.issn.1006-5709.2017.04.019
R574.5
A
1006-5709(2017)04-0435-06
2016-08-02

