英夫利西治疗克罗恩病的疗效综合评估与研究
朱秀丽,王巧民,贾 勇,吴正祥,江秋霞,王加加
安徽医科大学附属安徽省立医院消化内科, 安徽 合肥 230001
英夫利西治疗克罗恩病的疗效综合评估与研究
朱秀丽,王巧民,贾 勇,吴正祥,江秋霞,王加加
安徽医科大学附属安徽省立医院消化内科, 安徽 合肥 230001
目的 评估英夫利西(Infliximab,IFX) 对克罗恩病(Crohn’s disease,CD)患者的临床症状、黏膜愈合、营养状况、精神状况的综合疗效。方法 收集2011年8月-2016年10月接受IFX治疗的CD患者的临床资料,包括实验室指标、CD活动指数(CDAI)、CD简化内镜评分(SES-CD)、营养状况(NRS-2002、PG-SGA)、精神状况(SAS、SDS评分)、生活质量(IBD-Q)等。结果 治疗后0周、6周临床缓解率分别为68.2%、100%,14~30周时88.9%患者维持临床缓解,38~54周时100%维持临床缓解。14~30周时深度缓解率为16.7%,38~54周时深度缓解率为80.0%。根据PG-SGA评分,治疗前81.8%属重度营养不良,38~54周时,60.0%患者营养良好,无营养风险。治疗前40.9%患者伴有焦虑,54.5%患者伴有抑郁,治疗后6周内SAS、SDS评分较治疗前明显下降,差异有统计学意义(P<0.05),14~54周时患者在维持临床缓解的同时保持无抑郁、无焦虑状态,治疗后IBD-Q评分与治疗前相比显著增加(P<0.05)。结论 IFX可早期诱导并维持CD患者临床缓解,长期治疗可诱导、维持深度缓解,CD患者抑郁、焦虑发生率高,生活质量低,早期临床缓解可明显改善患者精神状况,提高生存质量。
克罗恩病;英夫利西;深度缓解;营养
克罗恩病(Crohn’s disease,CD)是一种病因尚不明确的慢性非特异性肠道炎性疾病,病情易反复迁延,随着对发病机制及治疗方法的深入研究,尤其是肿瘤坏死因子(TNF-α)单克隆抗体的应用,有学者[1]提出将“临床缓解”与“黏膜愈合”综合作为CD最新的治疗目标,定义为深度缓解,国外已有研究证实TNF-α单克隆抗体在诱导并维持深度缓解方面有一定作用,但是在国内,TNF-α单克隆抗体只有英夫利西单抗(Infliximab,IFX)上市时间短,仅有小样本研究表明IFX对CD患者的临床缓解、黏膜愈合有一定作用。在临床诊治过程中,临床医师更着重于临床疗效和黏膜改变。本研究旨在综合评估IFX在CD患者的临床疗效、深度缓解、营养状况、精神状况、生活质量、安全性等方面的作用。
1 资料与方法
1.1 研究对象和给药方法 选取2011年8月-2016年10月在安徽医科大学附属安徽省立医院接受IFX(商品名为类克,西安杨森制药有限公司)治疗的22例CD患者。所有研究对象均符合中华医学会炎症性肠病诊断与治疗共识意见(2012年广州)中的CD诊断标准[2],排除临床及随访资料不完整者,IFX注射次数<3次者,有活动性感染包括结核、病毒性肝炎、机会性感染等。所有研究对象分别于第0、2、6周给予5 mg/kg IFX静脉滴注,之后每隔8周各给予1次相同剂量。
1.2 疗效评价
1.2.1 一般资料:包括性别、发病年龄、确诊年龄、病程(自确诊至接受IFX治疗)、就诊原因、病变累及部位、疾病行为、既往腹部手术史、有无吸烟史等。
1.2.2 评价指标:分别于IFX治疗前、每次IFX治疗后、随访终点(2016年10月)对下述指标进行评价及统计学分析。
(1)实验室指标:包括血红蛋白、血小板、白蛋白、血沉(ESR)、C反应蛋白(CRP);(2)症状评估:应用Best的CD活动指数(Crohn’s disease activity index, CDAI),CDAI<150分为临床缓解期;≥150分为活动期,其中150~220分为轻度,221~450分为中度,>450分为重度[2]。(3)黏膜愈合:采用CD简化内镜评分(Crohn’s disease simplified endoscopic score,SES-CD)评估患者黏膜愈合情况,0~2分为黏膜愈合,>2分为未愈合[3]。(4)深度缓解:包括临床缓解和黏膜愈合,即CDAI<150分且SES-CD评分为0~2分[1]。(5)营养状况:包括体质量指数(body mass index,BMI)、营养风险筛查表(nutrition risk screening-2002,NRS-2002)和主观整体营养评分量表(patient-generated subjective global assessment,PG-SGA)。中国人BMI正常范围为18.5~23.9,≥24为超重,<18.5为偏瘦;NRS-2002评分≥3分为具有营养风险,需要根据患者的临床情况,给予营养干预;PG-SGA评分0~1分为营养良好(A级),2~8分为可疑或中度营养不良(B级),≥9分为重度营养不良(C级)[4]。(6)精神状况:采用抑郁评分量表(SDS)、焦虑评分量表(SAS),SAS/SDS评分≤50分为正常;50~60分为轻度焦虑/抑郁,61~70分中度焦虑/抑郁,≥70分重度焦虑/抑郁[5]。(7)生活质量:采用炎症性肠病患者生活质量分析评价表(inflammatory bowel disease questionnaire,IBD-Q),包括肠道症状、全身症状、情感能力、社会能力四个方面,总分值越高,表示生存质量越好[6]。(8)不良反应:记录治疗期间出现的任何不良事件,包括感染、输液反应、迟发型过敏反应、淋巴瘤或恶性肿瘤危险性增加等,记录、评价并描述不良反应的类型、发生及持续时间、采取的措施及与治疗的可能关系。
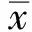
2 结果
2.1 一般资料 共22例患者确诊CD并接受IFX治疗,男17例,女5例,年龄10~45岁,发病年龄(22.9±8.3)岁,确诊年龄(24.9±7.4)岁,平均病程(3.0±3.3)年,就诊原因为腹痛(77.3%,17/22)、腹泻(63.6%,14/22)、消化道出血(13.6%,3/22)、发热(13.6%,3/22)、肠梗阻(9%,2/22)等。截止观察终点,有22例患者在0~6周时接受IFX治疗,14~30周时有18例患者接受IFX治疗,38~54周时有10例患者接受IFX治疗(见表1)。
表1 22例CD患者基本情况 [例数(%)]
Tab 1 Basic conditions of 22 patients with CD [n(%)]

一般情况例数病程(自发病至接受IFX治疗) <1年5(22.7) 1~5年13(59.1) >5年4(18.2)发病年龄(岁) <164(18.2) 16~4017(77.3) >401(4.5)病变累及部位 回结肠20(90.9) 空肠3(13.6) 累及上消化道或伴上消化道病变(炎症、溃疡)5(22.7)腹部手术史3(13.6)疾病行为 非狭窄非穿透12(54.5) 狭窄非穿透8(36.4) 穿透2(9.1)合并治疗 肠内营养8(36.4) AZA20(90.9) CTX、沙利度胺2(9.1)升阶梯治疗4(18.2)降阶梯治疗18(81.8)肛周病变(瘘管、皮赘、脓肿等)12(54.5)口腔溃疡19(86.4)吸烟7(31.8)
2.2 疗效评价
2.2.1 实验室指标:治疗后6周内ESR、CRP、血小板与治疗前相比均明显下降,差异有统计学意义(P<0.05),在0周、2周、6周时分别有54.5%(12/22)、86.4%(19/22)、90.9%(20/22)的患者上述指标恢复正常范围,6周内平均血红蛋白、白蛋白与治疗前相比有所增加。14~30周时,88.9%(16/18)患者ESR、CRP、血红蛋白、血小板水平在正常范围内,94.4%(17/18)患者白蛋白在正常范围,38~54周时100%(10/10)患者实验室指标维持在正常范围内(见表2)。
2.2.2 症状评分:治疗后6周内CDAI评分与治疗前比较均显著下降,差异有统计学意义(P<0.05)。治疗前95.5%(21/22)患者处于活动期(CDAI≥150分),0周、2周、6周临床缓解率分别为68.2%(15/22)、95.5%(21/22)、100%(22/22),治疗14~30周时,88.9%(16/18)患者维持临床缓解。38~54周时100%(10/10)患者达到临床缓解,且在14~30周获得临床缓解的患者均维持临床缓解(见表2)。
表2 治疗前、治疗后0~6周实验室指标和CDAI评分
Tab 2 The laboratory indicators and CDAI score before and after treatment (0~6 weeks)
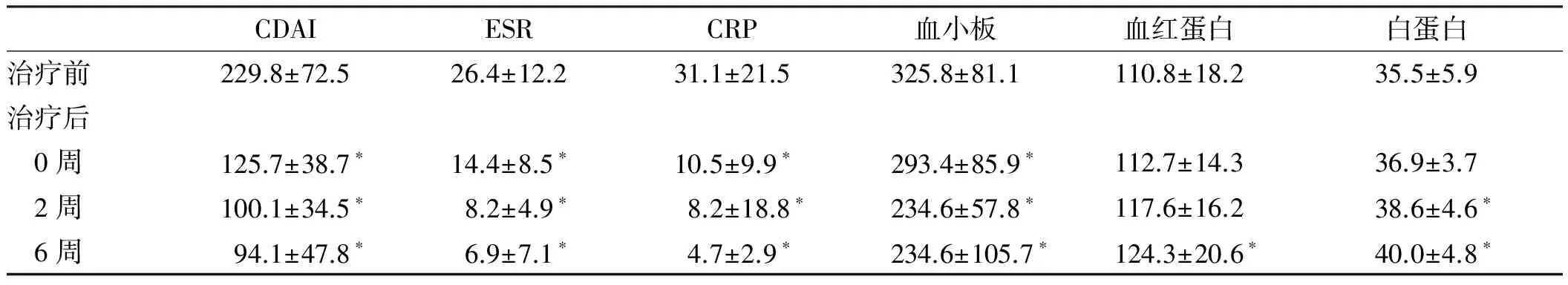
CDAIESRCRP血小板血红蛋白白蛋白治疗前229.8±72.526.4±12.231.1±21.5325.8±81.1110.8±18.235.5±5.9治疗后 0周125.7±38.7∗14.4±8.5∗10.5±9.9∗293.4±85.9∗112.7±14.336.9±3.7 2周100.1±34.5∗8.2±4.9∗8.2±18.8∗234.6±57.8∗117.6±16.238.6±4.6∗ 6周94.1±47.8∗6.9±7.1∗4.7±2.9∗234.6±105.7∗124.3±20.6∗40.0±4.8∗
注:与治疗前相比,*P<0.05。
2.2.3 黏膜愈合及深度缓解:治疗前SES-CD评分为(8.9±1.6)分,36.4%(8/22)患者局部肠腔狭窄,90.9%(20/22)患者回盲瓣受累变形,见溃疡形成。治疗14~30周,SES-CD评分较治疗前明显下降,肠道溃疡的大小、面积、病变范围均较治疗前缩小,16.7%(3/18)患者SES-CD评分≤2分,属黏膜愈合,且CDAI<150分,达到深度缓解。38~54周时,10例患者接受IFX治疗,80.0%(8/10)患者SES-CD评分≤2分且CDAI<150分,达到深度缓解,并在14~30周获得深度缓解的3例患者在38~54周维持深度缓解。6例患者停用IFX予以免疫抑制剂维持治疗,2例在停药10~12个月后内镜下复发,予以激素联合AZA治疗,现达到临床缓解,SEC-CD评分下降,4例停用IFX后一直维持临床缓解,2例患者一直维持深度缓解,最长达3年。
2.2.4 营养状况:治疗前63.6%(14/22)患者BMI<18.5,根据PG-SGA评分,81.8%(18/22)属重度营养不良,根据 NRS-2002评分,72.7%(16/22)患者具有营养风险。治疗0周、2周、6周时BMI较治疗前增加,PG-SGA评分与治疗前相比减少,重度营养不良患者所占比例逐渐下降,分别为72.7%(16/22)、22.7%(5/22)、9.1%(2/22)。治疗14~30周时,44.4%(8/18)患者BMI<18.5,PG-SGA评分明显下降,11.1%的(2/18)患者为营养良好,NRS-2002评分较治疗前有所下降,61.1%(11/18)患者具有营养风险。38~54周时,30.0%(3/10)患者BMI<18.5,60.0%(6/10)患者营养良好,无营养风险(见表3)。
表3 治疗前、治疗后0~6周的BMI,PG-SGA,NRS-2002情况
Tab 3 The BMI,PG-SGA,NRS-2002 score before and after treatment (0~6 weeks)
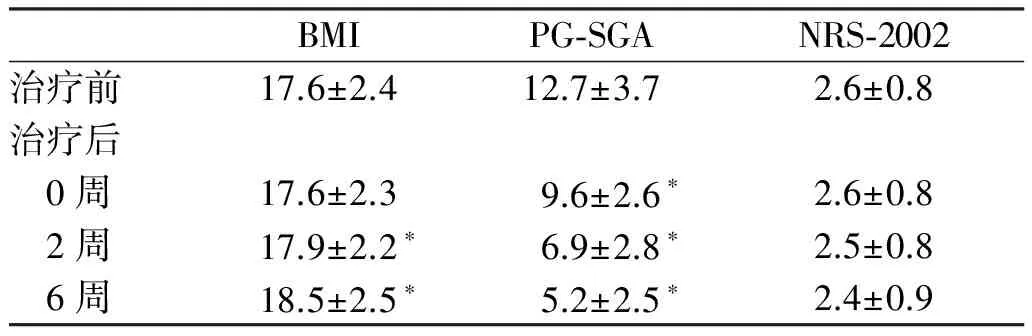
BMIPG⁃SGANRS⁃2002治疗前17.6±2.412.7±3.72.6±0.8治疗后 0周17.6±2.39.6±2.6∗2.6±0.8 2周17.9±2.2∗6.9±2.8∗2.5±0.8 6周18.5±2.5∗5.2±2.5∗2.4±0.9
注:与治疗前比较,P<0.05。
2.2.5 精神状况:治疗前40.9%(9/22)患者伴有焦虑,其中31.8%(7/22)伴有轻度焦虑,9.1%(2/22)伴有中度焦虑;54.5%(12/22)患者伴有抑郁,其中45.5%(10/22)伴有轻度抑郁,4.5%(1/22)伴有中度抑郁,4.5%(1/22)伴有重度抑郁,36.4%(8/22)患者同时伴有抑郁、焦虑;治疗后0周、2周、6周SAS、SDS评分均较治疗前明显下降,差异有统计学意义(P<0.05,见表4)。焦虑患者所占比例逐渐减少,分别为27.3%(6/22)、13.6%(3/22)、4.5%(1/22),抑郁患者所占比例也呈递减趋势,分别为27.3%(6/22)、13.6%(3/22)、13.6%(3/22)。14~54周时无患者伴有抑郁、焦虑。
表4 治疗前、治疗后0~6周SDS、SAS评分
Tab 4 The SDS,SAS score before and after treatment (0~6 weeks)

SDSSAS治疗前48.5±11.146.7±11.5治疗后 0周45.5±10.7∗44.2±10.6∗ 2周44.1±10.1∗42.5±9.9∗ 6周41.2±9.8∗38.3±8.7∗
注:与治疗前相比,*P<0.05。
2.2.6 生活质量:治疗后6周内IBD-Q评分较治疗前增加,在治疗2周、6周时肠道症状、全身症状、情感能力、社会能力四方面评分较治疗前相比,差异有统计学意义(P<0.05)。0周时仅情感能力评分与治疗前相比,差异有统计学意义(P<0.05,见表5)。14~54周时患者IBD-Q评分及四方面评分较治疗前增加。进行相关性分析,治疗前患者SAS评分与IBD-Q评分及肠道症状、全身症状、情感能力呈负相关(r1=-4.47,r2=-4.53,r3=-4.52,r4=-4.47,P<0.05),SDS评分与IBD-Q及其四方面无相关性(P>0.05)。
2.3 不良反应 22例患者IFX治疗及随访期间,无患者出现输液反应、迟发型过敏反应、药物性红斑狼疮、淋巴瘤或恶性肿瘤等,共发生14例次不良反应,包括10例次上呼吸道感染,1例次肺部细菌感染,予以抗生素(三代头孢类)治疗痊愈;1例次肝功能损伤,未予相关处理,1周后复查肝功能正常;1例次白细胞减少(WBC 3.74×109个/L),后自行恢复正常,可能与患者合用硫唑嘌呤引起免疫抑制有关;1例患者有肺结核病史,IFX治疗3次后发生肺结核,可能与IFX引起免疫系统功能降低,导致结核复发有关。
表5 治疗前、治疗后0~6周的IBD-Q评分
Tab 5 The IBD-Q score before and after treatment (0~6 weeks)
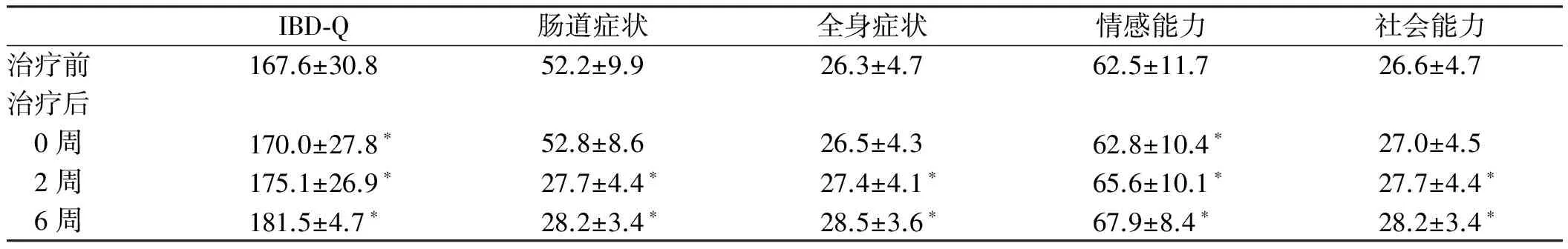
IBD⁃Q肠道症状全身症状情感能力社会能力治疗前167.6±30.852.2±9.926.3±4.762.5±11.726.6±4.7治疗后 0周170.0±27.8∗52.8±8.626.5±4.362.8±10.4∗27.0±4.5 2周175.1±26.9∗27.7±4.4∗27.4±4.1∗65.6±10.1∗27.7±4.4∗ 6周181.5±4.7∗28.2±3.4∗28.5±3.6∗67.9±8.4∗28.2±3.4∗
注:与治疗前相比,*P<0.05。
3 讨论
IFX是一种抗TNF-α人鼠嵌合型单克隆抗体,研究[7]证实cA2对中重度CD患者、激素依赖性患者治疗有效,许多大样本、多中心研究证实其对于活动期、难治性、肛瘘型等CD患者有一定疗效[8]。IFX在中国应用时间短,多数研究集中于临床疗效,有关IFX对CD患者营养状况、精神状况、生活质量的研究较少。
本研究中,首次IFX治疗后即有68.2%(15/22)患者达到临床缓解,2周、6周时临床缓解率分别为95.5%(21/22)、100%(22/22),反映CD活动性的实验室指标包括ESR、CRP、血小板在治疗后6周内明显下降,贫血及低蛋白血症情况也较治疗前明显改善,6周内获得临床缓解并继续接受IFX治疗的患者在54周内均可维持临床缓解。这些研究结果提示IFX可以早期、快速诱导患者达到临床缓解并长期维持。但CD最新的治疗目标不是临床缓解,而是深度缓解,Schnitzler 等[9]的研究纳入214予IFX治疗的CD患者,结果显示临床缓解率为85.5%,黏膜愈合率为67.8%,接近一半的患者达到深度缓解。Molander等[10]研究显示IFX持续治疗至少11个月,43%(79/183)达到深度缓解。中国关于深度缓解的临床研究较少,王新颖等[11]予IFX治疗中-重度CD患者,结果显示治疗14周、30周时深度缓解率分别为34.6%(9/26)、53.8%(14/26),且早期深度缓解的患者能在30周时维持缓解。在本研究中也得出相似结果,治疗14~30周时16.7%(3/18)患者达到深度缓解,38~54周时80.0%(8/10)患者达到深度缓解,并在14~30周获得深度缓解的3例患者在38~54周维持深度缓解。治疗前90.9%(20/22)患为回结肠型,内镜下表现均有回盲瓣受累,如回盲瓣变形、狭窄、深溃疡形成,治疗30周后结肠溃疡愈合较好,以散在浅溃疡、增生为主,但回盲瓣溃疡愈合差,深度缓解率低,治疗54周时,回盲瓣溃疡基本愈合、疤痕形成,达到黏膜愈合标准,深度缓解率高,这提示IFX可诱导并维持CD患者深度缓解,54周时深度缓解率明显高于30周时,IFX对结肠溃疡早期疗效较好,回盲瓣溃疡早期愈合率低,长期治疗可基本愈合。
营养不良是CD患者常见的临床表现之一,肠道病变使机体对蛋白质、微量元素、维生素等吸收减少,同时活动期患者存在高分解代谢状态,能量消耗增加,有些患者因胃肠道症状少食、畏食,以上原因都会导致患者营养不良[12],所以营养支持治疗是CD治疗中的一个重要组成部分。炎症性肠病营养支持治疗专家共识(2013·深圳)[13]推荐使用NRS-2002和PG-SGA二者联合评估患者营养水平并予适当营养干预。王立琼等[14]比较肠内营养与激素治疗对活动期CD儿童的疗效,结果显示治疗12周后,肠内营养组与激素组临床缓解率均达到80%以上,差异无统计学意义,但肠内营养组的内镜下缓解率显著高于激素组(72%vs34.8%)。郭振等[15]对8例活动期CD成年患者予全肠内营养治疗,4周后基本达到临床缓解,2例患者达到黏膜愈合,可以看出全肠内营养可以促使儿童和成人活动期CD患者达到临床缓解和黏膜愈合,对儿童疗效明显优于成人。本研究中,治疗前患者普遍消瘦,根据PG-SGA评分有81.8%(18/22)属重度营养不良,根据NRS-2002评分有72.7%(16/22)患者具有营养风险,治疗后患者体质量增加,营养状况改善,54周时60.0%(6/10)患者营养良好,无营养风险。本研究样本少,不能完全反应CD患者的营养状况,但可提示IFX对改善患者营养状况有一定作用。
CD病程长,易反复,需要长期药物维持治疗,疾病控制不佳时可能会发生出血、穿孔、瘘管等并发症,需要外科治疗,这些必然会影响患者的情绪,Ananthakrishnan 等[16]研究了707例进行肠切除手术并在手术前不伴有抑郁的CD患者,手术后5年16%CD患者伴有抑郁。一项Meta分析表明IBD患者伴有明显的焦虑、抑郁,生活质量低于常人,尤其是青少年IBD患者[17]。本研究显示CD患者发病年龄小,但确诊年龄落往往后于发病年龄2~3年,病程长,治疗前40.9%(9/22)患者伴有焦虑,54.5%(12/22)患者伴有抑郁,生活质量水平低,治疗后6周时仅4.5%(1/22)患者伴有焦虑,13.6%(3/22)伴有抑郁,14~54周时无患者伴有抑郁、焦虑,患者的生活质量明显改善,相关性分析提示患者的焦虑评分与生活质量呈负相关,可以看出CD患者较正常人更易伴有抑郁、焦虑,IFX可以早期改善患者临床症状,减轻痛苦,患者的精神状况和生活质量也随之改善。
相关研究总结了IFX临床研究及上市后的不良反应,包括感染(病毒、败血症、结核),严重药品输注反应,淋巴瘤及其他恶性肿瘤发病危险性增加等[18-19],但IFX临床应用中发生上述不良反应的几率低,以上呼吸道感染最为常见,少数严重不良反应仅个案报道。 Lichtenstein等[20]研究认为IFX治疗炎症性肠病并不影响感染、死亡率或恶性肿瘤的发生率,联合免疫抑制剂治疗的CD患者有较高的恶性肿瘤发病率,但Lichtenstein等[21]在一项大型研究中,对IFX治疗的CD患者随访超过5年以上,发现IFX治疗的患者感染发生率高于其他治疗药物,所以在IFX治疗过程中需要警惕感染的发生。本研究IFX治疗期间,并未发生恶性肿瘤,以上呼吸道感染发生次数最多,少数患者发生肺部细菌感染、肝功能轻度损伤、白细胞减少、肺结核复发,患者均联合免疫抑制剂治疗,分析不良反应的发生可能与IFX、免疫抑制剂导致免疫功能低下有关。
本研究样本量小,但通过临床观察、长期随访及数据分析,可以看出IFX可早期诱导并维持CD患者临床缓解,长期治疗可诱导、维持深度缓解,CD患者较正常人更容易伴有抑郁、焦虑,生活质量下降,早期临床缓解可明显改善患者精神状况,提高生活质量,今后有待进一步完善大型多样本研究,为临床诊治提高更多的参考依据。
[1]Panaccione R, Hibi T, Peyrin-Biroulet L, et al. Implementing changes in clinical practice to improve the management of Crohn’s disease.[J]. J Crohns Colitis, 2012, 6 Suppl 2: S235-S242.
[2]中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年·广州)[J]. 胃肠病学, 2012, 51(12): 763-781. Cooperative Group of Inflammatory Bowel Diseases of Digestive Disease of Chinese Medical Association. Chinese consensus on standard management of inflammatory bowel diseases (2007, Guangzhou) [J]. Gastroenterology, 2012, 51(12): 763-781.
[3]Sipponen T, Nuutinen H, Turunen U, et al. Endoscopic evaluation of Crohn’s disease activity: comparison of the CDEIS and the SES-CD [J]. Inflamm Bowel Dis, 2010, 16(12): 2131-2136.
[4]石英英, 张晓伟, 袁凯涛, 等. PG- SGA操作标准介绍[J].中华肿瘤防治杂志, 2013, 20(22): 1779-1782. Shi YY, Zhang XW, Yuan KT, et al. Introduction to PG-SGA operating standards [J]. Chin J Cancer Prev Treat, 2013, 20(22): 1779-1782.
[5]张春霞, 吴小平. 心理因素与炎症性肠病关系研究的现状与展望[J]. 医学新知杂志, 2015, 25(4): 217-219. Zhang CX, Wu XP. Present situation and prospect of the relationship between psychological factors and inflammatory bowel disease [J]. Journal of New Medicine, 2015, 25(4): 217-219.
[6]李如源, 杨雪松, 穆尔扎·别克, 等. 炎症性肠病患者健康相关生活质量评价研究[J].中华消化杂志, 2012, 32(1): 24-28. Li RY, Yang XS, Bike ME, et al. The evaluation of health-related quality of life in patients with inflammatory bowel disease [J]. Chin J Dig, 2012, 32(1): 24-28.
[7]van Dullemen HM, van Deventer SJ, Hommes DW, et al. Treatment of Crohn’s disease with anti-tumor necrosis factor chimeric monoclonal antibody (cA2) [J]. Gastroenterology, 1995, 109(1): 129-135.
[8]Rutgeerts P, Van Assche G, Vermeire S. Optimizing anti-TNF treatment in inflammatory bowel disease [J]. Gastroenterology, 2004, 126(6): 1593-1610.
[9]Schnitzler F, Fidder H, Ferrante M, et al. Mucosal healing predicts long-term outcome of maintenance therapy with infliximab in Crohn’s disease [J]. Inflamm Bowel Dis, 2009, 15(9): 1295-301.
[10]Molander P, Sipponen T, Kemppainen H, et al. Achievement of deep remission duringscheduled maintenance therapy with TNFα-blocking agents in IBD [J]. J Crohns Colitis, 2013, 7(9): 730-735.
[11]王新颖, 陈昭, 王国振, 等. 英夫利西单克隆抗体诱导和维持26例中重度克罗恩病患者深度缓解的疗效分析[J]. 中华消化杂志, 2014, 34(12): 811-816. Wang XY, Chen Z, Wang GZ, et al. Efficacy of infliximab monoclonal antibody in the induction and maintenance of 26 patients with moderate to severe Crohn’s disease [J]. Chin J Dig, 2014, 34(12): 811-816.
[12]Lochs H, Dejong C, Hammarqvist F, et al. ESPEN guidelines on enteral nutrition-gastroenterology.[J]. Clinical Nutrition, 2006, 25(2): 260-274.
[13]中华医学会消化病学分会炎症性肠病组. 炎症性肠病营养支持治疗专家共识(2013·深圳)[J]. 中华内科杂志, 2013, 52(12): 1082-1087. Cooperative Group of Inflammatory Bowel Diseases of Digestive Disease of Chinese Medical Association .Inflammatory bowel disease nutritional support treatment expert consensus (2013 Shenzhen) [J]. Chin J Intern Med, 2013, 52(12): 1082-1087.
[14]王立琼, 金向群, 赵红琳,等. 肠内营养与激素治疗对儿童克罗恩病的疗效对比研究[J]. 临床军医杂志, 2014, 42(12): 1227-1230. Wang LQ, Jin XQ, Zhao HL, et al. Enteral nutrition versus corticosteroids in treatment of active pediatric Crohn’s disease[J]. Chin J Med Offic, 2014, 42(12): 1227-1230.
[15]郭振, 朱维铭, 龚剑峰, 等. 全肠内营养对成人活动期克罗恩病患者黏膜愈合效果的研究[J]. 中华消化杂志, 2013, 33(12): 831-834. Guo Z, Zhu WM, Gong JF, et al. Effect of total enteral nutrition on mucosal healing in Crohn’s patients with adult activity [J]. Chin J Dig, 2013, 33(12): 831-834.
[16]Ananthakrishnan AN, Gainer VS, Cai T, et al. Similar risk of depression and anxiety following surgery or hospitalization for Crohn’s disease and ulcerative colitis [J]. Am J Gastroenterology, 2013, 108(4): 594-601.
[17]Greenley RN, Hommel KA, Nebel J, et al. A meta-analytic review of the psychosocial adjustment of youth with inflammatory bowel disease [J]. J Pediatr Psychol, 2010, 35(8): 857-869.
[18]Nyboe Andersen N, Pasternak B, Friis-Mller N, et al. Association between tumour necrosis factor-α inhibitors and risk of serious infections in people with inflammatory bowel disease: nationwide Danish cohort study [J]. BMJ, 2015, 350: h2809.
[19]Peyrin-Biroulet L, Deltenre P, de Suray N, et al. Efficacy and safety of tumor necrosis factor antagonists in Crohn’s disease: meta-analysis of placebo-controlled trials [J]. Clin Gastroenterol Hepatol, 2008, 6(6): 644-53.
[20]Lichtenstein GR, Rutgeerts P, Sandborn WJ, et al. A pooled analysis of infections, malignancy, and mortality in infliximab- and immunomodulator-treated adultpatients with inflammatory bowel disease [J]. Am J Gastroenterol, 2012, 107(7): 1051-1063.
[21]Lichtenstein GR, Feagan BG, Cohen RD, et al. Serious infection and mortality in patients with Crohn’s disease: more than 5 years of follow-up in theTREAT registry [J]. Am J Gastroenterol, 2012, 107(9): 1409-1422.
(责任编辑:陈香宇)
Primary studies on comprehensive clinical efficacy of Infliximab in Crohn’s disease
ZHU Xiuli, WANG Qiaomin, JIA Yong, WU Zhengxiang, JIANG Qiuxia, WANG Jiajia
1.Department of Gastroenterology, Anhui Provincial Hospital Affiliated to Anhui Medical University, Hefei 230001, China
Objective To investigate the effect of Infliximab (IFX) on clinical symptoms, mucosal healing, nutritional status and mental status of patients with Crohn’s disease (CD).Methods The clinical data of CD patients who received IFX treatment from Aug. 2011 to Oct. 2016 were collected, including laboratory indexes, CDAI, SES-CD, NRS-2002, PG-SGA, SDS, SAS and IBD-Q.Results The clinical remission rates were 68.2% (15/22), 100% (22/22) at 0, 6 weeks after treatment, respectively. 88.9% (16/18) of the patients maintained clinical remission at 14 to 30 weeks, 100% (10/10) maintained clinical remission at 38 to 54 weeks. The deep remission rates was 16.7% (3/18) at 14 to 30 weeks, 80.0% (8/10) at 38 to 54 weeks. According to the PG-SGA score, 81.8% (18/22) were severe malnutrition before treatment, 60.0% (6/10) of the patients had good nutrition and no nutritional risk at 38 to 54 weeks. Before treatment, 40.9% (9/22) patients were associated with anxiety, 54.5% (12/22) patients with depression. At 6 weeks after treatment, SAS and SDS scores were significantly lower than before treatment (P<0.05). At 14 to 54 weeks, the patients had no depression and anxiety, while the IBD-Q score was significantly increased after treatment(P<0.05).Conclusion IFX can induce and maintain clinical remission in patients with CD early. Long-term treatment can induce and maintain deep remission. In CD patients, the incidence of depression and anxiety is high and the quality of life is low. Early clinical remission can significantly improve the patients mental state and quality of life.
Crohn’s disease; Infliximab; Deep remission; Nutrition
朱秀丽,在读研究生,研究方向:IBD。E-mail:zhuxiuli0724@163.com
王巧民,主任医师,研究方向:IBD、IBS。E-mail:wqmin928@163.com
10.3969/j.issn.1006-5709.2017.04.015
R574.62
A
1006-5709(2017)04-0418-05
2016-11-16

