海底边界层溶解氧通量原位观测技术方法研究
崔尚公,于新生,2*,赵广涛,2,张晓东,2
(1.中国海洋大学 海洋地球科学学院,山东 青岛 266100;2.海底科学与探测教育部重点实验室,山东 青岛 266100)
海底边界层溶解氧通量原位观测技术方法研究
崔尚公1,于新生1,2*,赵广涛1,2,张晓东1,2
(1.中国海洋大学 海洋地球科学学院,山东 青岛 266100;2.海底科学与探测教育部重点实验室,山东 青岛 266100)
海底边界层是溶质和悬浮颗粒物在海床与水体间交换的重要场所,也是沉积物质的主要成岩作用区,对海洋、湖泊有着重要的生物、化学、地质学意义。底栖溶解氧消耗速率是评估早期碳矿化作用的重要指示剂,也是研究元素循环周转的重要指标。溶解氧通量原位监测技术是获取底栖溶解氧消耗速率、了解化学物质输运机制,进而研究底栖生态系统、环境污染影响、生物地球化学进程的重要手段。针对传统溶解氧观测方法在效率和准确度上的局限性,介绍了目前底边界层原位氧通量测量技术的发展现状,对包括底栖培养室、微电极剖面、涡动相关技术和平面光极系统在内的观测特点进行了对比分析,讨论了各自的不足与局限,提出了今后需要关注的改进方向。
溶解氧;沉积物-水界面;底栖培养室;微电极剖面;涡动相关;平面光极
占地球表面积约70%的海洋底部区域是物理、化学、生物、地质作用相互交汇的复杂场所[1],其间既有热量、溶质进行界面间的频繁交换,也存在着有机质成岩作用,同时还是底栖动植物、微生物栖息的重要场所[2],进而形成了特殊的底栖环境[3]。海底边界层(Benthic boundary layer,BBL)是指海底沉积物及沉积物—水界面 (Sediment-water interface,SWI)之上的水体区域,其理想分层模型如图1所示。在对数层中,流体的平均速度随高度呈对数形式增加;在黏滞层,垂直湍流运动和波浪能量消耗殆尽,溶质输运以动量黏滞迁移为主;在扩散边界层中分子扩散效应超过涡流扩散,成为溶质输运的主导进程。对于多孔砂质沉积而言,沙粒间的孔隙对流会对沉积物和水体间通量产生显著影响。此外,包括生物扰动、回灌在内的各种生物活动也是影响界面间溶质和颗粒物交换的关键要素之一[4]。
无论是浅海还是深海,氧都是海底边界层内元素循环周转的关键指标之一。氧由植物、微生物通过光合作用生成,再通过两种途径被消耗:(1)动物、细菌的好氧异养活动;(2)厌氧异养生物降解期间释放的还原无机产物再氧化[5](见图1)。当沉积物中厌氧矿化的降解无机溶质在沉积物中被完全氧化,总底栖耗氧(total benthic O2uptake,TOU)便可近似作为总底栖碳矿化的代理指标[6]。在评估环境的生态学意义和诸如C,N,P,S等元素循环时,准确的溶解氧通量动态变化资料对生物地球化学循环分析结果显得至关重要[7]。
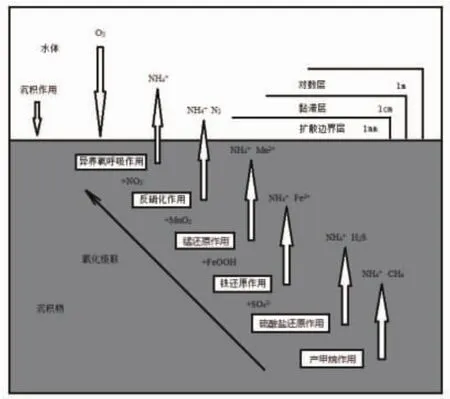
图1 水底边界层理想模型及主要成岩作用示意图[8]
受水下复杂环境影响,目前人们对于海底的物质通量动态过程缺乏深入了解,对底栖溶解氧在生态环境及全球生物地球化学循环中的贡献缺乏系统的认识,其主要原因是缺少海底的长时序实时观测资料。因此发展沉积物—海水界面原位观测技术对深入开展生态、环境、全球气候变化研究至关重要。传统的底栖溶解氧测量方法是通过科考船在现场利用沉积物取样器进行沉积物及水体取样,然后带回实验室做进一步分析[9]。经过几十年不断发展,传统的实验室分析方法趋于成熟,凭借其操作的便捷性和低成本特点,目前仍然是较为常用的评估手段[10]。但传统方法在采集过程中会改变液体静压力、温度以及其他物理和化学条件,容易在操作或置放容器等操作环节中对样品产生污染;其次,受科考船航次及气候变化等因素的制约,传统方法难以保证长时序实时连续监测,导致观测资料无法体现连续的变化过程;另外,传统方法也无法模拟原位温度、光照以及底栖生物扰动及回灌等特性对测量结果产生的影响[11]。Rolley和Owens[12]发现利用沉积物柱状样在实验室内进行分析会将耗氧速率低估约15%,James[13]发现样品实验室分析的耗氧量结果与理论计算相差48%,认为在采集样品和搬运过程中沉积物孔隙水流失会导致其氧梯度分布结构产生变化。Rasmussen和Jorgensen通过对比实验发现现场微电极原位观测方法与实验室分析方法在夏季年平均测量值可相差30%[14],Wenzhoefer和Glud观测到原位测量方法与实验室分析方法在深海的观测结果相差1倍,在大陆架处可相差3~4倍[15]。因此发展沉积物—海水界面原位观测新技术新方法对深入开展生态、环境、全球气候变化研究至关重要。
为克服传统方法存在的问题,近几十年来开发了多种原位现场监测技术,用于对底栖氧通量进行定量评估,获取沉积物-水界面的小尺度范围内的长周期、连续的高时空分辨率变化数据。本文归纳总结了这些海底边界层原位氧通量测量的技术方法,对包括底栖培养室、微电极剖面、涡动相关技术和平面光极系统在内的主要原位观测技术进行了对比分析,阐述了不同观测方法的应用及发展现状,讨论了各方法及技术的特点,期望促进海底边界层溶解氧通量原位观测新技术与新方法的发展。
1 底栖溶解氧通量原位监测技术
1.1 底栖培养室技术
底栖培养室技术起源于19世纪60年代中期,到70年代末,已经成为检测沉积物与水界面溶质交换的主要技术手段。该技术的测量原理是采用工程塑料和橡胶制作的钟罩型、圆柱型或方盒型开口箱体,将开口端嵌入到表层沉积物几厘米至几十厘米处,使得已知面积区域的沉积物及其上覆水体在海底呈封闭状态(见图2),同时通过在箱体上装配的序列注射式水样采集器接口或嵌入传感器对封闭上覆水中的如O2、H2S等化学物质浓度进行实时跟踪采样或测量。采集的液体样品可用于后期实验室分析,用于检测液体内的金属及无机物浓度含量变化。通过平均浓度变化速率时间序列进行相关性分析,可以评估封闭上覆水中的溶质通量的变化[16-18],沉积物—水界面的总氧交换通量计算公式如式(1)所示:

式中:ΔC为溶解氧浓度变化量;Δt为布设培养时间;V为箱室上覆水体积;A为箱室覆盖沉积物面积[19]。一般来说,封闭的上覆水中O2起始变化速率是近似线性的,底栖耗氧速率可以通过线性拟合进行计算。

图2 底栖通量室结构示意图
德国马克普朗克海洋微生物学研究所在2005年研制了带有新型嵌入控制系统和搅拌系统的“Sandy”底栖培养室来评估对流输运对溶质通量的贡献;西班牙加迪斯大学在2008年开发了配有水下离心泵搅拌系统的培养室;法国布雷斯特研究所在2010年研制了工作水深6 000 m的CLAMAR培养室[20-22]。目前报道的底栖培养室检测溶解氧浓度的精度已到达2 μmol/L的低浓度检出限,布设时长可达90 h以上。
底栖培养室最显著的优点在于可以简便直接地测量沉积物—水界面上由分子扩散耗氧(diffusive O2uptake,DOU)和生物耗氧 (benthos mediated O2uptake,BMU)组成的总底栖耗氧(TOU)。表1列出了近期使用过的培养室应用。大型培养室便于获取较全面的由底栖生物活动引起的溶解氧时空变化数据,为深入了解海底局部沉积异质性变化过程提供可靠数据资料。但是,培养室只能测量总底栖耗氧,因此随着覆盖面积的增大,其空间分辨率会随之降低。在时间尺度上,根据Bender等人研究发现,培养室内水体成分会随时间推移发生变化,进而改变沉积物—水界面的浓度梯度,使得测量的浓度—时间曲线发生弯曲,导致线性拟合得到的通量值要比非线性模型计算的平均低23%,但在10~20 h的时间范围内,线性拟合计算结果还是满足研究需求的[23]。此外,虽然在溶质交换以分子扩散为主的非渗透性沉积物中,底栖培养室方法可以获得较为准确的结果,但在浅海广泛存在的沙质沉积区,底栖室系统无法提供准确的通量[24-26]。这是由于渗透性沉积物中波浪和波形底纹间的相互作用使孔隙水间的对流迁移成为主要的输运机制,而底栖培养室封闭了区域沉积物与上覆水,影响了水体自然流动和水结组分的自然交换,这些外界动力环境变化无法在封闭的箱室系统中再现。为减小这种影响,通常会在底栖通量室内安装一个搅拌或水循环系统,在沉积物表面产生一个已知的压力梯度分布[27]。在实际观测过程中,为保证封闭箱体内上覆水空间体积的精度,底栖通量室系统在现场布设时还需要考虑精确插入深度问题及箱室下沿插入沉积物的控制方式问题。这些控制方式增加了底栖通量室实际应用的复杂性和成本。

表1 近期基于原位底栖通量室的实时观测应用
1.2 微电极剖面技术
微电极剖面技术的测量原理如图3所示,其采用水下电机,譬如步进马达,将溶解氧微电极以微米为单位从上覆水开始缓慢穿过沉积物—水界面逐步刺入沉积物中,检测不同深度位置的氧浓度,获得垂直方向氧浓度剖面分布信息,实现沉积物—水界面扩散边界层中的变化过程测量。根据修正的菲克第一扩散定律,扩散通量与浓度梯度符合下列关系:

式中:Φ为沉积物表面孔隙率;Ds为氧分子扩散系数为沉积物-水界面浓度梯度[9]。
与底栖通量室不同,微电极剖面技术并没有将沉积物与水体封闭起来,而是直接将氧微电极刺入了沉积物内测定孔隙水中的氧渗透深度和动态变化。因此,微电极剖面技术可以直接、简便地在自然水动力条件下测量分子扩散耗氧(DOU),并且可以进而通过氧浓度线性分布、剖面拐点计算出扩散边界层厚度,实现空间小尺度孔隙水内氧浓度监测。在时间尺度上,单一剖面的测量时间是由剖面深度、步进间隔决定的,一般为30 min~1 h左右。由于高分辨率的微电极测量会扰动沉积物使局部氧通量发生变化[33],因此在电机步进过程中需要间歇时间,保证界面梯度重新接近稳定再进行测量。其实际调整时间取决于初始剖面分布特征和干扰程度,总体以5~30 min为宜。
目前,溶解氧微电极主要有3种类型(见表2)。简单的阴极类型氧微电极最早应用于沉积物—水界面氧分布研究[34],但由于其无法保证良好的线性效应会产生持续的电流漂移,稳定性极易受到环境条件影响,因此无法满足氧浓度微剖面测量需求[35-36];改进的Clark型微电极具有完美的线性校准曲线,响应时间(t90)可达0.1 s,受外部介质干扰变化较小(<1%~2%),是目前生物地球化学测量应用较广的微电极传感器;伏安微电极主要用于电化学研究,由于其测定时会消耗大量的氧,破坏局部浓度梯度,且响应时间(几分钟)远远慢于其他类型微电极,因此在现场环境观测中很少使用。Revsbech等[37]在1983年利用溶解氧微电极测量了Solar湖微生物垫的溶解氧剖面;Sweerts等[38]在1991年测量了Vechten湖深层腐殖黑泥中的O2,NH4+,S2-浓度剖面,分析了不同氧化进程对氧消耗的占比情况;汪嘉宁等[39]在2010年对青岛会场湾淤泥潮滩进行了微剖面观测,探究了流速与DBL厚度的关系。

图3 溶解氧浓度剖面装置示意图及实测数据图[44]

表2 不同类型溶解氧微电极特性
微电极剖面技术的问题在于虽然其垂直分辨率很高,但仅能获取一维梯度溶解氧通量信息,无法反映远离氧微电极穿透区域的生物扰动和灌洗作用的影响[25-26];并且由于微电极尖端非常细,在实际观测应用中极易导致微电极的损坏,同时微电极的使用寿命短也是其在实际应用中需要克服的问题。
1.3 涡动相关技术
涡动相关技术原是大气科学领域中测定陆—气、海—气边界层CO2、湿度和能量交换的方法,Berg等[5]人在2003年首次将其应用于水底边界层界面,实现了水体耗氧通量的测量。涡动相关技术的基本原理是利用溶解氧微电极测量距海底15~30 cm固定一点的氧浓度,同时使用多普勒矢量流速仪(Acoustic Doppler Velocimeter,ADV)对溶解氧浓度测点位置的水流垂向流速进行测量,之后将二者以极高的频率进行拟合计算氧通量,如图4所示[45]。水体中任意位置任意时间点由于平流和分子扩散作用导致的垂向O2通量的数学表达式为:
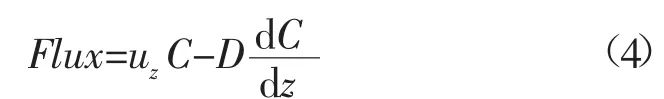
式中:uz为垂向速度;C为氧浓度;D为水体中O2的分子扩散系数为沉积物—水界面浓度梯度。由于测量位置位于对数层,式(4)中分子扩散项被省略,经过雷诺分解与简化,实际应用中的O2通量可以通过如下公式计算得出[5]。

式中:u'z为垂向速度波动;C'为氧浓度波动。
与底栖培养室和微电极剖面方法不同,涡动相关技术既没有封闭沉积物水体,也没有将微电极插入沉积物,因此可以获得无人为干扰的原位数据[24],Hume等人在2011年对海草区进行涡动氧通量观测发现,在高流速环境下(7.5~10 cm·s-1),涡动相关结果是底栖培养室结果的2~6倍[46]。由于不接触海床,因此系统布设不会被诸如沉积物渗透性、地形、植被等海底特征所限。2011、2012和2013年美国弗吉尼亚大学分别在海草区、海冰区和珊瑚礁区等其他方法无法布设的地形实施了涡动相关操作[46-48]。从本质上说,涡动相关技术是在沉积物—水界面之上可忽略的高度对底部探测区域垂向通量进行统计学近似。其指示区域面积与测点高度、沉积物表面粗糙程度有关,一般来说可以达到10~50 m2[49],这也从某种程度上解决了底栖观测中的空间异质性问题。Berg等人在2009年日本Sagami湾1 450 m深海使用培养室、微电极剖面和涡动相关方法进行了氧通量对比观测,三者结果分别为1.62±0.23(SE,n=7);1.65±0.33(n=2);1.43±0.15(n=25)mmol·m-2·d-1,较为一致的数据表明在低流速下,三种方法获得的结果是近似的,且涡动相关方法也具有极高的(<1mmol·m-2·d-1)的氧通量分辨率。在时间分辨率上,由于ADV和溶氧涡动电极具有高达16~64 Hz的采样频率,在进行高频拟合后可以在分钟水平上得到沉积物氧通量中的高时序变化,改善了其它方法仅能在小时到天水平上解决高时序变化的问题[26]。
由于进行统计学近似,该技术对所用传感器的精度及后期数据处理方法要求极其严格。Lorri等人通过对底边界层自然水动力不同湍流尺度的分析,测算出应用于涡动相关技术的流速和溶解氧传感器至少应分别具有0.001 m·s-1和0.012 mmol·m-3的精度,才能捕获所有最小湍流波动[50]。经过10余年发展,目前涡动相关技术的数据处理流程已逐步统一明确(见图5)。在数据统计上,为减小风、潮汐、强烈O2源汇效应对流速、O2浓度造成的瞬时影响,需合理延长统计区间,以15 min~1 h为宜[51]。

图4 涡动相关技术示意图

图5 涡动相关数据处理流程
但是,涡动相关技术与传统方法相比,造价昂贵,技术应用难度很大,对微电极及仪器的要求也更高,O2浓度涡动测量需要快速响应微电极(t90<0.4 s),但此类电极寿命仅为2~6个月[51]。且对于涡动相关技术应用于氧通量测量来说,需要复杂的数据处理与解释来划分大尺度对流和小尺度涡动的贡献边界,这也是极为困难的[52]。
1.4 平面光极技术
由于传统微传感器监测技术只能获取上覆水和沉积物内的一维数据,若要获取二维空间的氧分布变化信息,需要使用多个微电极在水平方向上移动,然后重复地进行垂直方向上的测量,这使得系统结构和控制变得复杂,水下操作难度加大。同时由于广泛使用的微电极存在寿命短、对压力变化敏感、测量过程中会消耗氧等缺陷,促使人们将目光转移到光化学传感技术上来[53]。
平面光极技术的溶解氧浓度测量是基于荧光淬灭机理,将对氧分子具有荧光淬灭作用的试剂作为荧光指示剂,包埋在高分子薄膜中,制成厚度约10 μm的传感膜。由于O2分子与荧光指示剂相互作用,导致荧光强度的衰减或荧光寿命的变化,该变化与溶解氧浓度关系可以用修正的Stern-Volmer方程表示:

式中:τ0和τ分别为无氧和有氧条件下的荧光寿命;I0和I分别为无氧和有氧条件下的荧光强度;KSV为双分子猝灭系数;[O2]为O2浓度,frac为分级因子,即参与荧光猝灭的指示剂分子百分比。通过校准确定I0,I,KSV,frac等系数,利用式(3)可计算出氧浓度[O2][54]。基于荧光强度的测量容易受外界照射强度、光照不均匀及荧光指示剂分布等因素的影响,导致测量精度及稳定性变差;而基于荧光寿命的测量依赖于荧光指示剂的本征参量,具有较高的抗外界光干扰能力,具备较好的准确性和稳定性,但是荧光寿命范围为微秒级或毫秒级,需要配置复杂的触发控制电路,使得观测仪器的制作变得复杂。因此现今更多采用比率检测法,其利用同时测量荧光激发强度与参考光的比值,可以消除荧光强度测量存在的对环境因素敏感的不足,同时不需要复杂的控制电路系统,可以获取两维溶解氧分布信息[55]。
1996 年,Glud等[56]利用氧分子的荧光猝灭原理制作了平面溶解氧光极,并将平面氧光极首次应用于沉积物—水界面溶解氧的观测应用,得到了具有较传统方法时空分辨率更佳的O2分布。另外,采用1 000×1 000像素的数字成像系统,从平面光极图像可以同时提取几百个溶解氧垂直剖面分布曲线。2001年德国马克普朗克海洋微生物学研究所首次开发出原位平面光极溶解氧观测的装置(见图6)。在实际应用中,首先利用电机将带有平面光极的传感器窗步进插入沉积物之后,利用发光二极管作为激发光源,荧光经过滤光片,由相机的电荷耦合靶面(CCD)接收,根据图像中像素的光强分布即可计算各点像素O2浓度[57]。该装置空间分辨率可达50× 50 μm/像素,响应时间约为300~400 s。中国海洋大学在2014年制备了响应时间约为20 s的平面光极传感膜,其对沉积物—水界面的测量结果如图7所示。
平面光极由于在测量过程中不消耗氧,且不需要参比电极,因此具有较长的使用寿命,可以对指定区域进行长期连续观测。另外,平面光极避免了微电极应用中会产生电磁噪声干扰的问题,制作成本较微电极也要低廉得多,具有较好的灵活性和较高的两维时空分辨率。但是和微电极剖面方法类似,平面光极在插入沉积物时会对界面的结构产生干扰;另外,平面传感薄膜的材料可能会对掘穴生物产生吸引或排斥影响,导致生物灌洗作用的改变[8]。目前,有关平面光极技术的许多应用理论和技术仍集中在对传感膜性能的改进上,对野外原位观测的研究还需进一步完善,如传感膜机械强度、灵敏性、响应时间、现场应用时插入深度控制等问题。
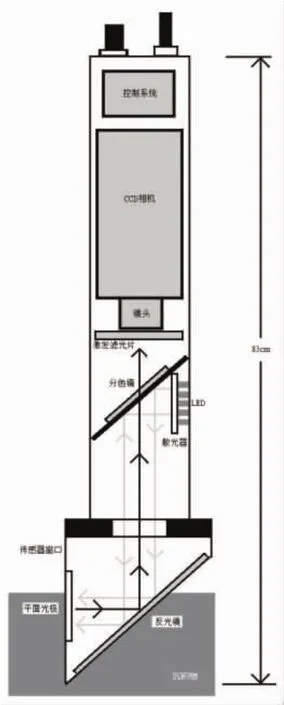
图6 原位平面光极装置示意图[57]

图7 平面光极传感膜对沉积物-水界面的测量结果[55]
2 结论与展望
海水中的溶解氧含量变化是底栖碳矿化作用和初级生产力研究中广泛应用的重要指标。准确快速地监测溶解氧通量变化对研究生物生长状况和污染程度具有重要意义。近几十年来,溶解氧原位监测技术迅速发展,特别是新的溶解氧微传感技术的不断发展,使得通量测量的精度、时间和分辨率都大大提高。但是目前现有的原位监测技术尚没有一种溶解氧原位检测技术能够在稳定性、简易性、沉积异质性反映程度、监测时间尺度等方面完全满足底边界层溶解氧测量要求。
底栖通量室技术成形最早,凭借操作简便、可以覆盖相对较大面积的海床这一优势,已成为应用最广的原位通量监测手段。但封闭的箱室阻塞水体流动,无法还原自然水动力影响的弊端在渗透性大的砂质沉积中依然尤为明显。微电极剖面技术装置较为简易,操作方便,通过将微电极刺入沉积物可以获得孔隙水溶氧数据,但其测量的是局部有限点的一维梯度通量。可以获取二维平面氧分布图像的平面光极手段可以提供高时空分辨率的边界层溶解氧分布信息,但传感膜的机械强度及响应时间等问题依然有待于进一步改善。涡动相关技术是近几年才发展起来的新方法,其改变了传统插入沉积物测量的方法,在海床之上通过浓度与流速的数据拟合计算氧通量,是目前测量原理上最具潜力的检测技术。排除对设备要求过高、造价昂贵等方面因素不谈,涡动相关技术在灵敏度、响应时间、测量时间尺度上是最佳选择,具备极大优势。表3对4种原位观测方法的特性进行了直接对比,可以看出各种原位观测方法在特定环境中均拥有独特的优势,因此,可以根据不同的观测研究区域选取多种溶解氧底栖通量原位检测方法,形成互补,获取更加全面的观测资料。
在海底边界层溶解氧原位观测中,其核心是原位溶解氧传感器,表4给出了目前已经商品化的溶解氧传感器主要技术指标,在实际观测中应根据所实际观测实验需求,选择合适的精度、灵敏度、响应时间的溶解氧传感器。

表3 4种溶解氧观测技术对比

表4 目前商品化的原位溶解氧传感器比较
针对海底环境的复杂性及观测资料的需求,海底边界层溶解氧通量原位监测方法依然面临着一系列挑战。今后原位监测技术改进可从以下几个方面入手:
(1)原位观测仪器设备的小型化、智能化。新一代溶解氧通量原位观测仪器设备结构要尽可能减小对沉积物—水界面的扰动与破坏。针对不同海底地质属性,仪器设备应具有自动判别和调节功能,以满足海底生物地球化学研究构建数值模型的不同需求。
(2)开发新型传感器。溶解氧传感器是底栖监测中最重要的工具,直接关系到获取数据的准确性与有效性。面对海底长时序的连续观测需求,开展新材料、新型传感器的研究是提高传感器的灵敏度、精度、低功耗、响应时间、水下工作稳定性,以及获取可靠的边界层溶解氧通量资料的保障,将为开展底栖通量微观变化研究提供更好的视野。
(3)完善应用理论。平面光极和涡动相关技术发展时间不长,这些方法应用于野外实际工作的机理及复杂环境下的数据质量还需进行深入的研究。我国在这方面的研究起步较晚,加强研究和开发底栖通量监测技术体系势在必行。
(4)多功能观测方法的集成应用。目前尚未有某一种观测技术能够满足各种复杂环境下的不同观测需求,因此结合实验室分析仪器工作原理,开发多种功能的原位观测仪器,拓展原位观测仪器设备的应用范围将是未来发展的方向之一。
参考文献:
[1]Khalil K,Raimonet M,Laverman A,et al.Spatial and temporal variability of sediment organic matter recycling in two temperate eutrophicated estuaries[J].Aquatic Geochemistry,2013,19(5):517-542.
[2]Lorke A,Wuest A.Application ofcoherent ADCP for turbulence measurements in the bottomboundarylayer[J].Journal ofAtmospheric &Oceanic Technology,2005,22(11):1821-1828.
[3]Attard K,Hancke K,Sejr MK,et al.Benthic primary production and mineralization in a High Arctic Fjord:In situ assessments by aquatic eddycovariance,Marine EcologyProgress,2016,554:35-50.
[4]Boudreau B P,Jorgensen B B.The benthic boundary layer:transport processes and biogeochemistry[M].NewYork:Oxford University Press,2001:4-6.
[5]Berg P,Roey H,Janssen F,et al.Oxygen uptake by aquatic sediments measured with a novel non-invasive eddy correlation technique [J].Marine EcologyProgress,2003,261(8),75-83.
[6]Hartnett HE,Keil RG,AL E,et al.Influence of oxygen exposure time on organic carbon preservation in continental marine regions[J]. Nature,1998,391(6667):572-575.
[7]Tahey TM,Duineveld GCA,Berghuis EM,et al.Relation between sediment-water fluxes of oxygen and silicate and faunal abundance at continental shelf,slope and deep-water stations in the northwest Mediterranean[J].Marine Ecology Progress,1994,104(1-2): 119-130.
[8]Glud RN.Oxygen dynamics ofmarine sediments[J].Marine BiologyResearch,2008,4(4):243-289.
[9]Archer D,Devol A.Benthic oxygen fluxes on the Washington shelfand slope:A comparison ofin situ microelectrode and chamber flux measurements[J].Limnology&Oceanography,1992,37(3):614-629.
[10]Abe K,Tsujino M,Kazama T,et al.Underestimation of nutrient fluxes due to possible bacterial activity during a core incubation experiment[J].Journal ofOceanography,2015,71(3):1-8.
[11]Tengber A,Bovee FD,Hall P,et al.Benthic chamber and profiling landers in oceanography-A reviewof design,technical solutions and functioning[J].Progress in Oceanography,1995,35(3):253-294.
[12]Rolley HLJ,Owens M.Oxygen consumption rates and some chemical properties of river muds[J].Water Research,1967,1(11-12): 759-766.
[13]Jame A.The measurement ofbenthal respiration[J].Water Research,1974,8(11):955-959.
[14]Rasmussen H,Jorgensen BB.Microelectrode studies on seasonal oxygen uptake in a coastal sediment:Role of molecular diffusion[J]. Marine Ecological Progress,1992,81(3):289-303.
[15]Wenzhoefer F,Glud RN.Benthic carbon mineralization in the Atlantic:Asynthesis based on in situ data fromthe last decade[J].Deep Sea Research Part I Oceanographic Research Papers,2002,49(7):1255-1279.
[16]Sommer S,Türk M,Kriwanek S,et al.Gas exchange system for extended in situ benthic chamber flux measurements under controlled oxygen conditions:First application-Sea bed methane emission measurements at Captain Arutyunov mud volcano[J]. Limnology&OceanographyMethods,2008,6(1):23-33.
[17]Viollier E,Rabouille C,Apitz SE,et al.Benthic biogeochemistry:state of the art technologies and guidelines for the future of in situ survey[J].Journal ofExperimental Marine Biology&Ecology,2003,285-286(3):5-31.
[18]Tengberg A,Hall POJ,Andersson U,et al.Intercalibration of benthic flux chambers II.Hydrodynamic characterization and flux comparisons of14 different designs[J].Marine Chemistry,2004,94(1-4):147-173.
[19]Warnken KW,Gill GA,Griffin LL,et al.Sediment-water exchange of Mn,Fe,Ni and Zn in Galveston Bay,Texas[J].Marine Chemistry,2001,73(3-4):215-231.
[20]Janssen F,Faerber P,Huettel M,et al.Pore-water advection and solute fluxes in permeable marine sediments(I):Calibration and performance ofthe novel benthic chamber systemSandy[J].Limnology&Oceanography,2005,50(3):768-778.
[21]Sara F,Ferno A,Castro CG,et al.Hydrodynamic characterization and performance of an autonomous benthic chamber for use in coastal systems[J].Limnology&OceanographyMethods,2008,6(6):558-571.
[22]Jean-Claude C,Nadine L,Philippe C,et al.A new CALMAR benthic chamber operating by submersible:first application in the cold-seep environment ofNapoli mud volcano(Mediterranean Sea)[J].Limnology&OceanographyMethods,2010,8(1):304-312.
[23]Bender M,JahnkeR,Ray W,et al.Organic carbon oxidation and benthic nitrogen and silica dynamics in San Clemente Basin,a continental borderland site[J].Geochimica Et Cosmochimica Acta,1989,53(3):685-697.
[24]Berg P,Long MH,Huettel M,et al.Eddy correlation measurements of oxygen fluxes in permeable sediments exposed to varying current flowand light[J].Limnology&Oceanography,2013,58(4):1329-1343.
[25]Kuwae T,KamioK,Inoue T,et al.Oxygen exchange fluxbetween sediment and water in an intertidal sandflat,measured in situ bythe eddy-correlation method[J].Marine EcologyProgress,2006,307(8):59-68.
[26]Berg P,Glud RN,Andrew H,et al.Eddy correlation measurements of oxygen uptake in deep ocean sediments[J].Limnology& OceanographyMethods,2009,7(2):576-584.
[27]Huettel M,Gust G.Impact of bioroughness on interfacia solute exchange in permeable sediments[J].Marine Ecology Progress, 1992,89(2-3):253-267.
[28]Pakhomova SV,Hall POJ,Kononets MY,et al.Fluxes ofiron and manganese across the sediment-water interface under various redox conditions[J].Marine Chemistry,2007,107(3):319-331.
[29]MacPherson TA,Cahoon LB,Mallin MA.Water column oxygen demand and sediment oxygen flux:pattern ofoxygen depletion in tidal creek[J].Hydrobiologia,2007,586(1):235-248.
[30]Fuchsman CA,Devol AH,Chase Z,et al.Benthic fluxes on the Oregon shelf[J].Estuarine Coastal&Shelf Science,2015,163: 156-166.
[31]Shim JG,Kang YC,Kang DJ,et al.Fluxes and budgets of biogenic elements at the sediment-water interface of Marian Cove,King Feorge Island[J].Antarctic Science,2011,23(4):358-368.
[32]Fuente ADL.Methodologyfor analyzingdissolved oxygen consumption in benthic chambers[J].Journal ofEnvironmental Engineering, 2014,141(7):1-11.
[33]Lundgren J,Glud RN,Revsbech NP,et al.Impact of microsensor-caused changes in diffusive boundary layer thickness on O2profiles and photosynthetic rates in benthic communities ofmicroorganisms[J].Marine EcologyProgress,1995,119(1-3):237-241.
[34]Reimers CE.An in situ microprofiling instrument for measuring interfacial pore water gradients:methods and oxygen profiles from the North Pacific Ocean[J].Deep Sea Research Part AOceanographic Research Papers,1987,34(12):2019-2035.
[35]Gust G,Booij K,Helder W,et al.On the velocitysensitivity(stirringeffect)ofpolarographic oxygen microelectrodes[J].Netherlands Journal ofSea Research,1987,21(4):255-263.
[36]Revsbech NP.An oxygen microelectrode with a guard cathode[J].Limnology&Oceanography,1989,34:474-478.
[37]Revsbech NP,Cohen Y.Microelectrode studies ofthe photosynthesis and O2,H2S,and pH profiles ofa microbial mat[J].Limnology& Oceanography,1983,28(6):1062-1074.
[38]Sweerts Jean-Pierre RA,Bär-Gilissen Marie-Jose,Cornelese AA,et al.Oxygen‐consuming processes at the profundal and littoral sediment‐water interface of a small meso‐eutrophic lake(Lake Vechten,The Netherlands)[J].Limnology&Oceanography,1991, 36(6):1124-1133.
[39]Wan JN,Zhao L,WeiVariable H.Variable diffusion boundary layer and diffusion flux at sediment-water interface in response to dynamic forcingover an intertidal mudflat[J].Science Bulletin,2012,57(13):1568-1577.
[40]Whalen WJ,RileyJ,Nair P.Amicroelectrode for measuringintracellular pO2[J].Journal ofApplied Physiology,1967,23(5):798-801.
[41]Revsbech NP,Ward DM.Oxygen microelectrode that is insensitive to medium chemical composition:use in an acid microbial mat dominated bycyanidiumcaldarium[J].Applied&Environmental Microbiology,1983,45(3):755-759.
[42]Heinze J.Elektrochemie mit Ultramikroelektroden[J].Angewandte Chemie,1993,105(9):1327-1349.
[43]Brendel PJ,Luther GWI.Development of a gold amalgam voltammetric microelectrode for the determination of dissolved Fe,Mn,O2, and S(-II)in porewaters ofmarine and freshwater sediments[J].Environmental Science&Technology,1995,29(3):751-761.
[44]WangC,Shan B,ZhangH,et al.Analyzingsediment dissolved oxygen based on microprofile modeling[J].Environmental Science and Pollution Research,2014,21(17):10320-10328.
[45]Andreas B,McGinnis DF,Bernhard W,et al.Intermittent oxygen flux from the interior into the bottom boundary of lakes as observed byeddycorrelation[J].Limnology&Oceanography,2008,53(5):1997-2006.
[46]Hume AC,Berg P,Mcglathery KJ.Dissolved oxygen fluxes and ecosystem metabolism in an eelgrass(Zostera marina)meadow measured with the eddycorrelation technique[J].Limnology&Oceanography,2011,56(1):86-96.
[47]Long MH,Koopmans D,Berg P,et al.Oxygen exchange and ice melt measured at the ice-water interface by eddy correlation[J]. Biogeosciences Discussions,2011,8(6):11255-11284.
[48]LongMH,BergP,Beer DD,et al.In situ coral reefoxygen metabolism:an eddycorrelation study[J].Plos One,2013,8(3):4422-4427. [49]BergP,RφyH,WibergPL.Eddycorrelation fluxmeasurements:The sediment surface area that contributes to the flux[J].Limnology &Oceanography,2007,52(4):1672-1684.
[50]Lorrai C,Mcginnis DF,Berg P,et al.Application of oxygen eddy correlation in aquatic systems[J].Journal of Atmospheric& Oceanic Technology,2010,27(9):1533-1546.
[51]Holtappels M,Glud RN,Donis D,et al.Effects oftransient bottomwater currents and oxygen concentrations on benthic exchange rates as assessed byeddycorrelation measurements[J].Journal ofGeophysical Research Oceans,2013,118(3):1157-1169.
[52]Mcginnis DF,Berg P,Brand A,et al.Measurements of eddy correlation oxygen fluxes in shallow freshwaters:Towards routine applications and analysis[J].Geophysical Research Letters,2008,350(4):222-256.
[53]Peterson JI,Fitzgerald RV,Buckhold DK.Fiber-opticprobeforin vivomeasurementofoxygen partialpressure[J].AnalyticalChemistry, 1984,56(1):62-67.
[54]Holst G,Grunwald B.Luminescence lifetime imagingwith transparent oxygen optodes[J].Sensors&Actuators B Chemical,2001,74 (1):78-89.
[55]姜子可.平面光极在沉积物—水界面的观测应用研究[D].青岛:中国海洋大学,2014.
[56]Glud RN,RamsingNB,Gundersen JK,et al.Planar optrodes:a newtool for fine scale measurements oftwo-dimensional O2distribution in benthic communities[J].Marine EcologyProgress,1996,140(1-3):217-226.
[57]Glud RN,TengbergA,Kühl M,et al.An in situ instrument for planar O2optode measurements at benthic interfaces[J].Limnology& Oceanography,2001,46(8):2073-2080.
Research on the In-Situ Observation Methods for Dissolved Oxygen Flux in the Benthic Boundary Layer
CUI Shang-gong1,YU Xin-sheng1,2,ZHAO Guang-tao1,2,ZHANG Xiao-dong1,2
1.College of Marine Geosciences,Ocean University of China,Qingdao 266100,Shandong Province,China;
2.Key Laboratory of Geosciences and Prospecting Techniques,Ministry of Education,Ocean University of China,Qingdao 266100, Shandong Province,China
The benthic boundary layer is the important region of intense transport of solutes and suspended particles and of diagenesis of deposited materials.This zone is of great significance to the study of the oceans, seas and lakes in terms of biology,chemistry,geology.The consumption rate of benthic dissolved oxygen is one of the important indicators of evaluatiing early mineralizing organic carbon.The dissolved oxygen also has strong influence on the cycling of elements.It is required to develop in-situ measurement of benthic dissolved oxygen flux to acquire consumption rates,to understand transport process mechanisms and to research the benthic ecosystem,pollution effects and biogeochemical process.Traditional dissolved oxygen measuring methods are limited in measurement due to low efficiency and accuracy.This report gives an overview of current state-of-theart techniques used for benthic oxygen measurement.The characteristics and limits of benthic chamber, microsensor profiler,eddy correlation and optode planar techniques are evaluated and contrasted to discuss the shortage and constraints of each obseving method,and to present future development directions.
dissolved oxygen;sediment-water surface;benthic chamber;microsensor profiler;eddy correlation; planner optode
P714
A
1003-2029(2017)02-0122-10
10.3969/j.issn.1003-2029.2017.02.021
2017-01-18
国家自然科学基金资助项目(41276089;41176078);国家高技术研究发展计划(863计划)资助项目(2009AA09Z201)
崔尚公(1992-),男,硕士,主要从事海底观测技术研究。E-mail:cui_sg@126.com
于新生,E-mail:xsyu@ouc.edu.cn

