壮药壮通饮对大鼠内源性脑神经干细胞归巢后神经元功能的影响
陈晓锋+吴世嫦+王婧婧+刘燕平+李凯风+何乾超+刘强


【摘要】目的:观察壮药复方壮通饮对脑梗死模型大鼠内源性神经干细胞归巢后神经元功能的影响。方法:240只大鼠分为模型组、假手术组、壮通饮治疗组、正常组,采用线栓法制作脑梗死模型,于术后1、3、7、14、21、28d这6个时间点分批处死大鼠。用免疫组化法检测大鼠海马区BrdU、Nestin和梗死区域及相对应区域的MBP、SYN的阳性细胞数目。结果:模型组脑缺血区域相对应区域MBP、SYN阳性细胞大量表达,正常组和假手术组海马区少量BrdU、Nestin阳性细胞。模型组和壮通饮治疗组BrdU、Nestin阳性细胞表达增多,MBP、SYN阳性细胞表达减少。壮通饮治疗组BrdU、Nestin、MBP、SYN阳性细胞表达量多于模型组,BrdU、Nestin阳性细胞表达在第7天达到高峰,MBP、SYN阳性细胞表达于第14天达到高峰。结论:壮通饮可以促进脑梗死后内源性神经干细胞的增殖,诱导分化为神经元、星形胶质细胞、少突胶质细胞,并发挥正常的神经功能。
【关键词】壮通饮;内源性神经干细胞;NSC;归巢;神经元
【中图分类号】R29【文献标志码】 A【文章编号】1007-8517(2017)08-0029-06
脑梗死是临床上常见的缺血性脑血管疾病,随着中国进入老龄化社会,脑梗死发病率和致残率呈增高态势,脑梗死区域的神经细胞的凋亡是必然的[1]。神经细胞是不可再生是长期以来的共识,作为神经细胞和神经胶质细胞的前体,内源性神经干细胞(Neural Stem Cell,NSC)具有增殖、迁移及分化功能,在脑缺血后神经损伤的修复过程中扮演重要角色[2]。壮通饮是治疗脑梗死的壮医药经验方,前期研究发现壮通饮影响新生大鼠海马神经干细胞增殖分化[3]。本实验通过观察壮通饮对脑梗死后内源性神经干细胞归巢后的神经元功能的影响,为阐明壮通饮促进神经增殖分化为成熟神经元后功能机制提供实验依据。
1实验材料
11实验动物选用清洁级雄性健康SD大鼠240只,体重(250±10)g,由广西医科大学动物实验中心提供(批號:SCXK桂~0004)。
12试剂鼠抗BrdU单克隆抗体(批号:BM0201)、兔抗nestin多克隆抗体(批号:A00806-1)、兔抗MBP多克隆抗体(批号:BA0094)、兔抗SYN多克隆抗体(批号:A00941)、山羊抗兔IgG(批号:1512174091)、ABC试剂盒(批号:d0110816)、DAB试剂盒(批号:AR1022)均购自武汉博士德生物工程有限公司。
2方法
21动物分组将240只大鼠随机分为模型组、假手术组、壮通饮治疗组、正常组,每组又设1、3、7、14、21、28d 6个时间点。每个时间点10只大鼠。
22药物制备壮通饮:扶芳藤30g,参三七10g,黄花倒水莲25g。药材煎煮两次,合并两次煎液,蒸发去水分至浓稠状,进一步干燥,4℃保存备用。临用前使用蒸馏水溶解浸膏至生药材含量为20 g/mL。
23MCAO模型建立参照Longa线栓法[4]制作MCAO模型。模型制作成功标准如下:①提尾悬空实验阳性;②右眼Horner征;③爬行时向左划圈;④站立时向左侧倾倒。假手术组除不进行大脑中动脉线栓外,其余操作均同模型组。
24给药方法壮通饮治疗组在造模后给予壮通饮水煎液(按单位体重的剂量来算,大鼠的等效剂量相当于成人用量的63倍[5],灌胃,每日2次,每次748g生药/kg,其他组同时给予等体积的无菌蒸馏水灌胃,灌胃至造模后1、3、7、14、21、28d 6个时间点处死时。
25BrdU标记增殖细胞各组动物均从处死前24h开始,腹腔注射BrdU(50mg/kg),1次/4h,共4次,末次注射后12h处死动物。
26组织切片制备各组大鼠于造模后1、3、7、14、21、28d 6个时间点取标本,将脑组织移入多聚甲醛中4℃固定6h,取材,脱水,包埋,切片。
27免疫组化方法切片经脱蜡,高温修复后,加入配好的03%的过氧化氢甲醇溶液(甲醇80mL+001MKPBS 100mL+30%过氧化氢)30min,用001MKPBS溶液冲洗后,加入10%正常羊血清,室温静置30min,甩干分别加相应的一抗,4℃过夜。用001MKPBS溶液冲洗后,滴加生物素化二抗(山羊抗兔IgG),室温静置30min,用001MKPBS溶液冲洗后,加入辣根过氧化酶标记的链霉卵白素工作液,室温静置30min,用001MKPBS溶液冲洗,采用SABC法染色,切片加葡萄糖氧化酶-DAB-硫酸镍胺溶液显色(不超过5min),自来水冲洗干净,苏木素复染2min,自来水冲洗,梯度酒精脱水,树胶封片,光镜下观察。
28观察指标分别观察各指标免疫组化染色阳性细胞的分布特点及形态特点。每只动物各个指标各取相对应位置切片3张,放大倍数×400,随机选取5个显微镜视野,计数阳性细胞数取平均值。
29统计学处理实验数据符合正态分布,以均数±标准差(x±s)表示,用SPSS 220统计软件对数据进行处理分析,同组不同时间点及组间比较比较采用单因素方差分析,P<005表示差异有统计学意义。
3结果
31BrdU免疫组化染色结果各组各时间点大鼠海马齿状回区域均见BrdU阳性细胞。正常组和假手术组海马区少量的BrdU阳性细胞,差异无统计学意义(P>005)。模型组和壮通饮治疗组BrdU阳性细胞表达多于假手术组(P<005);壮通饮治疗组BrdU阳性细胞表达多于模型组(P<005)。在不同时间点,正常组和假手术组BrdU阳性细胞表达无统计学意义(P>005)。模型组、壮通饮治疗组BrdU阳性细胞表达于第7天达到顶峰,之后呈现逐渐下降之势。详见图1~4,表1。
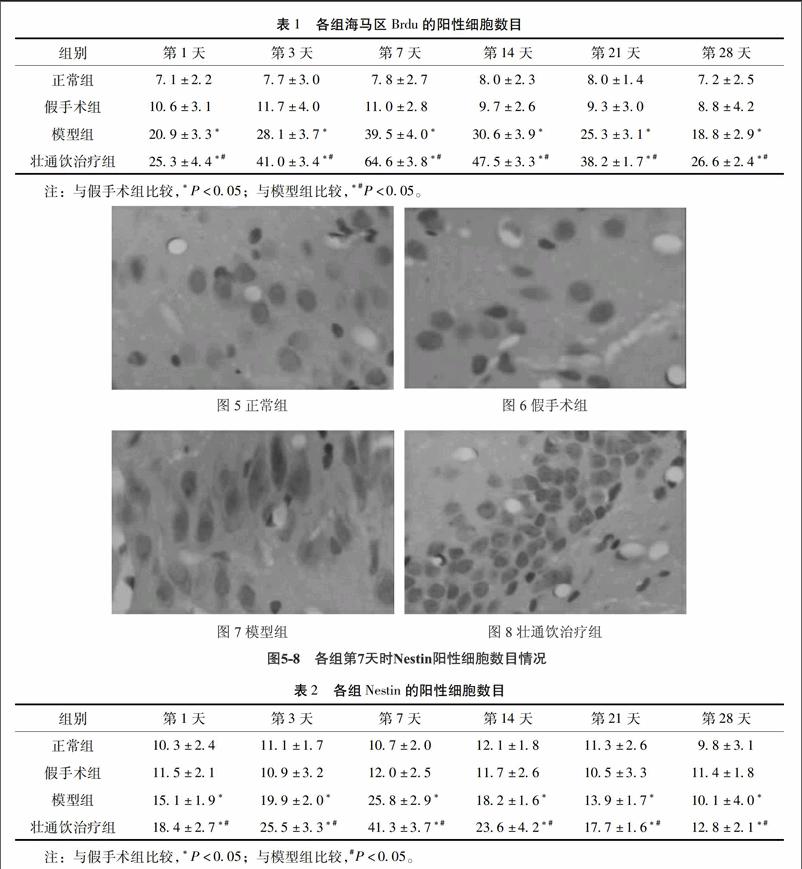
32Nestin免疫组化染色结果在各组各时间点大鼠海马齿状回区域均有Nestin阳性细胞表达。正常组和假手术组大鼠的海马区可见到少量的Nestin阳性细胞,差异无统计学意义(P>005)。模型组和壮通饮治疗组Nestin阳性细胞表达多于假手术组(P<005)。壮通饮治疗组Nestin阳性细胞表达多于模型组(P<005)。在不同时间点,正常组和假手术组Nestin阳性细胞表达也无统计学意义(P>005)。模型组Nestin阳性细胞表达量于造模后开始增多,1个周达到高峰,之后逐渐下降,这与壮通饮治疗组表达趋势类似。详见图5~8,表2。
33MBP免疫組化染色结果在各组各时间点大鼠缺血区大脑皮质和相对应的区域均可见不同数目的MBP阳性细胞。正常组和假手术组可见到大量的MBP阳性细胞表达,差异无统计学意义(P>005)。模型组和壮通饮治疗组MBP阳性细胞表达量少于假手术组(P<005)。壮通饮治疗组MBP阳性细胞数目多于模型组(P<005)。在不同时间点,正常组和假手术组MBP阳性细胞数目无统计学差异(P>005)。壮通饮治疗组和模型组MBP阳性细胞表达于造模后3d开始增多,14d达到顶峰。详见图9~12,表3。
34SYN免疫组化染色结果在各组各时间点大鼠缺血区大脑皮质和相对应的区域均见SYN阳性细胞表达。正常组和假手术组SYN阳性细胞表达量差异无统计学意义(P>005)。模型组和壮通饮治疗组SYN阳性细胞表达少于假手术组(P<005)。壮通饮治疗组第3、7、14天SYN阳性细胞表达量多于模型组(P<005)。在不同时间点,正常组和假手术组SYN阳性细胞表达量无统计学意义(P>005)。模型组和壮通饮治疗组造模后3d起,SYN阳性细胞增多,第14天达到峰值。详见图13~17,表4。
4讨论
壮通饮作为治疗脑梗死的传统壮医药经验方,由扶芳藤、参三七、黄花倒水莲组成。药理学研究表明,三七总皂苷可通过上调Bcl-2、Nestin、BDNF[6]、EGF蛋白的表达,从而促进神经干细胞增殖,并且抑制神经细胞凋亡。扶芳藤水煎液、醇提液能明显抑制血栓形成,延长凝血酶原时间,缩短小鼠凝血时间和出血时间[7];还能改善营养物质的供应,以减轻局灶性脑缺血后脑细胞的缺血性损伤;通过抑制脑组织中IL-1β和TNF-α的表达对大鼠急性脑缺血再灌注损伤进行保护[8]。黄花倒水莲总皂苷(PTS)可明显延长体外家兔血浆复钙时间 、凝血酶所致纤维蛋白凝固时间及APTT,体内给药可有效延长小鼠凝血时间,而对PT无明显影响,提示PTS可能通过对抗凝血通路的关键酶(凝血酶),影响内源性凝血系统从而发挥抗凝血作用[9]。前期研究发现壮通饮可影响新生大鼠海马神经干细胞增殖分化[3],但对于它的归巢后神经元功能的影响,目前缺乏有力的实验室证据。国内外对增殖后的神经元的鉴定多还停留在形态学水平及特异性标记表达方面,较缺乏是否具有成熟神经元功能检测的研究。归巢后的神经元能发展成为与受损区域神经组织相一致的细胞类型,并能行使相应的神经功能是干细胞治疗的关键。成熟神经元不仅要具有典型的神经元的形态、特异性标记,还要求具有兴奋性,能和其他神经元形成突触联系,产生突触电位。正常成熟的神经元具有电生理功能,能够产生动作电位是成熟神经元的重要标志。研究不仅可以在细胞层面通过Brdu、Nestin检测观察壮通饮干预下内源性干细胞增殖、分化情况;还可以在功能层面通过MBP、SYN检验归巢后神经元功能情况。
Brdu是一种胸腺嘧啶脱氧核苷类似物,在细胞增殖周期的S期代替胸腺嘧啶整合入新合成的DNA中,因而Brdu阳性细胞可以用来标记新增殖细胞[10]。内源性神经干细胞被激活后,可以增殖分化,产生新的神经细胞,包括神经元、星形胶质细胞、少突胶质细胞等。Nestin又名神经上皮干细胞蛋白,属于中间丝蛋白,主要在神经干细胞内一过性表达,当干细胞向着终末细胞分化完成后,其表达停止[11-12],因此实验选择巢蛋白作为成熟神经干细胞的标记物质。MBP,即碱性髓鞘蛋白,是少突胶质细胞的特殊标记物,少突胶质细胞的主要功能是在中枢神经系统中包绕轴突、形成绝缘的髓鞘结构、协助神经电信号的跳跃式高效传递,维持和保护神经元的正常功能[13]。有研究显示,作为中枢神经系统成髓鞘胶质细胞,少突胶质细胞对缺血应激非常敏感,缺血缺氧将导致早期的髓鞘脱失,缺氧、缺血是导致少突胶质细胞损伤的主要因素之一[14-15]。成年SD大鼠脑缺血再灌注后急性期梗死区皮质髓鞘相关蛋白(MyT1)基因表达增加,促进少突胶质细胞的再生形成,从而参与脑缺血后的早期的损伤修复[16]。本研究中,模型组和壮通饮治疗组由于受到脑缺血影响,少突胶质细胞减少,MBP阳性细胞表达下降,从第3天起,模型组和壮通饮治疗组MBP阳性细胞表达持续增加,第14天达到高峰,壮通饮治疗组MBP阳性细胞数目明显高于模型组。这表明,脑缺血损伤后,内源性神经干细胞在分化过程中,一部分分化成了少突胶质细胞,在中枢神经系统中包绕轴突、形成绝缘的髓鞘结构、协助神经电信号的跳跃式高效传递,维持和保护神经元的正常功能。壮通饮治疗可以促进内源性神经干细胞的增殖及分化,并能起到正常神经元功能作用。
突触素(Synaptophysin,SYN)是突触囊泡膜上的一种与突触结构和功能密切相关的钙结合蛋白,又称P38,是神经元形成神经突触的重要标记蛋白,是突触发生的标志。突触素还参与到不同神经元之间的信息传递过程中,直观反映突触传递效能。脑梗死发生后,梗死灶中的突触结构解体,神经元代谢能力和蛋白合成显著减少,突触素表达随之减少[17-19]。因此SYN可用来作为检测突触的密度、分布和功能的重要标记物。本研究中,正常组和假手术组由于神经元未受到明显损伤,彼此间维持正常接触,表现为一定数量SYN阳性细胞表达。部分神经元于脑缺血早期凋亡,神经元突触联系丧失,模型组SYN阳性细胞表达减少。部分NSC被激活、增殖分化为神经元,表现为SYN阳性细胞表达逐渐增多。壮通饮治疗组SYN阳性细胞表达量明显多于其他组,提示壮通饮可能通过促进缺血脑组织形成新的神经突触,修复了脑缺血的神经损伤。参考文献
[1]刘晖,石志革,尤年兴.不同年龄脑梗死患者TOAST分型与血脂和纤维蛋白原的相关分析[J].中国临床神经学,2012(04):449-451.
[2]Ikedab T.Stem cells and neonatal braininiury[J].Cell Tissue Res,2008,331(1):263.
[3]陈晓锋,王婧婧,陆惠.壮通饮对体外培养新生大鼠海马神经干细胞增殖分化的影响[J].天然产物研究与开发,2014(26):1099-1102.
[4]Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats [J]. Stroke, 1989,20(1):84-91.
[5]徐淑云.药理實验方法学[M].3版.北京:人民卫生出版社,2009.
[6]钟森,陈文超,徐永强,等.三七总皂苷对脑缺血再灌注损伤大鼠神经干细胞相关调节因子及脑细胞凋亡的影响[J].中国中医急症,2010,19(2):279-282.
[7]周智,韦奇志,吴植强,等.扶芳藤对血液流变学及凝血功能影响的研究[J].广西医学,2011,33(7):810.
[8]肖艳芬,肖健,王坤,等.扶芳藤提取物对大鼠急性脑缺血再灌注后IL-1β与TNF-α的影响研究[J].时珍国医国药,2011,22(2):404.
[9]寇俊萍,李景峰, 闫瑾,等.黄花倒水莲总皂苷对凝血系统及血栓形成的影响[J].中国药科大学学报,2003,34(3):257- 260.
[10]谭峰,王健,陈晶,等.电针对MCAO模型大鼠海马区内源神经干细胞表达的影响[J].中国中西医结合杂志,2017(02):198-203.
[11]Jun H,Hussaini SM,cho CH,et al.Gadol45b Mediate Electroconvnlsice shock Induced Porliferalion of Hippocampal Neural Stem Cell[J].Brain stimul,2015,8(6):1021-1024.
[12]Hosseini SM,Farahmandnia M,Raziz,et al.12 hours after cerebral ischemia is the optimal ime for bone marrow mesenchymal stemcell transplantation[J].Neural Regen Res,2015(16):904-908.
[13]孔迪,王翠云,庞永博,等.大鼠脑硬死后内质网应激对髓鞘碱性蛋白表述的影响[J].中华实用诊断与治疗杂志,2017(01):23-25.
[14]李凯.少突胶质细胞在早产儿缺血缺氧性脑损伤关键作用的研究进展[J].国际神经病学神经外科学杂志,2012,39(4):387-389.
[15]陈应柱,刘刚,杨德刚,等.大鼠脑缺血后胼胝体少突胶质细胞变化的特征[J].中风与神经疾病杂志,2011,28(1):7-11
[16]李华杰,吴坚,朱林凤,等.局灶脑缺血再灌注成年模型大鼠大脑髓鞘相关蛋白的基因表达[J].中国组织工程研究与临床康复,2011,15(50):9389-9392.
[17]Ruan GP, Han YB, WangTH. et alcomparative study among three different methods of bone marrowmesenchymal stem cell transplantation followingcerebral infarction in rats[J]. Neurol Res,2013,35(2):212-220.
[18]Liu YP, Seckin H, Izci Y, et al. Neuroprotective effectsof mesenchymal stem cells derived from humanembryonic stem cells in transient focal cerebralischemia in rats[J]. J Cereb Blood Flow Metab,2009,29(4):780-791.
[19]程率芳.骨髓间充质干细胞移植脑梗死大鼠:神经功能恢复与突触素的表达[J].中国组织工程研究,2016,20(28):4182-4187
(收稿日期:2017-02-23编辑:梁志庆)

