云南省边境地区口蹄疫抗体检测
廖德芳,苗海生,李 乐,寇美玲,王文华,沙丽东,李国华,李华春
(1. 云南省畜牧兽医科学院,云南昆明 650224;2. 元阳县动物疫病预防控制中心,云南元阳 662400;3. 富民县动物疫病预防控制中心,云南富民 650400;4. 墨江县动物疫病预防控制中心,云南墨江 654800)
云南省边境地区口蹄疫抗体检测
廖德芳1,苗海生1,李 乐1,寇美玲1,王文华2,沙丽东3,李国华4,李华春1
(1. 云南省畜牧兽医科学院,云南昆明 650224;2. 元阳县动物疫病预防控制中心,云南元阳 662400;3. 富民县动物疫病预防控制中心,云南富民 650400;4. 墨江县动物疫病预防控制中心,云南墨江 654800)
应用口蹄疫O、A、Asia-1型cELISA抗体检测试剂盒和口蹄疫非结构蛋白抗体单抗阻断ELISA试剂盒,对采集自云南省10个边境县的牛和猪血清进行检测。检测结果显示,牛口蹄疫O、A、Asia-1型抗体阳性率分别在9.23%~37.75%、3.00%~23.57%、9.75%~48.67%之间,阳性率偏低,并且地区间差异较大。非结构蛋白抗体阳性率在14.16%~51.00%之间,其中勐海为51.00%、芒市为48.96%,动物带毒风险较大。境内牛与境外入境牛口蹄疫O、A、Asia-1型抗体阳性率基本相当,非结构蛋白抗体阳性率略高于境内牛。由于入境牛免疫率较低,须加大对入境牛的监控。黄牛和水牛口蹄疫O、A、Asia-1型抗体阳性率基本一致,但黄牛非结构蛋白抗体阳性率为36.47%,水牛为26.86%,黄牛阳性率显著高于水牛,这可能是因为云南省边境地区的黄牛主要来自印度、孟加拉国,经缅甸进入我国。猪口蹄疫血清抗体阳性率较低,除芒市O型口蹄疫抗体阳性率达到81.00%外,其余均在0~6.00%之间,这可能与云南省近年来大量免疫合成肽疫苗有关。建议加强云南省边境地区的口蹄疫防控工作,提高口蹄疫免疫密度和抗体水平,严控边境地区口蹄疫易感动物的无序流动。
口蹄疫;边境地区;抗体检测
云南省地处我国西南部,有26个边境县分别与缅甸、越南、老挝接壤,边境线长4 061 km,有11个国家级口岸、9个省级口岸和近百条边境通道,与周边国家乃至东南亚、南亚的其他国家和地区交往频繁,是我国沟通东南亚、南亚地区的主要陆上通道。与云南省接壤的东南亚国家的口蹄疫防控意识薄弱,防控水平较低,口蹄疫疫情不断发生,动物带毒情况较普遍[1]。近年来,由于国内猪、牛肉价格较高,每年有大量猪、牛通过口岸或边境线进入我国境内,因此云南省边境地区的口蹄疫疫情防控形势严峻。为掌握云南省边境地区牛、猪口蹄疫疫苗免疫效果,本调查应用口蹄疫C-ELISA抗体检测试剂盒(O、A、Asia-1型)和口蹄疫非结构蛋白抗体单抗阻断ELISA试剂盒,对2015年底和2016年初采集自云南省10个边境县(市)的境内和入境牛血清2 799份、猪血清800份进行检测,并对检测结果进行分析,评估当地口蹄疫免疫状况和传入风险。
1 材料与方法
1.1 血清采集
血清样本采自云南省景洪、勐腊、勐海、孟连、沧源、镇康、耿马、芒市、瑞丽、富宁等10个边境县的散养户、养殖场、交易市场,由当地县级动物疫病预防控制中心负责样本采集。
1.2 检测方法
1.2.1 口蹄疫O、A、Asia-1型血清抗体检测。采用相应血清型检测试剂盒,对3种口蹄疫血清型进行检测。试剂盒均为云南省畜牧兽医科学院自行研制,各试剂盒操作方法相同。取出试剂盒内的ELISA抗原固定板,置室温15 min;用试剂盒提供的稀释液按1:1 000倍稀释竞争抗体,在稀释板上按每孔120 μL加入稀释好的竞争抗体,然后在每个孔中加30 μL待检血清,同时设立阴阳性血清对照,充分混匀;将1:5稀释的待检血清和阴阳性对照血清转移到活化好的ELISA板上,50 μL每孔,每个待检样品2孔,将稀释板上剩余的50 μL弃去;37 ℃温育1 h,用PBST洗液洗板3次,拍干;用稀释液按1:1 000稀释兔抗豚鼠酶标二抗,每孔50 μL,37 ℃温育30 min,用PBST洗液洗板5次,拍干;每孔加50 μL底物反应液,室温避光或37 ℃避光温育10~15 min,然后每孔再加50 μL终止液;立即在酶标仪450 nm波长下读取吸光值(OD值)。当阳性对照孔平均OD值≥0.8,阳性对照孔OD值≤0.3时,试验结果成立,否者不成立;根据抑制率=1-样品OD值/阴性血清OD值平均数,当抑制率≥40%时判为阳性,当抑制率<40%时判为阴性。
1.2.2 口蹄疫非结构蛋白抗体检测。采用口蹄疫非结构蛋白抗体单抗阻断ELISA试剂盒(北京世纪元亨动物防疫技术有限公司生产,批号CB20151201)对牛血清进行口蹄疫非结构蛋白抗体检测,按照试剂盒说明书进行操作。结果判定:按照阻断率=(阴性对照OD450平均值-样品孔OD450平均值)/阴性对照OD450平均值×100%进行计算,阳性对照OD450平均值≥55%、阴性对照OD450平均值-阳性对照OD450值≥0.6时检测成立,当被检样品阻断率≥40%时判为阳性,当被检样品阻断率在25%~40%间时判为可疑,否者为阴性。
1.3 检测结果分析
分别按地区、畜种、饲养方式、境内外家畜进行口蹄疫抗体统计分析,其中对畜种、饲养方式、境内外家畜的统计分析仅针对牛。
2 结果
2.1 口蹄疫牛血清抗体阳性率统计
2.1.1 不同地区牛的口蹄疫抗体统计。统计结果显示,牛口蹄疫O、A、Asia-1型抗体阳性率分别在9.23%~37.75%、3.00%~23.57%、9.75%~48.67%之间,阳性率显著偏低,并且地区间差异较大。非结构蛋白抗体阳性率在14.16%~51%之间,其中勐海为51.00%、芒市为48.96%,动物带毒风险较大(表1)。

表1 各地区牛口蹄疫血清抗体调查统计(单位:份/%)
2.1.2 境内牛和入境牛口蹄疫抗体统计。统计结果显示:境内牛O、A、Asia-1型抗体阳性率分别为23.43%、9.4%、39.72%,非结构蛋白抗体阳性率为25.56%;入境牛O、A、Asia-1型抗体阳性率分别为30.5%、7.5%、26.75%,非结构蛋白抗体阳性率为28.33%;背景不详牛O、A、Asia-1型抗体阳性率分别为32.96%、6.24%、30.34%,非结构蛋白抗体阳性率为45.06%(表2)。鉴于云南省边境地区实际情况,背景不详的牛极有可能也来自国外。

表2 境内牛和入境牛口蹄疫抗体统计(单位:份/%)
2.1.3 不同品种牛的口蹄疫抗体统计。统计结果显示:黄牛的O、A、Asia-1型抗体阳性率分别为33.99%、5.75%、19.52%,非结构蛋白抗体阳性率为36.47%,免疫效果较差,非结构蛋白阳性率偏高;水牛O、A、Asia-1型抗体阳性率分别为32.26%、5.91%、26.01%,非结构蛋白抗体阳性率为26.86%,免疫效果与黄牛基本一致,非结构蛋白阳性率比黄牛低(表3)。
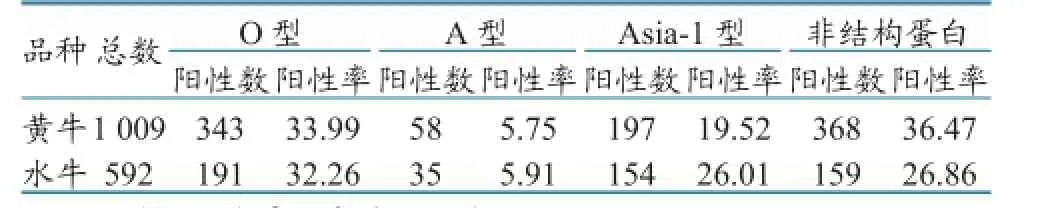
表3 不同品种牛的口蹄疫抗体统计(单位:份/%)
2.2 口蹄疫猪血清抗体阳性率统计
猪血清口蹄疫抗体阳性率较低,除芒市O型口蹄疫抗体阳性率达81.00%外,其余均在0~6.00%之间,这可能是因为云南省近年来大量免疫合成肽疫苗,普通ELISA抗体检测试剂盒无法检出抗体(表4)。
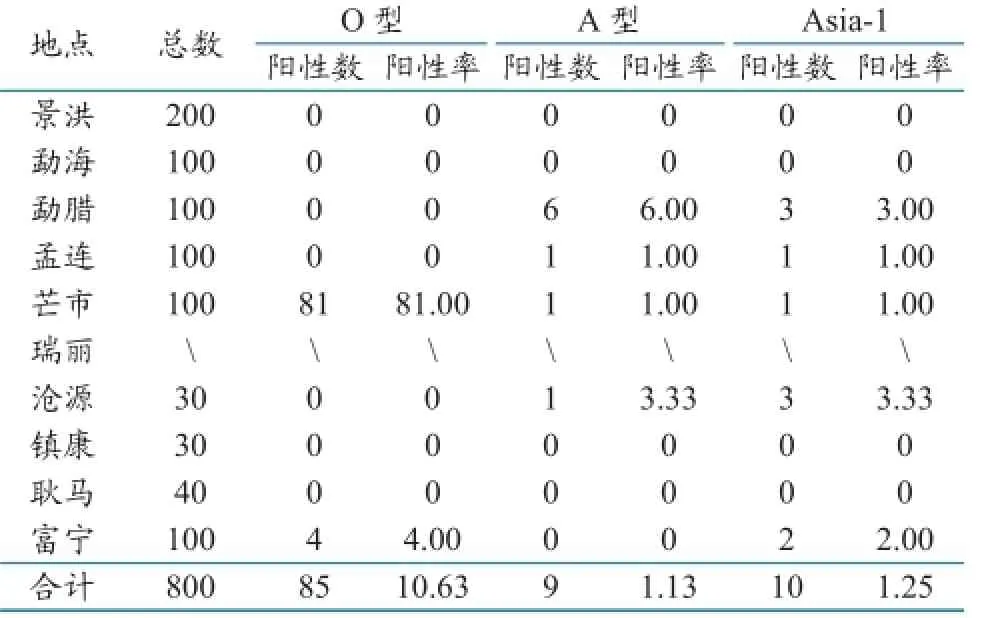
表4 猪口蹄疫血清抗体统计(单位:份/%)
3 讨论
本次调查选取云南省10个具有代表性的边境县(区)进行口蹄疫O、A、Asia-1型以及非结构蛋白抗体监测,共检测了2 799份牛血清、800份猪血清,区域涉及德宏州、临沧市、普洱市、西双版纳州,动物来源涉及入境牛、境内饲养牛,动物种类涉及黄牛、水牛以及本地饲养猪。
监测结果显示,牛口蹄疫O型、A型、Asia-1型总体血清抗体阳性率偏低,未能达到可以有效抵抗口蹄疫病毒传播的标准,口蹄疫非结构蛋白抗体阳性率偏高,平均达34.67%,牛隐性带毒风险极大。隐性带毒或者持续性感染是造成口蹄疫难以根除的一个重要原因,对此必须引起足够的重视。不同县(区)间口蹄疫抗体阳性率差异较大,这在一定程度上可以反映出该地区的口蹄疫疫苗免疫效果,但也不排除采样时在动物和时间选择方面的影响,毕竟样品数量有限。境内牛口蹄疫非结构蛋白抗体阳性率为25.56%,外来牛阳性率为28.33%,略高于境内牛,但对于经缅甸、印度、孟加拉等国家进入我国境内的牛,由于其原产国的兽医防疫体系严重落后,生物制品生产能力低下,大多不免疫,因此感染口蹄疫风险较高。黄牛和水牛口蹄疫O、A、Asia-1型抗体阳性率基本一致,但黄牛非结构蛋白抗体阳性率显著高于水牛,这可能是因为云南边境地区的黄牛主要来自印度、孟加拉国,其经缅甸进入我国。
本次猪口蹄疫抗体抽样检测结果显示,除芒市O型口蹄疫抗体阳性率达81.00%外,其余均在0~6.00%之间。经了解芒市着重免疫了口蹄疫O型单价灭活疫苗,检测结果与当地的工作重点一致。其它地区免疫背景不详,但云南省近年来大量免疫猪口蹄疫合成肽疫苗,普通口蹄疫ELISA抗体检测试剂盒无法检出其抗体。
近年来,导致国内口蹄疫疫情流行的毒株均来自于境外,因此我国防堵境外口蹄疫流行毒株的任务越来越重要[2]。建议继续加强云南省边境地区口蹄疫防控工作,提高口蹄疫免疫密度和抗体水平,严控边境地区口蹄疫易感动物的无序流动,降低境外口蹄疫病毒对国内家畜的威胁。
[1] KLEIN J. Understanding the molecular epidemiology of foot-and-mouth-disease virus[J]. Infection,Genetics and Evolution,2009,9(92):153-161.
[2]何继军,杨亚民,马维民,等. 我国O型Mya-98口蹄疫病毒流行情况与毒株分析[J]. 中国动物检疫,2014,31(5):45-50.
(责任编辑:朱迪国)
Antibody Detection of Foot-and-mouth Disease in Border Areas of Yunnan Province
Liao Defang1,Miao Haisheng1,Li Le1,Kou Meiling1,Wang Wenhua2,Sha Lidong3,Li Guohua4,Li Huachun1
(1. Yunnan Academy of Sciences of Animal Husbandry and Veterinary,Kunming,Yunnan 650224;2. Yuanyang Animal Disease Prevention and Control Center,Yuanyang,Yunnan 662400;3. Fumin Animal Disease Prevention and Control Center,Fumin,Yunnan 650400;4. Mojiang Animal Disease Prevention and Control Center,Mojiang,Yunnan 654800)
By using cELISA kits to detect antibodies against foot-and-mouth disease(FMD)type O,A,Asia-1,as well as the monoclonal antibody blocking ELISA kits to detect non-structural protein of FMDV,serum samples of bovine and swine that were collected from 10 border counties of Yunnan province were tested. Results showed that the FMD type O,A,Asia-1 antibody positive rates of cattle were 9.23%~9.23%,3.00%~23.57%,23.57%~48.67%,respectively,showing low levels,and the regional differences were relatively large. On the other side,the antibody positive rates of nonstructural protein were in the range of 14.16%~51.00%,specifically,the rate in Menghai was 51.00%,in Mangshi was 48.96%. Besides,a high risk of animals carrying FMDV was observed. As to the cattle both in and outside borders,the antibody levels against type O,A,Asia-1 were basically the same,while antibodies against nonstructural protein were higher in cattle outside the borders. Given the immunization rate of entry cattle was relatively low,monitoring for these cattle should be strengthened. Antibody positive rates of type O,A,Asia-1 between cattle and buffaloes also showed basic consistent results. Unlike that,the antibody positive rate of nonstructuralprotein in battle was 36.47%,while in buffalo it was 26.86%. The reason caused this significant difference may related to the fact that cattle in Yunnan border areas were mostly transported from India and Bangladesh via Myanma. Antibody positive rate of FMD of swine was low,ranges of 0~6.00% were detected in most counties except a rate of 81.00% against type O of FMD in Mang city,immunization with synthetic peptide vaccines in great quantities may be responsible for these results. At the end,suggestions were put forward,including strengthening FMD prevention and control,intensifying vaccination and enhancing the antibody levels,as well as strictly controlling the unordered fl ow of susceptible bovines in border areas.
Foot-and-mouth disease;border area;antibody detection
S851.3
:B
:1005-944X(2017)05-0025-04
10.3969/j.issn.1005-944X.2017.05.007
国家公益性行业科研专项(201103008)
李华春

