高脂日粮对初情期小鼠乳腺发育的影响及分子机制
孟莹莹, 张 静, 张枫琳, 艾 玮, 朱晓彤, 束 刚, 王丽娜, 高 萍, 江青艳, 王松波
(华南农业大学 动物科学学院,广东 广州 510642)
高脂日粮对初情期小鼠乳腺发育的影响及分子机制
孟莹莹, 张 静, 张枫琳, 艾 玮, 朱晓彤, 束 刚, 王丽娜, 高 萍, 江青艳, 王松波
(华南农业大学 动物科学学院,广东 广州 510642)
【目的】研究高脂日粮对初情期小鼠乳腺发育的影响及可能机制。【方法】选用20只4周龄昆明雌性小鼠,设对照组和高脂日粮组,试验期4周,每周称体质量并统计采食量。试验结束后采集小鼠乳腺并称质量,采用whole-mount 及HE染色观察小鼠乳腺组织形态结构及导管数量。利用Western blot检测初情期小鼠乳腺组织胰岛素样生长因子1(Insulin-like growth factor1, IGF-1)、增殖相关信号通路关键蛋白蛋白激酶B( Protein kinase B, Akt)、胞外调控的蛋白激酶(Extracellular regulated protein kinase, ErK)以及炎症信号通路关键蛋白Toll样受体4(Toll-like receptor 4, TLR4)、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和核因子κB激酶抑制剂(Inhibitor of nuclear factor kappa-B kinase, IKK)的表达。【结果】高脂日粮组小鼠采食量极显著低于对照组(P<0.01),但在能量摄入方面与对照组无显著差异。高脂日粮组小鼠的体质量增加显著高于对照组(P<0.05)。高脂日粮组小鼠在乳腺质量、乳腺质量与体质量的比值上均极显著高于对照组(P<0.01)。乳腺组织的whole-mount及HE染色结果表明,高脂日粮组小鼠乳腺导管发育明显被抑制,其乳腺组织的导管数和密度明显降低,乳腺组织的终末乳芽数量也极显著低于对照组(P<0.01)。高脂日粮能够显著抑制小鼠乳腺组织IGF-I的蛋白表达以及Akt、Erk和IKK的磷酸化水平(P<0.01或0.05),极显著促进小鼠乳腺组织TLR4的蛋白表达(P<0.01)和显著促进JNK的磷酸化水平(P<0.05)。【结论】高脂日粮能够抑制初情期小鼠乳腺发育,这可能是通过抑制乳腺增殖的相关信号和促进乳腺组织炎症的相关信号来实现。
高脂日粮; 小鼠; 乳腺发育; 增殖; 炎症; 蛋白表达
乳腺作为哺乳动物的泌乳器官,其良好的发育不仅对于其泌乳功能及后代生长发育具有重要影响,而且对于人类健康具有重要意义。乳腺的发育受到遗传、环境、激素等各种因素的影响[1-2],其中营养对乳腺的发育起着重要的作用[1, 3]。在生产中,后备母猪饲喂高能量日粮造成的过度肥胖,往往会导致其乳腺发育不良,对其后期泌乳功能造成不良影响[4]。此外,青春期肥胖也是引发乳腺癌的主要因素之一[5]。 因此,研究高脂(能)日粮对乳腺发育的影响及机制对于提高动物泌乳功能及人类乳腺健康具有重要意义。
雌性动物乳腺发育包括初情期、妊娠期和泌乳期等不同阶段[2]。在小鼠中,其乳腺发育从胚胎期开始,出生断奶后乳腺导管快速发育,到8周龄(性成熟)发育完善,随后伴随着妊娠和分娩乳腺腺泡呈现周期性变化[6-7]。研究表明,高脂日粮可通过影响小鼠早期乳腺发育,从而导致小鼠妊娠期和泌乳期的乳腺癌发生[8-9]。但是,目前有关高脂日粮对初情期小鼠乳腺发育影响的报道还很少,且主要集中在小鼠乳腺发育表型方面[10],对于高脂日粮调控初情期小鼠乳腺发育的机制尚不清楚。
本试验以初情期小鼠为对象,在研究高脂日粮对初情期小鼠乳腺导管发育的基础上,进一步探索高脂日粮对初情期小鼠乳腺增殖相关信号通路关键蛋白胰岛素样生长因子1(Insulin-like growth factor 1, IGF-1)、增殖相关信号通路关键蛋白蛋白激酶B(Protein kinase B, Akt)、胞外调控的蛋白激酶(Extracellular regulated protein kinase, ERK)以及炎症信号通路关键蛋白Toll样受体4(Toll-like receptor 4, TLR4)、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和核因子κB激酶抑制剂(Inhibitor of nuclear factor kappa-B kinase, IKK)表达的影响,旨在揭示高脂日粮对初情期小鼠乳腺发育的影响及其分子机制,为动物和人类乳腺健康发育的营养调控提供理论依据。
1 材料与方法
1.1 试验动物与试验设计
选用20只3周龄昆明雌性小鼠(购于广东省医学实验动物中心),预饲喂正常日粮1周后,根据体质量随机分为2组:对照组(饲喂正常日粮,脂肪提供10% 的能量)和高脂日粮组(饲喂高脂日粮,脂肪提供60 % 的能量),日粮成分配比见表1,每组10只。将小鼠同室分笼饲养,自由采食和饮水;每天光照与黑暗各12 h,环境温度控制在(25±1) ℃,湿度(60±5)%。每周进行小鼠采食量和体质量的测定,饲养4周后,通过颈部脱臼方式处死小鼠,采集小鼠乳腺组织并称质量,同时对乳腺进行染色和基因表达等检测。
表1 对照组和高脂日粮组日粮成分对比
Tab.1 Comparison of dietary composition for control group and high-fat diet group
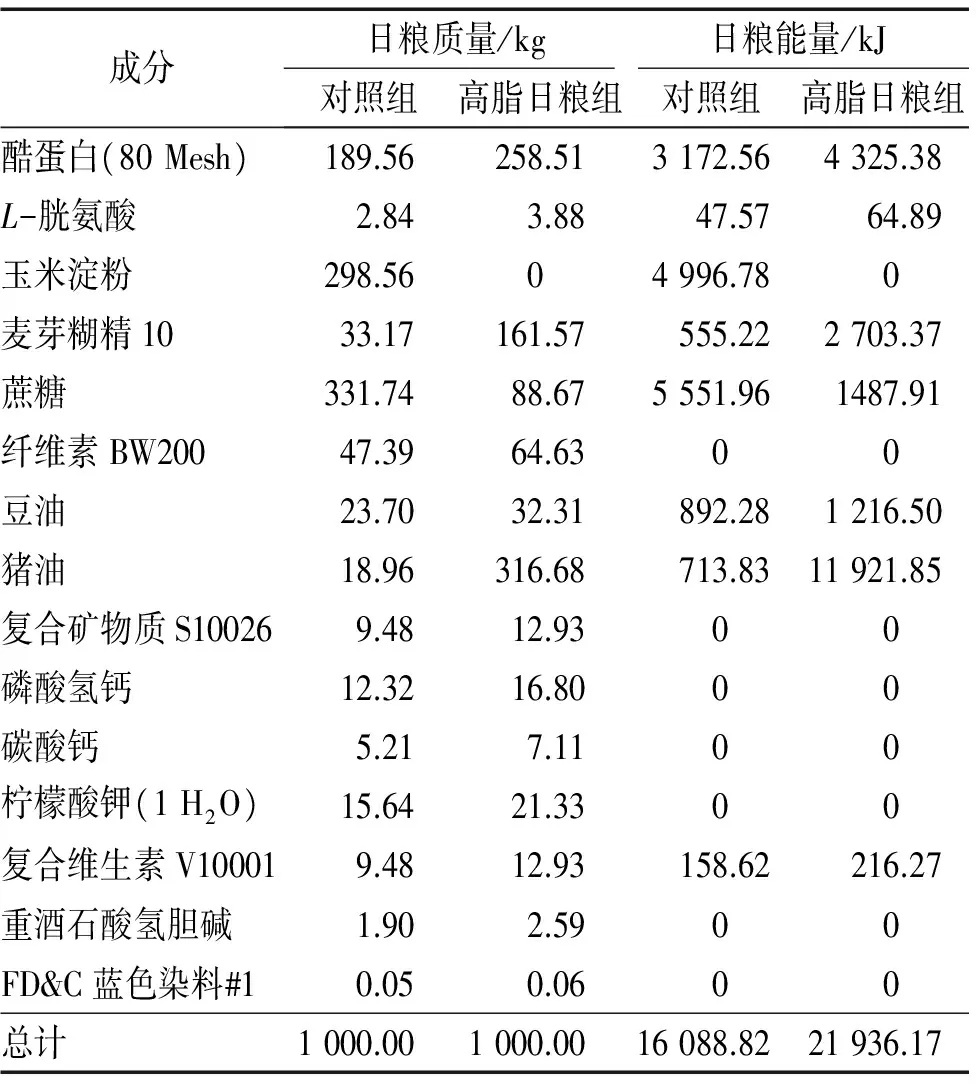
成分日粮质量/kg日粮能量/kJ对照组高脂日粮组对照组高脂日粮组酷蛋白(80Mesh)189.56258.513172.564325.38L-胱氨酸2.843.8847.5764.89玉米淀粉298.5604996.780麦芽糊精1033.17161.57555.222703.37蔗糖331.7488.675551.961487.91纤维素BW20047.3964.6300豆油23.7032.31892.281216.50猪油18.96316.68713.8311921.85复合矿物质S100269.4812.9300磷酸氢钙12.3216.8000碳酸钙5.217.1100柠檬酸钾(1H2O)15.6421.3300复合维生素V100019.4812.93158.62216.27重酒石酸氢胆碱1.902.5900FD&C蓝色染料#10.050.0600总计1000.001000.0016088.8221936.17
1.2 试剂材料
高脂日粮购于上海起发实验试剂有限公司,HE染色溶液购于上海歌凡生物,百里酚、胭脂红和硫酸铝钾购于成都艾科达化学试剂有限公司,p-JNK/JNK、p-AKT/AKT、p-ERK/ERK等抗体均购于Cell Signaling Technology;IGF-I、β-actin购于北京博奥森生物科技有限公司;TLR4购于Abcam 公司;p-IKK/IKK购于Santa Cruz Biotechnology。
1.3 测定指标及方法
乳腺采集和whole-mount、HE染色:切下双侧乳腺腹腺体(第4对乳腺)并称质量,涂布在玻璃载片上,进行whole-mount染色(染色液的制备:先将1.0 g胭脂红和2.5 g硫酸铝钾加入500 mL蒸馏水,加热煮20 min,调整最终体积为500 mL,过滤和添加百里酚作为防腐剂),步骤为:将涂布在玻璃载片上的整块乳腺组织经Carnoy液固定、脱水、着色、透明,最后制片进行显微镜观察。同时,我们对小鼠的乳腺组织进行HE染色,步骤为:组织脱水、包埋、切片、染色、封片,最后在显微镜下观察初情期小鼠乳腺组织结构,比较乳腺组织导管数量、密度和终末乳芽(Terminal end bud ,TEB)数量的变化。
组织样品采集和蛋白表达检测:试验结束切下双侧乳腺腹腺体(第4乳腺)并称质量,提取蛋白,通过Western blot分析检测各组小鼠乳腺组织增殖相关信号通路关键蛋白IGF-I(IGF-I/β-actin)、Akt(p-AKT/AKT)、Erk(p-Erk/Erk)及炎症信号通路关键蛋白TRL4(TLR4/β-actin)、JNK(p-JNK/JNK)、IKK(p-IKK/IKK)的表达,抗体和TBST缓冲液的体积比为1∶2 000。
1.4 统计分析
数据结果用平均值±标准误表示,统计分析采用SigmaPlot 12.5软件分析,采用t检验比较高脂日粮组和对照组的统计差异。
2 结果与分析
2.1 高脂日粮对初情期小鼠采食量、能量摄入和体质量增加的影响
如图1A所示,高脂日粮组小鼠的每周采食量均极显著低于对照组(P<0.01),但高脂日粮组小鼠的能量摄入除第1周极显著低于对照组外,其他各周2组小鼠的能量摄入均无显著差异(图1B);同时,在整个试验期,高脂日粮组和对照组小鼠在体质量上无显著差异(图1C),但从第2周开始,高脂日粮组小鼠的体质量增加显著高于对照组(P<0.05)(图1D)。
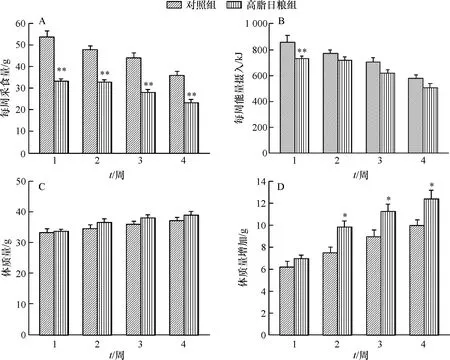
*、**分别表示与对照组相比差异达0.05、0.01的显著水平(t检验)。
Fig.1 Effects of high-fat diet on the feed intake (A), energy intake (B), body weight (C) and body weight gain (D) of pubertal mice
2.2 高脂日粮对初情期小鼠乳腺发育的影响
小鼠乳腺whole-mount染色如图2A~D所示,与对照组小鼠相比,高脂日粮组小鼠的乳腺组织在乳腺导管的密度和数量上有明显的降低;与whole-mount染色相同, HE染色结果(图 2E、2F)也显示,高脂日粮组的小鼠乳腺的导管数明显少于对照组小鼠。此外,与对照组小鼠相比,饲喂高脂日粮的小鼠的乳腺质量极显著增加(P<0.01),且乳腺质量与体质量的比值也极显著升高(P<0.01),但高脂日粮组小鼠乳腺导管的TEB数量极显著降低(P<0.01)(表2)。
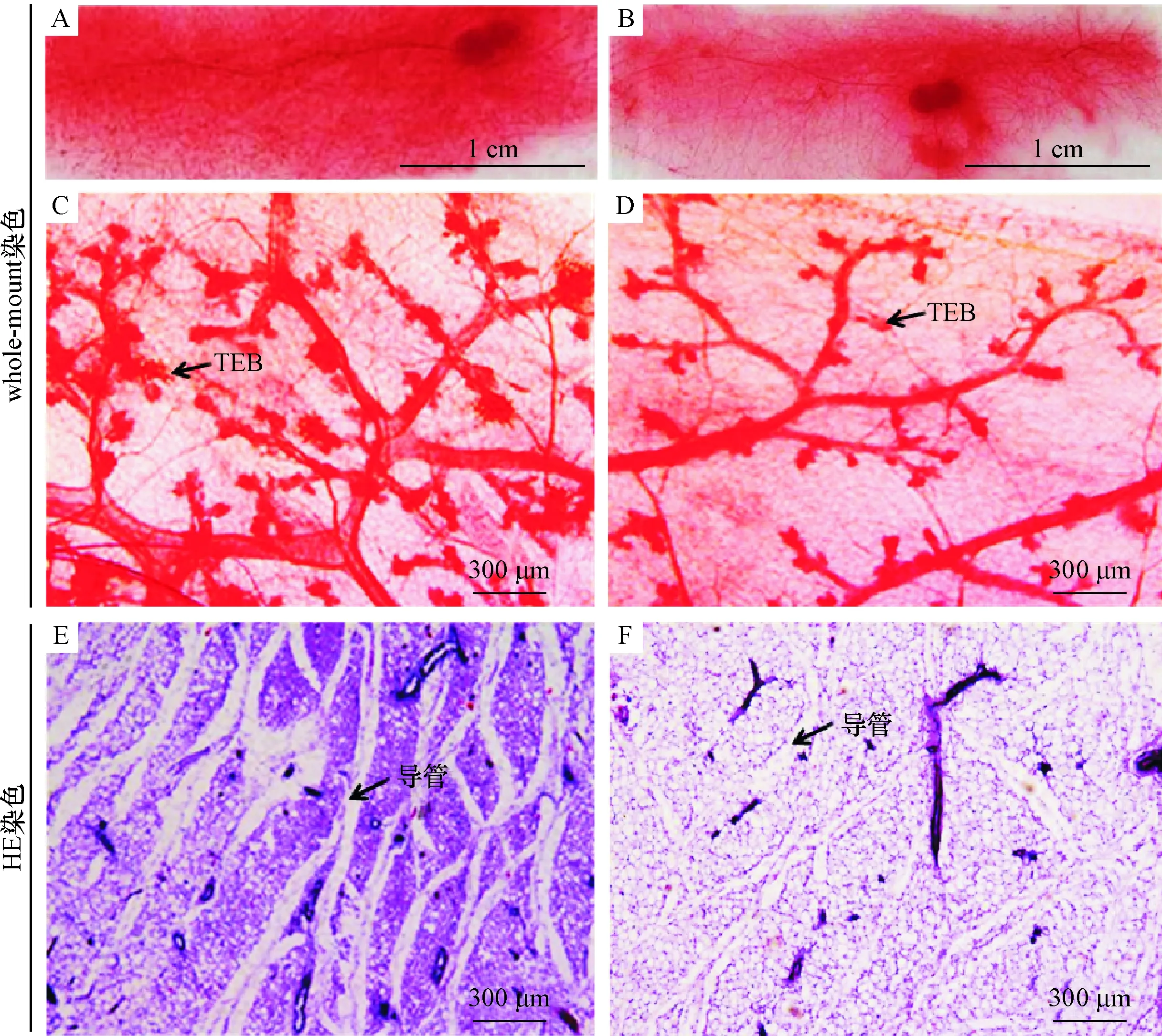
A、B分别为whole-mount染色后对照组和高脂日粮组小鼠乳腺组织的低倍显微镜照片,C、D分别为whole-mount染色后对照组和高脂日粮组小鼠乳腺组织的高倍显微镜照片;E、F分别为HE染色后对照组和高脂日粮组小鼠乳腺组织的高倍显微镜照片。
图2 高脂日粮对初情期小鼠乳腺形态和导管发育的影响
Fig.2 Effects of high-fat diet on mammary gland morphology and duct development of pubertal mice
表2 高脂日粮对初情期小鼠乳腺(第4对)质量和终末乳芽数量的影响1)
Tab.2 Effects of high-fat diet on mammary gland (the fourth pair) weight and the number of terminal end bud of pubertal mice
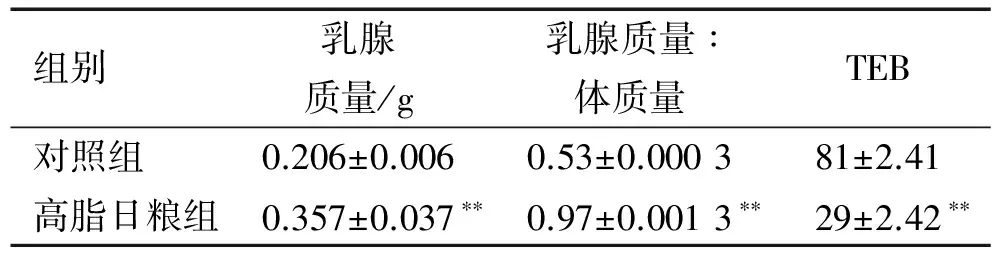
组别乳腺质量/g乳腺质量∶体质量TEB对照组0.206±0.0060.53±0.000381±2.41高脂日粮组0.357±0.037∗∗0.97±0.0013∗∗29±2.42∗∗
1) ** 表示与对照组相比差异达到0.01的显著水平(t检验)。
2.3 高脂日粮对初情期小鼠乳腺组织中IGF-I、增殖及炎症相关信号通路蛋白表达的影响
如图3所示,与对照组小鼠相比,高脂日粮组小鼠的乳腺组织中增殖相关因子IGF-I蛋白表达极显著降低(P<0.01);同时p-Akt/Akt、p-ERK/ERK比值极显著降低(P<0.01),提示增殖相关通路Akt和ERK被极显著抑制。此外,高脂日粮还极显著提高了小鼠的乳腺组织中炎症相关通路蛋白TLR4的蛋白表达(P<0.01)和显著提高了JNK磷酸化水平(P<0.05),但显著降低IKK的磷酸化水平(P<0.05)。
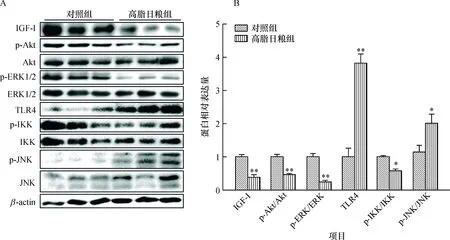
A:Western blot 条带;B:图A的蛋白统计图,IGF-I和TLR4的相对表达量计算均以β-actin为内参, *、** 分别表示与对照组相比差异达0.05、0.01的显著水平(t检验)。
图3 高脂日粮对初情期小鼠乳腺增殖及炎症相关蛋白表达的影响
Fig.3 Effects of high-fat diet on the expressions of proteins associated with proliferation and inflammation in mammary glands of pubertal mice
3 讨论与结论
3.1 高脂日粮对初情期小鼠体质量、体质量增加、采食量和能量摄入的影响
有文献报道,在高脂饮食诱导的小鼠肥胖试验中,小鼠体质量在第10周以后才出现显著升高[11]。此外,Kamikawa等[10]在研究饮食引起的肥胖对妊娠小鼠乳腺导管影响的试验中,也得到了类似的结果。本研究发现,对照组和高脂日粮组小鼠体质量在试验结束时(第8周)无显著差异,这与文献结果相一致。虽然高脂日粮对体质量无显著影响,但却可以显著影响小鼠的体质量增加。此外,高脂日粮组小鼠的采食量显著低于对照组,这与Mcfarlane等[12]报道相同。尽管高脂日粮组小鼠采食量低于对照组,但由于高脂日粮的能量较高,高脂日粮组小鼠在能量摄入方面与对照组并无显著差异。
3.2 高脂日粮对初情期小鼠乳腺导管发育的影响
在本试验中,whole-mount染色和HE染色结果表明,高脂日粮可显著降低乳腺导管的密度和数量以及TEB的数量,提示高脂日粮可显著抑制初情期小鼠乳腺的发育。我们的结果与Olson等[13]报道的初情期饲喂高脂日粮抑制C57BL/6小鼠乳腺发育的结果相一致。除了对初情期小鼠乳腺发育具有明显的抑制作用,高脂日粮还可抑制妊娠期、哺乳期和成年未孕小鼠的乳腺发育。研究显示,妊娠后期和哺乳期肥胖可导致小鼠乳腺导管长度变短、分支变少及导管宽度变窄[8]。同时,饮食导致的肥胖也会阻碍性成熟未孕小鼠的乳腺导管发育[10]。此外,本试验中我们还发现高脂日粮组小鼠的乳腺质量与体质量比极显著高于对照组,这可能与高脂日粮促进了小鼠皮下脂肪沉积有关。
3.3 高脂日粮对初情期小鼠乳腺组织增殖和炎症相关蛋白表达的影响
研究发现,IGF-I在初情期小鼠优先激活PI3K/Akt通路,增加细胞周期蛋白D1(cyclin D1)表达,而在初情期后则以Erk通路的活化为主,并不增加cyclin D1表达,提示小鼠乳腺发育的不同时期可能受不同信号通路的调控[14]。与以上报道相一致的是,本研究结果显示,高脂日粮显著降低小鼠乳腺组织增殖相关蛋白IGF-I的表达量,同时显著抑制增殖相关通路Akt和Erk的活性。以上结果提示,高脂日粮可能是通过抑制增殖信号(IGF-1、Akt和Erk)来抑制初情期小鼠乳腺发育的。
研究表明,高脂日粮不仅能够促进下丘脑和肝脏组织中的炎症反应[15-16],也可导致乳腺组织的局部炎症[17]。我们的结果也显示,高脂日粮可显著提高初情期小鼠乳腺组织的炎症信号分子(TLR4、p-JNK)的表达。在脂多糖诱导的小鼠乳腺炎模型和脂多糖处理的小鼠原代乳腺上皮细胞中,炎症因子TLR4表达会升高,同时细胞凋亡增加[18]。本研究中,高脂日粮显著促进初情期小鼠乳腺TLR4的表达,也可能是促进了乳腺上皮细胞的凋亡,进而抑制乳腺发育。同时,JNK基因敲除小鼠乳腺组织的分支好于野生型小鼠,提示JNK的激活与乳腺分支形态呈负相关[19]。而本试验结果中高脂日粮显著促进JNK的磷酸化,提示高脂日粮可能通过激活JNK通路抑制初情期小鼠乳腺的发育。此外,文献报道炎症信号通路IKK促进核转录因子kappa B(Nuclear factor kappa B,NF-кB)的表达,而NF-κB在小鼠发育早期阶段的分泌量过少会阻碍小鼠乳腺的发育(乳腺上皮细胞的增殖和乳腺导管的分支)[20]。本研究表明,高脂日粮显著抑制初情期小鼠乳腺IKK的磷酸化,提示高脂日粮也可能通过抑制IKK的激活降低NF-κB的表达,进而抑制乳腺的发育。
综上所述,高脂日粮可抑制初情期小鼠乳腺发育,其乳腺导管数量和密度降低,TEB数量减少。高脂日粮对初情期小鼠乳腺发育的抑制作用可能是通过抑制增殖相关信号(IGF-1、Akt和Erk)和促进炎症相关信号(TLR4、JNK)来实现的。研究结果为动物和人类乳腺健康发育的营养调控提供了科学的参考依据。
[1] FARMER C. Review: Mammary development in swine: Effects of hormonal status, nutrition and management[J]. Can J Anim Sci, 2013, 93(1): 1-7.
[2] MACIAS H, HINCK L. Mammary gland development[J]. Wiley Interdiscip Rev Dev Biol, 2012, 1(4): 533-557.
[3] REZAEI R, WU Z, HOU Y, et al. Amino acids and mammary gland development: Nutritional implications for milk production and neonatal growth[J]. J Anim Sci Biotechno, 2016, 7(20). doi: 10. 1186/s40104-016-0078-8.
[4] FARMER C, PALIN M F, MARTEL-KENNES Y. Impact of diet deprivation and subsequent over-allowance during prepuberty: Part 1: Effects on growth performance, metabolite status, and mammary gland development in gilts[J]. J Anim Sci, 2012, 90(3): 863-871.
[5] ZHAO Y, TAN Y S, AUPPERLEE M D, et al. Pubertal high fat diet: Effects on mammary cancer development[J]. Breast Cancer Res, 2013, 15(5): R100.
[6] 李健, 李庆章. 小鼠乳腺发育、泌乳和退化的组织形态学:Ⅰ:一般组织形态学变化[J]. 东北农业大学学报, 2007, 38(2): 196-201.
[7] 李健, 李庆章. 小鼠乳腺发育、泌乳和退化的组织形态学 :Ⅱ:超微组织形态学变化和β-酪蛋白分泌[J]. 东北农业大学学报, 2007, 38(3): 374-379.
[8] MASUYAMA H, HIRAMATSU Y. Additive effects of maternal high fat diet during lactation on mouse offspring[J]. PLoS One, 2014, 9(3): e92805.
[9] MONTALES M T E, MELNYK S, SIMMEN R. Maternal high fat diet promotion of mammary tumor risk in adult progeny is associated with early expansion of mammary cancer stem-like cells and increased maternal oxidative environment[J]. FASEB J, 2013, 27(Suppl 1): 235. 2.
[10]KAMIKAWA A, ICHII O, YAMAJI D, et al. Diet-induced obesity disrupts ductal development in the mammary glands of nonpregnant mice[J]. Dev Dynam, 2009, 238(5): 1092-1099.
[11]MATSUBARA T, MITA A, MINAMI K, et al. PGRN is a key adipokine mediating high fat diet-induced insulin resistance and obesity through IL-6 in adipose tissue[J]. Cell Metab, 2012, 15(1): 38-50.
[12]MCFARLANE M R, BROWN M S, GOLDSTEIN J L, et al. Induced ablation of ghrelin cells in adult mice does not decrease food intake, body weight, or response to high-fat diet[J]. Cell Metab, 2014, 20(1): 54-60.
[13]OLSON L K, TAN Y, ZHAO Y, et al. Pubertal exposure to high fat diet causes mouse strain-dependent alterations in mammary gland development and estrogen responsiveness[J]. Int J Obes (Lond), 2010, 34(9): 1415-1426.
[14]TIAN J, BERTON T R, SHIRLEY S H, et al. Developmental stage determines estrogen receptor alpha expression and non-genomic mechanisms that control IGF-1 signaling and mammary proliferation in mice[J]. J Clin Invest, 2012, 122(1): 192-204.
[15]BODEN G, SHE P, MOZZOLI M, et al. Free fatty acids produce insulin resistance and activate the proinflammatory nuclear factor-kappaB pathway in rat liver[J]. Diabetes, 2005, 54(12): 3458-3465.
[16]ZHANG X, ZHANG G, ZHANG H, et al. Hypothalamic IKKbeta/NF-kappaB and ER stress link overnutrition to energy imbalance and obesity[J]. Cell, 2008, 135(1): 61-73.
[17]COWEN S, MCLAUGHLIN S L, HOBBS G et al. High-fat, high-calorie diet enhances mammary carcinogenesis and local inflammation in MMTV-PyMT mouse model of breast cancer[J]. Cancers, 2015, 7(3): 1125-1142.
[18]SONG X, GUO M, WANG T et al. Geniposide inhibited lipopolysaccharide-induced apoptosis by modulating TLR4 and apoptosis-related factors in mouse mammary glands[J]. Life Sci, 2014, 119(1): 9-17.
[19]CELLURALE C, GIRNIUS N, JIANG F et al. Role of JNK in mammary gland development and breast cancer[J]. Cancer Res, 2012, 72(2): 472-481.
[20]CAO Y, KARIN M. NF-kappaB in mammary gland development and breast cancer[J]. J Mammary Gland Biol Neoplasia, 2003, 8(2): 215-223.
【责任编辑 庄 延】
Effect of high-fat diet on mammary gland development ofpubertal mice and the molecular mechanism
MENG Yingying, ZHANG Jing, ZHANG Fenglin, AI Wei, ZHU Xiaotong,SHU Gang, WANG Lina, GAO Ping, JIANG Qingyan, WANG Songbo
(College of Animal Science, South China Agricultural University, Guangzhou 510642, China)
【Objective】 To investigate the effect of high-fat diet (HFD) on mammary gland development of pubertal mice and explore the possible underlying mechanisms.【Method】 Twenty 4-week-old Kunming female mice were randomly divided into control group and HFD group. The trial lasted for four weeks. The body weight and feed intake were recorded weekly. At the end of the trial, mammary glands were collected and weighed. The morphology and number of ducts were observed by using whole-mount and HE staining. Western blot was used to analyze the expressions of insulin-like growth factor 1 (IGF-1), proliferation related signaling pathway proteins such as protein kinase B (Akt) and extracellular regulated protein kinases (ErK), as well as inflammation related signaling pathway proteins, including toll-like receptor 4 (TLR4), c-Jun N-terminal kinase (JNK) and inhibitor of nuclear factor kappa-B kinase (IKK) in the mammary glands.【Result】 The feed intake of the HFD group was significantly lower than that of control group(P<0.05), There was no significant difference in energy intakes between two groups. The body weight gain of HFD group was significantly higher than that of control group (P<0.05). In addition, HFD significantly increased mammary gland weight and the ratio of mammary gland weight to body weight (P<0.01). The results of whole-mount and HE staining demonstrated that the mammary gland development of HFD group mice were markedly inhibited, with significantly decreased duct number, duct density and number of terminal end buds (P<0.01). HFD significantly inhibited IGF-1 expression and the phosphorylation of Akt, Erk and IKK in mammary glands (P<0.01 or 0.05), while significantly promoted TLR4 expression (P<0.01) and JNK phosphorylation (P<0.05). 【Conclusion】 HFD can suppress mammary gland development of pubertal mice, which might result from the inhibiton of proliferative signals and stimulation of inflammatory signals.
high-fat diet (HFD); mouse; mammary gland development; proliferation; inflammation;protein expression
2016- 07- 17 优先出版时间:2017-04-12
孟莹莹(1989—),男,硕士研究生,E-mail:1326036268 @qq.com;通信作者:王松波(1980—),男,副教授,博士,E-mail:songbowang@scau.edu.cn
国家重点研发计划(2016YFD0500503);广东省特支计划(2014TQ01N260)
S828
A
1001- 411X(2017)03- 0009- 06
优先出版网址:http://kns.cnki.net/kcms/detail/44.1110.s.20170412.1431.022.html
孟莹莹, 张 静, 张枫琳, 等.高脂日粮对初情期小鼠乳腺发育的影响及分子机制[J].华南农业大学学报,2017, 38(3):9- 14.

