乳酸菌胞外多糖对黑莓果酒品质的影响
李建军+周剑忠++董月++夏秀东++王英
摘要:通过测定经植物乳杆菌(Lactobacillus plantarum)FM-L1-3和明串珠菌(Leuconostoc mesenteroides)T-L1胞外多糖处理前后黑莓果酒中蛋白质、总酚、花色苷、色度、澄清度以及热稳定性等参数的变化,研究乳酸菌胞外多糖处理对黑莓果酒品质的影响。结果表明,适量的乳酸菌胞外多糖处理黑莓果酒,能明显降低导致果酒沉淀的蛋白质、总酚含量,显著提高果酒的澄清度和热稳定性,显著延长果酒的储存稳定性,另外,胞外多糖处理降低了果酒的花色苷含量和果酒的色泽;相同含量的FM-L1-3和T-L1 胞外多糖处理果酒,对果酒品质影响不同。与对照相比,乳酸菌胞外多糖对黑莓果酒品质均具有提升作用。
关键词:乳酸菌;胞外多糖;黑莓果酒;品质
中图分类号: TS262.7文献标志码: A文章编号:1002-1302(2017)06-0178-04
黑莓果酒中富含多酚、黄酮、类黄酮、叶黄素、花青素、叶酸、微量元素锰等物质,不仅可以提高人体免疫力,还能降血压[1]。相对于葡萄酒,黑莓果酒不仅富含多酚类物质,而且黑莓果酒有着更有效的体外抗氧化的功效[2]。黑莓果酒中的花青素可预防心血管病,降低中风风险,花青素和原花青素可有效改善血管健康状况,减少动脉粥样硬化,预防和降低冠心病和中风的风险。随着人们生活水平的提高和保健意识的增强,兼具丰富营养和功能的黑莓果酒产业将会有很大的发展前景。
黑莓果酒在贮藏过程中存在一些品质上的波动,例如出现浑浊、沉淀和色泽减弱。虽说果酒的轻微浑浊和少量沉淀对消费者的健康并没有多大的影响,但是这将大大影响消费者购买意向。销售量是每个产品生命力的体现,为了提高黑莓果酒的市场前景,必须大大提高黑莓果酒的储存稳定性。
乳酸菌胞外多糖(exopolysaccharides,EPS)是乳酸菌生长代谢过程中分泌到细胞壁外的黏液多糖和荚膜多糖的总称[3-4],具有改善发酵食品质构、口感、流变性、稳定性、持水性等独特的理化特性,同时还具有多种生物活性,具有抑菌、抗诱变、抗肿瘤、降胆固醇、调节肠胃功能等作用[5-8]。近年来对乳酸菌EPS的研究和开发引起广大研究者和食品加工业的重视[9-11]。
目前,乳酸菌胞外多糖对果酒品质的影响,尤其是果酒储存稳定性的影响还未见报道。本课题将探究2种乳酸菌多糖的添加对黑莓果酒中蛋白质含量、总酚含量、花色苷含量、澄清度、色度、热稳定性及储存稳定性的影响,分析乳酸菌胞外多糖对果酒品质的影响,以期开发新的具有提高黑莓果酒品质功效的物质来源。
1材料与方法
1.1试验材料
黑莓采自江苏省南京市溧水区黑莓种植基地。植物乳杆菌(Lactobacillus plantarum)FM-L1-3和明串珠菌(Leuconostoc mesenteroides)T-L1,由江苏省农业科学院农产品加工研究所食品生物工程研究室保存。
1.2试剂及仪器
试剂:福林酚(Folin-Phenol),SIGMA;没食子酸,上海西陇化工有限公司;福尔马肼浊度标准溶液,上海昕瑞仪器仪表有限公司;无水碳酸钠,南京寿德试剂有限公司;
设备:紫外可见分光光度计UV-1600PC,上海美普达仪器有限公司;电热恒温水浴锅,上海精宏实验设备有限公司;浊度计,上海昕瑞仪器仪表有限公司;双向磁力加热搅拌器,江苏金坛市中大仪器厂。
1.3试验方法
1.3.1果酒制备工艺黑莓果清洗→打浆→配料(添加偏重亚硫酸钾、果胶酶和蔗糖)→接种→发酵→过滤→澄清。
1.3.2乳酸菌培養及其胞外多糖的提取挑取活化后单菌落分别接种到液体MRS试管中,37 ℃条件下培养24 h,传代2次。按3%的接种量分别接种装有液体MRS的三角瓶中,培养24 h。胞外多糖的提取方法参照文献[12]并做适当改进。在4 ℃条件下离心去除菌体。上清液用蛋白酶脱除蛋白,再添加3倍体积的冷乙醇于上清液中,4 ℃ 下静置过夜。冷冻离心得沉淀物,用冷乙醇洗涤沉淀物3~5次,利用透析袋(截留分子量为5 000~8 000)进行透析处理,冷冻干燥得胞外多糖提取物。
1.3.3黑莓果酒的胞外多糖处理取黑莓果酒200 mL置于250 mL的试剂瓶中,按照胞外多糖终浓度分别为50、250、500 mg/L 将FM-L1-3和T-L1的胞外多糖分别加入到黑莓果酒中,充分混匀后,静置5~7 d,经4 500 r/min离心15 min,获得胞外多糖处理的黑莓果酒,同时以未加多糖的黑莓果酒作为对照。试验重复3次。
1.3.4果酒各理化指标测定
1.3.4.1果酒中蛋白质含量测定采用考马斯亮蓝染色法,具体操作方法参照文献[13]。
1.3.4.2果酒中总酚含量测定采用Folin-酚试剂法,具体操作方法参照文献[14]。
1.3.4.3果酒中总糖的测定采用苯酚硫酸法,具体操作方法参照文献[15]。
1.3.4.4花色苷的测定在2个 10 mL 的容量瓶里各加入 1 mL 稀释后的黑莓果酒,分别用 pH值1.0的缓冲溶液(0.2 mol/L KCl,用HCl调pH值为1.0)及 pH值4.5(1 mol/L CH3COONa,用HCl调pH值为4.5)的缓冲溶液定容。将定容后的溶液放置在冰箱, 4 ℃避光静置2 h 后,在波长510 nm及700 nm下测吸光度D,结果以矢车菊-3-O-葡萄糖苷计 [16]。花色苷含量计算公式:
花色苷含量(mg/L)=(D×m×n×1 000)/(ε×L)。
式中:D=(D510 nm,pH值1.0-D700 nm,pH值1.0) -(D510 nm,pH值4.5-D700 nm,pH值4.5);m为矢车菊-3-O-葡萄糖苷的相对分子质量,449.2;n为稀释倍数,10;ε为矢车菊-3-O-葡萄糖苷的摩尔消光系数,26 900;L为比色皿的光程长度,1。
1.3.4.5色度的测量[17]将处理好的果酒倒入比色皿中,以蒸馏水为参比,于420、520、620 nm 处测其吸光度,以三者吸光度之和表示色度。
1.3.4.6澄清度的测量将果酒倒入比色皿中,以蒸馏水为参比,于680 nm处测其透光率,具体操作方法参照文献[18]。
1.3.4.7热稳定性测定[19]将处理好的果酒取5 mL置于试管中,置于80 ℃水浴中处理6 h后,取出放置在4 ℃下 16 h,然后在室温下用浊度计测定其浊度值,以样品热处理后与热处理前的浊度差值(ΔNTU)表示其热稳定性。
1.3.4.8果酒的储存稳定性根据前期的试验结果,选择终浓度为250 mg/L的FM-L1-3和T-L1的胞外多糖处理黑莓果酒,每隔3个月测定果酒的浊度值,分析时间为12个月,以未用胞外多糖处理的果酒为对照。
2结果与分析
2.1乳酸菌胞外多糖对黑莓果酒中蛋白质含量的影响
一般来说,果酒中蛋白质含量很低,不是果酒的主要营养成分,每升果酒中蛋白质含量为几十到几百毫克之间。但是,已有的研究结果表明,果酒中蛋白质是引起果酒浑浊的一个必要因素,且蛋白质的含量越高,果酒越不稳定,越易发生浑浊沉淀现象[20-22],导致果酒的货架期大大缩短。如何去除果酒中的蛋白质,保持果酒的澄清稳定性,延长果酒的货架期,是目前果酒产业研究的一个热点。
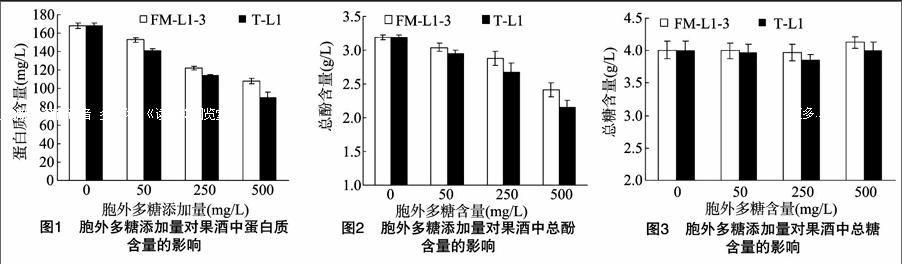
前人的研究结果显示,向果酒中加入一些澄清剂,可以降低果酒中的蛋白质含量,提高果酒的澄清稳定性。Francois等利用皂土处理葡萄果酒,随着皂土添加量的增加,果酒中蛋白质的含量呈现降低趋势,当皂土添加量达到0.5 g/L时,蛋白质含量可以去除50%[23]。王英等利用皂土处理黑莓果酒,当皂土用量为0.6 g/L时,蛋白质的去除率达到62.4%[24]。另外,添加单宁也会不同程度地降低果酒中的蛋白质含量。本研究中乳酸菌胞外多糖的添加对果酒中蛋白质含量的影响见图1。从图1可以看出,随着胞外多糖添加量的增多,果酒中的蛋白质含量整体呈现减少趋势。与对照相比,当胞外多糖添加量为500 mg/L时,FM-L1-3胞外多糖处理的果酒中蛋白质含量降低了35.82%,T-L1胞外多糖处理的果酒中蛋白质含量降低了46.06%。可见,乳酸菌胞外多糖具有优良的去除果酒中蛋白质的功能,且不同乳酸菌的胞外多糖去除果酒中蛋白质能力不同。
2.2乳酸菌胞外多糖对黑莓果酒中总酚含量的影响
酚类物质是果酒中一个重要组成部分,也是一个重要的功能成分,对果酒的感观特性(颜色、风味、苦味等)有重要贡献,由于其具有抗氧化、抑菌、抗炎症等功能活性而备受关注[25-26]。同时已有的研究表明,酚类物质也是引起果酒沉淀的一个重要的非生物因素[27-28]。添加不同的澄清剂,对果酒中的酚类物质也具有不同程度的降低作用,进而达到提高澄清稳定性的作用。通常用聚乙烯吡咯烷酮(PVPP)去除果酒中的酚类物质,通过氢键与酒中的酚类物质络合,对小分子物质具有很强的吸附能力。乳酸菌胞外多糖的添加对果酒中总酚含量的影响见图2。从图2可以看出,随着胞外多糖添加量的增多,果酒中的总酚含量整体呈现减少趋势。与对照相比,当胞外多糖添加量为500 mg/L时,FM-L1-3胞外多糖处理的果酒中总酚含量降低了24.34%,T-L1胞外多糖处理的果酒中总酚含量降低了32.71%。可见,乳酸菌胞外多糖具有较好的去除果酒中总酚的功能,且不同乳酸菌的胞外多糖去除果酒中总酚能力不同。
2.3乳酸菌胞外多糖对黑莓果酒中总糖含量的影响
从图3可以看出,在FM-L1-3的胞外多糖含量添加量为0~250 mg/L时,果酒体系中的总糖含量变化不大,当多糖含量添加为500 mg/L时,果酒体系中总糖含量反而增加了2.91%。T-L1的胞外多糖含量添加量为0~250 mg/L时,果酒体系中的总糖含量呈现下降趋势,当多糖含量添加为500 mg/L时,果酒体系中总糖含量与对照相比保持一致。总体来说,乳酸菌胞外多糖对果酒中的总糖含量影响不大。
2.4乳酸菌胞外多糖对黑莓果酒中花色苷含量的影响
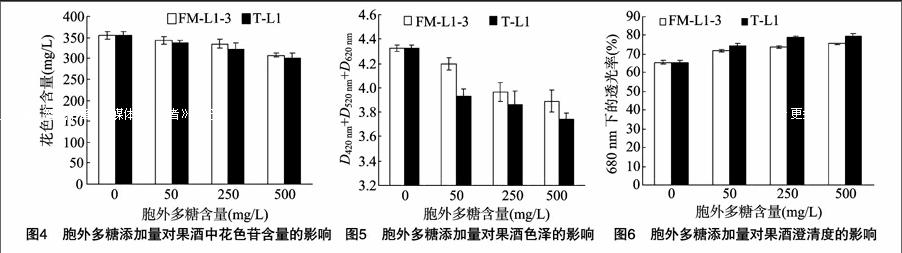
果酒颜色是果酒的一个重要感官品质,也是判断果酒酒龄的一个重要依据,花色苷是赋予果酒颜色的一类主要化合物。另外,花色苷是一种功能性水溶色素,具有抗氧化、清除自由基等多种生理活性[5]。乳酸菌胞外多糖的添加对果酒中花色苷含量的影响见图4。从图4可以看出,随着胞外多糖添加量的增多,果酒中的花色苷含量整体呈现减少趋势。与对照相比,当胞外多糖添加量为500 mg/L时,FM-L1-3胞外多糖处理的果酒中花色苷含量降低了12.57%,T-L1胞外多糖处理的果酒中花色苷含量降低了15.43%。结果显示,乳酸菌胞外多糖能够不同程度地降低果酒中的花色苷含量,且不同乳酸菌的胞外多糖对果酒中花色苷的影响能力不同。
2.5乳酸菌胞外多糖对黑莓果酒色泽的影响
从图5可以看出,随着胞外多糖添加量的增多,果酒中的色泽整体呈现减少趋势。这是由于胞外多糖的加入,降低了果酒中呈色物质(酚类物质和花色苷)含量,进而导致了果酒色泽的降低。从图5中还可以看出,乳酸菌FM-L1-3 和
T-L1的胞外多糖添加相同含量,但对果酒的色泽影响不同,相同含量胞外多糖处理果酒,乳酸菌 T-L1的胞外多糖对果酒的色泽影响更大,这与乳酸菌 T-L1胞外多糖处理对果酒中的酚类物质和花色苷物质的影响趋势相同,T-L1胞外多糖对多酚和花色苷含量的影响更大。
2.6乳酸菌胞外多糖对黑莓果酒的澄清度的影响
果酒澄清度是果酒的一个重要感官品质,虽然很多果酒商品都会标注有少许沉淀不影响饮用。但是,带有沉淀或少许浑浊的果酒会影响消费者的购买欲。乳酸菌胞外多糖的添加对果酒澄清度的影响见图6。从图6可以看出,随着胞外多糖添加量的增多,果酒澄清度整体呈现增加趋势。与对照相比,当胞外多糖添加量为500 mg/L时,FM-L1-3胞外多糖处理使黑莓果酒的澄清度增加了15.53%,T-L1胞外多糖处理使黑莓果酒的澄清度提高了22.12%。这与T-L1和FM-L1-3胞外多糖處理时对影响果酒澄清稳定性的蛋白质和酚类物质的结果一致,前面的研究结果显示,相同含量的胞外多糖处理,T-L1胞外多糖处理对果酒中蛋白质和总酚含量的去除能力更强。
2.7乳酸菌胞外多糖對黑莓果酒热稳定性的影响
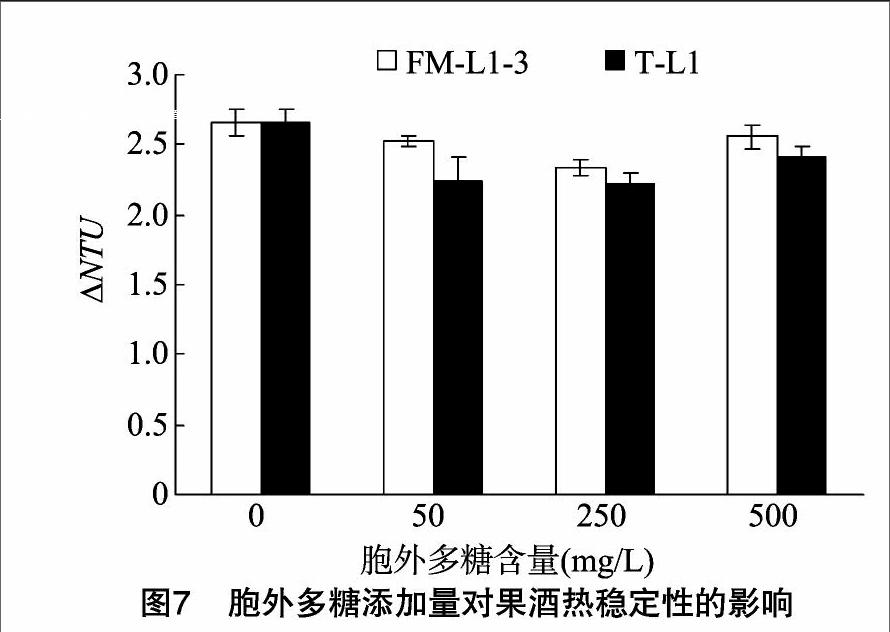
从图7可以看出,随着胞外多糖添加量的增多,果酒的热稳定性呈现先增加后降低的趋势。与对照相比,胞外多糖的添加能够降低ΔNTU值,增加黑莓果酒的稳定性,但是,不同胞外多糖的添加量和不同乳酸菌的胞外多糖对果酒的热稳定性的影响不同。从图7可以看出,T-L1胞外多糖添加量为50~250 mg/L时,ΔNTU的值最小,黑莓果酒的热稳定性最高,当继续增加胞外多糖,ΔNTU的值开始增大,热稳定性开始降低,试验结果显示,并不是果酒中总酚物质、蛋白质含量、花色苷含量越低,果酒稳定性越高,这可能是由于影响果酒澄清稳定性的因素除了蛋白质、总酚和花色苷物质之外,还有其他的因素起到重要作用,这将在后续的研究工作中做进一步的探讨和分析。
2.8乳酸菌胞外多糖对黑莓果酒储存稳定性的影响
果酒货架期澄清度的稳定性是影响果酒品质的重要指标之一。乳酸菌胞外多糖的添加对黑莓果酒储存期澄清度的影响见图8。从图8可以看出,随着储存时间的延长,不同处理的果酒的NTU值增大,可见,随着储存时间的延长,果酒的澄清度呈现下降趋势。从图8还可以看出,与对照相比,在相同的储存时间内, 胞外多糖添加能显著提高果酒澄清度的稳定
性;另外,T-L1胞外多糖处理效果要高于同等浓度的FM-L1-3胞外多糖的处理效果。
3结论
本研究测定了植物乳杆菌(Lactobacillus plantarum)FM-L1-3 和明串珠菌(Leuconostoc mesenteroides)T-L1胞外多糖处理前后黑莓果酒中蛋白质、总酚、花色苷、色度、澄清度以及热稳定性等参数的变化,结果表明,适量的乳酸菌胞外
多糖处理黑莓果酒,能明显降低导致果酒沉淀的蛋白质、总酚含量,显著提高果酒的澄清度和热稳定性,显著延长果酒的储存稳定性,另外,胞外多糖处理降低了果酒的花色苷含量和果酒的色泽。
相同含量的FM-L1-3和T-L1 胞外多糖处理黑莓果酒,对果酒品质影响不同,说明不同的乳酸菌胞外多糖对黑莓果酒品质影响不同。
参考文献:
[1]庄晶晶,陈卫,李亚,等. 黑莓黄酮的自由基清除活性与防护肝细胞氧化损伤研究[J]. 中国食品学报,2015,15(7):46-53.
[2]Reena P,Gopinadhan P. Antioxidant and calmodulin-inhibitory activiyies of phenolic components in fruit wines and its biotechnological implications[J]. Food Biotechnology,2001,15(3):179-192.
[3]Ai L Z,Zhang H,Guo B H,et al. Preparation,partial characterization and bioactivity of exopolysaccharides from Lactobacillus casei LC2W[J]. Carbohydrate Polymers,2008,74:353-357.
[4]Yang Z N,Li S Y,Zhang X,et al. Capsular and slime-polysaccharide production by Lactobacillus rhamnosus JAAS8 isolated from Chinese sauerkraut:potential application in fermented milk products[J]. Journal of Bioscience and Bioengineering,2010,110(1):53-57.
[5]张宏志,马艳弘,李亚辉,等. 菊芋乳酸菌饮料生产工艺及稳定性研究[J]. 江苏农业科学,2015,43(12):291-294.
[6]张筠,刘宁,孟祥晨. 乳酸菌胞外多糖的生物学活性[J]. 国外医学(卫生学分册),2004,31(4):227-230.
[7]Alan D,Welman S M. Exopolysaccharides from lactic acid bacteria:perspectives and challenges[J]. Trends in Biotechnology,2003,21(6):269-274.
[8]Sun J,Shi Y H,Le G W,et al. Distinct immune response induced by peptidoglycan derived from Lactobacillus sp.[J]. World Journal of Gastroenterology,2005,11(40):6330-6337.
[9]Badel S,Bernardi T,Michaud P. New perspectives for Lactobacilli exopolysaccharides[J]. Biotechnology Advances,2010,29(1):54-66.
[10]Mostafa H,Daba A,El-Mezawy A. Screening of potential Lactobacilli protein-bound exopolysaccharides[J]. Deutsche Lebensmittel-Rundschau,2006,102(2):62-66.
[11]Wang Y P,Li C,Liu P,et al. Physical characterization of exopolysaccharide produced by Lactobacillus plantarum KF5 isolated from Tibet Kefir[J]. Carbohydrate Polymers,2010,82:895-903.
[12]Savadogo A,Cheik A,Sawadogo O P. Identification of exopolysacccharides-producing lactic acid bacteria from Burkina Faso fermented milk samples[J]. African Journal of Biotechnology,2004,3(3):189-194.
[13]Batalia M A,Monzingo A F,Ernst S,et al. The crystal structure of the antifungal protein zeamatin,a member of the thaumatin-like,PR-5 protein family[J]. Nature Structural Biology,1996,3(1):19-23.
[14]仇小妹,王英,董明盛,等. 复合酶酶解对蓝莓出汁率及总抗氧化能力的影响[J]. 食品科学,2013,34(24):25-29.
[15]郭雷,吕明生,王淑军,等. 苯酚-硫酸法测定樱桃酒中总糖[J]. 食品研究与开发,2010,31(6):130-132.
[16]Bfntsis T,Robinson R K. A study of the effects of adjunct cultures on the aroma compounds of Feta-type cheese[J]. Food Chemistry,2004,88(3):435-441.
[17]梁冬梅,李記明,林玉华.分光光度法测葡萄酒的色度[J]. 中外葡萄与葡萄酒,2002(3):9-10,13.
[18]李维新,林晓姿,何志刚,等. 枇杷果酒澄清与稳定性研究[J]. 酿酒科技,2005(7):62-64.
[19]Pocock K F,Rankine B C. Heat test for detecting protein instability in wine[J]. Australian Wine Brewing Spirit Review,1973,91:42-43.
[20]Esteruelas M,Poinsaut P,Sieczkowski N,et al. Characterization of natural haze protein in sauvignon white wine[J]. Food Chemistry,2009,113(1):28-35.
[21]Fusi M,Mainente F,Rizzi C,et al. Wine hazing:A predictive assay based on protein and glycoprotein independent recovery and quantification[J]. Food Control,2010,21(6):830-834.
[22]Marangon M,Sauvage F X,Waters E J,et al. Effects of ionic strength and sulfate upon thermal aggregation of grape chitinases and thaumatin-like proteins in a model system[J]. Journal of Agricultural and Food Chemistry,2011,59(6):2652-2662.
[23]Sauvage F X,Bach B,Moutounet M A. Proteins in white wines:Thermo-sensitivity and differential adsorbtion by bentonite[J]. Food Chemistry,2010,118(1):26-34.
[24]王英,周剑忠,黄开红,等. 皂土在黑莓果酒澄清中的应用研究[J]. 中国酿造,2012,31(8):47-51.
[25]Li Z,Pan Q H,Jin Z M,et al. Comparison on phenolic compounds in Vitis vinifera cv. Cabernet Sauvignon wines from five wine-growing regions in China[J]. Food Chemistry,2011,125(1):77-83.
[26]Jeong J H,Jung H,Lee S R,et al. Anti-oxidant,anti-proliferative and anti-inflammatory activities of the extracts from black raspberry fruits and wine[J]. Food Chemistry,2010,123(2):338-344.
[27]Esteruelas M,Kontoudakis N,Gil M A,et al. Phenolic compounds present in natural haze protein of Sauvignon white wine[J]. Food Research International,2011,44(1):77-83.
[28]Sarmento M R,Oliveira J C,Slatner M,et al. Influence of intrinsic factors on conventional wine protein stability tests[J]. Food Control,2000,11(6):423-432.吴嘉琪,王沛,王红霞,等. 富含γ-氨基丁酸谷芽豆乳生产技术研究[J]. 江苏农业科学,2017,45(6):182-185.
doi:10.15889/j.issn.1002-1302.2017.06.048

