生草对沙地葡萄园土壤微生物群落碳源利用特征的影响
司 鹏,于会丽,高登涛,邵 微,乔宪生,陈锦永
(中国农业科学院郑州果树研究所, 河南 郑州 450009)
生草对沙地葡萄园土壤微生物群落碳源利用特征的影响
司 鹏,于会丽,高登涛,邵 微,乔宪生,陈锦永
(中国农业科学院郑州果树研究所, 河南 郑州 450009)
为了研究葡萄园行间生草处理对土壤微生物群落功能多样性的影响,以清耕为对照,运用Biolog-Eco板技术,分析生草处理下的土壤微生物群落碳源利用特征。结果表明:生草处理的AWCD值和多样性指数(Shannon-Wiener多样性指数、Simpson优势度指数和丰富度指数)均显著高于清耕对照,且随土层深度的增加均呈下降趋势,以生草0~20 cm土层处理最高;与清耕对照相比,生草处理土壤微生物对6类碳源利用强度均显著增加,平均增幅顺序为:羧酸类化合物>酚酸类化合物>胺类化合物>碳水化合物类>氨基酸类>聚合物。主成份分析表明,清耕对照和生草处理分布在不同区域,表明两处理土壤微生物存在一定的代谢差异性,生草显著改变了土壤微生物群落功能,并对土壤微生物代谢羧酸类化合物、碳水化合物和酚酸类化合物3类碳源的影响最为明显。结果提示,生草有利于葡萄园土壤微生物群落结构的改善。
生草;土壤微生物功能多样性;Biolog-Eco技术
果园生草是果园生态培育的一种土壤管理模式[1-2],已在欧美、日本等果树生产发达国家广泛应用[3-4]。行间生草可降低果园土壤容重,提高总孔隙度,增强土壤通气透水性,提高土壤酶活性,从而改善土壤肥力[5-8]。近几年,在李[9]、梨[10]、葡萄[11-12]等果树上的研究发现,行间生草还可提高果园土壤酶活性,增加微生物数量,并对土壤微生物数量及其群落中真菌、细菌和放线菌的比例有良好的调节作用。
土壤微生物是土壤生态系统重要组成,参与土壤中有机质转化、养分循环以及生物腐殖以及降解[13],能够快速应对土壤环境的改变[14],并及时反映土壤的肥力状况[15],并影响地表植物的生长[16]。Biolog-Eco分析技术通过分布于96孔中的碳源底物来分析微生物生理代谢特征[17],BiologTM的Eco测试板(Eco MicroPlate,美国Matrix Technologies Corporation)含有3套31种不同碳源(其中碳水化合物8种、氨基酸类6种、羧酸类化合物7种、聚合物3种、胺类化合物3种、酚酸类化合物2种),一个板可以测3个平行。与微生物rRNA(rDNA)和磷酸脂肪酸方法相比,Biolog-Eco板技术更为简单快速,能够广泛应用于评价不同植被类型[18-19]、不同土壤类型[20]及不同管理模式[21-22]下土壤的微生物群落功能多样性[23]。徐华勤等[24]在茶园间作三叶草的研究中发现,生草能够提高土壤微生物整体活性和丰富度,但降低了微生物的均匀度。滕应等[25]认为生草可提高铜矿区复垦红壤土壤微生物AWCD值。但由于相关研究仍开展较少,果园生草对土壤微生物功能多样性的研究尚不系统。
本研究运用Biolog-Eco板技术,对主要耕作层(0~60 cm)进行土壤微生物功能多样性研究,旨在探讨生草对葡萄园土壤微生物碳代谢特征的影响,以期为制定生草措施,改善葡萄园土壤质量提供一定的理论依据。
1 材料与方法
1.1 试验区概况
试验在中国农业科学院郑州果树研究所国家葡萄种质资源圃内进行。资源圃位于东经113°42′,北纬34°48′,海拔110.4 m。年平均气温14.2℃,全年总积温4 658.1℃。年降雨量666 mm,7—8月降雨量270 mm,占全年降雨的42%。全年平均相对湿度66%。年日照2 436 h,无霜期213 d。土壤为褐色土类,质地为沙壤土,pH 7.1~7.5,呈微碱性,土壤理化性质如表1。株行距为1 m×3 m,南北行向。

表1 清耕和生草土壤的土壤基本理化性状
1.2 试验设计
2009年10月设置生草处理。行间间作毛叶苕子设为处理,播种量均为5 kg·667 m-2,每年刈割1~2次,树干距生草带各50 cm。以地面清耕为对照(CK),对照采用人工除草。对照与处理其他管理措施完全相同。
1.3 土样采集
2015年3月15日在清耕对照区与生草处理区采集土壤样品,取样方法为梅花形布点法,选5个点,每个点用土钻分别取0~20、20~40 cm和40~60 cm土层的土样,剔除石块、植物残根等杂物后,每层土样分别混合于无菌封口保鲜袋,于4℃的冰箱中保存,待测。
1.4 Biolog-Eco分析
称取相对于1 g风干土的新鲜土样,加入到盛有99 mL 0.85% NaCl无菌溶液的三角瓶中,封口后在摇床上震荡(200 r·min-1)30 min,使土样与生理盐水充分混匀,再放置在4℃冰箱内静置30 min,然后加样于Biolog-Eco微孔板中,每孔加入150 μL。将加好样的Biolog-Eco微孔板加盖,25℃恒温暗培养,每隔24 h Biolog-Eco微生物分析系统读取590 nm波长的光密度值,连续测定192 h。采用培养120 h的数据进行土壤微生物碳源利用分析和主成分分析。
1.5 微生物群落功能多样性的计算
土壤微生物群落利用碳源的整体能力用平均吸光值(AWCD)表示,其计算公式为:AWCD=∑(Ci-R)/n式中:Ci为所测定的31个碳源孔的吸光值;R为对照孔的吸光值;n为培养基碳源总数(本研究中为31)。
丰富度(Richness)指数S,指被利用的碳源的总数,为每孔中(C-R)的值大于0.25的孔个数。
Shannon-Wiener多样性指数:H'=-Σ(Pi·lnPi)
式中,Pi为有培养基的孔和对照孔的光密度值差与整板总差的比值,即Pi=(Ci-R)/Σ(Ci-R)。
优势度Simpson指数(D),是对多样性方面的集中性度量,D称为Gini指数(1921年Gini提出)。
Simpson指数:D=1-ΣPi2。均匀度(Evenness)指数(E),是群落实测多样性与最大多样性的比率。均匀度指数计算公式为:
E=H'/lnS
式中,S为被利用的碳源总数。
1.6 数据统计分析
采用Microsoft Excel 2007进行数据处理用;Canoco 4.5进行主成分分析(PCA)和SPSS 17.0进行相关分析;用统计软件SAS 8.2进行单因素方差分析,以P<0.05作为显著性的标准。
2 结果与分析
2.1 生草与清耕对土壤微生物AWCD值的影响
AWCD可以用来表示微生物的代谢平均活性,能直观的体现微生物群落反应速度和程度。由图1可知,随着培养时间的延长,各处理的AWCD值呈S曲线模式。生草与清耕的土壤微生物活性均随时间的增加而提高。24 h内,生草与清耕土壤微生物活性均无显著变化,说明在24 h内碳源基本未被利用;48 h以后,随着培养时间延长微生物活性快速增加,微生物碳代谢速率明显加快,但生草与清耕比较,土壤微生物碳代谢速率提高。在培养结束时,生草处理三个土层的AWCD值均高于清耕对照,说明生草能提高土壤微生物AWCD值,其中0~20 cm土层增加幅度最大,生草处理对该土层土壤微生物碳代谢影响最大。

图1 不同处理土壤微生物AWCD随培养时间的变化
Fig.1 Changes of average well color development during incubation of soil microbial community under different treatments
2.2 生草与清耕处理对土壤微生物利用碳源类型的影响
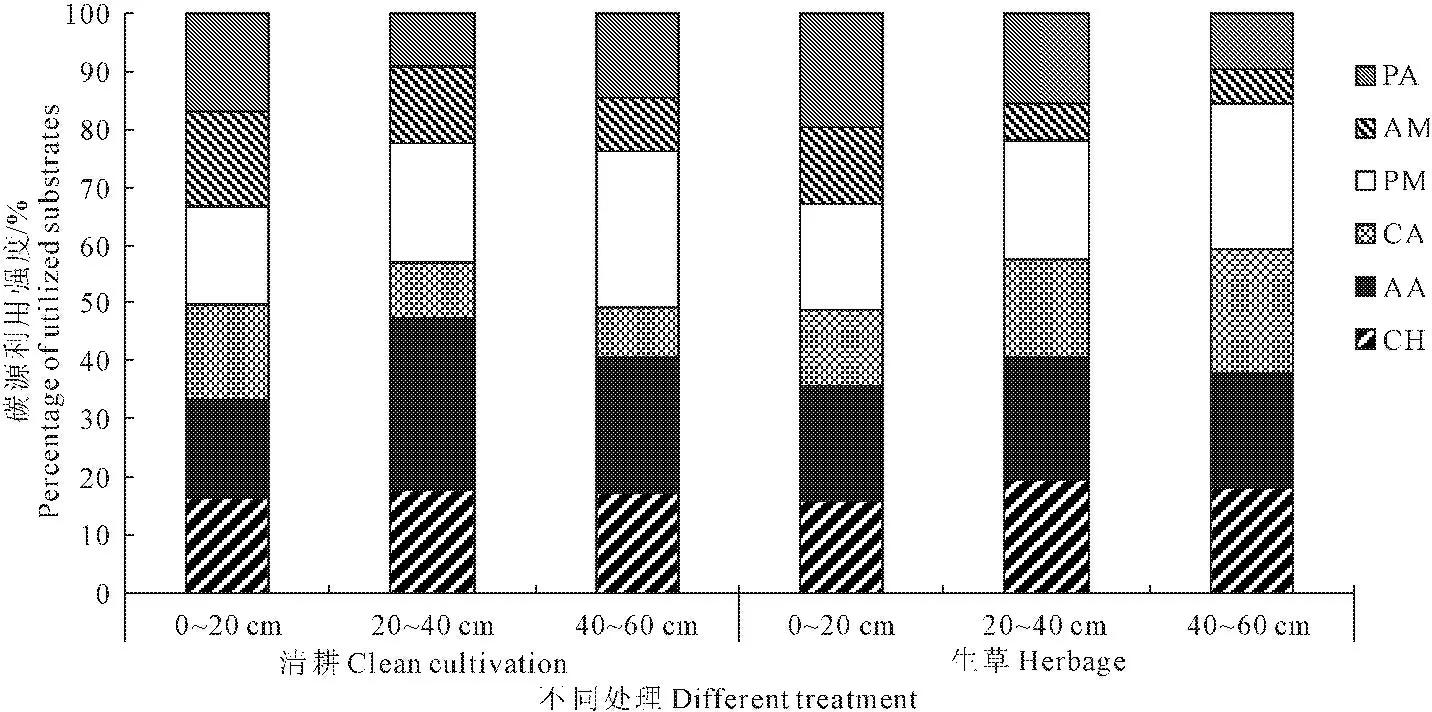
根据化学基团的性质,将Biolog-Eco板上的31种碳源分成6类,即碳水化合物、氨基酸类、羧酸类化合物、聚合物、胺类化合物、酚酸类化合物,将生草处理与对照不同土层的6大类碳源在120 h的光密度数据(C-R)值进行平均(见图2)。由图2可知,清耕与生草处理下,葡萄园土壤微生物对六类碳源的利用情况有一定差异,但碳源相对利用率总体以聚合物、氨基酸类和碳水化合物较高,羧酸类、胺类和酚酸类化合物较低。
注:CH:碳水化合物;AA:氨基酸类;CA:羧酸类;PM:聚合物;AM:胺类;PA:酚酸类化合物,下同。
Note: CH: carbohydrate; AA: amino acids; CA: carboxylic acids; PM: polymer; AM: amine; PA: phenolic acid compound. The same below.
图2 不同处理土壤微生物对碳源利用百分比
Fig.2 Percentage of utilized substrates by soil microbes under different treatments
由图3可知,生草处理与清耕对照的土壤微生物对Biolog-Eco板中每一类碳源的利用程度存在较大差异。与对照相比,生草处理显著提高了微生物对碳源的利用程度,对碳水化合物、氨基酸类、羧酸类化合物、聚合物、胺类化合物和酚酸类化合物六类碳源平均利用程度分别提高了144.05%、128.62%、344.87%、103.29%、157.97%和308.43%。除聚合物类碳源以外,生草处理土壤微生物对其他5类碳源利用强度均随土层深度的增加而降低,对聚合物类碳源利用强度表现为,0~20 cm土层土壤微生物对氨基酸类、胺类和酚酸类化合物利用与其它两土层差异显著;而对照处理的土壤微生物对6类碳源利用强度的变化在不同土层间无显著差异;在同一土层中,与对照相比,生草处理土壤微生物对碳水化合物、氨基酸类、羧酸类化合物、聚合物、胺类化合物和酚酸类化合物碳源的利用增幅最大的土层分别是20~40、0~20、40~60、20~40、0~20 cm和0~20 cm,增幅依次为176.78%、246.87%、406.53%、153.56%、491.16%和801.48%,差异达显著水平。
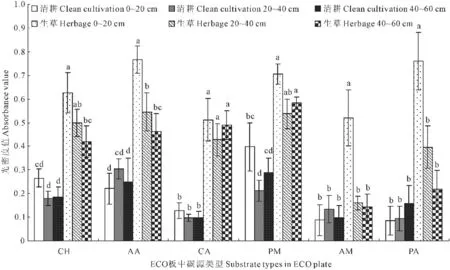
注:不同字母分别表示相同碳源模式下不同处理间0.05水平下的差异显著性(P<0.05),下同。
Note: Different lowercase letters indicate significant difference at 0.05 level, the same below.
图3 不同处理土壤微生物对6类碳源的利用强度
Fig.3 Utilization intensity of microbes to six types of substrate under different treatments
2.3 生草与清耕处理对土壤微生物多样性的影响
根据Biolog-Eco板培养120 h光密度数据(C-R)值,计算120 h的Shannon-Wiener指数、优势度指数、丰富度指数和均匀度指数(见表2)。从表2可知,不同处理各土层微生物生态学指数差异规律不同。
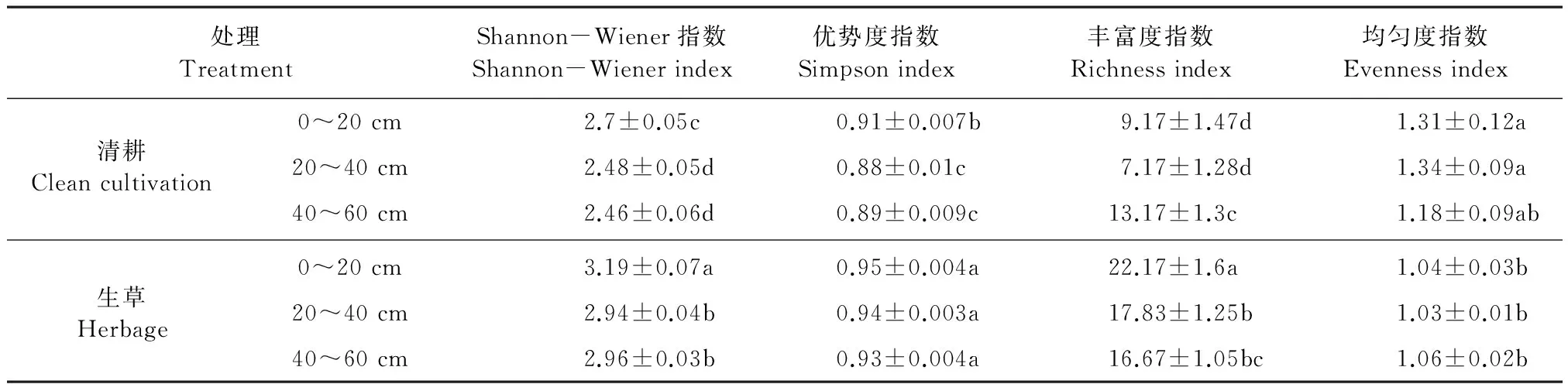
表2 不同处理微生物群落多样性指数
由表2可知,清耕对照与生草处理的Shannon-Wiener多样性指数均随着土层深度的增加呈下降趋势:0~20 cm土层的Shannon-Wiener指数显著高于其他两个土层,但20~40 cm与40~60 cm土层之间没有明显差异。与对照相比,生草处理0~20、20~40 cm和40~60 cm土层的Shannon-Wiener指数分别显著提高18.14%、18.54%、20.32%。优势度指数变化趋势与Shannon-Wiener指数类似(见表2):生草处理优势度指数均显著高于对照,其中以0~20 cm土层最高,较对照同一土层提高4.39%,差异达显著水平,但生草处理不同土层间优势度指数差异不显著。相同处理不同土层下微生物丰富度指数不同(见表2):生草处理的丰富度指数大小的顺序依次为0~20 cm>20~40 cm>40~60 cm,但清耕对照以40~60 cm土层最大,其次是0~20 cm土层;与清耕对照相比,生草处理不同土层微生物丰富度指数平均提高了92.04%。从表2还可以看出,生草处理微生物均匀度指数均低于对照,但同一处理土层之间无显著差异。
2.4 土壤微生物功能多样性主成分分析
为研究葡萄园生草和清耕两种地面管理技术的微生物群落碳源利用多样性特点,选择120 h作为取样时间点,对Biolog测试获得数据进行标准化变换后,应用Canoco for Windows 4.5进行主成分分析。分别提取4个主成分,第1主成分(PC1)为82.9%,第2主成分(PC2)为8.2%,第3主成分(PC3)为5.7%,第4主成分(PC4)为2.2%,其中前两个主成分积累贡献率达91.1%。因此,取前两个主成分得分作图来表征不同处理微生物群落碳源代谢特征(图4);处理间距离的大小表示处理间的相似程度,距离越近相似程度越高。如图4所示,清耕对照和生草处理分布在不同区域,处理间样点离散程度较大,其中,清耕对照土层样点主要分布在第二和第三象限,即分布图的左侧,与PC1呈负相关;生草土层样点主要分布在第一和第四象限,与PC1呈正相关;清耕3个土层样点在PCA2上有所差距,生草各土层样点在PCA1和PCA2上差距均较大,样点间距离较远,表明果园生草显著改变了葡萄根际微生物群落功能多样性。
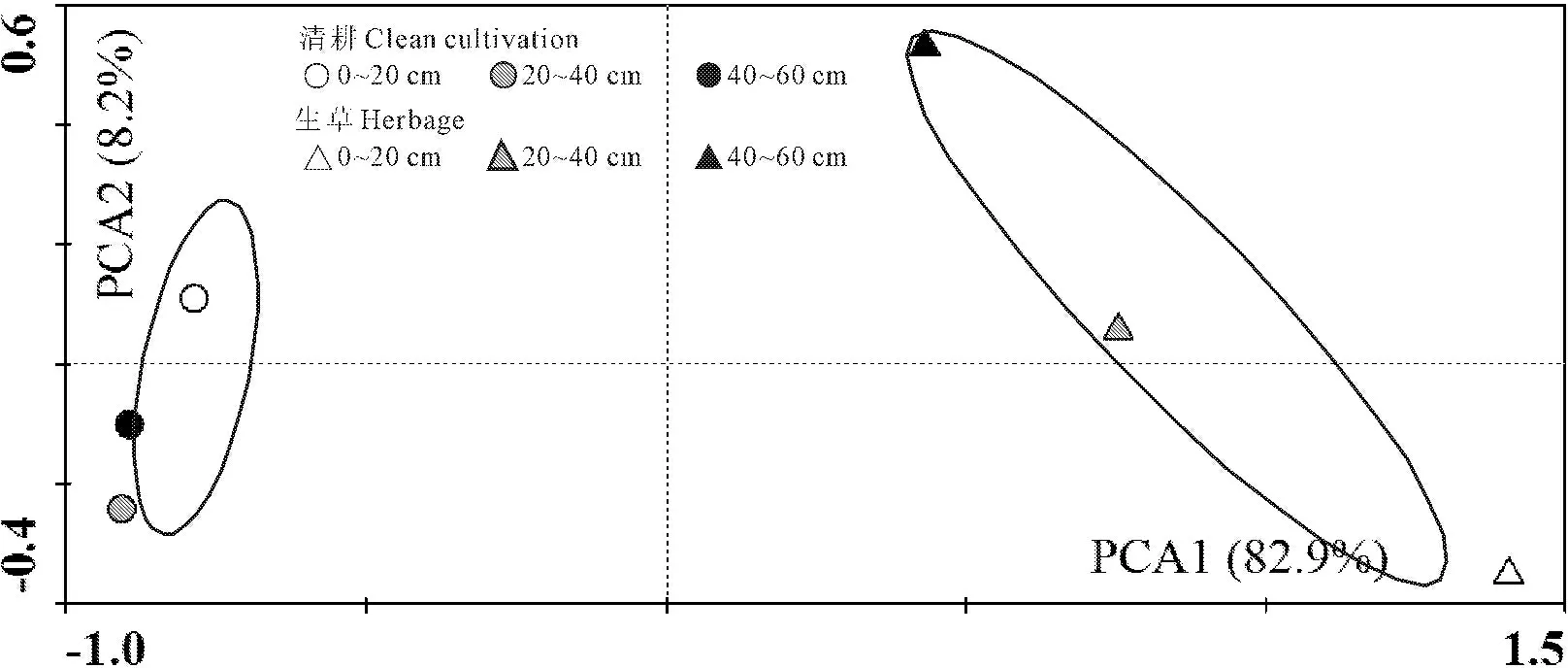
图4 不同处理的微生物功能多样性主成分(PCA)分析
Fig.4 Principal component analysis for function of microbial community under different treatments
为了找到对PC1和PC2影响较大的碳源种类,进一步利用PC1和PC2得分系数与31种碳源吸光度值进行相关分析得到相关系数,相关系数绝对值越大,表示该碳源对主成分的影响越大。从表3可看出,除a-D-乳糖碳源外,其他30个碳源均与PC1有高的相关性(相关系数r>0.6)[26],其中达到显著相关的碳源有22种,即碳水化合物类(7个)、氨基酸类(5个)、羟酸类化合物(5个)、聚合物类(3个)、胺类化合物(1个)和酚酸类化合物酸类(1个)。而与PC2具有较高相关性的碳源仅有3类,分别为羧酸类化合物、碳水化合物和酚酸类化合物,各为1个。以上分析表明,在PC1和PC2上相关性较高的碳源主要是羧酸类化合物、碳水化合物和酚酸类化合物,表明这3类碳源是区分清耕对照和生草处理间差异的敏感碳源。
表4列出了生草与清耕处理下土壤微生物利用率较高的碳源和未被利用的碳源,生草处理利用较高碳源种类多于清耕对照,生草处理0~20、20~40 cm和40~60 cm土层微生物利用率较高的碳源种类分别有6种、3种、3种,3个土层中利用率较高的共同碳源有L-天冬酰胺酸和D-甘露醇2种,清耕对照只有20~40 cm土层有1种利用率较高的碳源,为L-天冬酰胺酸。从表3中还可看出,生草处理未被利用的碳源少于清耕果园,其中0~20 cm土层有2种碳源均被利用,20~40 cm和40~60 cm土层未被利用碳源分别为5种和6种,α-丁酮酸碳源均未被生草处理利用;清耕对照0~20、20~40 cm和40~60 cm土层未被利用碳源种类分别有6种、12种、15种,其中,有5种碳源均未被利用,分别为2-羟苯甲酸、L-苯基丙氨酸、L-苏氨酸、α-丁酮酸和苯乙基胺。

表3 31种碳源与PC1、PC2的相关系数(r)
注:* 表示相关性达5%显著水平;表中未列数值者表示相关系数在-0.6~0.6之间。
Note: * indicates significant level at 0.05. When no value is given, the correlation coefficient is -0.6~0.6.
2.5 生草与清耕处理不同土层与AWCD值、生物功能多样性指标的相关性
由表5可知,清耕对照各土层与Shannon-Wiener指数呈线性极显著负相关,相关系数为-0.60,而与其他指标相关性不大;生草处理各土层土壤AWCD值、Shannon-Wiener指数、丰富度指数和优势度指数均呈极显著负相关,说明生草可以显著提高土壤表层0~20 cm土层的微生物功能多样性,清耕对照对土壤土层间微生物群落影响不大。
3 讨 论
3.1 清耕和生草处理对土壤微生物AWCD值的影响
Biolog-Eco碳源利用平均值AWCD可以反映微生物群落对31种单一碳源整体利用能力,它提供了在相同碳源下不同微生物对碳源利用相比较的可能性[27],AWCD值越大表明微生物密度越大,活性越高;反之微生物密度越小,活性越低[28]。由图1可以看出,生草处理微生物AWCD值均显著高于清耕对照,说明果园生草可提高土壤微生物活性和群落功能多样性,改善了果园土壤环境(如表2),这与钱进芳等[29]和焦奎宝[30]的研究结果相似。果园生草与土壤的良性关系可以归结为:一方面,生草可以改善土壤温度、水分及孔隙度,为微生物的生长营造了良好的生存环境;另一方面,草根茎系统的分泌物和果园枝叶残体为土壤中微生物的活动提供了必需的营养物质,有利于微生物的生长繁殖,从而增加了土壤微生物的多样性和代谢活性[31-32],进而影响到土壤养分的矿化和微环境[33]。此外,根据相关分析表明(表4),生草处理的土层深度与AWCD值呈显著线性负相关关系,说明生草对葡萄园0~20 cm微生物群落影响较大;同时研究发现,生草40~60 cm土层微生物碳源利用能力显著高于清耕对照(见图1),可能与生草处理能够疏松土壤,促进果树根系向更深处生长有关[34-35],进而影响较深土层微生物群落。
3.2 清耕和生草处理对土壤微生物多样性指数的影响
多样性指数可以用来反映土壤微生物群落功能多样性。Shannon指数主要反映了群落多样性的高低,Simpson指数评估土壤中微生物群落优势度,较多的反映群落中最常见的物种,Pielou指数是群落物种均一性的度量,是群落实测多样性与最大多样性的比率[36]。杨智仙等[37]和董艳等[38]通过小麦间作桑豆发现,土壤多样性指数和丰富度指数均高于对照,本试验的结果与之类似:果园生草处理的多样性指数、优势度指数和丰富度指数显著高于清耕对照,在各土层间存在显著性差异(见表2),同时与土壤深度呈极显著线性相关关系(表4),而清耕处理土层间多样性指数均没有显著差异,说明生草提高了土壤各土层的微生物代谢多样性,并以0~20 cm土层多样性指数最大。

表4 不同处理对31种碳源(基质)利用情况
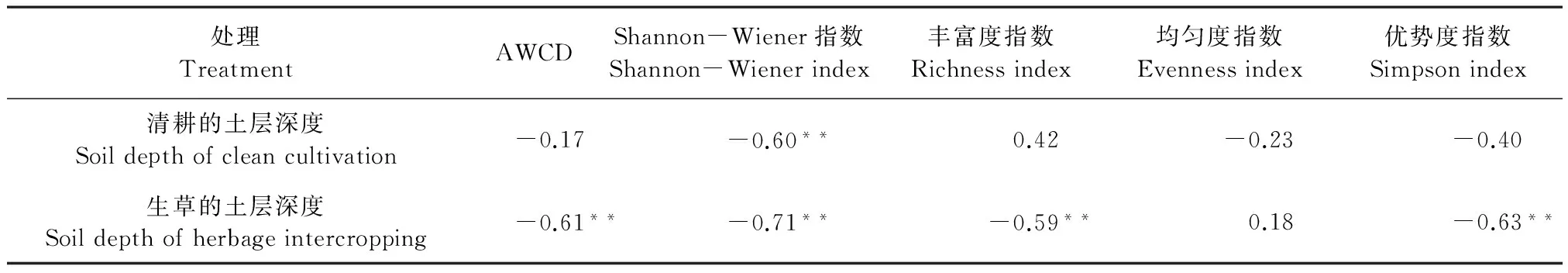
表5 生草与清耕处理不同土层深度与AWCD值和生物功能多样性指标的相关性(r值)
注: ** 表示相关性达1 %显著水平。 Note: ** indicates significant level at 0.01.
3.3 清耕和生草处理土壤微生物对碳源利用的影响
本研究发现,清耕对照和生草处理对6大类碳源利用呈现出与AWCD值的变化规律相同,其中,氨基酸类和聚合物类的利用率最高,而羧酸类、胺类和酚类化合物利用率较低(见图2),这将为我们了解葡萄园土壤微生物营养需求提供支持,并为以后培养土壤微生物定向强化提供可靠依据,以利于土壤C/N平衡和物质循环。通过对Biolog生态板上31种单一碳源利用的主成分(PCA)分析可以比较不同处理间土壤微生物碳源利用的差异,本研究发现,前两个主成分(PC1/PC2)积累贡献率为91.1%,主成分1、主成分2解释了大部分的变异,生草处理主要分布于一、四象限,与清耕对照离散程度较大,说明生草对葡萄园微生物产生较大的影响。在PC1和PC2上相关性较高的碳源主要是羧酸类化合物、碳水化合物和酚酸类化合物碳源(见表3),这3类碳源是区分清耕对照和生草处理间差异的敏感碳源。
群落水平多样性不仅要分析微生物对碳源利用模式,更要分析其中某一碳源的绝对利用情况,再结合其生态学意义,就能更好地了解微生物群落代谢特征。本试验研究发现,葡萄园清耕和生草处理共同利用碳源(AWCD>1)为L-天冬酰胺酸,L-天门冬酰胺属于酸性氨基酸,表明葡萄园土壤微生物对酸性氨基酸利用率较高;生草处理土壤对甘露醇和吐温-80的利用率高于清耕土壤,可能与毛叶苕子根系分泌物有关,分泌物对甘露醇和吐温-80为碳源的微生物有促进作用[39],具体机制需进一步研究。
4 结 论
在生草和清耕两种地面管理技术下,土壤微生物对相同碳源利用、碳源代谢及速率上存在不同程度的差异,即:与清耕对照相比,果园生草处理土壤微生物平均吸光值、Shannon-Wiener指数、Simpson指数和丰富度显著增加,以0~20 cm土层值最大;同时,生草处理显著改善了果园土壤微生物群落,其对羧酸类化合物、碳水化合物和酚酸类化合物3类碳源的利用最为敏感。
[1] 黄毅斌,应朝阳,郑仲登,等.红壤丘陵区生态果园建设的模式、技术与效应[J].福建农业学报,2000,15:182-184.
[2] 梅立新,李会科.渭北旱地苹果园生草小气候效应研究[J].干旱地区农业研究,2010,28(1):187-192.
[3] Ripoche A, Celette F, Cinna J P, et al. Design of intercrop management plans to fulfill production and environmental objectives in vineyards[J]. European Journal of Agronomy, 2010,32:30-39.
[4] Celette F, Findeling A, Gary C. Competition for nitrogen in an unfertilized intercropping system: The case of an association of grapevine and grass cover in a Mediterranean climate[J]. European Journal of Agronomy, 2009,30:41-51.
[5] King A P, Berry A M. Vineyardδ15N, nitrogen and water status in perennial clover and bunch grass cover crop systems of California's central valley[J]. Agriculture, Ecosystems and Environment, 2005,109:262-272.
[6] 王艳廷,冀晓昊,吴玉森,等.我国果园生草的研究进展[J].应用生态学报,2015,26(6):1892-1900.
[7] 李会科,张广军,赵政阳,等.渭北黄土高原旱地果园生草对土壤物理性质的影响[J].中国农业科学,2008,41(7):2070-2076.
[8] 惠竹梅,李 华,张振文,等.西北半干旱地区葡萄园生草对土壤水分的影响[J].干旱地区农业研究,2004,22(4):123-126.
[9] 徐 雄,张 健,廖尔华.四种土壤管理方式对李园土壤微生物和土壤酶的影响[J].土壤通报,2006,(5):901-905.
[10] 红 英,孔 云,姚允聪.间作芳香植物对沙地梨园土壤微生物数量与土壤养分的影响[J].中国农业科学,2010,43(1):140-150.
[11] 惠竹梅,岳泰新,张 瑾,等.西北半干旱区葡萄园生草体系中土壤生物学特性与土壤养分的关系[J].中国农业科学,2011,44(11):2310-2317.
[12] Whitelaw-Weckert M A, Rahman L, Hutton R J. Coombes N.Permanent swards increase soil microbial counts in two Australian vineyards[J]. Applied Soil Ecology, 2007,36(2):224-232.
[13] 田雅楠,王红旗.Biolog法在环境微生物功能多样性研究中的应用[J].环境科学与技术,2011,34(3):50-57.
[14] 吕美蓉,李忠佩,刘 明,等.长期有机无机肥配合施用土壤中添加不同肥料养分后土壤微生物短期变化[J].生态与农村环境学报,2011,27(4):69-73.
[15] Bucher A E, Lanyon L E. Evaluating soil management with microbial community-level physiological profiles[J]. Applied Soil Ecology, 2005,29(1):59-71.
[16] Berendsen R L, Pieterse C M J, Bakker P A H M. The rhizosphere microbiome and plant health[J]. Trends in Plant Science, 2012,17(8):478-486.
[17] An S S, Li G H, Chen L D. Soil microbial functional diversity between rhizosphere and non-rhizosphere of typical plants in the hilly area of southern Nixia[J]. Acta Ecologica Sinica, 2011,31(18):5225-5234.
[18] Zak J C, WilligM R, Moorhead D L, et al. Functional diversity of microbial communities: a quantitative approach[J]. Soil Biol Biochem, 1994,26(9):1101-1108.
[19] 毕江涛,贺达汉,沙月霞,等.荒漠草原不同植被类型土壤微生物群落功能多样性[J].干旱地区农业研究,2009,27(5):149-155.
[20] Garland J L, Mills A L. Classification and characterization of het-erotrophic microbial communities on the basis of patterns of community-level sole-carbon-source-utilization[J]. Appl. Environ. Microb., 1991,57(8):2351-2359.
[21] Bossio D D, Scow K M. Impact of carbon and flooding on the metabolic diversity ofmicrobial communities in soils[J]. Appl. Environ. Microb., 1995,61(11):4043-4050.
[22] Buyer J S, Drinkwater L E. Comparison of substrate utilization assay and fatty acid analysis of soil microbial communities[J]. J. Microb. Methods, 1997,30(1):3-11.
[23] 郑 华,欧阳志云,方治国,等.BIOLOG在土壤微生物群落功能多样性研究中的应用[J].土壤学报,2004,(3):456-461.
[24] 徐华勤,肖润林,宋同清,等.稻草覆盖与间作三叶草对丘陵茶园土壤微生物群落功能的影响[J].生物多样性,2008,16(2):166-174.
[25] 滕 应,黄昌勇,龙 健,等.复垦红壤中牧草根际微生物群落功能多样性[J].中国环境科学,2003,23(3):295-299.
[26] Yin R, Deng H, Wang H, et al. Vegetation type affects soil enzyme activities and microbial functional diversity following revegetation of a severely eroded red soil in sub-tropical China[J]. Catena, 2014,115:96-103.
[27] Choi K H, Dobbs F C. Comparison of two kinds of Biolog micro-plates(GN and ECO)in their ability to distinguish among aquatic microbial communities[J]. Journal of Microbiological Methods, 1999,36(3):203-213.
[28] Garland J L. Analysis and interpretation of community-level physiological profiles in microbial ecology[J]. FEMS Microbiology Ecology, 1997,24:289-300.
[29] 钱进芳,吴家森,黄坚钦.生草栽培对山核桃林地土壤养分及微生物多样性的影响[J].生态学报,2014,34(15):4324-4332.
[30] 焦奎宝.生草制苹果园土壤微生物群落结构与功能特征研究[D].沈阳:沈阳农业大学,2014.
[31] Jiao K, Qin S, Lyu D, et al. Red clover intercropping of apple orchards improves soil microbial community functional diversity[J]. Acta Agriculturae Scandinavica, Section B-Soil & Plant Science, 2013,63(5):466-472.
[32] Kowalchuk G A, Buma D S, de Boer W, et al. Effects of above-ground plant species composition and diversity on the diversity of soil-borne microorganisms[J]. Antonie van Leeuwenhoek, 2002,81(1):509-520.
[33] 李玉娣,谷 洁,付青霞,等.陕西云阳蔬菜大棚土壤养分及微生物群落功能多样性研究[J].农业环境科学学报,2014,33(4):765-771.
[34] 李 华,惠竹梅,房玉林,等.葡萄园生草对葡萄与葡萄酒质量的影响[J].果树学报,2005,22(6):101-105.
[35] 李会科,李金玲,王雷存,等.种间互作对苹果/白三叶复合系统根系生长及分布的影响[J].草地学报,2011,19(6):960-968.
[36] 李志斐,谢 骏,郁二蒙,等.基于Biolog-ECO技术分析杂交鳢和大口黑鲈高产池塘水体微生物碳代谢特征[J].农业环境科学学报,2014,(1):185-192.
[37] 杨智仙,汤 利,郑 毅,等.不同品种小麦与蚕豆间作对蚕豆枯萎病发生根系分泌物和根际微生物群落功能多样性的影响[J].植物营养与肥料学报,2014,20(3):570-579.
[38] 董 艳,汤 利,郑 毅,等.小麦-蚕豆间作条件下氮肥施用量对根际微生物区系的影响[J].应用生态学报,2008,19(7):1559-1566.
[39] 倪才英,曾 珩,黄玉源,等.紫云英根际微生物碳源利用多样性研究[J].广西植物,2009,29(5):614-620.
Effects of intercropping herbages on carbon source metabolism of soil microbial community in sandy vineyard
SI Peng, YU Hui-li, GAO Deng-tao, SHAO Wei, QIAO Xian-sheng, CHEN Jin-yong
(InstituteofZhengzhouFruitResearch,ChineseAcademyofAgriculturalSciences,Zhengzhou,He'nan450009,China)
In order to study the functional diversity of soil microbial community in vineyard intercropping with herbage, the Biolog-Eco technology was used to analyze the utilization features of carbon sources by microbial community, with clean cultivation as the control. The results revealed that the average well color development (AWCD) and diversity indices (Shannon-Wiener index, Simpson index and richness index) under herbage intercropping were significantly increased compared with the control, and they decreased as soil depth increasing, with the highest values in 0~20 cm soil layer under herbage intercropping. Additionally, the utilization intensity of 6 carbon substrates was enhanced by herbage intercropping, and the increase rate was ranked as: carboxylic acids>phenolic acid>amines>carbohydrates>amino acids>polymer. The principal component analysis showed that samples of control and herbage intercropping were distributed in different zones, which meant that the function of soil microbial community was obviously altered by herbage intercropping. Carboxylic acids, carbohydrates and phenolic acids were the most sensitive carbon sources in the aspect of soil microbial metabolism induced by herbage intercropping. Overall, herbage intercropping could not only enrich the diversity of microbial community, but also improve its structure in sandy vineyard.
herbage intercropping; soil microbial functional diversity; Biolog-Eco technology
1000-7601(2017)02-0247-08
10.7606/j.issn.1000-7601.2017.02.40
2015-12-24基金项目:河南省重点科技攻关项目(152102110112);中央级科研院所基本科研业务费专项(1610192017607);中国农业科学院科技创新工程专项经费(CAAS-ASTIP-2017-ZFRI)
司 鹏(1983—),男,河北深泽人,助理研究员,硕士,主要从事果树营养与施肥技术研究。
S663.1
A

