基于穿刺活检的复发转移性结直肠癌患者源性异种移植模型的建立
复旦大学附属肿瘤医院介入科,复旦大学上海医学院肿瘤学系,上海 200032
基于穿刺活检的复发转移性结直肠癌患者源性异种移植模型的建立
马 晗,王 英,王广志,许立超,何新红,李文涛
复旦大学附属肿瘤医院介入科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:现行的结直肠癌患者源性异种移植(patient-derived xenografts,PDXs)模型建模样本多来源于外科手术,但复发转移性结直肠癌(metastatic colorectal cancer,mCRC)患者手术机会少,难以获取标本。该研究旨在利用穿刺活检术建立mCRC的PDXs模型。方法:入组12例结直肠癌根治术后患者,存在临床症状和(或)影像学提示术后复发和(或)转移,需行穿刺活检明确诊断、且不存在穿刺活检禁忌证者,保留用于常规病理诊断包括基因检测的组织量后,剩余的标本用于PDXs模型的建立。结果:共成功建立7例mCRC的PDXs模型,成功率为77.8%。结论:基于穿刺活检术建立mCRC的PDXs模型成功率高,可较完整的复制原始肿瘤特性,且操作安全、简便。
穿刺活检术;复发转移性结直肠癌;患者源性异种移植模型
患者源性异种移植(patient-derived xenografts,PDXs)模型是将患者的肿瘤接种到免疫缺陷小鼠体内用于制作模型,作为肿瘤研究的有效工具。目前国际上已经建立了多个瘤种的PDXs模型,包括胰腺癌、结直肠癌、肺癌和乳腺癌等[1]。其中,PDXs肺癌模型在克服表皮生长因子受体(epidermal growth factor receptor,EGFR)或渐变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)酪氨酸激酶抑制剂耐药的研究中已获得较大突破[2]。以往结直肠癌的PDXs模型建立方法比较成熟,成功率达60%以上,很大程度上由于建模标本主要来源于外科手术切除[1],可以获得足够的组织量,但复发转移性结直肠癌(metastatic colorectal cancer,mCRC)患者手术机会少,难以获取标本。本研究采用穿刺活检手段获取肿瘤组织标本来建立mCRC的PDXs模型,探索安全简便、成功率高的建模方法,为mCRC的治疗研究提供良好的模型。
1 材料和方法
1.1 患者入组
结直肠癌根治术后患者,存在临床症状和(或)影像学提示术后复发和(或)转移,需行穿刺活检明确诊断、且不存在穿刺活检禁忌证者,保留用于常规病理诊断包括基因检测的组织量后,剩余的标本用于PDXs模型的建立。入组12例患者,签署受试者知情同意书,经复旦大学附属肿瘤医院伦理委员会审批通过。
收集患者临床资料,包括年龄、性别、TNM分期、家族史、实验室检查结果、影像学检查结果、病理学检查结果(包括基因突变情况)、治疗资料(用药方案、不良反应和治疗效果等)及复发转移情况(出现时间、临床症状、部位和病灶大小),建立患者资料表。
1.2 实验动物
雌性BABL/c裸鼠12只,6周龄,体质量20 g左右,均购自上海斯莱克实验动物有限责任公司,饲养于华中师范大学脑功能研究所无特定病原体(specific pathogen free,SPF)动物房。
1.3 取材方法
以CT引导下套管针穿刺活检取材获取结直肠癌复发或转移灶组织标本,最后1次取材后采用明胶海绵封堵穿刺针道,防止出血及针道种植转移。除去临床诊断所需,剩余组织置于含有0.9%氯化钠溶液的无菌培养皿中,储存于4 ℃恒温冰箱中,并在6 h内运输至华中师范大学脑功能研究所SPF动物房以供接种。运输中肿瘤样本置于冻存盒中,以保证肿瘤样本的活性。
1.4 种植方法
固定裸鼠,暴露腹侧,以75%乙醇浸泡的棉球消毒腹侧皮肤穿刺点,同轴套管针针芯拔出少许,无菌镊夹取取材组织装入套管针鞘,两指捏起裸鼠腹侧皮肤,将装有取材组织的同轴套管针插入裸鼠皮下,针尖推至腋下血供丰富处,轻推针芯将组织块推入裸鼠皮下,轻轻退出穿刺针,消毒穿刺点,以针管轻碾接种部位皮肤,保证接种组织集中于接种部位。每3 d观测1次肿瘤生长情况,如果超过90 d裸鼠接种部位仍无移植瘤生长迹象即判定为失败。当原代模型(F0代)建立成功,移植瘤可在鼠间连续传代则被视为建模成功。
1.5 肿瘤传代
肿瘤成功移植后待F0代裸鼠肿瘤体积达到
500 mm3,颈椎脱臼法处死裸鼠,取出肿瘤组织,留取1/5肿瘤组织冻存,1/10组织送检确定基因突变类型,1/10组织10%的甲醛溶液固定、石蜡薄层切片,H-E染色后于光镜下观察。其余均分5份传代至F1代裸鼠。F1代模型成熟后传代15~20只裸鼠(F2代)。当F2代裸鼠肿瘤体积达到200 mm3后可行药物试验。记录原代模型成瘤率、各代实验动物生长情况及肿瘤生长曲线。
2 结 果
2.1 穿刺活检术
共取12例患者穿刺活检样本,穿刺活检术后患者均未出现严重并发症(表1)。
2.2 模型的建立
12例患者中,3例患者穿刺标本与预期病理结果不符(1例倾向间叶性肿瘤,1例倾向恶性淋巴瘤,1例未见恶性证据)。共成功建立7例结直肠癌PDXs模型,成功率为77.8%。7例模型均成功传代(图1)。接种成功的裸鼠可于15~30 d内于接种部位触及结节,黄豆大小,表面光滑,质硬,活动度差。3个月左右肿瘤体积可达到传代要求,直径0.7~1.0 cm。
2.3 模型传代
肿瘤传代后生长速度明显高于上一代并随着传代次数呈递增趋势(图2),由此可见,异种移植肿瘤可在鼠间传代过程中逐渐适应裸鼠体内环境,可能与原始肿瘤中的基质细胞随着模型鼠间传代而逐渐被小鼠体内基质细胞所取代有关,后期将进一步开展相关研究。

表 1 入组患者一般资料Tab. 1 Clinical characteristics of patients
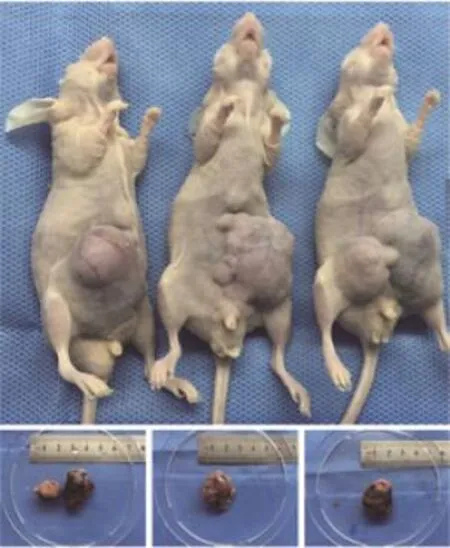
图 1 基于穿刺活检术成功建立的mCRC的PDX模型Fig. 1 The mCRC PDXs established by image-guided biopsy
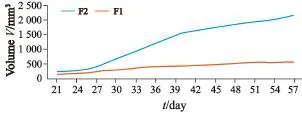
图 2 同一肿瘤的PDXs模型F1代和F2代生长曲线Fig. 2 The tumors growth curve of F1 generation PDXs and F2 generation PDXs derived from the same primary tumor
2.4 肿瘤样本生长情况
BRAF基因野生型肿瘤样本生长较快,生长不均匀,传代时可见瘤块内坏死组织偏多,质地疏松;而BRAF突变型肿瘤样本生长较慢,但长势稳定,尤其初代模型,其原代与传代模型瘤块较均匀,传代时可见其大部分为鱼肉样致密组织,坏死组织少(图3、4)。
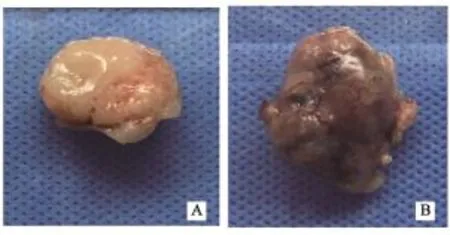
图 3 BRAF突变型和BRAF野生型mCRC肿瘤样本Fig. 3 The tumor specimens of BRAF mutant mCRC and BRAF wild mCRC
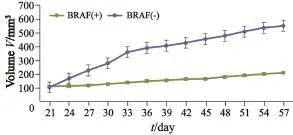
图 4 BRAF突变型结直肠转移癌与BRAF野生型结直肠转移癌F1代PDX模型生长曲线Fig. 4 The F1 generation tumor growth curve of BRAF mutant mCRC and BRAF wild mCRC
3 讨 论
精准癌症医疗是利用最先进技术研究癌症与患者的特征,然后设计患者特异性治疗方案以便精准的靶向定位疾病的遗传变异靶点。很多临床实验,如针对非小细胞肺癌的BATTLE实验[3],均证明了该策略的应用价值。然而,最近的数据表明,该方法施行过程中出现约10%的低响应率[4],那些携带肿瘤驱动突变基因如EGFR突变基因型的患者即使接受对症治疗方案,其总生存期获益仍然很低[5]。在美国食品药品监督管理局(Food and Drug Administration,FDA)批准的靶向治疗方法中,响应率波动范围较大。人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)过表达或基因扩增的乳腺癌对曲妥单抗的响应率约为30%[6],携带BRAF基因突变的黑色素瘤对维罗非尼的响应率为60%[7]。此外,大部分响应靶向治疗的癌症,最终都会产生耐药性[7]。耐药肿瘤样本组织切片可用于研究继发性耐药的机制。然而,缺乏耐药患者肿瘤组织标本则阻碍了这个关键问题的研究。
PDXs模型的建立有望解决精准医疗中所遇到的问题。该模型是基于未经筛选和未经培养的患者肿瘤标本所建立的,拥有与患者相同的遗传背景和组织形态学特征。已有研究证实,PDXs具有相对稳定的基因组。因此,基于PDXs施行的疗效研究可更真实的反映肿瘤患者的药物反应,有研究证实,患者和PDXs的反应有极高的一致性[8]。
PDXs另一个显著的特征是可基于一个患者发展出许多相同的PDXs,可为靶向治疗和化疗的筛选提供便利,不论单一药物或药物组合,均可筛选出最有效的药物。就精准医疗来说,主要问题是一个患者的肿瘤有多个潜在的靶点[9],然而大多数这些遗传变异并不是癌症细胞功能的关键驱动点。临床上由于预期寿命和毒性的限制,仅允许有限的几个不同药物在患者身上尝试。因此,在最初的几次尝试中选择最有效的治疗方法在癌症治疗中至关重要。PDXs可将相同的肿瘤复制到大量的小鼠体内,为测试治疗靶点的潜在效能提供模型,不论是单药还是药物组合,均可同时进行。PDXs模型可用于判断肿瘤对化疗药的敏感性,并筛选出哪些药是有效的。此外,实验过程中或肿瘤复发时均可获得一系列的活检样本用于研究继发性耐药的机制,这一点在临床研究实体肿瘤患者时是很难实现的。
PDXs在精准医学方面具备其他几种模型所不具备的独特优势,如癌细胞株移植瘤模型和基因工程小鼠模型(genetically engineered mouse,GEMM)。癌细胞株在体外经过长时间的培养,积累了许多不同于原发肿瘤的额外遗传变异。已有研究证实,即使传代次数不多,原发肿瘤和来自该肿瘤的细胞系之间也存在着极大地不可逆的基因分化[10]。因此,基于细胞株基因背景建立的药物反应预测模型经常无法预测临床药物的药效[11]。而基因工程小鼠模型利用种系转基因、基因敲除或突变,以及更复杂的时空基因表达调控等多种技术修改小鼠的基因表达[12]。肿瘤通常在数月至2年内在小鼠体内发展成熟。尽管GEMM表现出人类肿瘤的某些发展特征,然而GEMM小鼠体内的肿瘤具有较高的基因同质性。而许多人类肿瘤基因暴露在吸烟和环境致癌物中多年,产生了多种多样的基因变异。因此,基于GEMM实施的临床前实验无法满足针对特定靶点的患者特异性治疗方案的研究需求。
但PDXs也有许多缺点不能忽视[2],尤其是基于PDXs得出实验结论时需慎重:① 并不是所有的肿瘤都可以建立异种移植模型,因此PDXs无法代表患者群体特征;② 通常需要4~5个月建立原代PDXs,但传代后PDXs仅需2~5周便可发展成熟。这一缺陷使PDXs更多应用于实验研究而不是临床工作中,尤其在那些疾病进展快、患者生存期短的肿瘤中,如非小细胞肺癌和胰腺癌[13-14]。但在疾病进展相对较慢的肿瘤中,基于PDXs所得出的临床前实验使研究结果可以转化为临床应用,如结直肠癌和前列腺癌。此外,原始肿瘤的基质成分在传代过程中会被小鼠基质所替换和免疫缺陷受体小鼠不具备免疫应答功能也是PDXs的主要缺点。
经过不断的发展,PDXs将来或许可用于临床,如多种药物同时选择最有效的药物或药物组合治疗的筛选,揭示原发耐药机制,在临床决策中为患者选择生物标志物。这些都将有助于将分子靶向治疗转化为肿瘤精准治疗[15]。
PDXs常用制作方法是将手术标本或活检样本裁剪后直接接种至受体小鼠体内,通过免疫缺陷小鼠间传代来保持模型长期可用。同时,最好留取一部分原始肿瘤或初代模型肿瘤组织冻存以便随时取用。种植成功率与所需时间主要取决于小鼠品系、肿瘤侵袭程度和种植部位。常见接种部位有原位接种、皮下接种和肾包膜下接种。但原位种植不便观测肿瘤的发展与变化,肾包膜下接种技术难度大,而皮下接种易于种植且便于观测,因此,本研究选择通过皮下接种的方式建立mCRC的PDXs模型。
mCRC较原发灶具有更高的侵袭性和异质性,其主要治疗方式是辅助性化疗联合分子靶向治疗,大部分患者不具备外科手术切除的条件。由于这些患者在原发灶术后均接受过一定程度的化疗,因此对既有的化疗方案有一定的耐药性。而分子靶向治疗费用高昂且响应率低[16]。同时,由于个体间差异,无论是化疗药物还是靶向药对患者的疗效都不尽相同,因此,mCRC患者的生存期望较低[17]。
在以往的研究中,由于取材困难,mCRC的PDXs模型难以成型,无法为临床和基础研究提供良好的模型和充足的肿瘤样本。影像引导下的穿刺活检不失为一种良好的方法,其适应证广泛,手术风险低。即解决了取材的困难,还极大的降低了患者承受的风险和伤害。同时,mCRC的高侵袭性保证了建模的成功率。
总之,本研究成功建立mCRC的PDXs模型,并且可基于该模型进行一系列有效药物和药物组合的筛查,研究耐药机制。利用该模型可能会加速新药物的发现,指导mCRC治疗方案的改进。
[1] GARBER K. From human to mouse and back: ‘tumorgraft’models surge in popularity [J]. J Natl Cancer Inst, 2009, 101(1): 6-8.
[2] HIDALGO M, AMANT F, BIANKIN A V, et al. Patientderived xenograft models: an emerging platform for translational cancer research[J]. Cancer Discov, 2014, 4(9): 998-1013.
[3] KIM, E S, et al. The BATTLE trial: personalizing therapy for lung cancer[J]. Cancer Discov, 2011, 1(1): 44-53.
[4] TSIMBERIDOU A M, WEN S, HONG D S, et al. Personalized medicine for patients with advanced cancer in the phase I program at MD Anderson: validation and landmark analyses[J]. Clin Cancer Res, 2014, 20(18): 4827-4836.
[5] VOGEL C L, COBLEIGH M A, TRIPATHY D, et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer[J]. J Clin Oncol, 2002, 20(3): 719-726.
[6] CHAPMAN P B, HAUSCHILD A, ROBERT C, et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation[J]. N Engl J Med, 2011, 364(26): 2507-2516.
[7] PAO W, MILLER V A, POLITI K A, et al. Acquired resistance of lung adenocarcinomas to gefitinib or erlotinib is associated with a second mutation in the EGFR kinase domain[J]. PLoS Med, 2005, 2(3): e73.
[8] ZHANG X, CLAERHOUT S, PRAT A, et al. A renewable tissue resource of phenotypically stable, biologically and ethnically diverse, patient-derived human breast cancer xenograft models[J]. Cancer Res, 2013, 73(15): 4885-4897.
[9] VOGELSTEIN B, PAPADOPOULOS N, VELCULESCU V E, et al. Cancer genome landscapes[J]. Science, 2013, 339(6127): 1546-1558.
[10] DANIEL V C, MARCHIONNI L, HIERMAN J S, et al. A primary xenograft model of small-cell lung cancer reveals irreversible changes in gene expression imposed by culture in vitro[J]. Cancer Res, 2009, 69(8): 3364-3373.
[11] JOHNSON J I, DECKER S, ZAHAREVITZ D, et al. Relationships between drug activity in NCI preclinical in vitro and in vivo models and early clinical trials[J]. Br J Cancer, 2001, 84(10): 1424-1431.
[12] WALRAT J C, HAWES J J, VAN DYKE T, et al. Genetically engineered mouse models in cancer research[J]. Adv Cancer Res, 2010, 106: 113-164.
[13] TENTLER J J, TAN A C, WEEKES C D, et al. Patient-derived tumour xenografts as models for oncology drug development[J]. Nat Rev Clin Oncol, 2012, 9(6): 338-350.
[14] SIOLAS D, HANNON G J. Patient-derived tumor xenografts: transforming clinical samples into mouse models[J]. Cancer Res, 2013, 73(17): 5315-5319.
[15] SIA D, MOEINI A, LABGAA I, et al. The future of patientderived tumor xenografts in cancer treatment[J]. Pharmacogenomics, 2015, 16(14): 1671-1683.
[16] 蔡三军, 章 真, 杜 祥. 循证结直肠肛管肿瘤学[M]. 上海: 上海科学技术出版社, 2016: 400-409.
[17] HOUGHTON J A, TAYLOR D M. Growth characteristics of human colorectal tumours during serial passage in immunedeprived mice[J]. Br J Cancer, 1978, 37(2): 213-223.
Establishment of metastatic colorectal cancer patient-derived xenografts models by image-guided biopsy
MA Han, WANG Ying, WANG Guangzhi, XU Lichao, HE Xinhong, LI Wentao (Department of Interventional Radiology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
LI Wentao E-mail: liwentao98@126.com
Background and purpose:Current colorectal cancer patient-derived xenografts (PDXs) models were established by samples taken during surgery. However, metastatic colorectal cancer (mCRC) patients have less surgical opportunities, and it was difficult to obtain enough tumor fragment. The aim of the present study was to establish mCRC PDXs by image-guided biopsy.Methods:A total of 12 patients with colorectal cancer who underwent surgery were included. All patients had recurrent lesions or metastatic lesions needed to be histologically confirmed, and none of them had contraindication to biopsy. Tumor tissues not required for clinical diagnosis were used to establish mCRC PDXs.Results:Seven PDXs grew sufficiently for transfer into mice. The success rate was 77.8%.Conclusion:The PDXs established by image-guided biopsy had the advantage of convenient operation, good reproducibility, high achievement ratio, short experimental periodicity and reliably retain specific genetic and morphological features of the primary patient tumors.
Biopsy; Metastatic colorectal cancer; Patient-derived xenografts models
10.19401/j.cnki.1007-3639.2017.04.006
R735.3
A
1007-3639(2017)04-0276-05
2016-09-13
2016-12-07)
国家重点研发计划(2016YFC0106203);上海市科委实验动物专项(14140902202);上海市申康新兴前沿技术项目(SHDC12014112);上海科委自然科学基金(14ZR1407900)。
李文涛 E-mail: liwentao98@126.com

