2016年胰腺癌研究及诊疗进展
濬
复旦大学附属肿瘤医院胰腺外科,复旦大学胰腺肿瘤研究所,复旦大学上海医学院肿瘤学系,上海 200032
2016年胰腺癌研究及诊疗进展
梁丁孔,施 思,徐 近,虞先濬
复旦大学附属肿瘤医院胰腺外科,复旦大学胰腺肿瘤研究所,复旦大学上海医学院肿瘤学系,上海 200032

虞先濬,主任医师、教授、博士研究生导师,目前担任复旦大学胰腺肿瘤研究所所长、复旦大学附属肿瘤医院胰腺外科主任、中国抗癌协会胰腺癌专业委员会候任主任委员。主要从事胰腺肿瘤外科综合治疗的临床转化研究。主要学术成绩:① 创新“胰肠吻合”方法,显著提高手术安全性;② 揭示胰腺癌淋巴转移特性,规范手术清扫范围;③ 建立甄别不同胰腺癌亚群的血清生物学标签,阐述相关机制;④发现胰腺神经内分泌肿瘤增殖、淋巴转移的特性,改变国际指南的分期。获国家杰出青年科学基金、国家自然科学基金中德国际合作项目各1项,国家自然科学基金面上项目3项,省部级课题7项;入选科技部创新人才推进计划。近5年以第一作者或通讯作者(含共同)在J Clin Oncol、Ann Surg、Cell Res、Clin Cancer Res和Oncogene等权威期刊发表SCI论文68篇,总影响因子超过280分,单篇论著最高影响因子20.98分。作为第一发明人获得5项国家实用新型专利、上海市优秀发明选拔赛“金奖”。研究成果已纳入多部胰腺肿瘤临床指南和专家共识。
胰腺癌是消化系统恶性程度最高的肿瘤之一,病情进展快,预后极差。近年来,发病率亦明显升高。胰腺癌的治疗模式已由单纯的手术优先,走向包括外科手术、化学治疗和放射治疗等在内的多学科综合治疗,其临床疗效有了明显提高。近年来,随着对胰腺癌发生、发展机制研究的不断深入,研究者对疾病本身有了更加清晰的认识,也为基础临床的转化提供了线索。该研究参考2016年国内外发表的胰腺癌基础和临床研究相关文献,针对胰腺癌发病因素、基础研究热点、外科手术相关进展及化学治疗进展等方面进行综述。
胰腺癌;流行病学;基础研究;临床研究;进展
胰腺癌是一种高度恶性的消化系统肿瘤,在全世界范围内每年死亡人数超过200 000例[1]。根据美国癌症协会统计,胰腺癌位列癌症相关死亡的第4位,预计到2017年美国地区新发胰腺癌将达到53 670例,因胰腺癌死亡病例将达到43 090例[2-3]。中国国家癌症中心的统计数据表明,2000—2011年胰腺癌发病率与死亡率逐渐上升,2015年全国男性和女性胰腺癌发病率分别为52.2/10万和37.9/10万,死亡率则分别为45.6/10万和33.8/10万[4]。胰腺癌的基础和临床研究在去年取得了长足的进步,本文针对胰腺癌发病因素、基础研究热点、外科手术相关进展及化学治疗进展等方面进行综述。
1 胰腺癌发病相关因素的研究
胰腺癌的发病是环境因素与遗传因素共同作用的结果[5]。流行病学研究证实,吸烟、慢性胰腺炎和家族遗传等相关因素可增加胰腺癌的发病风险,但多局限于回顾性研究[6]。除此之外,肥胖、25-羟维生素D、血糖及他汀类药物的使用等方面越来越受到关注。肥胖与胰腺癌相关性已达成共识,相关研究显示,男性身体质量指数(body mass index,BMI)大于等于35 kg/m2或女性BMI大于40 kg/m2罹患胰腺癌的风险增加,且BMI每增加1 kg/m2,其死亡率上升10%[7-9]。此外,大规模前瞻性研究也证明,血浆中25-羟维生素D3水平是胰腺癌的独立预后因素之一,血浆中25-羟维生素D3正常水平的胰腺癌患者生存期更长[10]。与此同时,血糖与胰腺癌的关系也越发受到重视。Liao等[11]回顾性分析显示,空腹血糖水平与胰腺癌患病率呈明显线性关系,空腹血糖每上升0.56 mmol/L,胰腺癌发生率上升14%。二甲双胍作为治疗2型糖尿病的一线口服降糖药物,被证实可以通过胰岛素依赖或非胰岛素依赖途径抑制胰腺肿瘤进展[12]。另一项回顾性研究也发现,在糖尿病相关性胰腺癌患者中,对比其他药物,口服二甲双胍治疗的患者生存期更长[13]。此外,大型队列研究证实,他汀类药物能够通过非脂质依赖的机制降低胰腺癌的死亡风险[14-15]。既往研究证明,牙龈疾病或牙周炎病史会增加胰腺癌患病风险[16]。Fan等[17]的前瞻性队列研究也证明,牙龈卟啉单胞菌和伴放线杆菌会增加胰腺癌的发病率。
2 基础研究进展
胰腺癌诊治的快速发展离不开基础研究的支持。随着分子生物学技术尤其是高通量测序技术的发展,胰腺癌基因组研究逐渐成为关注热点,而胰腺癌独特的代谢组学及肿瘤微环境也受到了广泛关注。
2.1 基因组学
Bailey等[18]通过对456例胰腺癌患者的标本进行全基因组测序,鉴定出10个遗传通路中的32个基因,并将胰腺癌区分为鳞状上皮肿瘤、胰腺祖细胞瘤、异常分化内分泌腺肿瘤和免疫原性肿瘤4种亚型。这4种胰腺癌亚型的遗传学特征、发病过程和生存期存在明显差异。鳞状上皮肿瘤型胰腺癌患者的平均生存期仅为4个月,约为其他类型的一半;胰腺祖细胞瘤型胰腺癌的特征与调节胰腺早期胚胎发育的基因网络相关;异常分化内分泌腺肿瘤型胰腺癌是胰腺祖细胞瘤型的一个子类,其鉴定与胰腺发育后期阶段的转录网络有关;免疫原性肿瘤型胰腺癌则表现出显著的免疫渗透。临床可应用性胰腺癌基因分型的构建,使胰腺癌的精准治疗成为可能。此外,Notta等[19]通过检测107例胰腺癌患者基因组发现,染色体碎裂事件可导致胰腺癌发生所必须的2个或多个基因同时突变,而不是此前认为的顺次突变,为揭示胰腺癌发生、发展的分子机制提供了新的线索。
2.2 代谢组学
近年来,随着肿瘤代谢研究的不断深入,其在肿瘤发生、发展过程中的作用越来越受到重视[20]。Liang等[21]提出胰腺癌可能具有的4种代谢表型,分别是Warburg亚型、反Warburg亚型、谷氨酰胺依赖亚型及脂肪酸依赖亚型,并对这4种代谢分型的相关临床特点和基础研究进行了总结。同时,Liang等[22]强调了胰腺肿瘤代谢可塑性主要与肿瘤异质性有关,除了受自身的遗传物质的影响以外,还和其所在的微环境有着密不可分的关系。此外,针对胰腺癌细胞的谷氨酰胺代谢过程,Wang等[23]研究发现,蛋白精氨酸甲基转移酶4可对苹果酸脱氢酶1进行甲基化修饰并降低其活性,进而抑制胰腺癌细胞的增殖和谷氨酰胺代谢过程,表明苹果酸脱氢酶1的甲基化调控是一个潜在的胰腺癌治疗靶点。
2.3 肿瘤微环境
2.3.1 肿瘤间质微环境
胰腺癌的发生、发展不仅取决于肿瘤细胞本身的生物学特性,还与多种间质成分构成的微环境密切相关[24-25]。胰腺星形细胞是一种与肝星状细胞结构和功能相似的细胞,通常处于静息状态,其增殖和激活是胰腺纤维化发生的中心环节。活化的胰腺星形细胞通过合成大量的细胞外基质,在胰腺癌胰腺纤维化的过程中发挥重要作用[26]。近期有研究表明,胰腺癌细胞在富间质、乏血供的环境中通过启动周围胰腺星状细胞的自噬来获取替代性的丙氨酸,随后在肿瘤细胞线粒体中利用其作为葡萄糖的替代能源,在体内实验中,阻断小鼠体内星状细胞的自噬过程,胰腺癌的生长受到明显抑制,提示胰腺癌细胞与星状细胞之间的一种全新的互动方式[27]。因此,通过干扰胰腺癌细胞的这种极具灵活的代谢方式能为胰腺癌治疗提供新思路。
2.3.2 肿瘤免疫微环境
多种功能失调的免疫细胞和异常分泌的因子可激活多个信号途径的级联反应,促进胰腺癌独特的免疫微环境的形成[28]。在胰腺癌间质内,调节性T细胞、髓系来源的抑制性细胞、CD4+辅助性T淋巴细胞和M2型巨噬细胞等免疫抑制相关细胞均有异常浸润[29],而抗肿瘤细胞,如NK细胞、CD8+毒性T淋巴细胞和成熟的树突状细胞等数量锐减[30-31]。有研究证明,CXC型趋化因子受体2(CXC chemokine receptors 2,CXCR2)在胰腺癌微环境中的中性粒细胞和(或)髓系来源的抑制性细胞中表达上调,而在肿瘤细胞内几乎不表达。清除中性粒细胞和(或)髓系来源的抑制性细胞或抑制CXCR2功能能够抑制胰腺癌的侵袭转移,表明CXCR2在胰腺癌建立和维持转移灶的过程中发挥关键作用[32]。
3 临床诊疗进展
3.1 胰腺癌美国癌症联合委员会(American Joint Committee on Cancer,AJCC)分期修订
准确的肿瘤分期是指导临床实践、个体化地选择适宜的治疗方式及判断患者预后的重要基础。近期发布的第8版胰腺癌分期系统在T分期和N分期上进行了较大的修订。最新循证医学证据显示,肿瘤大小和患者的生存关系更为密切,AJCC第8版T分期T1-3根据肿瘤大小界定,不再使用肿瘤胰腺外侵犯的概念;T4是指肿瘤侵犯腹腔干动脉、肠系膜上动脉和(或)肝总动脉,摒弃可切除性的定义。原N1分期则根据转移淋巴结数目分层为N1和N2(表1、2)。AJCC第8版胰腺癌分期系统较第7版定义更为清晰,分期更细,判断标准更突出客观性的可测量指标。
Allen等[33]研究发现,第8版分期系统对胰腺癌患者的生存期具有更准确的预测作用,AJCC第8版对胰腺癌分期的更新体现出研究者对疾病本质认识的深入,更具指导性及临床可操作性。
3.2 胰腺癌的外科手术治疗
3.2.1 胰腺癌围手术期诊疗
胰腺癌术前等待时间、术中内外引流的选择、术后营养支持及胰瘘等问题在近期多项研究中开展。由于医疗资源的紧缺,术前等待时间的长短和外科治疗窗是困扰胰腺癌患者的一大问题。Sanjeevi等[34]通过回顾性队列研究发现,当影像确诊和手术间隔时间大于32 d时,肿瘤进展的风险增加1倍,证明确诊与手术间隔时间是肿瘤进展的危险因素。此外,胰十二指肠切除术中内外支架的选择也是热点,1项纳入328例Whipple手术的多中心、平行分组、随机等效临床试验证明,胰管内支架在术后早期并发症发生率要低于外支架,外支架组术后胰瘘率为24.4%,内支架组仅为18.9%,且内支架还有着便于管理、不易滑脱和扭结等优势[35]。此外,胰十二指肠切除术后的早期肠内营养仍然存在争议。在Nutri-DPC临床试验中,Perinel等[36]发现,早期肠内营养组术后并发症、胰瘘的发生严重程度较肠外营养组显著增加,而在全肠外营养组中,平均能量摄入显著增加,患者能够早期恢复经口进食。

表 1 第7版和第8版AJCC胰腺癌分期比较Tab. 1 The comparison of AJCC staging system for pancreatic adenocarcinoma in 7thand 8thedition

表 2 第8版AJCC胰腺癌分期Tab. 2 AJCC staging system for pancreatic adenocarcinoma (8thedition)
胰瘘是胰腺肿瘤术后最常见的并发症之一,国际胰腺外科研究小组更新了2016版术后胰瘘的定义和分级系统[37]。2016版中A级胰瘘被更名为生化瘘,不再包含在胰瘘内,也不属于术后并发症。B级和C级胰瘘的定义更为严格。B级胰瘘需要有明确的术后进程改变,包括:① 持续引流3周以上;② 出现临床相关胰瘘治疗措施改变;③ 使用经皮或内镜穿刺引流;④ 采取针对出血的血管造影介入治疗;⑤发生除器官衰竭外的感染征象。C级胰瘘指出现由术后胰瘘引起的二次手术,单或多器官衰竭,甚至死亡。2016版术后胰瘘定义和分级系统简明扼要且实用性更强,有助于寻找预防和治疗胰瘘的新方法。同时,胰瘘的预测在近期多项研究中有所涉及。一项前瞻性研究证明,在胰十二指肠切除术后第1天引流液淀粉酶含量小于600 U/L的患者,胰瘘的发生率仅为0.9%;而淀粉酶含量大于600 U/L的患者,胰瘘发生率则高达31.4%[38]。Giglio等[39]则发现,B、C级胰瘘的术后第1天测定引流液淀粉酶含量的界值分别为350 U/L和5 000 U/L。
3.2.2 胰腺癌手术进展
3.2.2.1 胰腺癌开腹手术
经典的胰腺癌手术发展至今已逾百年,虽然不断有各种改良术式出现,但国内外尚缺乏针对手术入路的胰腺癌分型。为了规范胰腺癌手术,Wang等[40]根据肿瘤和血管的关系将胰腺癌分为8种类型,用于指导具体的手术入路。由于胰头癌与周围血管解剖位置毗邻,为提高R0切除,常常需要联合血管切除,但其安全性及有效性始终存在争议。有研究表明,未直接侵犯静脉壁的可切除胰腺癌中,联合肠系膜-门静脉的胰十二指肠切除术会增加手术时间和出血量,但并不增加围手术期的并发症及死亡率,同时,R0切除率的增加能够给患者带来远期获益[41]。然而,1项纳入27项研究的大样本Meta分析却得出了截然相反的答案,联合肠系膜-门静脉的胰十二指肠切除术不仅增加了围手术期死亡率和R1切除率,还降低了远期获益[42]。由此可见,联合静脉切除与胰腺癌临床预后的关系需要进一步研究。
3.2.2.2 胰腺癌微创手术进展
微创技术的推广给外科手术带来了革命性的变化,因此胰腺肿瘤手术也进入了新阶段。在手术根治性方面,多项回顾性研究证实,开腹和微创下胰十二指肠切除术基本相同[43-49]。但是,由于腹腔镜下吻合的技术难度较大,胰十二指肠切除术更易发生术后C级胰瘘及出血[45]。因此,腹腔镜联合腹部小切口行吻合入路可能是个折中的选择,但需要更多的临床证据证明[47]。另外,美国国家癌症数据库的分析显示,在低通量胰腺中心中,腹腔镜下胰十二指肠切除术的术后死亡率是开腹手术的2倍;相反,在高通量胰腺中心中,腹腔镜下胰十二指肠切除术具有媲美开腹手术的安全性[50]。综上所述,微创手术技术的应用需要扎实的开腹手术经验,并在高通量胰腺中心中开展[43,50]。另外,由于胰体尾切除术难度较胰十二指肠切除术低,微创手术已成为治疗良性和低度恶性胰腺肿瘤的标准手术方式[43]。多项回顾性研究显示,在手术安全性(如胰瘘率、术后出血等)方面,机器人和腹腔镜下胰体尾切除术差异无统计学意义,但机器人辅助的胰体尾切除术能够显著减少中转开腹的概率,并能降低术中大量出血的风险,进而缩短术后平均住院时间,而在手术有效性方面,机器人辅助的胰体尾切除术能够获得更高的切缘阴性率,并能进行更充分的淋巴结清扫[51-52]。在腹腔镜保脾胰体尾切除术中,Dai等[53]回顾性分析指出,胰体尾肿瘤大小是联合脾脏切除的独立危险因素,其肿瘤大小界值为3 cm。
3.2.2.3 胰十二指肠切除术中腹腔引流管的放置在过去几十年中,胰腺切除术后放置腹腔引流管被认为是早期发现和减少术后并发症(尤其是术后胰瘘)的重要手段。而让人困扰的是,腹腔引流管也提供了腹腔与外界细菌接触的途径,增加了围手术期腹腔感染的可能性。有研究者针对这个问题开展了目前最大的前瞻性双中心、随机对照的非劣效性临床试验,结果显示,未放置腹腔引流管组中临床相关的B/C级胰瘘发生率及胰瘘相关并发症(胃排空延迟、胰瘘出血及腹腔脓肿等)的发生率明显降低,同时需要临床干预(再次手术或介入治疗)的发生率也较放置腹腔引流管组低,但在手术时间、围手术期死亡率及住院天数上差异无统计学意义,因此,研究者并不推荐胰十二指肠切除术后预防性放置腹腔引流管[54-56]。因此,放置腹腔引流管的标准仍是一个值得商榷的问题。McMillan等[57]通过胰瘘风险评分模型将胰十二指肠切除术的患者分为低危组和高危组,在低危组中,术中并不放置腹腔引流管,在高危组中,术后第1天引流液淀粉酶小于等于5 000 U/L的患者术后第3天拔除引流管,而术后第1天引流液淀粉酶大于5 000 U/L的患者则应由临床医师决定,结果证明,低危组中并未发生临床相关胰瘘,高危组中引流液淀粉酶小于等于5 000 U/L的患者能够从早期拔除引流管中获益,而通过有效的胰瘘分层和临床处理,临床相关胰瘘及其并发症的发生率均较历史队列水平有明显的下降。因此,胰瘘风险评分模型能够有效区分这3种人群的胰瘘风险,为是否放置腹腔引流管和早期拔除腹腔引流管提供了一个新思路。
3.2.2.4 胰腺癌手术切缘新标准
由于胰腺癌手术切缘标准并未统一,导致各项研究的R0切除率参差不齐,ESPAC-4临床试验采用的是“1 mm标准”,而JASPC01临床试验则采用的“0 mm标准”。因此,亟需拟定胰腺手术切缘国际共识,以确保不同的切除和辅助治疗之间的可比性。针对此问题,来自德国海德堡大学的前瞻性研究证实,小于等于1 mm范围内有肿瘤残留是不良预后指标之一,“1 mm标准”能够更准确的反映肿瘤残余和预测预后[58]。
4 胰腺癌的化学治疗
由于胰腺癌早期诊断困难,手术切除率低,放化疗联合的多学科治疗是局部晚期及转移性胰腺癌的主要治疗手段。随着新药的研发和临床试验的不断开展,给晚期胰腺癌的治疗带来了新希望(表3)。
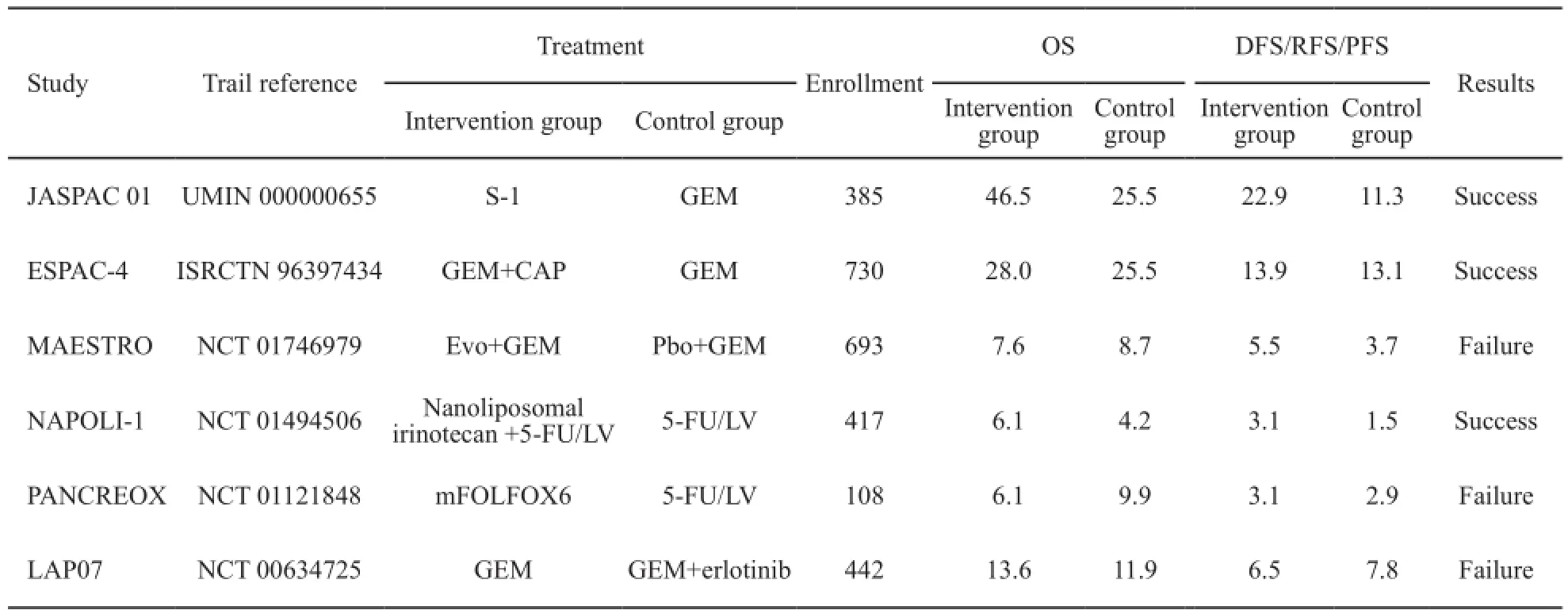
表 3 2016年胰腺癌Ⅲ期药物临床试验结果Tab. 3 The summary of phase Ⅲ clinical trial of pancreatic adenocarcinoma in 2016
4.1 胰腺癌辅助化疗研究进展
1项多中心、非劣效性Ⅲ期随机对照临床试验对比了替吉奥(S-1)和吉西他滨在胰腺癌术后辅助化疗中的疗效和安全性(JASPAC 01),结果显示,胰腺癌切除术后接受口服S-1辅助化疗可显著提高患者生存率,5年生存率接近50%,中位生存期显著延长21个月,无进展生存期显著延长11.6个月,局部复发和肝转移的风险也显著降低,此外,S-1治疗具有良好的耐受性,有助于改善患者生活质量[59]。S-1可作为亚洲胰腺癌根治术后辅助化疗的一线选择,但是对于高加索人或其他族裔患者,其有效性仍需进一步验证。
另外1项多中心的Ⅲ期临床试验对比了吉西他滨联合卡培他滨与吉西他滨单药在术后胰腺癌的患者中的疗效和安全性(ESPAC-4),结果显示,吉西他滨联合卡培他滨组的中位总生存期为28.0个月,而吉西他滨组为25.5个月,吉西他滨联合卡培他滨组的总生存率也高于吉西他滨单药组,两组的3~4级不良反应发生率基本一致,因此,吉西他滨联合卡培他滨的辅助化疗方案是欧美胰腺癌切除术后的标准治疗,两者常见的不良反应及3~4级不良反应的发生率差异无统计学意义[60]。但吉西他滨联合卡培他滨在亚洲人群中的治疗效果仍需验证。
同时,新的临床试验也在不断开展,如吉西他滨联合白蛋白紫杉醇(APACT研究)和mFOLFIRINOX(PRODIGE研究)等前瞻性Ⅲ期临床试验仍在进行中,期待能帮助研究者更好地认识和把握辅助化疗的临床价值和意义。
4.2 胰腺癌新辅助治疗进展
对局部晚期和不能手术切除的胰腺癌患者,在过去的10年中进行了多项关于新辅助治疗和连续手术的探索性研究。Hackert等[61]开展了目前为止样本量最大的前瞻性试验,共纳入了海德堡大学2001—2015年进行新辅助治疗的575例患者,其中292(50.8%)例患者在新辅助化疗后成功切除肿瘤,结果显示,Folfirinox化疗方案切除率为61%(76/125),吉西他滨联合放疗切除率为46%(150/322),其他治疗方案切除率为52%(66/128),根治性切除和非根治性切除相比,患者的平均总生存期分别为15.3和8.5个月,但Folfirinox化疗方案、吉西他滨和其他治疗方案组患者的中位生存期和3年生存率差异无统计学意义。综上所述,Folfirinox方案是胰腺癌新辅助治疗中一个有价值的治疗选择。
4.3 胰腺癌晚期一线治疗进展
1项随机、双盲Ⅲ期临床试验对比了evofosfamide(TH302)联合吉西他滨与安慰剂联合吉西他滨治疗转移或不可切除胰腺癌的安全性和有效性(MAESTRO),结果显示,TH302联合吉西他滨和安慰剂联合吉西他滨中位总生存期分别为8.7和7.6个月,1年生存率分别为34.2%和29.8%(P=0.059),中位无进展生存期分别为5.5和3.7个月(P=0.002),尽管主要研究终点总生存期差异无统计学意义,但TH302联合吉西他滨仍对无进展生存期和客观有效率有贡献,也未观察到新的安全性问题,值得一提的是,该研究入组了123例(17%)来自日本和韩国的亚洲患者,联合治疗组总生存期为12.0个月,而安慰剂组总生存期仅为8.5个月,死亡风险较安慰剂组下降了42%,对比本研究中其他种族的患者,亚洲患者的总生存期获益最大[62]。该亚组分析结果若能够得到进一步验证,或许能为亚洲的胰腺癌患者带来新的治疗突破。
4.4 胰腺癌晚期二线治疗进展
吉西他滨治疗后进展期胰腺癌的二线治疗尚缺乏标准治疗方案。NAPOLI-1试验对比了纳米脂质体伊立替康联合5-FU/亚叶酸钙与5-FU/亚叶酸钙在一线吉西他滨治疗后进展的转移性胰腺癌中的疗效和安全性,结果显示,接受纳米脂质体伊立替康联合5-FU/亚叶酸钙和5-FU/亚叶酸钙患者的中位生存期分别为6.1和4.2个月,但纳米脂质体伊立替康单药较5-FU/亚叶酸钙并不能明显改善生存[63]。综上所述,纳米脂质体伊立替康联合5-FU/亚叶酸钙可作为吉西他滨方案治疗后进展的转移性胰腺癌二线治疗选择。然而,对比5-FU/亚叶酸钙单用或联合奥沙利铂(mFOLFOX6方案)在吉西他滨治疗后进展期胰腺癌的二线治疗的Ⅲ期临床试验却以失败告终。PANCREOX试验结果显示,mFOLFOX6组或5-FU/亚叶酸钙组无进展生存期差异无统计学意义,而mFOLFOX6组总生存期明显缩短,且不良反应明显增多,更多的患者由于无法耐受不良反应退出了试验,因此,mFOLFOX6对比5-FU/亚叶酸钙在进展期胰腺癌吉西他滨一线化疗失败后的二线化疗中并无明显的生存获益[64]。此外,LAP07是一项开放、Ⅲ期随机试验,该研究的首要指标是评估局部晚期胰腺癌患者经过4个月的吉西他滨单用或联合厄洛替尼的诱导化疗后,联合放疗是否可以改善总生存期,次要目标是评估厄洛替尼对生存的影响,结果显示,对于局部进展的胰腺癌患者,在单纯化疗的基础上增加放疗并不能提高总生存率,此外,吉西他滨联合厄洛替尼和吉西他滨单用的中位生存期分别为11.9和13.6个月,对于总生存期没有改善[65]。
4.5 胰腺癌免疫治疗进展
胰腺癌免疫机制及生物免疫治疗已成为近年来的研究热点之一,且部分免疫治疗方法已进入临床试验阶段,初步结果显示出一定的抗肿瘤效果。近期公布的TG01临床Ⅰ、Ⅱ期数据给免疫治疗带来了一丝曙光,该实验中的2年生存率超过60%。由于样本量较少,仍需要进一步验证该药物的疗效。
胰腺癌是一种高度恶性肿瘤,进展快,预后极差。胰腺癌相关的基础和临床研究,应更多着眼于其特殊的解剖位置和肿瘤生物学行为。随着对胰腺癌临床病理特征和分子生物学特性研究的逐步深入,更多的新药将被开发出来应用于临床,造福患者,改善预后。
[1] KAMISAWA T, WOOD L D, ITOI T, et al. Pancreatic cancer[J]. Lancet, 2016, 388(10039): 73-85.
[2] SMITH R A, ANDREWS K S, BROOKS D, et al. Cancer screening in the United States, 2017: a review of current American Cancer Society guidelines and current issues in cancer screening[J]. CA Cancer J Clin, 2017, 67(2): 100-121.
[3] SIEGEL R L, MILLER K D, JEMAL A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30.
[4] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[5] BARONE E, CORRADO A, GEMIGNANI F, et al. Environmental risk factors for pancreatic cancer: an update[J]. Arch Toxicol, 2016, 90(11): 2617-2642.
[6] SETON-ROGERS S. Pancreatic cancer: fast or slow?[J]. Nat Rev Cancer, 2016, 16(12): 755.
[7] MAJUMDER K, GUPTA A, ARORA N, et al. Premorbid obesity and mortality in patients with pancreatic cancer: a systematic review and Meta-analysis[J]. Clin Gastroenterol Hepatol, 2016, 14(3): 355-368.
[8] ARKAN M C. Cancer: fat and the fate of pancreatic tumours[J]. Nature, 2016, 536(7615): 157.
[9] SETON-ROGERS S. Pancreatic cancer: connecting obesity and cancer mechanistically[J]. Nat Rev Cancer, 2016, 16(7): 411.
[10] YUAN C, QIAN Z R, BABIC A, et al. Prediagnostic plasma 25-hydroxyvitamin D and pancreatic cancer survival[J]. J Clin Oncol, 2016, 34(24): 2899-2905.
[11] LIAO W C, TU Y K, WU M S, et al. Blood glucose concentration and risk of pancreatic cancer: systematic review and dose-response meta-analysis[J]. BMJ, 2015, 349: g7371.
[12] CHAITEERAKIJ R, PETERSEN G M, BAMLET W R, et al. Metformin use and survival of patients with pancreatic cancer: a cautionary lesson[J]. J Clin Oncol, 2016, 34(16): 1898-1904.
[13] JU H, LI H, TIAN T, et al. Melatonin overcomes gemcitabine resistance in pancreatic ductal adenocarcinoma by abrogating nuclear factor-κB activation[J]. J Pineal Res, 2016, 60(1): 27-38.
[14] HUANG B Z, CHANG J I, LI E, et al. Influence of statins and cholesterol on mortality among patients with pancreatic cancer[J]. J Natl Cancer Inst, 2016, 109(5): djw275.
[15] ARCHIBUGI L, CAPURSO G, DELLE FAVE G. Statin use and survival in resectable pancreatic cancer: confounders and mechanisms[J]. Am J Gastroenterol, 2016, 111(3): 436.
[16] JACOB J A. Study links periodontal disease bacteria to pancreatic cancer risk[J]. JAMA, 2016, 315(24): 2653-2654.
[17] FAN X, ALEKSEYENKO A V, WU J, et al. Human oral microbiome and prospective risk for pancreatic cancer: a population-based nested case-control study[J]. Gut, 2016.[Epub ahead of print].
[18] BAILEY P, CHANG D K, NONES K, et al. Genomic analyses identify molecular subtypes of pancreatic cancer[J]. Nature, 2016, 531(7592): 47-52.
[19] NOTTA F, CHAN-SENG-YUE M, LEMIRE M, et al. A renewed model of pancreatic cancer evolution based on genomic rearrangement patterns[J]. Nature, 2016, 538(7625): 378-382.
[20] OLIVARES O, VASSEUR S. Metabolic rewiring of pancreatic ductal adenocarcinoma: new routes to follow within the maze[J]. Int J Cancer, 2016, 138(4): 787-796.
[21] LIANG C, QIN Y, ZHANG B, et al. Metabolic plasticity in heterogeneous pancreatic ductal adenocarcinoma[J]. Biochim Biophys Acta, 2016, 1866(2): 177-188.
[22] LIANG C, QIN Y, ZHANG B, et al. Energy sources identify metabolic phenotypes in pancreatic cancer[J]. Acta Biochim Biophys Sin (Shanghai), 2016, 48(11): 969-979.
[23] WANG Y P, ZHOU W, WANG J, et al. Arginine methylation of MDH1 by CARM1 inhibits glutamine metabolism and suppresses pancreatic cancer[J]. Mol Cell, 2016, 64(4): 673-687.
[24] REITER J G, IACOBUZIO-DONAHUE C A. Pancreatic cancer: pancreatic carcinogenesis-several small steps or one giant leap?[J]. Nat Rev Gastroenterol Hepatol, 2016, 14(1): 7-8.
[25] CARR R M, FERNANDEZ-ZAPICO M E. Pancreatic cancer microenvironment, to target or not to target?[J]. EMBO Mol Med, 2016, 8(2): 80-82.
[26] Autophagic pancreatic stellate cells promote pancreatic tumor growth[J]. Cancer Discov, 2016, 6(10): OF9.
[27] SOUSA C M, BIANCUR D E, WANG X, et al. Erratum: pancreatic stellate cells support tumour metabolism through autophagic alanine secretion[J]. Nature, 2016, 540(7631): 150.
[28] SETON-ROGERS S. Pancreatic cancer: dodging immunosuppression[J]. Nat Rev Cancer, 2016, 16(8): 480-481.
[29] SETON-ROGERS S. Pancreatic cancer: spotlight on B cells[J]. Nat Rev Cancer, 2016, 16(2): 67.
[30] ROGHANIAN A, FRASER C, KLEYMAN M, et al. B cells promote pancreatic tumorigenesis[J]. Cancer Discov, 2016, 6(3): 230-232.
[31] HUTCHESON J, BALAJI U, POREMBKA M R, et al. Immunologic and metabolic features of pancreatic ductal adenocarcinoma define prognostic subtypes of disease[J]. Clin Cancer Res, 2016, 22(14): 3606-3617.
[32] STEELE C W, KARIM S A, LEACH J D, et al. CXCR2 inhibition profoundly suppresses metastases and augments immunotherapy in pancreatic ductal adenocarcinoma[J]. Cancer Cell, 2016, 29(6): 832-845.
[33] ALLEN P J, KUK D, CASTILLO C F, et al. Multi-institutional validation study of the american joint commission on cancer (8thedition) changes for T and N staging in patients with pancreatic adenocarcinoma[J]. Ann Surg, 2017, 265(1): 185-191.
[34] SANJEEVI S, IVANICS T, LUNDELL L, et al. Impact of delay between imaging and treatment in patients with potentially curable pancreatic cancer[J]. Br J Surg, 2016, 103(3): 267-275.
[35] JANG J Y, CHANG Y R, KIM S W, et al. Randomized multicentre trial comparing external and internal pancreatic stenting during pancreaticoduodenectomy[J]. Br J Surg, 2016, 103(6): 668-675.
[36] PERINEL J, MARIETTE C, DOUSSET B, et al. Early enteral versus total parenteral nutrition in patients undergoing pancreaticoduodenectomy: a randomized multicenter controlled trial (nutri-DPC)[J]. Ann Surg, 2016, 264(5): 731-737.
[37] BASSI C, MARCHEGIANI G, DERVENIS C, et al. The 2016 update of the International Study Group (ISGPS) definition and grading of postoperative pancreatic fistula: 11 years after[J]. Surgery, 2017, 161(3): 584-591.
[38] KAWAI M, HIRONO S, OKADA K, et al. Randomized controlled trial of pancreaticojejunostomy versus stapler closure of the pancreatic stump during distal pancreatectomy to reduce pancreatic fistula[J]. Ann Surg, 2016, 264(1): 180-187.
[39] GIGLIO M C, SPALDING D R C, GIAKOUSTIDIS A, et al. Meta-analysis of drain amylase content on postoperative day 1 as a predictor of pancreatic fistula following pancreatic resection[J]. Br J Surg, 2016, 103(4): 328-336.
[40] WANG M, ZHU F, QIN R, et al. Which is the best surgical approach for the pancreatic cancer? A classification of pancreatic cancer to guide operative decisions is needed[J]. Ann Surg, 2016. [Epub ahead of print].
[41] KANG M J, JANG J, KIM S. Surgical resection of pancreatic head cancer: what is the optimal extent of surgery?[J]. Cancer Lett, 2016, 382(2): 259-265.
[42] GIOVINAZZO F, TURRI G, KATZ M H, et al. Meta-analysis of benefits of portal-superior mesenteric vein resection in pancreatic resection for ductal adenocarcinoma[J]. Br J Surg, 2016, 103(3): 179-191.
[43] DE ROOIJ T, KLOMPMAKER S, HILAL M A, et al. Laparoscopic pancreatic surgery for benign and malignant disease[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(4): 227-238.
[44] ZUREIKAT A H, POSTLEWAIT L M, LIU Y, et al. A multiinstitutional comparison of perioperative outcomes of robotic and open pancreaticoduodenectomy[J]. Ann Surg, 2016, 264(4): 640-649.
[45] DE ROOIJ T, LU M Z, STEEN M W, et al. Minimally invasive versus open pancreatoduodenectomy: systematic review and Meta-analysis of comparative cohort and registry studies[J]. Ann Surg, 2016, 264(2): 257-267.
[46] KECK T, WELLNER U F, BAHRA M, et al. Pancreatogastrostomy versus pancreatojejunostomy for reconstruction after pancreatoduodenectomy (RECOPANC, DRKS 00000767)[J]. Ann Surg, 2016, 263(3): 440-449.
[47] DEL CHIARO M, VALENTE R, ARNELO U. Minimally Invasive pancreaticoduodenectomy for the treatment of pancreatic-head and periampullary tumors[J]. JAMA Surg, 2016. [Epub ahead of print].
[48] MCMILLAN M T, ZUREIKAT A H, HOGG M E, et al. A propensity score-matched analysis of robotic vs open pancreatoduodenectomy on incidence of pancreatic fistula[J]. JAMA Surg, 2016. [Epub ahead of print].
[49] LAKS S, KOOBY D A, KIM H J. Comparing outcomes for robotic and open pancreatoduodenectomy: a technological advance?[J]. JAMA Surg, 2016. [Epub ahead of print].
[50] KUTLU O C, LEE J E, KATZ M H, et al. Open pancreaticoduodenectomy case volume predicts outcome of laparoscopic approach[J]. Ann Surg, 2016. [Epub ahead of print].
[51] GOH B K P. Robot-assisted minimally invasive distal pancreatectomy is superior to the laparoscopic technique[J]. Ann Surg, 2016, 263(3): e48.
[52] DOKMAK S, AUSSILHOU B, FTÉRICHE F S, et al. Robotassisted minimally invasive distal pancreatectomy is superior to the laparoscopic technique[J]. Ann Surg, 2016, 263(3): e48.
[53] DAI M H, SHI N, XING C, et al. Splenic preservation in laparoscopic distal pancreatectomy[J]. Br J Surg, 2017, 104(4): 452-462.
[54] MCMILLAN M T, MALLEO G, BASSI C, et al. Multicenter, prospective trial of selective drain management for pancreatoduodenectomy using risk stratification[J]. Ann Surg, 2017. [Epub ahead of print].
[55] VAN BUREN G 2nd, FISHER W E. Pancreaticoduodenectomy without drains: interpretation of the evidence [J]. Ann Surg, 2016, 263(5): e74-e76.
[56] WITZIGMANN H, DIENER M K, KIENKÖTTER S, et al. No need for routine drainage after pancreatic head resection:the dual-center, randomized, controlled PANDRA trial (ISRCTN04937707)[J]. Ann Surg, 2016, 264(3): 528-537.
[57] MCMILLAN M T, ZUREIKAT A H, HOGG M E, et al. A propensity score-matched analysis of robotic vs open pancreatoduodenectomy on incidence of pancreatic fistula[J]. JAMA Surg, 2016. [Epub ahead of print].
[58] STROBEL O, HANK T, HINZ U, et al. Pancreatic cancer surgery: the new R-status counts[J]. Ann Surg, 2017, 265(3): 565-573.
[59] UESAKA K, BOKU N, FUKUTOMI A, et al. Adjuvant chemotherapy of S-1 versus gemcitabine for resected pancreatic cancer: a phase 3, open-label, randomised, noninferiority trial (JASPAC 01)[J]. Lancet, 2016, 388(10041): 248-257.
[60] NEOPTOLEMOS J P, PALMER D H, GHANEH P, et al. Comparison of adjuvant gemcitabine and capecitabine with gemcitabine monotherapy in patients with resected pancreatic cancer (ESPAC-4): a multicentre, open-label, randomised, phase 3 trial[J]. Lancet, 2017, 389(10073): 1011-1024.
[61] HACKERT T, SACHSENMAIER M, HINZ U, et al. Locally advanced pancreatic cancer: neoadjuvant therapy with folfirinox results in resectability in 60% of the patients[J]. Ann Surg, 2016, 264(3): 457-463.
[62] VAN CUTSEM E, LENZ H J, FURUSE J, et al. Evofosfamide (TH-302) in combination with gemcitabine in previously untreated patients with metastatic or locally advanced unresectable pancreatic ductal adenocarcinoma: Primary analysis of the randomized, double-blind phase Ⅲ MAESTRO study[J]. Asco Gi, 2016, 19(527): 314-315.
[63] WANG-GILLAM A, LI C P, BODOKY G, et al. Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1): a global, randomised, open-label, phase 3 trial[J]. Lancet, 2016, 387(10018): 545-557.
[64] GILL S, KO Y J, CRIPPS C, et al. PANCREOX: a randomized phase Ⅲ study of 5-fluorouracil/leucovorin with or without oxaliplatin for second-line advanced pancreatic cancer in patients who have received gemcitabine-based chemotherapy[J]. J Clin Oncol, 2016. [Epub ahead of print].
[65] HAMMEL P, HUGUET F, VAN LAETHEM J L, et al. Effect of chemoradiotherapy vs chemotherapy on survival in patients with locally advanced pancreatic cancer controlled after 4 months of gemcitabine with or without erlotinib: the LAP07 randomized clinical trial[J]. JAMA, 2016, 315(17): 1844-1853.
Recent advances in basic research, clinical diagnosis and treatment of pancreatic cancer in 2016
LIANG Dingkong, SHI Si, XU Jin, YU Xianjun (Department of Pancreatic Surgery, Fudan University Shanghai Cancer Center; Pancreatic Cancer Institute, Fudan University; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
YU Xianjun E-mail: yuxianjun@fudanpci.org
Pancreatic cancer is a highly malignant, fast progressive digestive system neoplasm with poor prognosis, and the incidence has increased significantly in the recent years. The treatment mode of pancreatic cancer has been transformed from surgery-first approach to multidisciplinary approach including surgery, chemotherapy, radiotherapy and other comprehensive treatment modalities, accompanying with significant improvement in clinical efficacy. During the last decade, the molecular mechanism of pancreatic cancer has been explored in depth. Indeed, wehad a clearer understanding of the disease, which provides clues for translation of basic research into clinical practice. This review summarized recent high quality studies on pancreatic cancer including pathogenic factor, advances in basic research, and clinical treatment.
Pancreatic cancer; Epidemiology; Basic research; Clinical research; Progress
10.19401/j.cnki.1007-3639.2017.04.001
R735.9
A
1007-3639(2017)04-0241-10
2017-02-20
2017-03-28)
国家杰出青年科学基金(81625016);上海市青年科技英才杨帆计划(17YF1402500)。
虞先濬 E-mail: yuxianjun@fudanpci.org

