钙调神经磷酸酶对阿尔茨海默病大鼠学习记忆及海马区基质金属蛋白酶-9的影响
刘倩倩, 阳 洪, 石胜良, 韦柠琳 , 陈仕检, 林保全
钙调神经磷酸酶对阿尔茨海默病大鼠学习记忆及海马区基质金属蛋白酶-9的影响
刘倩倩1, 阳 洪1, 石胜良2, 韦柠琳1, 陈仕检1, 林保全1
目的 探讨钙调神经磷酸酶对阿尔茨海默病大鼠学习记忆及海马区基质金属蛋白酶-9 (MMP-9)的影响。方法 采用 Aβ1-42海马注射建立AD模型,以他克莫司(FK506)干预。用Morris水迷宫检测大鼠的空间学习记忆能力,RT-PCR、免疫组化以及明胶酶谱技术检测海马区MMP-9的表达。结果 与对照组相比,AD模型组大鼠学习记忆能力明显减退(P<0.01),MMP-9基因转录、蛋白表达和酶活性均明显增加(P<0.05)。FK506干预后,AD大鼠学习记忆能力明显改善,其海马区MMP-9基因转录减少、酶活性降低(P<0.05)。结论 抑制CaN激活可改善AD症状,可能与影响MMP-9的表达有关。
阿尔茨海默病; 钙调神经磷酸酶; 基质金属蛋白酶-9
阿尔茨海默病 (Alzheimer’s disease,AD)是以认知功能减退及行为学改变为主要特点的神经系统退行性疾病,其主要的病理学特点是神经原纤维缠结、细胞外淀粉样老年斑的形成、突触损伤、神经元细胞调亡等。钙调神经磷酸酶(Calcineurin,CaN)是一种活性受Ca2+/CaM调节的丝/苏氨酸蛋白磷酸酶,它能上调细胞因子及炎症因子活性,在大脑皮质、海马神经元中表达最为丰富,而在星形胶质细胞中表达甚微。CaN也可参与神经递质和激素的释放以及突触可塑性调节,其抑制剂已广泛应用于肿瘤、心血管、器官移植后抗排斥反应等治疗。Hong[1]等研究发现CaN抑制剂FK506可穿透血脑屏障,影响基质金属蛋白酶-9(Matrix Metalloproteinase-9,MMP-9)表达,并减少AD大鼠中β淀粉样蛋白(Amyloid protein,Aβ)的沉积。FK506也可抑制氧化应激、维护血脑屏障结构和功能完整而发挥脑保护作用[2],但其机制尚不明确。本实验通过FK506腹腔注射干预,观察大鼠行为学改变及海马区MMP-9的表达来探讨CaN作用于AD的可能机制。
1 材料与方法
1.1 实验动物及材料 健康SD雄性大鼠36只;体重220~250 g,3~4月龄(由广西医科大学动物实验中心提供);Aβ1-42(美国sigma,用前先溶于PBS,前3 d 37℃孵育,使其变为聚集状态);FK506(美国Selleckchem);RNAiso Plus、逆转录试剂盒、SYBR®Premix Ex TaqTMII (Takara);兔抗大鼠基质金属蛋白酶-9抗体;SP免疫组化试剂盒、DAB试剂盒。
1.2 方法
1.2.1 造模及分组 36只大鼠随机分为AD模型组、FK506处理组及对照组(每组12只)。麻醉大鼠后平颅位固定于脑立体定向仪上。参照包新民所著的大鼠脑立体定位图谱,确定两侧海马坐标:前囟后3 mm,正中矢状缝左右旁开2 mm,硬脑膜下3.5 mm。按上述位点钻孔后,每侧海马注射5μl Aβ1-42,10 min内注完,并留针5min以保证药物充分弥散。设0.01 mol PBS注射作为对照组。之后进行药物干预。对照组和模型组按0.2 mg/100 g腹腔注射生理盐水;FK506组按0.2 mg/100 g注射FK506,隔日一次,共30 d。
1.2.2 大鼠行为学观察 应用Morris水迷宫系统对大鼠进行定向航行和空间搜索实验。前5 d,每只大鼠分别从4个不同象限入水,记录大鼠寻找并爬上平台(目标象限距水面下2 cm处)所需时间(逃避潜伏期),取4次平均值作为每天的逃避潜伏期。若120 s内未找到平台,则由助手帮助其上平台。第6天撤去平台,将大鼠放入平台所在对角线的象限内,记录2 min内大鼠穿过隐匿平台次数以及在目标象限游泳时间来评价小鼠记忆成绩指标。
1.2.3 RT-PCR 各组随机选取6只,迅速分离左侧海马,参照RNAiso Plus试剂说明书提取总RNA,逆转录成cDNA后(37 ℃孵育15 min;85 ℃孵育5 s,4 ℃终止反应),进行扩增,MMP-9:上游引物5’-GATCAGCCGGGAACGTATCT-3’;下游引物5’-TTCACCCGGTTGTGGAAACT-3’,产物:198 bp。GAPDH:上游引物5’-GGAGATTACTGCCCTGGCTCCTA-3’;下游引物5’-GACTCATCGTACTCCTGCTTGCTG-3’,产物:135 bp。反应条件为:95 ℃预变性30 s,然后进入循环反应,95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸1 min,共40个循环。表达量的多少通过内参GAPDH比较来反映。
1.2.4 免疫组化染色 各组剩余6只,经心脏灌注生理盐水冲洗和多聚甲醛固定后取脑,常规石蜡包埋切片,取海马冠状层面行免疫组化染色,DAB显色。MMP-9抗体的浓度为1∶75。阴性对照用PBS代替一抗。每个标本取2张切片,每张切片随机选取5个不重叠的海马视野区高倍镜下观察,应用IPP6.0软件测定其积分光密度值(IOD)和阳性面积(area),计算平均积分光密度(IOD/area)。
1.2.5 明胶酶谱法 取各组剩余6只右侧海马,参照MMP Zymograph assay Kit试剂说明书检测MMP-9活性。凝胶经双色红外成像系统拍摄记录,采用Quantity one 软件计算条带灰度值,并以此来反映酶活性高低。

2 结 果
2.1 定向航行及空间搜索实验 前5 d各组大鼠搜索平台的平均潜伏期均逐日缩短;AD组大鼠逃避潜伏期较对照组及FK506组明显延长,而穿越隐匿平台的次数及在目标象限游泳时间明显减少 (P<0.05) (见表1)。
2.2 RT-PCR结果 AD模型组MMP-9的mRNA表达量为(1.39±0.19),与FK506处理组(1.00±0.42) 相比,差异有统计学意义(P<0.05);对照组为(0.93±0.16),与AD组比较,差异有统计学意义(P<0.05)。
2.3 免疫组化结果 免疫组化的阳性细胞显色为胞浆或胞膜染为棕黄色或棕褐色。AD组MMP-9蛋白的IOD/area为(0.21±0.02),FK506组为(0.18±0.02),两组比较无显著性差异。对照组为 (0.14±0.01),与AD组比较,差异有统计学意义(P<0.05)(见图1)。
2.4 明胶酶谱结果 AD模型组MMP-9酶活性为(2.28±0.88),对照组为(0.57±0.09),两者比较差异有统计学意义(P<0.05);FK506组为(1.58±0.31),与AD组比较,差异有统计学意义(P<0.05)(见图2)。
表1 各组大鼠水迷宫实验结果比较±s)
AD组与对照组比较*P<0.01;FK506组与AD组比较#P<0.05,△P<0.01;FK506组与对照组比较P<0.05
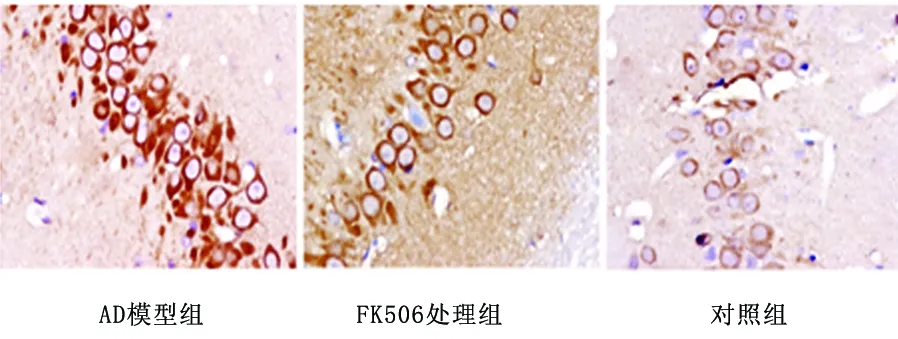
图1 各组大鼠海马区MMP-9表达的改变(×400)

图2 各组大鼠海马区MMP-9酶活性的改变
3 讨 论
AD是由多因素引起,涉及多种病理机制,并有多种病理表现的“多因异质性疾病”。脑内Aβ代谢异常并过度沉积后,通过一系列瀑布样放大效应,对脑细胞造成毒性作用,引起神经元及突触功能失调,另外沉积的Aβ作用于神经胶质细胞产生炎症反应、氧化应激等,从而加强或促进AD的病理过程。本研究采用双侧海马区注射Aβ1-42诱导AD大鼠模型,与侧脑室注射相比,避免了聚集态的Aβ1-42在海马区扩散不均、模型成功率低等缺点。而通过水迷宫实验我们发现AD组大鼠较正常对照组穿越平台潜伏期明显延长,穿越平台次数及在目标象限游泳时间明显减少,说明本实验AD大鼠造模成功。
MMPs属于含有Zn2+和Ca2+的蛋白水解酶家族,能降解几乎所有的细胞外基质。也是目前在脑脊液中发现的与Aβ代谢密切相关的重要金属酶[3]。MMP-9作为一种明胶酶,在AD患者海马区,特别是淀粉样斑块聚集的星形胶质细胞周围表达丰富。MMP-9能降解Aβ[4],但同时降解细胞外基质、髓鞘碱性蛋白、层粘连蛋白等,并能破坏血脑屏障的完整性,从而加重AD患者的大脑损伤。其在中枢神经系统中还参与调节突触可塑性[5]、细胞调亡[6]等过程。而本研究通过RT-PCR、免疫组化及免疫印迹技术发现AD组大鼠海马区MMP-9在基因或蛋白表达水平均较对照组明显增高,说明MMP-9在AD发病过程中发挥重要作用。研究发现[7],敲除MMP-9基因后,可防止因氧化应激导致的血脑屏障破坏,而氧化应激损伤可加重AD的病理过程。Lorenzl等[8]通过明胶酶谱技术也发现AD患者血浆中MMP-9表达明显增高。从而,我们可以推测MMP-9可能作为早期诊断AD的重要分子生物学指标。
研究认为,Aβ的异常产生和蓄积影响细胞膜上的AMPA、NMDA等钙离子通道以及谷氨酸受体,导致细胞内钙离子增多和IP3生成,它们可作用于内质网膜上的RyR和IP3R3而导致钙离子大量流入细胞质,从而激活CaN[9],CaN活化后去磷酸化激活活化T细胞核因子 (nuclear factor of activated T cells,NFAT),然后NFAT进入细胞核开始转录,介导一系列的生理病理反应,包括tau蛋白的去磷酸化[10]、炎症反应、细胞调亡等。而MMP-9基因可结合NFTA多个位点[11]。本研究中,急性给予FK506干预后,与AD组大鼠相比,其穿越平台潜伏期明显缩短,而穿越隐匿平台次数及在目标象限游泳时间增多,说明抑制CaN活性可改善AD大鼠的学习记忆能力。同时,我们也发现FK506组中MMP-9基因产物及酶活性较AD组降低,说明CaN可能通过上调MMP-9的表达从而缓解AD症状。但是FK506组较对照组大鼠MMP-9表达有增加,可能与MMP-9参与降解Aβ,或者FK506尚不能完全逆转神经功能损伤,这与Hong[1]等人的研究结果一致,因此,我们仍需大样本的实验来进一步验证。
本实验运用动物实验说明,抑制CaN激活可能通过下调MMP-9的表达而改善AD症状,但其作用于AD的具体机制仍需进一步探讨。对各组大鼠Aβ、CaN活性的测定以及其他MMPs家族成员的检测可能更有助于我们了解其作用于AD 的机制,从而找到新的神经保护性药物。
[1]Hong HS,Hwang JY,Son SM,et al.FK506 reduces amyloid plaque burden and induces MMP-9 in AbetaPP/PS1 double transgenic mice[J].J Alzheimers Dis,2010,22(1):97-105.
[2]蔡志友,晏 勇,晏 宁,等.盐酸多奈哌奇对阿尔茨海默病患者血清MMP-2、MMP-9、ox-LDL的影响[J].中国老年学杂志,2008,28(20):2035-2037.
[3]Rosenberg GA.Matrix metalloproteinases and their multiple roles in neurodegenerative diseases[J].Lancet Neurol,2009,8(2):205-216.
[4]Yan P,Hu X,Song H,et al.Matrix metalloproteinase-9 degrades amyloid-beta fibrils in vitro and compact plaques in situ[J].J Biol Chem,2006,281(34):24566-24574.
[5]Mizoguchi H,Yamada K,Nabeshima T.Matrix metalloproteinases contribute to neuronal dysfunction in animal models of drug dependence,Alzheimer's disease,and epilepsy[J].Biochem Res Int,2011,2011:681385.
[6]王知非,廖达光,吴 浩,等.大鼠弥漫性脑损伤中基质金属蛋白酶-9通过激活钙蛋白酶导致细胞凋亡[J].中国现代医学杂志,2010,20(9):1336-1338.
[7]Haorah J,Ramirez SH,Schall K,et al.Oxidative stress activates protein tyrosine kinase and matrix metalloproteinases leading to blood-brain barrier dysfunction[J].J Neurochem,2007,101(2):566-576.
[8]Lorenzl S,Buerger K,Hampel H,et al.Profiles of matrix metalloproteinases and their inhibitors in plasma of patients with dementia[J].Int Psychogeriatr,2008,20(1):67-76.
[9]Woods NK,Padmanabhan J.Neuronal calcium signaling and Alzheimer's disease[J].Adv Exp Med Biol,2012,740:1193-1217.
[10]Qian W,Yin X,Hu W,et al.Activation of protein phosphatase 2B and hyperphosphorylation of tau in Alzheimer’s disease[J].J Alzheimers Dis,2011,23(4):617-627.
[11]Doller A,Akool el S,Muller R,et al.Molecular mechanisms of cyclosporin A inhibition of the cytokine-induced matrix metalloproteinase-9 in glomerular mesangial cells[J].J Am Soc Nephrol,2007,18(2):581-592.
Effect of Calcineurin on learning and memory and MMP-9 of hippocampus region in rats with Alzheimer’s disease
LIUQianqian,YANGHong,SHIShengliang,etal.
(DepartmentofNeurology,FourthAffiliatedHospitalGuangxiMedicalUniversity,Guangxi545005,China)
Objective To explore the effect of calcineurin on learning and memory and MMP-9 of hippocampus region in Aβ1-42-induced AD rats.Methods AD rats were established by direct Aβ1-42injection.The learning and memory ability and the expression of MMP-9 were analyzed.Results FK506 could improve learning and memory ability,reduce the expression of MMP-9 in AD rats.Conclusions Inhibiting calcineurin may influence the expression of MMP-9,thus alleviate the AD symptom.
Alzheimer’s diseas; Calcineurin; MMP-9
1003-2754(2017)04-0339-03
2016-12-23;
2017-03-29
地区科学基金项目(No.81460183)
(1.广西医科大学第四附属医院神经内科,广西 柳州 545005;2.广西医科大学第二附属医院神经内科,广西 南宁 540021)
石胜良,E-mail:ssl_1964@163.com
R749.1
A

