混合型小细胞肺癌外科治疗后预后分析*
韩轲 杨海棠 范力文 赵珩
·临床研究与应用·
混合型小细胞肺癌外科治疗后预后分析*
韩轲①②杨海棠①范力文①赵珩①
目的:探索混合型小细胞肺癌(C-SCLC)术后患者生存的预后影响因素。方法:回顾性分析2010年1月至2014年12月在上海交通大学附属胸科医院行肺癌根治性切除及系统性淋巴结清扫C-SCLC患者的临床资料。结果:共计78例患者入组,其中C-SCLC合并大细胞神经内分泌肿瘤(large cell neuroendocrine carcinoma,LCNEC)患者所占比例最多(n=42),其次是C-SCLC合并鳞癌(SCC)患者(n=18)、C-SCLC合并腺癌(AC)患者(n=10)及C-SCLC合并腺鳞癌(ASC)患者(n=8)。本研究队列5年生存率(OS)39.1%。多因素Cox回归分析表明:肿瘤大小[<3 cm vs.>3 cm;危险度(HR)=0.406;95%可信区间(95%CI):0.202~0.816;P= 0.011]、体力状态评分(<2 vs.>2;HR=0.113;95%CI:0.202-0.631;P=0.013)、混合性非小细胞肺癌(NSCLC)成分(LCNEC vs.非LCNEC成分,HR=3.00;95%CI:0.096~0.483;P<0.001)、病理分期(ⅢA期vs.Ⅰ期;HR=0.195,95%CI:0.063-0.602;P=0.004)及辅助治疗(是vs.否,HR=0.402;95%CI:0.195~0.831;P=0.014)为C-SCLC患者预后影响因素。结论:混合型小细胞肺癌中的大细胞神经内分泌肿瘤成分会显著影响患者生存;术后辅助治疗明显有益于C-SCLC术后患者生存率的提高。
混合型小细胞肺癌 外科手术 生存率
小细胞肺癌(SCLC)是原发性肺癌的一种组织学亚型,约占全部肺癌总数的15%[1-3]。世界卫生组织(WHO)目前将SCLC分为两个亚型:纯小细胞肺癌(P-SCLC)和混合型小细胞肺癌(C-SCLC)。混合型小细胞肺癌的定义是:SCLC合并其他任何非小细胞肺癌(NSCLC)组织学类型,如大细胞癌、鳞癌(SCC)和腺癌(AC)。C-SCLC的发病率远低于纯小细胞肺癌C-SCLC[4],其原因可能是:1)术前活检或细胞学检查所能够提供的标本有限;2)目前广泛认为手术治疗SCLC疗效不佳[5],致使接受手术切除的SCLC患者数量有限。
据以往报道称[5-7],C-SCLC同P-SCLC相比,两者预后之间存在一定的差异,提示这两种亚型各自具有不同的生物学特征。然而,当前大部分研究都集中于P-SCLC[8],或者将两种亚型当作一个整体来进行分析[9-10]。有关混合型小细胞肺癌的研究十分有限,因此,本研究针对C-SCLC的临床特征及预后进行了回顾性分析。
1 材料与方法
1.1 临床资料
2008年1月至2014年12月间上海交通大学附属胸科医院共287例SCLC患者进行了外科手术。按照2015年WHO最新的肺癌诊断及分类标准[11],本研究回顾性分析了其中78例C-SCLC术后患者,所有患者都接受了完全切除及系统性淋巴结清扫,并根据第七版TNM分期标准进行分期[12]。本研究得到上海市胸科医院伦理委员会批准。
1.2 方法
所有手术切除的肿瘤组织均按照相应标准进行了系统性取样,石蜡包埋标本由两位高年资病理科医生进行分析,免疫组织化学染色用于区分C-SCLC中的小细胞和非小细胞成分。
能耐受化疗的患者均建议在术后1个月开始进行辅助化疗。总生存期(OS)定义为从手术日至最后一次随访或死亡的时间。无疾病生存期(DFS)定义为手术日至发现局部复发或远处转移的时间。本研究的主要观察指标是OS。
1.3 统计学分析
2 结果
2.1 患者临床资料及特征
患者临床资料特征(表1),本研究包含64(82.1%)例男性患者和14(17.9%)例女性患者,平均年龄53.0(31~71)岁。
42(53.8%)例患者进行了术前病理学诊断,包括细胞学或组织学检查(细针穿刺、经支气管镜毛刷及灌洗、经皮穿刺活检),其中纯小细胞肺25例,低分化癌6例,鳞癌(SCC)有5例,坏死组织有4例,腺癌(AC)有2例。术后病理均证实为C-SCLC,其中包括小细胞肺癌合并大细胞神经内分泌癌(SCLC/ LCNEC)最为常见(n=42),其次是SCLC/SCC(n=18)、SCLC/AC(n=10)及腺鳞癌(ASC,n=8)。
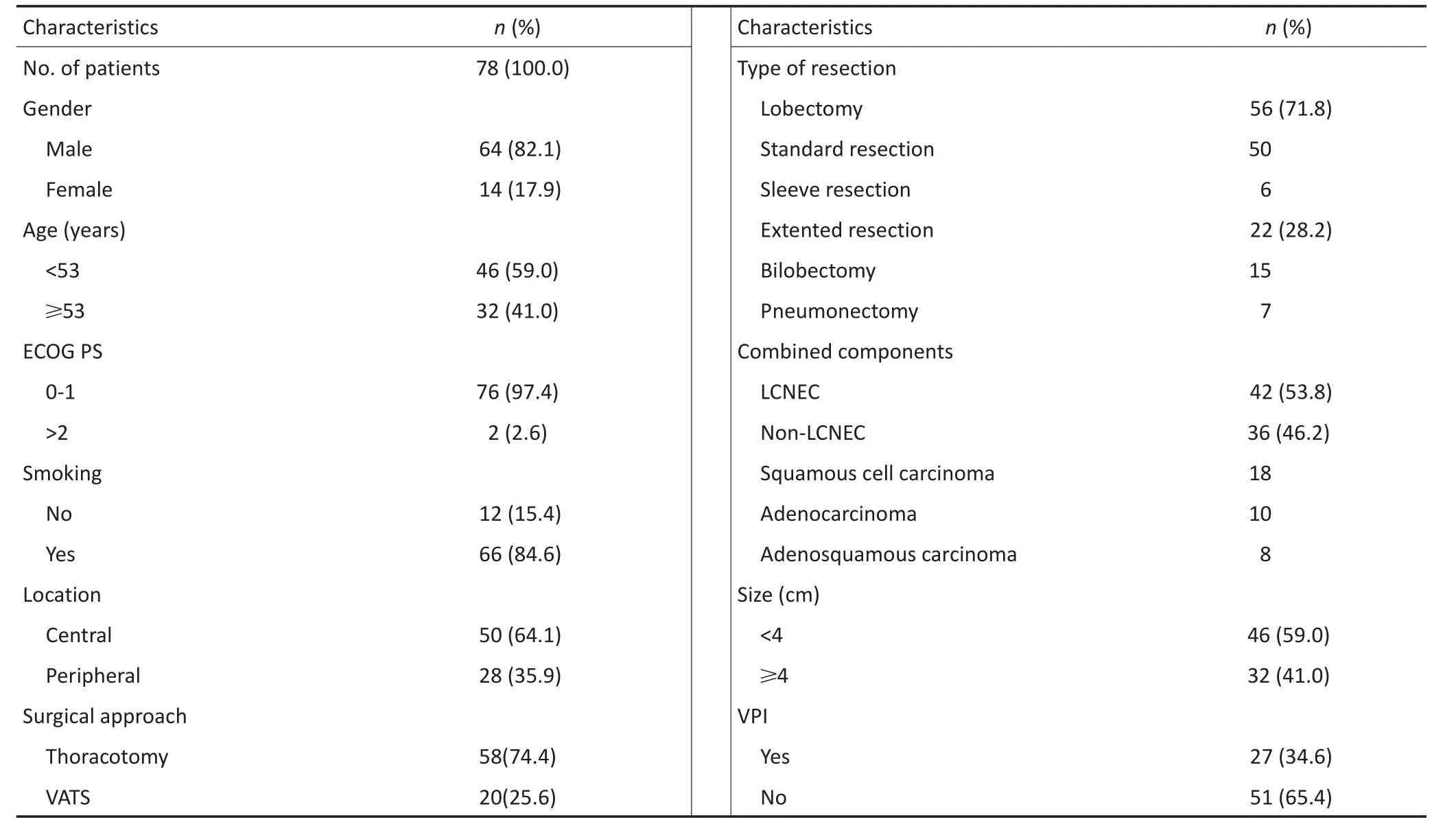
表1 患者临床特征Table 1 Patients,characteristics
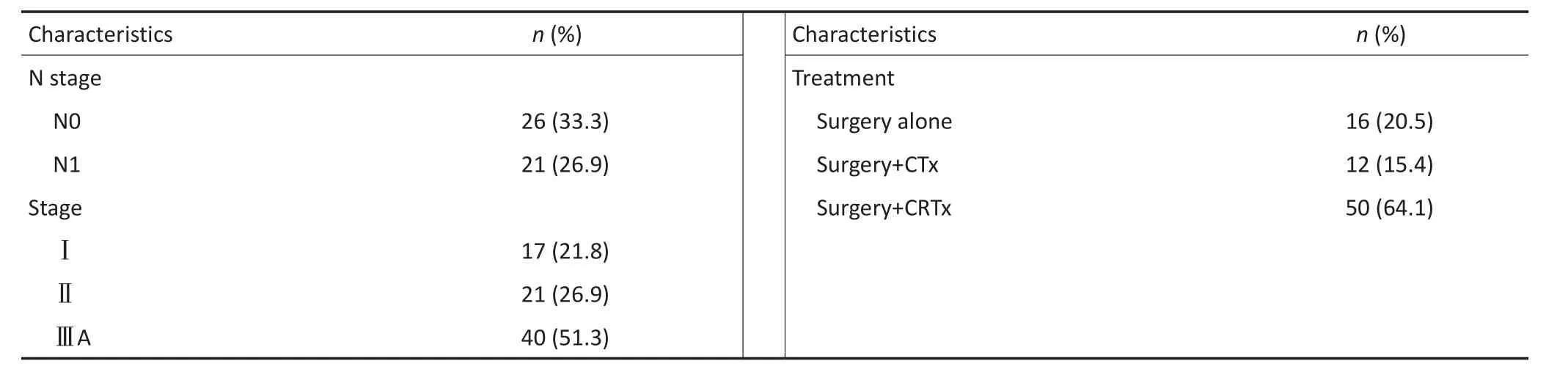
表1 患者临床特征(续表1)Table 1 Patients,characteristics
2.2 辅助治疗
纳入研究的78例C-SCLC患者中,62(79.5%)例患者接受了术后辅助治疗(本机构常规建议对Ⅰ期C-SCLC患者行单纯化疗,对Ⅱ期患者行化疗+胸部放射治疗及ⅢA期患者行化疗+预防性颅脑照射+胸部放射治疗):其中50例患者接受了联合辅助治疗(化疗+胸部放射治疗15例;化疗+预防性颅脑照射+胸部放射治疗35例),12(15.4%)例患者仅接受了术后辅助化疗,16(20.5%)例患者未接受术后辅助治疗。化疗方案大部分采用了依托泊苷+铂类药物(EP方案,n=54),其余患者采用长春瑞滨、异环磷酰胺+顺铂(NIP方案,n=8)。
2.3 生存分析
中位随访时间是27.0(6~82)个月,截至最后一次随访,45(57.7%)例患者死亡,56(71.8%)例患者局部区域复发和远处转移,5年OS和DFS分别为39.1%和28.4%。
单因素分析结果表2显示,同SCLC/non-LCNEC相比,SCLC/LCNEC患者的OS明显较差(P=0.001,图1);另外,仅接受手术治疗与手术联合术后辅助治疗的患者相比,OS也具有显著差异性(P<0.001,图1)。
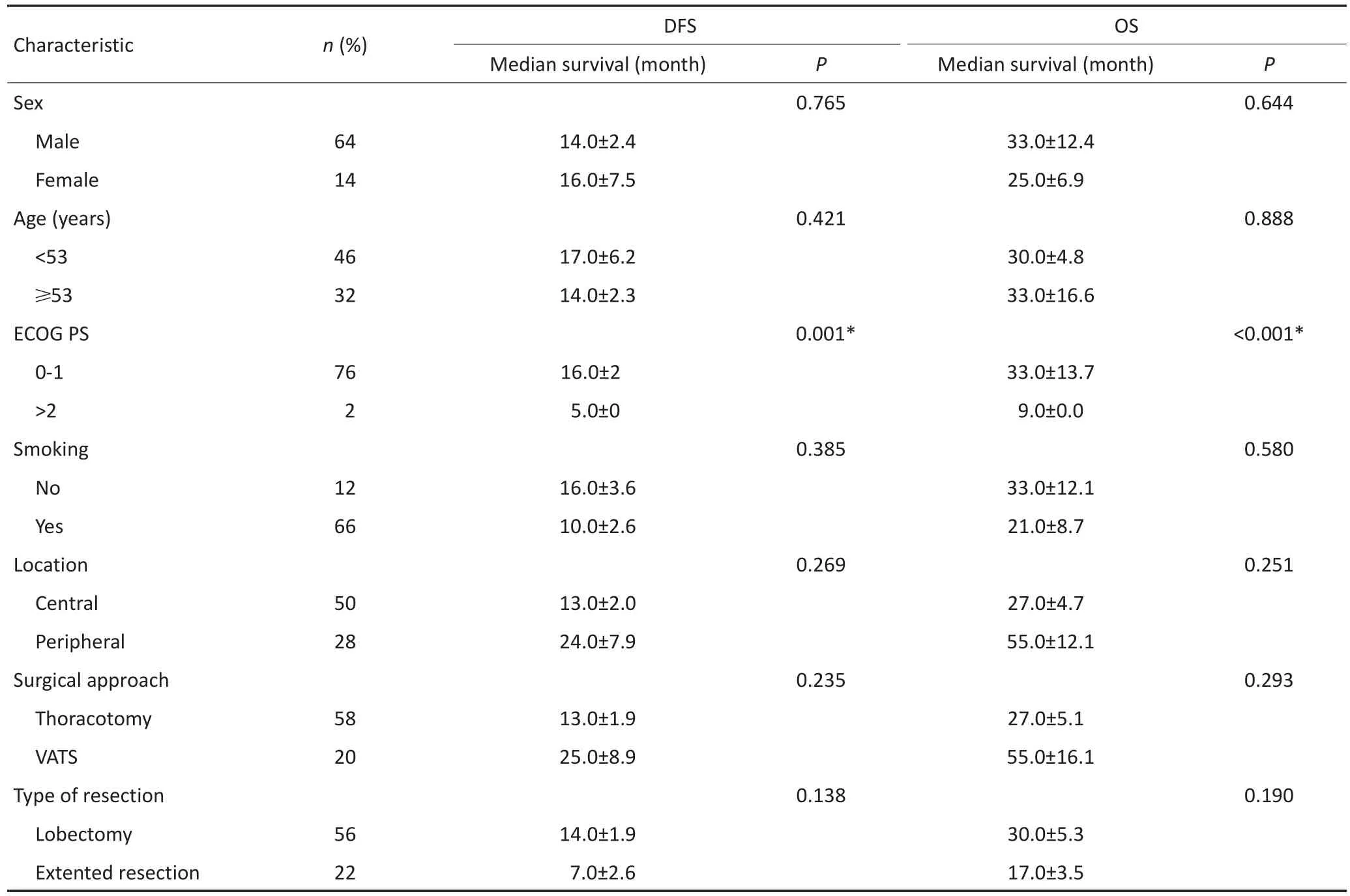
表2 DFS和OS的单因素分析Table 2 Univariate analysis for DFS and OS
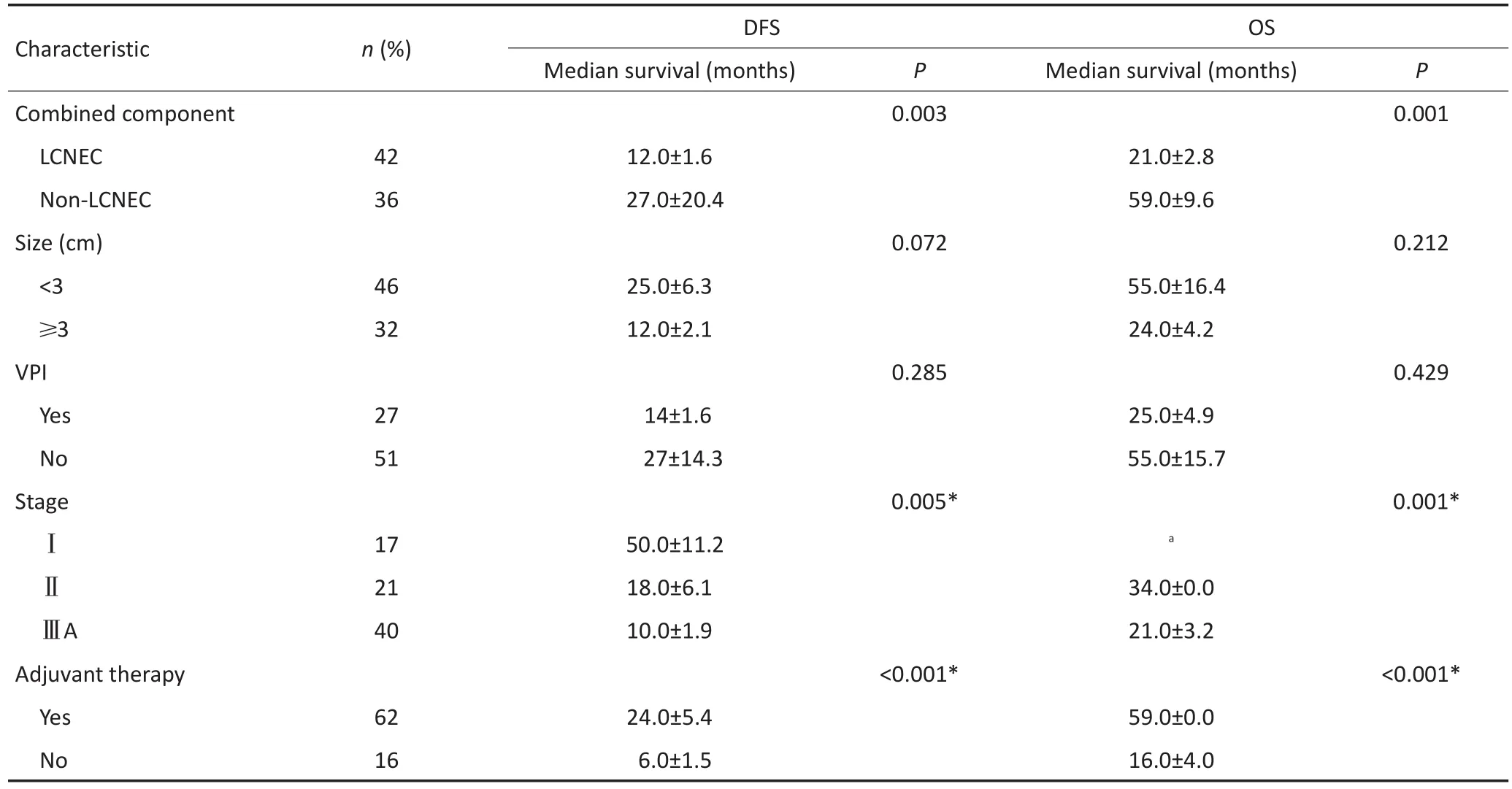
表2 DFS和OS的单因素分析(续表2)Table 2 Univariate analysis for DFS and OS
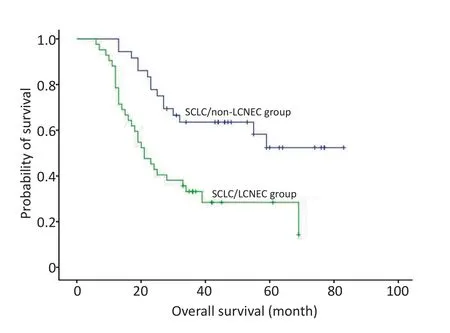
图1 SCLC/LCNEC组同SCLC/non-LCNEC组生存率的比较Figure 1 The overall survival analysis showed that SCLC/non-LCNEC group survived longer than SCLC/LCNEC group
多因素Cox回归分析表明:肿瘤大小(<3cmvs.>3cm;HR=0.406;95%CI:0.202~0.816;P=0.011)、体力状态评分(<2 vs.>2;HR=0.113;95%CI:0.202~0.631;P=0.013)、混合性非小细胞肺癌(NSCLC)成分(LCNEC vs.非LCNEC成分,HR=3.00;95%CI:0.096~0.483;P<0.001)、病理分期(ⅢA期vs.Ⅰ期;HR=0.195,95%CI:0.063~0.602;P= 0.004)及辅助治疗(是vs.否,HR=0.402;95%CI:0.195~0.831;P=0.014)为C-SCLC患者OS的预后影响因素。同样,体力状态评分(<2 vs.>2;HR=0.167,95%CI:0.035~0.790;P=0.024)、肿瘤大小(<3 cm vs.>3 cm;HR=0.473;95%CI:0.269~0.832;P=0.009)、病理分期(ⅢA期vs.Ⅰ期;HR=0.345,95%CI:0.162~0.733;P=0.006)是DFS的相应预后影响因素(表3)。
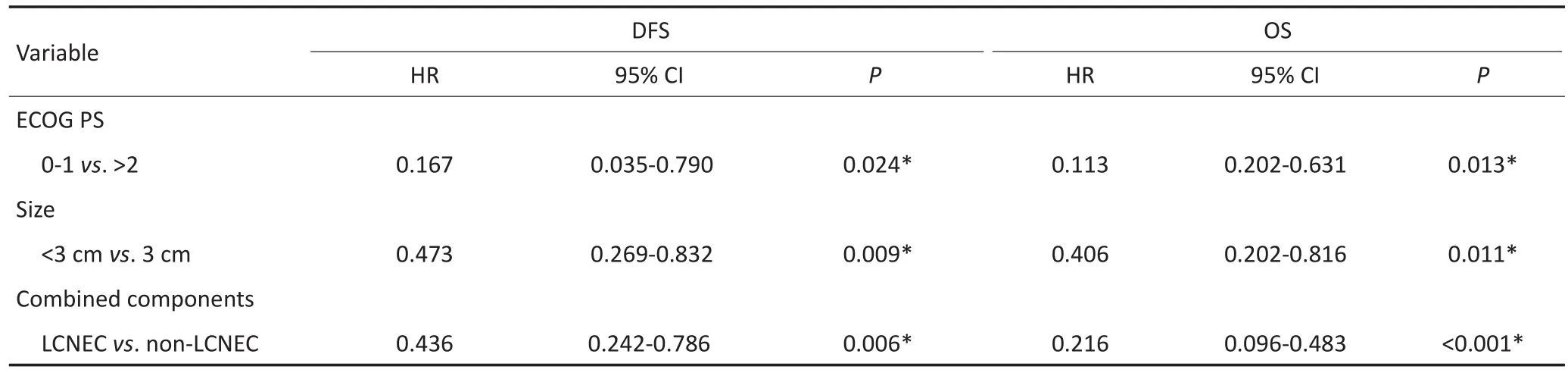
表3 DFS和OS的多因素分析Table 3 Multivariable analysis for DFS and OS
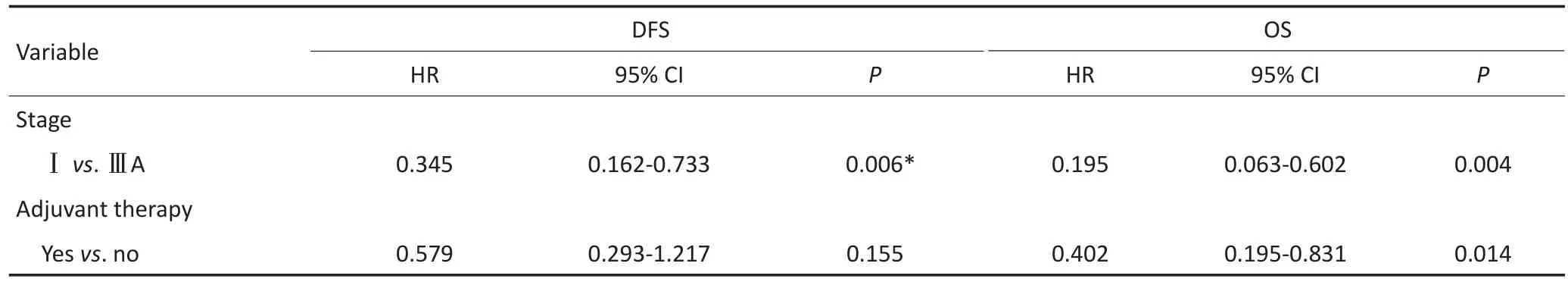
表3 DFS和OS的多因素分析(续表3)Table 3 Multivariable analysis for DFS and OS
3 讨论
SCLC是一类具有特殊的病理学特点和临床特征的恶性肿瘤,大约占所有原发性肺癌的15%。CSCLC和P-SCLC同为SCLC的亚型,但两者具有不同的预后特点,且C-SCLC较P-SCLC更为少见。因此,目前国内外有关C-SCLC的研究十分有限。本研究对接受手术治疗的C-SCLC患者进行了回顾性分析,结果显示:混合成分的不同及术后辅助治疗对CSCLC患者远期生存有显著影响。
据报道,C-SCLC总的发生率(活检+手术)约占SCLC的2%~24%[7,13-14]。但是,也有研究报道称[4],接受手术治疗的SCLC患者当中,有高达28%的手术标本病理证实为C-SCLC。在我们机构中,手术治疗的SCLC患者中C-SCLC所占比例为27.1%,由此说明了同非手术方式取得病理标本相比,手术标本更能准确地反映该肿瘤的病理学特征,同时也说明了CSCLC的实际发病率比预期的要高。本研究的各种病理学亚型中,混合LCNEC成分的最为常见,其次是混合SCC及AC成分,这一结果与之前的研究报道一致[7,15]。
外科手术在局限期SCLC患者治疗过程中所起的作用越来越受到重视[8-10],C-SCLC也同样如此[7]。这是因为手术切除可以提供足够的组织标本用于病理学诊断,而细胞学检查或活检有时提供的诊断信息十分有限,无法准确判断肺癌的病理学类型,尤其是具有混合组织学亚型的肿瘤[16-17]。细胞学检查或活检有时可以快速准确地诊断出P-SCLC,但是诊断C-SCLC时往往可能会出现误诊[5,18-19]。本研究中,有42例患者术前诊断分别为:P-SCLC(n=25)、低分化癌(n=6)、SCC(n=5)、坏死组织(n=4)及AC(n=2),而术后病理却证实为C-SCLC。这说明C-SCLC术前与术后病理学诊断往往存在较大的差异,术前通过非手术方式取得的诊断容易造成误诊。其原因是:术前诊断主要通过组织标本在光学显微镜下的形态学特征做出判断,而低分化或含有混合成分的肿瘤细胞较难通过形态学进行鉴别。因此,对于无法手术的SCLC患者应该充分考虑混合型的可能性,进而选择最佳的治疗方案。
目前,SCLC的标准化疗方案是EP方案,但是CSCLC中的NSCLC成分对EP方案并不敏感,这就有可能导致化疗效果不理想。本研究显示术后辅助化疗能够提高C-SCLC患者预后,与先前的研究一致[20-22]。Luo等[23]研究比较了NIP方案与EP方案治疗晚期C-SCLC患者的疗效和安全性,其结果显示:EP方案在生存率上有所获益,但与NIP方案相比没有统计学差异;在不良反应方面EP方案发生率显著低于NIP方案。Li等[24]研究显示EP方案联合紫杉醇与单用EP方案相比具有较好的客观反应率,但是在生存率上没有明显获益。由于本研究中接受非EP方案治疗的病例数有限,因此未就不同化疗方案对CSCLC疗效的差异进一步研究。
C-SCLC中NSCLC成分是否与SCLC成分具有相同的克隆起源尚不清楚。Wagner等[25]研究显示,7例C-SCLC患者中有6例SCLC成分与NSCLC成分具有相同的免疫表型,于是研究者提出:由于两种组织学成分具有相同的克隆起源,所以不应将其分类为不同的亚型,而都应视为纯小细胞肺癌。而本研究显示,SCLC/LCNEC与SCLC/non-LCNEC的患者相比具有较低的生存率,说明了NSCLC成分能够影响CSCLC预后,这一结果与之前另一些报道一致[6],但也有报道提出了不同观点[15]。希望将来有大样本量的试验对C-SCLC中各成分的分化方向及其转化机制做出进一步研究。
本研究作为回顾性研究,同样存在一定局限性。首先,由于我们没有能对标本中的NSCLC成分和SCLC成分进行显微解剖,所以未能对两种成分是否具有相同的分子特征做出研究;其次,由于样本量较小,未进一步就胸部放疗与预防性颅脑照射是否对生存有所获益做出比较;最后,考虑到不同NSCLC成分的存在,未能对不同化疗方案的疗效进行比较也是本研究的不足之处之一,其原因主要也是因为样本量较少。因此,未来需要进一步行大样本多中心试验来证实这些问题。
[1]Govindan R,Page N,Morgensztern D,et al.Changing epidemiology of small-cell lung cancer in the United States over the last 30 years: analysis of the surveillance,epidemiologic,and end results database[J].J Clin Oncol,2006,24(28):4539-4544.
[2]Owonikoko TK,Ragin CC,Belani CP,et al.Lung cancer in elderly patients:an analysis of the surveillance,epidemiology,and end results database[J].J Clin Oncol,2007,25(35):5570-5577.
[3]Eskandar A,Ahmed A,Daughtey M,et al.Racial and sex differences in presentation and outcomes of small cell lung cancer in the United States:1973 to 2010[J].Chest,2015,147(4):e164-165.
[4]Nicholson SA,Beasley MB,Brambilla E,et al.Small cell lung carcinoma(SCLC):a clinicopathologic study of 100 cases with surgical specimens[J].Am J Surg Pathol,26(9):1184-1197.
[5]Adelstein DJ,Tomashefski JF Jr,Snow NJ,et al.Mixed small cell and non-small cell lung cancer[J].Chest,1986,89(5):699-704.
[6]Radice PA,Matthews MJ,Ihde DC,et al.The clinical behavior of "mixed"small cell/large cell bronchogenic carcinoma compared to "pure"small cell subtypes[J].Cancer,1982,50(12):2894-2902.
[7]Babakoohi S,Fu P,Yang M,et al.Combined SCLC clinical and pathologic characteristics[J].Clin Lung Cancer,2013,14(2):113-119.
[8]Combs SE,Hancock JG,Boffa DJ,et al.Bolstering the case for lobectomy in stagesⅠ,Ⅱ,andⅢA small-cell lung cancer using the National Cancer Data Base[J].J Thorac Oncol,2015,10(2):316-323.
[9]Takei H,Kondo H,Miyaoka E,et al.Surgery for small cell lung cancer:a retrospective analysis of 243 patients from Japanese Lung Cancer Registry in 2004[J].J Thorac Oncol,2014,9(8):1140-1145.
[10]Takenaka T,Takenoyama M,Inamasu E,et al.Role of surgical resection for patients with limited disease-small cell lung cancer[J].Lung cancer,2015,88(1):52-56.
[11]Travis WD,Brambilla E,Burke AP,et al.WHO Classification of Tumours of the Lung,Pleura,Thymus and Heart[J].J Thorac Oncol, 2015,10(9):1240-1242.
[12]Goldstraw P,Crowley J,Chansky K,et al.The IASLC Lung Cancer Staging Project:proposals for the revision of the TNM stage groupings in the forthcoming(seventh)edition of the TNM Classification of malignant tumours[J].J Thorac Oncol,2007,2(8):706-714.
[13]Hirsch FR,Osterlind K,Hansen HH.The prognostic significance of histopathologic subtyping of small cell carcinoma of the lung according to the classification of the World Health Organization.A study of 375 consecutive patients[J].Cancer,1983,52(11):2144-2150.
[14]Mangum MD,Greco FA,Hainsworth JD,et al.Combined small-cell and non-small-cell lung cancer[J].J Clin Oncol,1989,7(5):607-612.
[15]Wallace AS,Arya M,Frazier SR et al.Combined small-cell lung carcinoma:An institutional experience[J].Thorac Cancer,2014,5(1):57-62.
[16]Song TN,Zhang JH,Li B et al.Misdiagnosis of a small cell lung cancer resulting from inaccurate pathology[J].Ann Thorac Surg,2015, 99(5):e125-127.
[17]Chen J,Gao YD,Cao Y et al.Surgical specimen histology revealed inadequacy of conventional transbronchial needle aspiration sample in the diagnosis of adenosquamous lung carcinoma[J].J Thorac Dis, 2015,7(4):680-686..
[18]Marchevsky AM,Wick MR.Diagnostic difficulties with the diagnosis of small cell carcinoma of the lung[J].Semin Diagn Pathol,2015,32 (6):480-488.
[19]Iwata T,Nishiyama N,Nagano K et al.Role of pulmonary resection in the diagnosis and treatment of limited-stage small cell lung cancer:revision of clinical diagnosis based on findings of resected specimen and its influence on survival[J].Gen Thorac Cardiovasc Surg,2012,60(1):43-52.
[20]Corso CD,Rutter CE,Park HS et al.Role of Chemoradiotherapy in Elderly Patients With Limited-Stage Small-Cell Lung Cancer[J].J Clin Oncol,2015,33(36):4240-4246.
[21]Behera M,Ragin C,Kim S et al.Trends,predictors,and impact of systemic chemotherapy in small cell lung cancer patients between 1985 and 2005[J].Cancer,2016,122(1):50-60.
[22]Yang CF,Chan DY,Speicher PJ et al.Role of Adjuvant Therapy in a Population-Based Cohort of Patients With Early-Stage Small-Cell Lung Cancer[J].J Clin Oncol,2016,122(1):50-60.
[23]Luo J,Wu FY,Li AW et al.Comparison of vinorelbine,ifosfamide and cisplatin(NIP)and etoposide and cisplatin(EP)for treatment of advanced combined small cell lung cancer(cSCLC)patients:a retrospective study[J].Asian Pac J Cancer Prev,2012,13(9):4703-4706.
[24]Li YY,Zhou C,Yang DX et al.Paclitaxel-etoposide-carboplatin/cisplatin versus etoposide-carboplatin/cisplatin as first-line treatment for combined small-cell lung cancer:a retrospective analysis of 62 cases[J].Cancer Biol Med,2015,12(2):117-1125.
[25]Wagner PL,Kitabayashi N,Chen YT et al.Combined small cell lung carcinomas:genotypic and immunophenotypic analysis of the separate morphologic components[J].Am J Clin Pathol,2009,131(3): 376-382.
(2017-01-10收稿)
(2017-02-24修回)
(编辑:杨红欣 校对:郑莉)
Prognostic factors of combined small cell lung cancer after surgical resection
Ke HAN1,2,Haitang YANG1,Liwen FAN1,Heng ZHAO1
Heng ZHAO;E-mail:h_zhao28@163.com
1Department of Thoracic Surgery,Shanghai Chest Hospital,Shanghai Jiao Tong University,Shanghai 200030,China;2Department of Thoracic Surgery,Shiyan People's Hospital,Shiyan 442000,China
This study was supported by the Scientific and Technotlogic Innovition Project of Shanghai Jiao Tong University(No.YG2015ZD14)
Objective:To investigate the prognostic factors and survival of patients with combined small cell lung cancer(C-SCLC)after they underwent complete resection.Methods:The clinical records of C-SCLC patients who were subjected to complete resection and systematic nodal dissection in one institution between January 2010 and December 2014 were retrospectively reviewed.Results:Seventy-eight patients with histologically diagnosed C-SCLC were identified.The most common combined component was large cell neuroendocrine carcinoma(LCNEC)(n=42),followed by squamous cell carcinoma(SCC)(n=18),adenocarcinoma(AC)(n=10),and adenosquamous carcinoma(ASC)(n=8).The overall survival(OS)rate of the entire cohort was 39.1%.Multivariate analyses using Cox's proportional hazard models revealed that size[<3 cm vs.>3 cm;hazard ratio(HR)=0.406;95%confidence interval(CI)=0.202-0.816;P=0.011], performance status(<2 vs.>2;HR=0.113;95%CI=0.202-0.631;P=0.013),combined non-small cell lung cancer(NSCLC)components (LCNEC vs.non-LCNEC,HR=3.00;95%CI=0.096-0.483;P<0.001),stageⅢA vs.Ⅰ;HR=0.195,95%CI:0.063-0.602;P=0.004)and adjuvant therapy(yes vs.no,HR=0.402;95%CI=0.195-0.831;P=0.014)were significant prognostic factors of OS.Conclusion:The mixed NSCLC components within C‐SCLC significantly influence survival.Adjuvant therapy is bene fi cial for patients with complete resection of C-SCLC.
combined small cell lung cancer,surgery,survival

10.3969/j.issn.1000-8179.2017.07.041
①上海交通大学附属胸科医院胸外科(上海市200030);②湖北省十堰市人民医院胸外科
*本文课题受上海交通大学科技创新专项基金(编号:YG2015ZD14)资助
赵珩 h_zhao28@163.com
韩轲 专业方向为肺癌的诊断与治疗。
E-mail:158001558126@163.com

