癫痫患儿血清HMGB1、IL-2、INF-γ 水平变化及其意义
桂兰,康靖,吕丽英 (兴安职业技术学院医学分院,内蒙古乌兰浩特37400;兴安盟人民医院)
癫痫患儿血清HMGB1、IL-2、INF-γ 水平变化及其意义
桂兰1,康靖2,吕丽英2
(1兴安职业技术学院医学分院,内蒙古乌兰浩特137400;2兴安盟人民医院)
目的 观察儿童癫痫患者血清高迁移率族蛋白1(HMGB1)、白细胞介素1(IL-2)、干扰素-γ(INF-γ)变化,并探讨其意义。方法 选择10例儿童癫痫患者为观察组,30例健康儿童为对照组。观察组癫痫频发29例,持续状态22例,非频发或持续状态38例。采用双抗体酶联免疫吸附法检测两组血清HMGB1、IL-2及INF-γ水平。结果 观察组血清HMGB1、IL-2、INF-γ水平高于对照组(P均<0.05)。观察组癫痫频发、处于持续状态患儿血清HMGB1、IL-2、INF-γ水平高于非频发或持续状态患儿(P均<0.05),癫痫频发患儿血清HMGB1、IL-2、INF-γ水平与持续状态患儿相比,P均>0.05。结论 癫痫患儿血清HMGB1、IL-2、INF-γ水平升高。检测HMGB1、IL-2、INF-γ可能有助于儿童癫痫的诊断及病情评估。
癫痫;高迁移率族蛋白1;白细胞介素2;干扰素-γ
免疫功能的紊乱以及炎症性反应在成人癫痫发作过程中有重要作用[1,2]。高迁移率族蛋白1(HMGB1)是广泛存在于心、肝、脾、肺、肾等组织细胞中的非组蛋白染色体结合蛋白,有研究发现[3],HMGB1参与了颅内感染、脑缺血、脑损伤以及败血症等炎症性疾病的发生发展过程。IL-2由活化的CD4+T、CD8+T细胞合成并分泌,是具有广泛生物活性的调控免疫应答的细胞因子,有研究证实白细胞介素2(IL-2)在癫痫发生发展过程中扮演重要作用[4]。干扰素-γ(INF-γ)是在一定刺激原作用下由T淋巴细胞分泌的细胞因子,能通过调节并诱导细胞趋化因子的表达而促进炎症性反应的发生[5]。但是癫痫儿童血清HMGB1、IL-2、IFN-γ水平的变化并不明确。本研究观察了癫痫儿童血清中HMGB1、IL-2、IFN-γ水平变化,探讨其在儿童癫痫发生发展过程中的作用及其临床意义。现报告如下。
1 资料与方法
1.1 临床资料 收集2014年1月~2016年12月收治的89例儿童癫痫患者为观察组,其中男49例、女40例,年龄3个月~14岁、平均5.7岁。病程3个月~5年,平均1.2年。纳入标准:①符合2010年国际抗癫痫联盟和国际癫痫局制定的癫痫发作和癫痫综合征诊断指南[6],并结合临床特征、病史、脑电图、MRI等检查确诊的原发性癫痫;②年龄0~14岁;③近1个月内未服用免疫抑制剂、激素类以及其它可能影响本研究结果的药物;④患者家属在知情同意书上签字;⑤获得医院伦理委员会的通过。排除标准:①颅脑损伤、脑出血、中枢神经系统等引起的继发性癫痫;②近期感染性疾病者;③内分泌性疾病、恶性肿瘤等患者。根据癫痫发作的频率以及每次发作持续时间,本组癫痫频发29例、持续状态22例、非癫痫频发或持续状态38例。另选取同期查体的30例健康儿童为对照组,其中男18例,女12例;年龄1~13岁,平均6.1岁。本研究已经我院医学伦理委员会批准。所有受试者的监护人已签署知情同意书。
1.2 血清HMGB1、IL-2、IFN-γ检测方法 观察组患儿清晨采集癫痫发作12 h内空腹肘静脉血4 mL,对照组儿童于清晨体检时采集空腹肘静脉血4 mL,在室温下静置30 min后以3 000 r/min的速度离心10 min,留取血清液置于-80 ℃环境下保存待测。采用双抗体酶联免疫吸附法(ELISA)测定血清HMGB1、IL-2、INF-γ水平,其中HMGB1、IL-2试剂盒均购自上海生工生物工程股份有限公司(HMGB1检测试剂盒批号:A729AD0275,IL-2检测试剂盒批号:A729AD0276),INF-γ试剂盒购自北京中杉金桥生物技术有限公司(INF-γ检测试剂盒批号:20130403)。严格按照试剂盒说明书操作。

2 结果
2.1 两组血清HMGB1、IL-2、INF-γ水平比较 观察组患儿血清HMGB1、IL-2、INF-γ水平均高于对照组(P均<0.05)。两组患儿血清HMGB1、IL-2、INF-γ水平比较见表1。
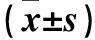
表1 两组患儿血清HMGB1、IL-2、INF-γ水平比较
注:与对照组相比,*P<0.05。
2.2 观察组不同病情患儿血清HMGB1、IL-2、INF-γ水平比较 观察组不同病情癫痫儿童血清HMGB1、IL-2、INF-γ水平水平见表2。观察组癫痫频发、处于持续状态患儿血清HMGB1、IL-2、INF-γ水平高于非频发或持续状态患儿(P均<0.05),癫痫频发患儿血清HMGB1、IL-2、INF-γ水平与持续状态患儿相比,P均>0.05。经Pearson积矩相关分析,观察组患者血清HMGB1与IL-2、INF-γ均呈正相关关系(r=0.793、0.659,P<0.05),血清IL-2与INF-γ呈正相关关系(r=0.812,P<0.05)。
HMGB1主要存在于心、肝、脾、肺、肾等组织的真核细胞中,是一类非组蛋白染色体结合蛋白,具有调节神经细胞出芽以及迁移的作用,参与了脑发育的生理过程。报道表明[11],HMGB1参与了组织损伤、缺血性脑损伤、脓毒血症等疾病的病理过程。Huang 等[12]研究显示,癫痫大鼠海马神经元细胞、星形胶质细胞中HMGB1水平升高,Choy等[13]发现癫痫患者海马组织中HMGB1表达明显增加。IL-2主要是由激活的T细胞分泌的可溶性因子,具有调节淋巴细胞平衡、促进淋巴细胞增生的功能。研究发现[14],IL-2抗体、IL-2受体的抗体可以抑制兴奋性氨基酸的神经传导作用,并促进γ氨基丁酸的神经传递作用,进而抑制癫痫的发作。由此推断,IL-2作为炎症因子,可能参与了癫痫的发病过程。IFN是具有广泛生物活性的防御糖蛋白,具有免疫调节、抗病毒、抗细胞增殖等作用,INF-γ主要是由T细胞、NK细胞所分泌,属于小分子多肽,只存在于人或者灵长类动物组织细胞中。研究发现[15],INF-γ介导了机体感染后的多种免疫应答反应。
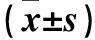
表2 观察组不同病情癫痫患儿血清HMGB1、IL-2、INF-γ水平比较
注:与非癫痫频发或持续状态者相比,#P<0.05。
3 讨论
本研究结果显示,观察组患儿血清HMGB1、IL-2、INF-γ水平高于对照组,提示HMGB1、IL-2、INF-γ可能参与了癫痫的发病过程,与文献[12,16]一致。儿童癫痫发病过程极为复杂,发作频率、发作持续时间对评估癫痫病情有重要意义,发作频率越高、持续时间越久,患者预后相对越差。本研究结果显示,观察组癫痫频发、处于持续状态患儿血清HMGB1、IL-2、INF-γ水平高于非频发或持续状态患儿,癫痫频发患儿血清HMGB1、IL-2、INF-γ水平与持续状态患儿相比P均>0.05。说明发作频繁、发作持续时间久的儿童癫痫患者血清HMGB1、IL-2、INF-γ水平明显升高,HMGB1、IL-2、INF-γ水平越高,癫痫病情越严重。癫痫病情越严重,免疫应答反应越强烈,合成并分泌的细胞因子水平越高。
近年来,生态旅游业发展火爆,各地都在积极开发生态旅游事业,取得了一定的成效,生态旅游已经成为旅游业可持续发展的有效途径。在发展生态旅游业的过程中,也遇到了一些问题和阻碍,没有有效发挥生态旅游对环境保护的积极作用,对此,还需要进一步提升认识,积极组织开展生态旅游,推进生态旅游发展模式的不断优化,才能促进生态旅游和环境保护的协同发展。
循环式空气源热泵热水系统是先将外界冷水送入保温水箱,然后通过水泵不断地将保温水箱内的水送入热泵机组内循环加热,直至将保温水箱内的水加热到设定温度。热泵机组的进水温度和出水温度每次均不相同。
由于行政事业单位的管理者对内部控制工作不够重视,使得单位不能很好地贯彻和落实国家传达的各项政策。行政事业单位的管理者对国家政策中的核心的理念理解不够深入,进而在单位内部控制建设上产生消极的态度,不能很好地发挥内部控制的真正作用。
癫痫是临床常见的综合征,我国人群癫痫的患病率在3.3%~5.8%之间,其中约有75%~80%在儿童期起病[7]。正规抗癫痫治疗后,约70%的癫痫患者病情可得到有效控制甚至治愈,30%的患者反复发作而发展为难治性癫痫。癫痫严重损伤脑组织,加上药物的不良反应,给患者的神经系统发育造成严重影响[8]。免疫系统在复杂的神经网络中具有双向调节作用,神经系统可产生不同类型的神经调质介导免疫功能,而免疫系统可产生免疫活性物质介导神经功能。因此,神经系统性疾病常伴发不同程度的免疫系统功能紊乱,神经系统能产生并分泌多种细胞因子,同时也能表达多种细胞因子受体。研究发现[9],癫痫发病机制中,神经免疫调节功能的失衡具有重要作用,并且癫痫发病类型、病程的长短以及发作频率等均会影响免疫系统功能,从而造成体内细胞因子分泌水平的不同。Bembeeva 等[10]研究显示,细胞因子在癫痫患者脑组织及癫痫动物模型大脑皮层中呈不同程度的升高。
2018年7月初,连续降雨致使许多苹果园叶片出现生理性“蒸叶”现象,根系生长受阻,进一步影响树体对养分的吸收、运输和转化。
相关性分析显示,病例组患者血清HMGB1与IL-2、INF-γ均呈正相关,血清IL-2与INF-γ呈正相关,提示HMGB1与IL-2、INF-γ相互作用,共同参与癫痫的发病过程。HMGB1处于致炎因子网络的中心环节,受损坏死细胞、巨噬细胞被激活后能释放HMGB1,进而利用信号通路诱介导IL-2、INF-γ等细胞因子的合成和分泌,反过来,HMGB1和细胞因子又能促进HMGB1的释放,最终通过互相调节的正反馈环路而在癫痫发病过程中启动、维持、放大炎症反应。
[1] Keller SS, Glenn GR, Weber B, et al. Preoperative automated fibre quantification predicts postoperative seizure outcome in temporal lobeepilepsy[J]. Brain, 2017,140(Pt 1):68-82.
[2] Matin N, Tabatabaie O, Falsaperla R, et al. Epilepsy and innate immune system: A possible immunogenic predisposition and related therapeutic implications[J]. Hum Vaccin Immunother, 2015,11(8):2021-2029.
[3] Nguyen AH, Detty SQ, Agrawal DK. Clinical implications of high-mobility group box-1 (HMGB1) and the receptor for advanced glycation end-products (RAGE) in cutaneous malignancy: a systematic review[J]. Anticancer Res, 2017,37(1):1-7.
[4] Steinborn B, Zarowski M, Winczewska-Wiktor A, et al. Concentration of Il-1β,IL-2, Il-6, TNFα in the blood serum in children with generalized epilepsytreated by valproate[J]. Pharmacol Rep, 2014,66(6):972-975.
[5] 黄寒,钟礼立,彭力,等.难治性肺炎支原体肺炎患儿支气管肺泡灌洗液中IL-4及INF-γ水平的研究[J].中国当代儿科杂志,2012,14(8):581-584.
[6] Appleton RE, Freeman A, Cross JH. Diagnosis and management of the epilepsies in children: a summary of the partial update of the 2012 NICE epilepsy guideline[J]. Arch Dis Child, 2012,97(12):1073-1076.
[7] Molugulu N,Gubbiyappa KS,Vasudeva-Murthy CR,et al.Evaluation of self-reported medication adherence and its associated factors among epilepsypatients in Hospital Kuala Lumpur[J]. J Basic Clin Pharm,2016,7(4):105-109.
[8] Terra VC, D'Andrea-Meira I, Amorim R, et al. Neuromodulation in refractory epilepsy: Brazilian specialists consensus[J]. Arq Neuropsiquiatr, 2016,74(12):1031-1034.
[9] Lascano AM, Korff CM, Picard F.Seizures and epilepsies due to channelopathies and neurotransmitter receptor dysfunction: a parallel between genetic and immune aspects[J]. Mol Syndromol, 2016,7(4):197-209.
[10] Bembeeva RTs, Zavadenko NN. Intravenous immunoglobulin in treatment of autoimmune neurological diseases in children[J]. Nevrol Psikhiatr Im Korsakova, 2015,115(8):83-93.
[11] Jia Y, Wang L, Zhao GY, et al. Carbon monoxide inhibits the nuclear-cytoplasmic translocation of HMGB1 in an in vitro oxidative stress injury model of mouse renal tubular epithelial cells[J]. J Huazhong Univ Sci Tech Med Sci, 2016,36(6):791-795.
[12] Huang JS, Wu Y, Huang Q, et al. Expression level and distribution of HMGB1 in Sombati's cell model and kainic acid-inducedepilepsy?model[J]. Eur Rev Med Pharmacol Sci, 2015,19(15):2928-2933.
[13] Choy M, Dube CM, Patterson K, et al. A novel, noninvasive, predictive epilepsy biomarker with clinical potential[J]. J Neurosci, 2014,34(26):8672-8684.
[14] 蒋萍,刘骅,郑丽华.癫痫及癫痫性抑郁障碍患者血清细胞因子的变化研究[J].成都中医药大学学报,2013,36(2):69-71.
[15] 张晓军,何韶衡,刘长庭.老年COPD患者痰IL-4、IL-10、INF-γ水平及临床意义[J].临床肺科杂志,2013,18(6):1004-1006.
[16] 黄艳军,郑帼,陈静.炎性细胞因子及C反应蛋白在癫痫患儿外周血中的表达及临床意义[J].实用临床医药杂志,2014,18(24):40-42.
·作者·编者·读者·
《山东医药》关于医学名词与统计学符号的应用说明
医学名词要以1989年及以后由全国自然科学名词审定委员会审定、公布,科学出版社出版的《医学名词》和相关科学的名词为准,暂未公布者仍以人民卫生出版社出版的《英汉医学词汇》为准。中文药物名称应使用1995年药典(法定药物)或卫生部药典委员会编辑的《药名词汇》(非法定药物)中的名称,英文药物名称则采用国际非专利药名,不用商品名。
内蒙古自治区自然科学基金资助项目(2013MS1130)。
10.3969/j.issn.1002-266X.2017.11.019
R742.1
B
1002-266X(2017)11-0060-03
2016-12-23)

