腹腔注射雷帕霉素的实验性自身免疫性脑脊髓炎小鼠脊髓神经元病理变化及其机制
谢阳, 黄远帅, 杨元, 李作孝(西南医科大学附属医院,四川泸州 646000)
·基础研究·
腹腔注射雷帕霉素的实验性自身免疫性脑脊髓炎小鼠脊髓神经元病理变化及其机制
谢阳, 黄远帅, 杨元, 李作孝
(西南医科大学附属医院,四川泸州 646000)
目的 观察腹腔注射雷帕霉素的实验性自身免疫性脑脊髓炎(EAE)小鼠脊髓神经元病理变化,并探讨其机制。方法 将45只C57BL/6小鼠随机分为对照组、模型组和观察组,各15只。对照组不作任何处理。模型组和观察组制备EAE模型。观察组小鼠腹腔注射雷帕霉素0.75 mg/(kg·d),2 d后再注射百日咳菌稀释液0.5 mL,满18 d后处死。取脊髓组织行尼氏染色,光镜下观察病理变化。采用DCF化学荧光法检测脊髓组织匀浆活性氧簇(ROS)水平。 采用Western blotting法检测各组小鼠自噬标志物LC3-Ⅱ/LC3-Ⅰ和Akt/mTOR/P70s6k信号通路蛋白p-Akt、p-mTOR。结果 光镜下观察模型组小鼠脊髓神经元尼氏小体体积变小、数量减少及颜色变浅,排列松散,胞体与轴突轮廓模糊。与模型组相比,观察组小鼠脊髓神经元内排列较整齐,尼氏小体数量及体积均增多,胞体与轴突轮廓模糊现象少见。对照组、模型组、观察组小鼠脊髓组织匀浆ROS含量分别为(43.34±2.67)、(84.22±3.15)、(64.10±3.59)U/mgprot。模型组小鼠脊髓组织匀浆ROS含量高于对照组(P<0.05);观察组小鼠脊髓组织匀浆ROS含量高于对照组(P<0.05),低于模型组(P<0.05)。对照组、模型组、观察组小鼠脊髓组织自噬标志物LC3-Ⅱ/LC3-Ⅰ条带光密度值分别为0.486±0.021、0.251±0.032、0.566±0.054。小鼠脊髓组织自噬标志物LC3-Ⅱ/LC3-Ⅰ条带光密度值观察组高于模型组,模型组低于对照组,P均<0.05。模型组小鼠小鼠脊髓组织p-Akt、p-mTOR条带光密度值高于对照组,P均<0.05;观察组小鼠小鼠脊髓组织p-Akt、p-mTOR条带光密度值低于对照组和模型组,P均<0.05。结论 腹腔注射雷帕霉素的EAE小鼠脊髓神经元病理变化程度减轻。这可能是由于雷帕霉素可抑制AKT/mTOR/P70s6k通路激活自噬活性,清除ROS抑制氧化应激。
雷帕霉素;实验性自身免疫性脑脊髓炎;细胞自噬;氧化应激;PI3K-AKT-mTOR通路
多发性硬化(MS)是一种以中枢神经系统白质慢性炎性脱髓鞘病变为主要特点的神经退行性疾病,免疫失衡在其中发挥重要作用。活性氧簇(ROS)是需氧细胞在代谢过程中产生的一系列活性氧族,在生理状态下与抗氧化机制共同维系细胞的稳态[1]。中枢神经系统氧耗量大,且抗氧化物质相对于外周血中浓度偏低[2],导致氧化与抗氧化作用失衡,可产生大量氧化中间产物ROS,它通过氧化损伤神经元细胞中的蛋白质、DNA及脂质成分,并介导脂质过氧化反应等引起神经元退行性变性[3]。雷帕霉素是一种新型大环内酯类免疫抑制剂,近年来有关雷帕霉素作为自噬诱导剂用于肿瘤及神经退行性疾病治疗的研究屡见不鲜,主要通过对哺乳动物雷帕霉素靶蛋白(mTOR)特异性抑制,以及选择性的抑制mTOR下游P70S6激酶的磷酸化与功能活化,诱导自噬进而加强对细胞内蛋白质的清除,减少聚集体的形成并抑制神经元和神经胶质细胞的死亡[4]。雷帕霉素作为自噬诱导剂在MS及其动物模型EAE中是否可以对神经元起到保护作用及其机制尚不明确。为此, 本研究观察了腹腔注射雷帕霉素的EAE小鼠脊髓神经元细胞病理改变程度的变化,并探讨氧化应激、细胞自噬和AKT/mTOR/P70s6k通路在其中的作用。现报告如下。
1 材料与方法
1.1 材料 45只实验用C57BL/6雌性小鼠(6~8周,17~20 g)购于成都达硕实验动物有限公司,饲养于西南西科大学忠山校区动物房中,饲养室温(24±2)℃,每12 h明暗交替一次,给予足够的食料与饮水。实验过程符合《实验室动物饲养和操作条例》。MOG35-55 (北京中科亚光生物技术公司),结核杆菌H37Ra(Difco 公司),百日咳毒素(美国Sigma公司产品),福氏完全佐剂(美国Sigma公司),雷帕霉素(武汉凯通精细化工有限公司),兔抗小鼠多克隆微管相关蛋白1轻链3(LC3)B(CST公司),兔抗GAPDH抗体(Abcam公司),山羊抗兔HRP(KPL公司),兔抗小鼠AKT、P-AKT抗体(CST公司),兔抗小鼠P70s6k、P-P70s6k抗体(CST公司),ROS检测试剂盒(南京建成生物工程研究所),Tunel染色试剂盒(拜意尔生物)。
1.2 小鼠分组、EAE模型制作及雷帕霉素应用方法 将45只小鼠随机分为对照组、模型组和观察组,每组15只。模型组和观察组制备EAE模型。将抗原MOG35-55用PBS液稀释成3 mg/mL,用等体积福氏完全佐剂混匀至乳浊液,按0.2 mL/只的剂量于小鼠脊柱段两侧任选2点处进行皮下注射,腹腔注射百日咳菌稀释液0.5 mL。观察组小鼠腹腔注射雷帕霉素0.75 mg/(kg·d),2 d后再注射百日咳菌稀释液0.5 mL,满18 d后处死进行后续实验。
1.3 各组小鼠脊髓神经元病理变化观察 水合氯醛麻醉,灌注针从左心室深入升主动脉,小心剪开右心耳,用生理盐水快速灌注直至肝脏发白,然后用4%多聚甲醛灌流约30 min后取出脊髓组织,常规石蜡包埋并切片,在脊髓腰膨大处连续切片,切片厚5 μm,行脊髓神经元尼氏染色。光镜下观察脊髓神经元病理形态。
1.4 各组小鼠脊髓匀浆ROS水平检测 在冰盘上经水合氯醛麻醉后,去眼球放血处死并快速断头,在冰上迅速取出脊髓组织,快速剪碎脊髓组织,加生理盐水稀释10倍,用玻璃匀浆器在冰上研磨,制成脊髓组织匀浆,然后离心(3 000 r/min离心15 min),取上清液进行超滤离心,最后取上清液,放入-80 ℃冰箱保存备用采用DCF化学荧光法检测脊髓组织匀浆ROS水平。DCFH-DA试剂和PBS按照1∶9的比例配制DCFH-DA工作液。先在测试孔和对照孔中均加入上清液190 μL,然后在测试孔中加入1 mmol/L的DCFH-DA工作液10 μL,在对照孔中加入PBS液10 μL,用移液器吸打使之充分混匀,37 ℃孵育30 min,最佳激发波长为500 nm,最佳发射波长为525 nm,测定其荧光强度。
1.5 各组小鼠脊髓组织自噬标志物LC3-Ⅱ/LC3-Ⅰ检测 采用Western blotting法。将分离出的脊髓腰膨大用RIPA裂解液裂解后提取总蛋白,用BCA蛋白测定法测定蛋白浓度,经过SDS-PAGE电泳、转膜、室温下封闭处理后加入1∶1 000稀释的LC3B和GAPDH一抗,并在4 ℃中孵育过夜,用TBST洗涤3次回收的一抗稀释液,再加入二抗(山羊抗兔HRP抗体)室温孵育1 h,滴加ECL混合液于暗室中曝光,通过调整光强度显影,最后用Alpha Ease FC软件处理系统分析目标带的光密度值即蛋白表达水平。
1.6 各组小鼠脊髓组织AKT/mTOR通路蛋白检测 采用Western blotting法。一抗为AKT/P-AKT、mTOR/P-mTOR。其余同上。

2 结果
2.1 各组小鼠脊髓神经元病理变化 光镜下观察,对照组小鼠脊髓神经元细胞形态及分布未见异常,神经元胞体与轴突界限清晰,尼氏小体深染区与胞核淡染区轮廓清晰,尼氏小体丰富呈虎斑样分布。模型组小鼠脊髓神经元尼氏小体体积变小、数量减少及颜色变浅,排列松散,胞体与轴突轮廓模糊。与模型组相比,观察组小鼠脊髓神经元内排列较整齐,尼氏小体数量及体积均增多,胞体与轴突轮廓模糊现象少见。
2.2 各组小鼠脊髓组织匀浆ROS水平比较 对照组、模型组、观察组小鼠脊髓组织匀浆ROS水平分别为(43.34±2.67)、(84.22±3.15)、(64.10±3.59)U/mgprot。模型组小鼠脊髓组织匀浆ROS水平高于对照组(P<0.05);观察组小鼠脊髓组织匀浆ROS水平高于对照组(P<0.05),低于模型组(P<0.05)。
2.3 各组小鼠脊髓组织自噬标志物LC3-Ⅱ/LC3-Ⅰ条带光密度值比较 对照组、模型组、观察组小鼠脊髓组织自噬标志物LC3-Ⅱ/LC3-Ⅰ条带光密度值分别为0.486±0.021、0.251±0.032、0.566±0.054。小鼠脊髓组织自噬标志物LC3-Ⅱ/LC3-Ⅰ条带光密度值观察组高于模型组,模型组低于对照组,P均<0.05。
2.4 各组小鼠脊髓组织p-AKT、p-mTOR条带光密度值比较 各组小鼠脊髓组织p-AKT、p-mTOR条带光密度值见表1。模型组小鼠小鼠脊髓组织p-AKT、p-mTOR条带光密度值高于对照组,P均<0.05;观察组小鼠小鼠脊髓组织p-AKT、p-mTOR条带光密度值低于对照组和模型组,P均<0.05。
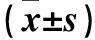
表1 三组小鼠脊髓组织p-AKT、p-mTOR表达量比较
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。
3 讨论
MS发病机制至今尚未明确,在过去的研究中已经证实炎性细胞浸润和免疫失衡参与其中[6]。随着对其研究的深入,在MS病灶中还可以发现髓鞘脱失、轴索损伤、神经元变性及血脑屏障破坏等病理改变,而这些病理损伤都与氧化应激有着密切的联系[7]。这与中枢神经系统氧耗量大,抗氧化能力低,氧化与抗氧化作用失衡时产生大量氧化中间产物ROS而遭受氧化应激损伤有关[8]。已有研究证实在MS急性期发病中,活化的巨噬细胞与小胶质细胞大量释放活性氧而造成氧化应激,它可以直接损伤细胞器的脂膜、DNA及蛋白质,而受损的细胞器及异常的蛋白质大量积聚于胞内破坏细胞的平衡与稳态[9]。并且Dasgupta等[10]在EAE小鼠脊髓束的大部分细胞中发现有不同程度的碳素化蛋白质积聚,并且此机制贯穿EAE整个病情进展始末。自噬作为正常真核细胞清除蛋白质和细胞器的主要途径,是由单层或多层膜结构包裹对受损细胞器等形成自噬小体,然后运送至溶酶体中形成自噬溶酶体并降解消化其内容物的过程[11],在真核细胞中,当发生氧化应激损伤时,机体启动相关防御机制,可通过自噬对受损细胞器及异常的蛋白质进行降解而抵抗氧化应激反应,从而维持细胞内的稳态及细胞器的更新[12]。已有研究表明由于谷胱甘肽的缺陷及蛋白酶体抑制可以引起氧化应激的发生及碳素化蛋白质的大量积聚,导致神经元细胞及神经胶质细胞死亡[13]。
mTOR作为经典的调节自噬的蛋白激酶,在自噬的信号转导通路中,mTOR是被发现参与其中的第一个分子,Ⅰ类PI3K/AKT信号通路是mTOR参与自噬的一条经典的信号途径,在它的下游信号中,丝/苏氨酸激酶P70s6k可通过调控核糖体蛋白S6的磷酸化而抑制自噬的发生[14]。作为mTOR特异性抑制剂的雷帕霉素在1977年就被Martel发现它对EAE动物模型的病情进展进行完全的阻遏,并在慢性EAE小鼠模型中也证实了雷帕霉素可以延缓EAE临床症状的出现及降低严重程度[16]。雷帕霉素可与FK506结合蛋白(FKBP12)相结合而形成Rapa-FKBP12复合物,并在靠近mTOR的C末端激酶结构域上游与该复合物的结合位点(FRB)结合对mTOR特异性抑制,并且可以选择性的抑制P70s6激酶的磷酸化与功能活化,从而诱导自噬的发生,被抑制的mTOR通过增加对溶酶体的生物合成,从而促进自噬溶酶体的形成,加强对细胞内蛋白质的清除,减少聚集体的形成并抑制神经元和神经胶质细胞的死亡。雷帕霉素作为免疫抑制剂在EAE及MS发病机制中的作用已被证实,但其作为自噬诱导剂在EAE中神经元保护作用的机制尚无报道,所以笔者设计了该实验初步探讨雷帕霉素在EAE中神经保护作用机制。
本研究结果显示,与对照组相比较,模型组小鼠脊髓神经元中尼氏小体数量及体积减少,神经元结构模糊,损伤严重;观察组小鼠脊髓神经元结构清晰,尼氏小体数量及体积介于对照组与EAE模型组之间。模型组小鼠脊髓匀浆ROS水平升高,自噬相关标记物LC3-Ⅱ/LC3-Ⅰ降低;观察组小鼠脊髓匀浆ROS水平低于模型组,LC3-Ⅱ/LC3-Ⅰ升高。表明雷帕霉素可以保护受到损伤的小鼠脊髓神经元,降低氧化应激,提高自噬水平。Shringarpure等[19]在EAE小鼠研究中发现大量积聚于神经元细胞核及细胞质的蛋白质中含有许多被氧化的蛋白酶。有研究证实雷帕霉素可以通过诱导自噬减轻聚集蛋白质的毒性作用从而减缓神经退行性变。我们推测EAE发病高峰期ROS大量释放诱发氧化应激,造成细胞器及蛋白质等损害,而EAE发病高峰期中存在自噬缺陷,使大量的受损细胞器及蛋白质无法得到有效清除而积聚于胞内,大量积聚的已破坏的细胞器及蛋白质等可正反馈促进ROS释放,持续遭受攻击损害致病情进行性加重。雷帕霉素可通过对自噬诱导,加强对受损细胞器和蛋白质等物质的清除,对氧化应激产生抑制效应而使ROS水平降低,减轻神经元损伤,从而起保护作用。为进一步验证我们的推测,我们对自噬通路中AKT/P70s6蛋白磷酸化水平进行检测,结果显示模型组小鼠脊髓组织p-AKT、p-mTOR条带光密度值高于对照组,观察组小鼠脊髓组织p-AKT、p-mTOR条带光密度值低于对照组和模型组。提示模型组小鼠因磷酸化AKT及P70s6高表达而对自噬产生抑制效应,从而出现自噬缺陷。雷帕霉素可对mTOR信号通路中上下游磷酸化AKT及P70s6蛋白激酶的抑制而诱导自噬的发生,并对胞内大量积聚的受损细胞器及异常蛋白质进行有效的清除,从而使氧化/抗氧化作用得以平衡,抑制了氧化应激的进展,限制ROS对脊髓神经元的损伤破坏,从而对EAE小鼠脊髓神经元细胞起保护作用。
[1] Ohl K, Tenbrock K, Kipp M. Oxidative stress in multiple sclerosis: central and peripheral mode of action[J]. Exp Neurol,2016,277:58-67.
[2] Miller E, Mrowicka M, Zolynski K, et al. Oxidative stress in multiple sclerosis[J]. Polski Merkur Lek,2009,27(162):499-502.
[3] Gandhi S, Abramov AY. Mechanism of oxidative stress in neurodegneration[J]. Oxid Med Cell Long,2012,2012(3):428010-428010.
[4] Ravikumar B, Duden R, Rubinsztein DC. Aggregate-prone proteins with polyglutamine and polyalanine expansions are degraded by autophagy[J]. Hum Mol Gen,2002,11(9):1107-1117.
[5] Bergamini E.Autophagy: a cell repair mechanism that retards ageing and age-associated diseases and can be intensified pharmacologically[J]. Mol Aspects Med,2006,27(5-6):403-410.
[6] Nakajima H, Fukuda K, Doi Y, et al. Expression of TH1/TH2-related chemokine receptors on peripheral T cells and correlation with clinical disease activity in patients with multiple sclerosis[J]. Eur Neurol,2004,52(3):162-168.
[7] Gonsette RE. Neurodegeneration in multiple sclerosis: the role of oxidative stress and excitotoxicity[J]. J Neurol Sci,2008,274(1-2):48-53.
[8] Miller E, Walczak A, Saluk J, et al. Oxidative modification of patient's plasma proteins and its role in pathogenesis of multiple sclerosis[J]. Clinical Biochemistry, 2012, 45(1-2):26-30.
[9] Qi X, Lewin AS, Sun L, et al. Mitochondrial protein nitration primes neurodegeneration in experimental autoimmune encephalomyelitis[J]. Biol Chem, 2006,281(42):31950-31962.
[10] Dasgupta A, Zheng J, Perrone-Bizzozero NI, et al. Increased carbonylation, protein aggregation and apoptosis in the spinal cord of mice with experimental autoimmune encephalomyelitis[J]. ASN Neuro,2013,5(2):111.
[11] Kiffin R, Bandyopadhyay U, Cuervo AM. Oxidative stress and autophagy[J]. Antioxid Redox Signal,2006,8(1-2):152-162.
[12] He LQ, Lu JH, Yue ZY. Autophagy in ageing and ageing-associated diseases[J]. Acta Pharmacologica Sinica,2013,34(5):605-611.
[13] Divald A,Powell SR. Proteasome mediates removal of proteins oxidized during myocardial ischemia[J]. Free Radic Biol Med, 2006,40(1):156-164.
[14] Kumar S, Patel R, Moore S, et al. Estrogen receptor beta ligand therapy activates PI3K/Akt/mTOR signaling in oligodendrocytes and promotes remyelination in a mouse model of multiple sclerosis[J]. Neurobiol Dis, 2013,56(4):131-144.
Pathological changes of spinal cord neurons in EAE mice with intraperitoneal injection of rapamycin
XIEYang,HUANGYuanshuai,YANGYuan,LIZuoxiao
(TheAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China)
Objective To investigate the pathological changes of spinal cord neurons in experimental autoimmune encephalomyelitis (EAE) mice with intraperitoneal injection of rapamycin and the mechanisms underlying it.Methods C57BL/6 mice were randomly divided into the control group, model group and observation group, 15 mice in each group. In the model group and observation group, we prepared the EAE models. The mice in the observation group were injected with rapamycin 0.75 mg/(kg·d) intraperitoneally and were injected with 0.5 mL of the pertussis bacteria dilution after 2 days and killed after 18 days. Collecting the spinal tissues to observe pathological changes with nissl staining, detecting the content of ROS with DCF chemical fluorescence, the expression of autophagy markers LC3-II/LC3-I and mTOR, Akt proteins in Akt/mTOR signaling pathway with Western blotting. Results Compared with the control group, the nissl bodies had smaller volumes, less number and fuzzy boundaries in spinal cord neurons of mice in the model group. Compared with the model group, the spinal cord neurons were neatly arranged, the number and the volume of the nissl bodies were increased, fuzzy boundaries phenomenons were rare in the observation group. The content of ROS in the control group, model group and observation group were (43.34±2.67), (84.22±3.15) and (64.10±3.59) U/mgprot, respectively. The content of ROS in the model group was higher than that of the control group (P<0.05). The content of ROS in the observation group was higher than that in the control group (P<0.05), which was lower than that in the model group (P<0.05). The autophagy marker LC3-Ⅱ/LC3-Ⅰstrip optical density (OD) values in the spinal cord tissues of three groups were 0.486±0.021, 0.251±0.032 and 0.566±0.054, respectively; the observation group was higher than the model group, and the model group was lower than the control group (all P<0.05). Meanwhile, the OD values of p-Akt and p-mTOR proteins in the model group were higher than those of the control group (bothP<0.05), and the OD values of p-Akt and p-mTOR proteins in the observation group were lower than those of the control group and model group (allP<0.05). Conclusions Intraperitoneal injection of rapamycin reduces the pathological changes of spinal cord neurons in EAE mice. This may be due to the fact that rapamycin inhibits autophagic activity of AKT/mTOR/P70S6 pathway, removes ROS and inhibits oxidative stress.rapamycin can inhibit the mTOR signaling pathways to activate the autophagy activities, and reduce the ROS levels to inhibit the oxidative stress ,thus protecting the spinal cord neurons in EAE mice.
rapamycin; experimental autoimmune encephalomyelitis; cell autophagy; oxidative stress; PI3K-AKT-mTOR signaling pathways
四川省卫生厅科研基金资助项目(120336)。
谢阳(1992-),男,硕士研究生,医师,主要研究方向为神经免疫学。E-mail: 464418617@qq.com
李作孝(1964-),男,硕士,教授,主要研究方向为神经免疫学。E-mail: lzx3235@sina.com
10.3969/j.issn.1002-266X.2017.11.008
R744.5
A
1002-266X(2017)11-0026-04
2016-09-22)
——雷帕霉素

