贝伐单抗联合化疗对铂敏感型复发性卵巢癌的近期疗效及安全性研究*
马丽芳,周 琦,李 蓉
(重庆市肿瘤研究所妇瘤科 400030)
·经验交流·
贝伐单抗联合化疗对铂敏感型复发性卵巢癌的近期疗效及安全性研究*
马丽芳,周 琦,李 蓉△
(重庆市肿瘤研究所妇瘤科 400030)
目的 观察贝伐单抗(BEV)联合紫杉醇及铂类药物化疗对铂敏感型复发性卵巢癌的临床疗效和安全性。方法 50例确诊为铂敏感型复发性卵巢癌的患者,分为观察组与对照组。观察组采用BEV联合紫杉醇+卡铂/顺铂方案化疗者20例,对照组采用紫杉醇+卡铂/顺铂方案化疗者30例。化疗前均常规使用地塞米松及5-羟色胺3(5-HT3)拮抗剂,予以抗过敏及止吐。采用实体瘤疗效评价标准(RECIST)1.0版和糖类抗原125(CA125)、人附睾上皮分泌蛋白4(HE4)两个指标综合评价疗效,按照美国国家癌症研究院(NCI)的常见毒性标准3.0版对BEV联合紫杉醇及铂类药物化疗的不良反应进行分级。结果 观察组近期有效率为60.0%明显高于对照组26.7%,差异有统计学意义(P<0.05)。两组患者不良反应均表现为骨髓抑制、消化道症状、周围神经毒性、脱发及肝肾毒性等,差异无统计学意义(P>0.05)。但观察组1例发生腹痛,2例发生腹泻;对照组患者无明显腹痛、腹泻症状。结论 BEV联合紫杉醇及铂类药物化疗对铂敏感型复发性卵巢癌的疗效肯定,耐受性较好,是值得推荐的可行的治疗方法。
贝伐单抗;联合化疗;复发性卵巢癌;铂敏感型
卵巢癌是妇科常见的恶性肿瘤之一,据2014年WHO最新数据统计,全球卵巢癌的发病率位居妇科恶性肿瘤的第二位,仅次于子宫颈癌,其中75%的患者就诊时已属晚期。国内外的资料显示,长期以来尽管一些新的、有效的化疗药物出现给卵巢癌的治疗带来了一线希望,但其5年生存率并没有多大提高,仍然在30%~40%。英国一项统计数据显示,2003-2007年确诊的卵巢癌患者5年生存率为41%[1]。究其原因,除了早期诊断困难以外,治疗后复发是一个重要的因素。即使已达到临床治愈的患者在停止治疗后仍有70%将在近期或远期出现复发转移[2]。有研究显示,血管内皮生长因子(vascular endothelial growth factor,VEGF)和其他血管生成标志物与卵巢癌的预后有关。VEGF在卵巢癌组织中呈高表达,与卵巢癌的复发转移有着密切的关系。贝伐单抗(bevacizumab,BEV)是一种针对VEGF的重组人源化单克隆抗体,可通过与VEGF结合,抑制血管内皮细胞增殖及新生血管的生成,从而发挥抗肿瘤的作用。研究证实,在卵巢癌模型的研究中BEV有抑制VEGF活性,减缓肿瘤生长、复发及转移的作用[3-4]。目前BEV在联合化疗治疗中的作用已在多种肿瘤中广泛研究,已有GOG-218、ICON7两项研究显示BEV作为一线药物联合紫杉醇和卡铂化疗可以有效改善卵巢癌患者的无进展生存期[5]。而BEV在复发性卵巢癌中的应用效果及安全性报道少见,且大部分集中于铂类耐药复发阶段。本文旨在通过对50例铂敏感型复发性卵巢癌患者采用BEV联合紫杉醇和铂类方案化疗,以观察其临床疗效及安全性,现报道如下。
1 资料与方法
1.1 一般资料 选取本院2013年3月至2015年4月收治的50例铂敏感型复发性卵巢癌患者,年龄32~65岁,平均51.7岁。纳入标准:(1)接受以铂类为基础的一线化疗并已获得临床缓解,经组织病理学证实或影像学提供证据为复发性卵巢癌患者;(2)距前次化疗停止时间间隔为6~12个月;(3)病灶为CT、MRI等影像学检查能够客观测量的实体性肿瘤;(4)预计生存期大于3个月;(5)患者生活质量美国东部肿瘤协作组(ECOG)体力评分均在0~2分;(6)无肿瘤相关出血病史;(7)无严重肝肾功能不全及严重心肺疾病。将其分为观察组20例和对照组30例。两组患者一般资料及基线特征具有可比性,差异无统计学意义(P>0.05)。
1.2 方法 对照组:采用紫杉醇联合卡铂/顺铂一线方案化疗,紫杉醇135~175 mg/m2,卡铂药时曲线下面积(AUC)=5~6或顺铂(DDP)50~60 mg/m2,每3周1次,至少3个周期;化疗前常规使用地塞米松及5-羟色胺3(5-HT3)拮抗剂,前者可预防过敏,后者可止呕,用DDP患者化疗前后予以水化。观察组:在对照组基础上加用BEV(7.5 mg/kg)。治疗期间对患者每天进行血压监测,每周进行血常规监测、肝肾功能检测等,每21天为1个治疗周期,所有患者均至少连续用药3个周期。所有患者用药前均签署知情同意书。
1.3 评价标准
1.3.1 安全性及耐受性 按照美国国家癌症研究院(NCI)的常见毒性标准3.0版对BEV联合含铂药物化疗的不良反应进行分级。在接受BEV联合化疗后的每个周期,患者均接受其毒副反应的评价。用监测血压和心电图检查来判断心血管毒性,用血常规检查来判断血液学毒性,用肝功能检查来判断肝脏毒性,用尿常规和肾功能检查来评判泌尿系统的毒性。毒性分为0~4级。
1.3.2 短期疗效评价 在治疗完成3个周期后进行主观症状评价及CT或MRI检查,采用实体瘤疗效评价标准(RECIST)1.0版和糖类抗原125(CA125)、人附睾上皮分泌蛋白4(HE4)两个指标结合的综合法判断,分为:CR、PR、SD、PD。近期客观总有效率(RR)=CR(%)+PR(%)。
1.4 统计学处理 采用SPSS13.0统计软件包,近期疗效和不良反应评价用χ2检验和Fisher′s精确检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者近期疗效比较 观察组近期有效率明显高于对照组,差异有统计学意义(P<0.05)。见表1。
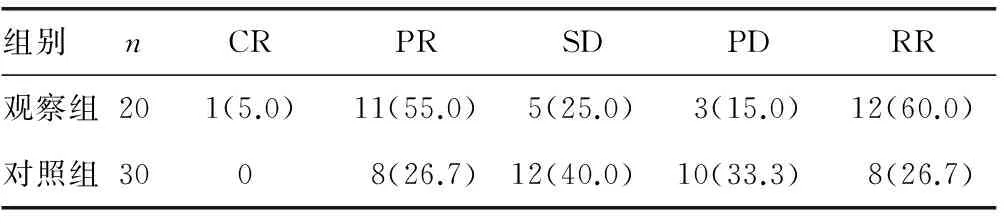
表1 两组患者近期疗效比较[n(%)]
2.2 两组患者不良反应比较 两组患者均未发生化疗相关性死亡,不良反应均表现为骨髓抑制、消化道反应、周围神经毒性、脱发及肝肾毒性等,无严重出血、血栓、肠穿孔、高血压等严重不良反应事件。两组不良反应发生情况比较,差异无统计学意义(P>0.05)。观察组患者中发生1例腹痛,2例腹泻;对照组患者未出现明显腹痛、腹泻症状。见表2。
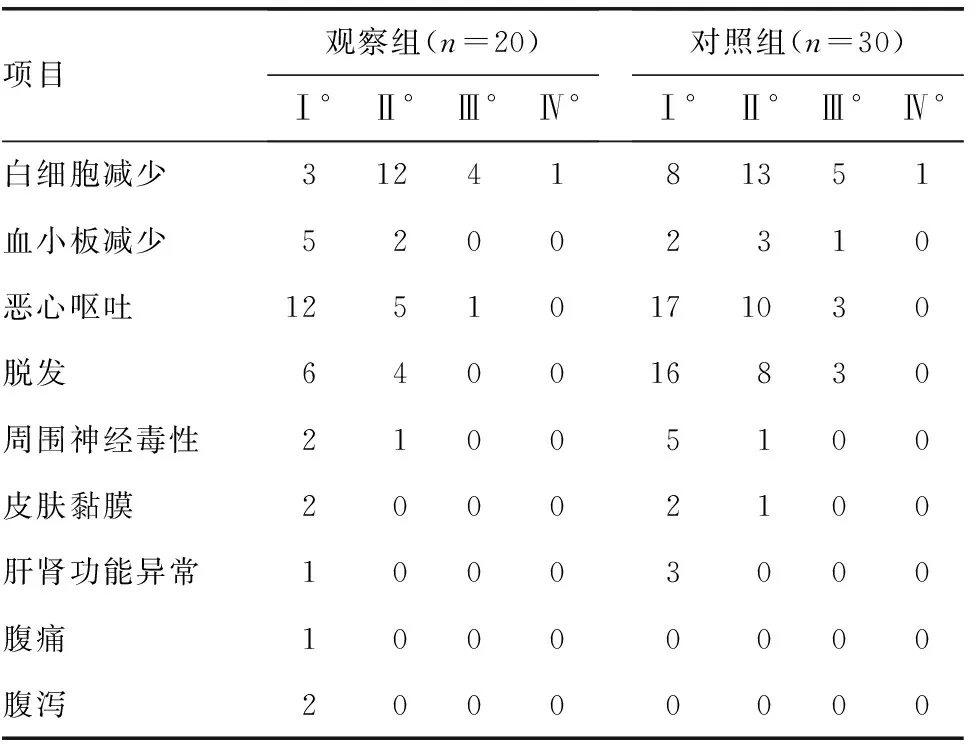
表2 两组患者不良反应情况比较(n)
3 讨 论
对于卵巢癌的治疗,目前虽有多种非铂类化疗药物出现,但总的有效率多低于30%,尤其是复发耐药和难治性卵巢癌的疗效更差。因此,寻求新的、有效的药物已成为妇科肿瘤界的研究热点。美国妇科肿瘤学组(GOG)将停用铂类药物化疗并已达到临床缓解6个月以上出现的复发灶定义为铂敏感型,很多研究显示:无铂间期越长,反应率越高。然而,Markman等[6]的回顾性研究显示,无铂间期为5~12个月的复发卵巢癌患者再次给予铂为基础的化疗,其有效率仅为27%。有学者的研究也显示,无铂间期为6~12个月的部分铂敏感型复发性卵巢癌患者再次给予含铂方案化疗的有效率分别为17%及29%[7-8]。因此对这部分患者如何提高疗效,也是临床工作的难点。随着对卵巢癌发病机制及治疗认识的不断深入,分子靶向治疗已成为卵巢癌治疗领域的研究热点,BEV是通过阻断VEGF与受体结合,来抑制血管内皮细胞的增殖及新生血管的生成,从而抑制肿瘤的生长,以达靶向治疗的目的[9]。此外,BEV还可以促进血管正常化,提高化疗药物在肿瘤组织内的传递,从而起到更有效的抗肿瘤作用[10]。在一系列有关BEV治疗复发性卵巢癌的Ⅱ期临床试验及其作为卵巢癌辅助疗法中的一线治疗药物的Ⅲ期临床试验(包括GOG-218、ICON7研究)已证实,在传统化疗中加用BEV可有效延长卵巢癌患者的无进展生存期和总生存期[11-16]。Richardson等[17]的报道显示,BEV联合健择+顺铂治疗35例复发性卵巢癌的临床有效率达78%,≥80%的患者为铂敏感型。李淑敏等[18]报道显示,BEV与化疗联合治疗18例复发性卵巢癌的总有效率为83.3%。本研究中观察组患者一般情况与对照组患者相比差异无统计学意义(P>0.05),因大部分患者经济条件有限纳入对照组。本研究结果显示,对照组有效率为26.7%,与报道基本相符。观察组近期有效率为60.0%,明显高于对照组患者,差异有统计学意义(P<0.05)。表明BEV联合紫杉醇及铂类药物化疗对无铂间隔为6~12个月的铂敏感型复发性卵巢癌患者的疗效明显优于单纯化疗。本研究较其他研究报道的临床有效率低,可能与使用BEV的周期数较少、例数较少有关,尚有待本研究的后续结果进一步验证。
本研究中BEV相关的不良反应主要为骨髓抑制和胃肠道反应,但两组比较差异无统计学意义(P>0.05)。BEV常见的不良反应如高血压、蛋白尿、出血、血栓及胃肠穿孔等,在本研究中均未见,可能与BEV的给药剂量有关。本研究中所观察到的不良反应均可控制,说明所采用BEV 7.5mg/kg联合紫杉醇及铂类化疗是安全的。观察组患者中1例发生腹痛,2例发生腹泻,症状均不重,经对症处理后很快缓解,未出现肠梗阻、肠穿孔现象。但关于BEV应用时引起胃肠穿孔并发症国外已有学者报道[19]。因此,在采用BEV联合化疗治疗复发性卵巢癌时需密切观察患者症状与体征,尽早发现患者腹痛、腹胀症状,必要时结合影像学检查,以便调整药物剂量,或及时停药。
总之,BEV联合紫杉醇及铂类药物化疗对铂敏感型复发性卵巢癌疗效肯定,耐受性较好,是值得推荐的、可行的治疗方法。但因本研究时间仓促,尚未进行远期疗效及总生存期统计。目前入组患者已死亡9例,其余41例仍在随访、治疗期间。后续研究中,将进一步增加观察组患者例数,并统计入组患者的“无铂间期”、无进展生存期、总生存期等资料。
[1]Ferlay J,Steliarova-Foucher E,Lortet-Tieulent J,et al.Cancer incidence and mortality patterns in Europe:Estimates for 40 countries in 2012[J].Eur J Cancer,2013,49(6):1374-1403.
[2]Rauh-Hain JA,Krivak TC,Del Carmen MG,et al.Ovarian cancer screening and early detection in the general population[J].Rev Obstet Gynecol,2011,4(1):15-21.
[3]Teng LS,Jin KT,He KF.Advances in combination of antiangiogenic agents targeting VEGF-binding and conventional chemotherapy and radiation for cancer treatment[J].J Chin Med Assoc,2010,73(6):281-288.
[4]Monk BJ,Choi DC,Pugmire G,et al.Activity of bevacizumab (rhuM AB VEGF) in advanced refractory epithelial ovarian cancer[J].Gynecol Oncol,2005,96(3):902-905.
[5]Konner JA,Grabon DM,Gerst SR,et al.Phase Ⅱ study of intraperitoneal paclitaxel plus cisplatin and intravenous paclitaxel plus bevacizumab as adjuvant treatment of optimal stage Ⅱ/Ⅲ epithelial ovarian cancer[J].J Clin Oncol,2011,29(35):4662-4668.
[6]Markman M,Rothman R,Hakes T,et al.Second-line platinum therapy in patients with ovarian cancer previously treated with cisplatin[J].J Clin Oncol,1991,9(3):389-393.
[7]Gore ME,Fryatt I,Wiltshaw E,et al.Treatment of relapsed carcinoma of the ovary with cisplatin or carboplatin following initial treatment with these compounds[J].Gynecol Oncol,1990,36(2):207-211.
[8]Blackledge G,Lawton F,Redman C,et al.Response of patients in phase Ⅱ studies of chemotherapy in ovarian cancer:implications for patient treatment and the design of phase Ⅱ trials[J].Brit J Cancer,1989,59(4):650-653.
[9]Jin K,Shen Y,He K,et al.Aflibercept (VEGF Trap):one more double-edged sword of anti-VEGF therapy for cancer[J].Clin Transl Oncol,2010,12(8):526-532.
[10]Randall LM,Monk BJ.Bevacizumab toxicities and their management in ovarian cancer[J].Gynecol Oncol,2010,117(3):497-504.
[11]Santillan A,Montero AJ,Kavanagh JJ,et al.Vulvar Langerhans cell histiocytosis:a case report and review of the lietrature[J].Gyneco1 Oncol,2003,91(1):241-246.
[12]Burger RA,Sill M,Monk BJ,et al.Phase II trial of bevacizumab in persistent or recurrent epithelial ovarian cancer (EOC) or primary peritoneal cancer(PPC):a Gynecologic Oncology Group(GOG) study[J].J Clin Oncol,2005,23(16):457-459.
[13]Garcia AA,Oza AM,Hirte H,et al.Interim report of a phase 1I clinical trial of bevacizumab(Bev)and low dose metronomic oral cyclophosphamide (mCTX ) in recurrent ovarian (OC)and primary peritoneal carcinoma[J].J Clin Oneol,2005,23(16):455-457.
[14]Cannistra SA,Matulonis U,Penson R,et al.Bevacizumab in patients with advanced platinum-resistant ovarian cancer[J].J Clin Oncol,2006,24(18):5006.
[15]Stark D,Nankivell M,Pujade-Lauraine E,et al.Standard chemotherapy with or without bevacizumab in advanced ovarian cancer:quality-of-life outcomes from the International Collaboration on Ovarian Neoplasms (ICON7) phase 3 randomised trial[J].Lancet Oncol,2013,14(3):236-243.
[16]Burger RA,Brady MF,Bookman MA,et al.Incorporation of Bevacizumab in the Primary Treatment of Ovarian Cancer EJ[J].N Engl J Med,2011,365(26):2473-2483.
[17]Richardson DL,Backes FJ,Seamon LG,et al.Combination gemcitabine,platinum,and bevacizumab for the treatment of recurrent ovarian cancer[J].Gynecol Oncol,2008,111(3):461-466.
[18]李淑敏,张蓉,李洪君,等.贝伐单抗与化疗联合治疗复发性卵巢癌18例临床观察[J].中华临床医师杂志,2010,4(3):68-70.
[19]Wright JD,Secord AA,Numnum TM,et al.A multi-institutional evaluation of factors predictive of toxicity and efficacy of bevacizumab for recurrent ovarian cancer[J].Int J Gynecol Cancer,2008,18(3):400-406.
10.3969/j.issn.1671-8348.2017.11.031
重庆市卫生和计划生育委员会基金资助项目(2014-2094)。 作者简介:马丽芳(1981-),主治医师,硕士,主要从事妇科肿瘤外科的研究。△
,E-mail:lsl4b@163.com。
R737.31
B
1671-8348(2017)11-1532-04
2016-11-26
2017-01-23)

