运动诱导骨骼肌PGC-1α亚型的表达及其生物学功能差异研究进展
陈俊飞严翊林家仕许杰孙景权谢敏豪
1北京体育大学运动人体科学学院(北京 100084)
2江苏省体育科学研究所(南京 210033)3集美大学体育学院(厦门 361021)
4成都大学体育学院(成都 610106)5国家体育总局运动医学研究所(北京 100061)
运动诱导骨骼肌PGC-1α亚型的表达及其生物学功能差异研究进展
陈俊飞1,2严翊1林家仕3许杰4孙景权1谢敏豪5
1北京体育大学运动人体科学学院(北京 100084)
2江苏省体育科学研究所(南京 210033)3集美大学体育学院(厦门 361021)
4成都大学体育学院(成都 610106)5国家体育总局运动医学研究所(北京 100061)
过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)具有多种生物学功能,它是当前研究运动促进健康机制的热点之一。近年来发现,运动可以诱导骨骼肌表达不同PGC-1α亚型(包括:FLPGC-1α-a、FL-PGC-1α-b、FL-PGC-1α-c、NT-PGC-1α-a、NT-PGC-1α-b、NT-PGC-1α-c、PGC-1α2和PGC-1α3),并且不同PGC-1α亚型的生物学功能存在一定的差异。探讨不同PGC-1α亚型的生物学功能差异及不同强度、不同方式运动诱导骨骼肌PGC-1α亚型的表达,将有利于明确不同运动产生的不同健康效益的生物学机制,对于个性化运动处方的制定,“运动药丸”治疗靶点的选择具有重要的指导意义。本文综述了PGC-1α亚型的类型、生物学功能,以及不同强度、不同方式运动对骨骼肌PGC-1α亚型表达影响的研究现状。
PGC-1α;FL-PGC-1α;NT-PGC-1α;生物学功能;差异;运动;骨骼肌
过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferators-activated receptor γ coactiva⁃tor-1α,PGC-1α)最初是在棕色脂肪组织中被发现[1],随后发现在骨骼肌、心肌、肝脏、神经、肾脏等代谢旺盛的组织中均能表达PGC-1α。运动诱导骨骼肌产生的PGC-1α是当前研究运动促进健康机制的热点之一[2-4]。
PGC-1α可与多种核受体结合,共同激活下游基因转录[5],促进线粒体生物合成[6,7],脂肪酸氧化[8,9]、氧化磷酸化(OXPHOS)、血管生成[10],肌纤维类型转换[11],肝脏的糖异生[12]等。最新的研究显示,运动可以诱导骨骼肌表达不同的PGC-1α亚型。不同PGC-1α亚型的生物学功能又有哪些差异?不同强度、不同方式运动究竟对骨骼肌PGC-1α亚型表达有何影响?又如何进一步影响骨骼肌的生物学适应?本文将重点对这些问题进行论述。
1 PGC-1α基因、蛋白的亚型和结构
1.1 PGC- 1 α基因和蛋白亚型
PGC-1α属于PGC-1家族,这个家族成员还包括PGC-1β、PRC(PGC-1-related coactivator)。人的PGC-1α基因位于4p15.1,其DNA全长约67 kb,包括12个内含子和13个外显子[13]。小鼠的PGC-1α基因位于5号染色体,蛋白质序列与人类的同源程度为94.7%[14]。
骨骼肌中PGC-1α基因存在两个启动子:PP(proxi⁃mal promoter/canonical promoter)和AP(alternative pro⁃moter)。PP位于起始密码子(ATG)上游约90~119 bp,其上有肌增强因子2(myocyte enhancer factor 2,MEF2)和cAMP反应元件结合蛋白(cAMP response el⁃ement binding protein,CREB)的结合位点。安静状态下,基因转录从PP启动。AP位于PP上游13.7 kb。和人类大部分的多外显子基因一样[15],由于启动子的差异和转录后mRNA的选择性剪切,组织中会表达多种PGC-1α亚型[16]。PGC-1α基因和不同蛋白亚型结构如图1所示。
1.1.1 全长PGC-1α(FL-PGC- 1α)
全长PGC-1α(Full length PGC-1α,FL-PGC-1α),包括FL-PGC-1α-a、FL-PGC-1α-b、FL-PGC-1α-c(或PGC-1α1[9]、PGC-1α2[17]、PGC-1α3[17])3种亚型。各亚型间的不同取决于第一外显子,基因转录从PP启动,表达FL-PGC-1α-a,其蛋白由797AA构成,预测分子量是91 kDa,实际大约是115 kDa[9]。基因转录从AP启动,表达FL-PGC-1α-b或FL-PGC-1α-c,其蛋白分别由793AA、785AA构成。

图1 PGC-1α基因和各亚型蛋白模式图[14]
1.1.2 N端缩短PGC-1α(NT-PGC-1α)
2009年,Zhang等[18]发现PGC-1α基因的第6和第7外显子间存在终止密码子(TAA),最终可以表达一种约270个氨基酸的PGC-1α亚型,分子量预测是30 kDa,实际大约是37 kDa[9,18]。该亚型缺失268-797AA,并将其命名为NT-PGC-1α(N-truncated PGC-1α)。同样,由于第一外显子的不同,共有NT-PGC-1α-a、NT-PGC-1α-b[19,20](PGC-1α4[9])、NT-PGC-1α-c 3种亚型。
除了大鼠由于基因缺失1c(或1b’)段的序列,不表达FL-PGC-1α-c[21]和NT-PGC-1α-c,上述各PGC-1α亚型在小鼠[18,19]、大鼠[21]、人[6,22-24]骨骼肌中均可表达。
1.1.3 a、b、c亚型PGC-1α
由于PGC-1α亚型生物学功能存在差异,本文对a、b、c亚型PGC-1α进行讨论。其中a亚型PGC-1α包括FL-PGC-1α-a和NT-PGC-1α-a,b亚型PGC-1α包括FL-PGC-1α-b和NT-PGC-1α-b,c亚型PGC-1α包括FL-PGC-1α-c和NT-PGC-1α-c。
1.1.4 PGC-1α2和PGC-1α3
另外,Ruas等[9]还从小鼠骨骼肌中克隆出PGC-1α2和PGC-1α3,其蛋白含第1b/1c、2、3、7、8外显子,长度分别为379AA和370AA,预测分子量分别为41.9 kDa和40 kDa。此外,在肝细胞中,还可以表达L-PGC-1α[12];在神经组织中,可以表达B4、B5、B4-8a、B5-NT-7a、B4-3ext、Ex1-8a等PGC-1α亚型[25]。
1.2 PGC-1α亚型蛋白结构
FL-PGC-1α的N端含有转录激活结构域,该结构域具有保守性氨基酸序列,即LXXLL或者LLXXL基序(L为亮氨酸,X为其他氨基酸),可与核受体结合。中间为转录抑制结构域,通过对该区域的共价修饰对PGC-1α的活性发挥调控作用。PGC-1α的C端有一个富含精氨酸/丝氨酸区域(arginine-serine-rich domain,RS)和 RNA结合结构域(RNA recognition motif,RRM)。C端主要参与转录后调节和修饰(其上含GSK3β、AMPK、Akt、p38MAPK、PKA的磷酸化位点,以及精氨酸甲基化和赖氨酸乙酰化位点)[18,26,27]。NTPGC-1α C端缺失PPARγ、SR、RRM、FOXO1、MEF2C、TRAP220结构域,对其功能和稳定性产生一定的影响。鼠FL-PGC-1α蛋白的基本结构如图2所示:
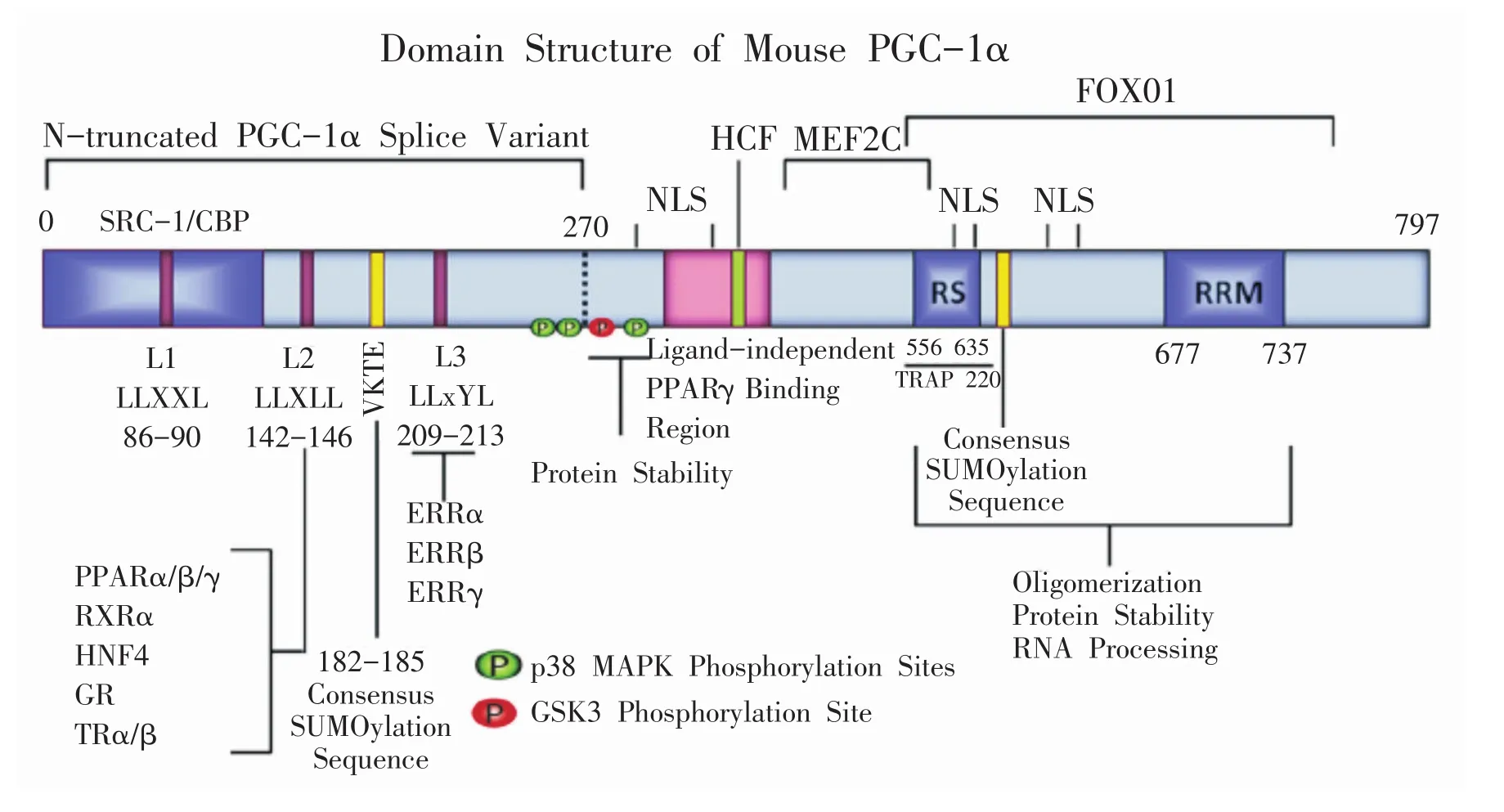
图2 小鼠FL-PGC-1α蛋白结构及结构域示意图[18]
2 PGC-1α各亚型的生物学功能差异
不同PGC-1α亚型的生物学功能有所差异。Ruas等[9]利用基因芯片技术进行研究,发现FL-PGC-1α-a(PGC-1α1)可以活化2002个基因,而NT-PGC-1α-b(PGC-1α4)只活化519个基因,且交叉的基因仅有98个。此外,PGC-1α亚型的磷酸化、甲基化、乙酰化、小泛素样修饰等[13],及其在细胞中的位置和稳定性均可能对骨骼肌的生物适应进一步产生影响。不同PGC-1α亚型转基因鼠在跑步时间和距离上也存在差异[8,9]。通过不同水平、不同层次的研究进一步明确了各亚型间生物学功能的差异。
2.1 FL和NT-PGC-1α的生物学功能差异
2.1.1 FL和NT-PGC-1α在促进线粒体生物合成上的差异
FL-PGC-1α在促进线粒体生物合成、脂肪酸氧化、碳水化合物氧化、血管生成等方面具有重要作用。FLPGC-1α被上游蛋白修饰后,可与核受体结合,调控下游基因转录。它与NRF1、NRF2共同作用,可以诱导线粒体转录因子A(TFAM),B1(TFB1M),B2(TFB2M)基因转录。TFAM和TFB2M进入到线粒体后,促进线粒体DNA的复制。另外,NRF1、NRF2可以调控编码线粒体蛋白的核基因(nuclear genes encoding mitochondri⁃al proteins,NUGEMP)和线粒体DNA基因转录,促进线粒体的生物合成[6]。
PGC-1α可与PPARα和PPARγ共同作用,调控脂肪酸有氧氧化相关基因的转录。Ruas等[9]用腺病毒将FL-PGC-1α-a基因转染到肌管中,发现肉毒碱棕榈酰转移酶1(CPT1)、中链酰基辅酶A脱氢酶(MACD)基因转录水平升高。Tadaishi等[8]通过转FL-PGC-1α-b基因鼠研究发现,脂肪酸代谢相关蛋白基因上调,包括:脂蛋白脂酶(lipoprotein lipase,LPL)、脂肪酸受体(CD36)、脂肪酸转运蛋白1(fatty acid transport pro⁃tein-1,FATP1)、脂肪酸结合蛋白(fatty acid binding protein,FABP)、脂肪酸结合蛋白3(fatty acid binding protein-3,FABP3)、CPT1和MCAD。另外,PGC-1α与雌激素相关受体α(ERRα)结合可促进血管内皮生长因子B(vascular endothelial growth factor B,VEGF-B)的合成,VEGF-B可促进脂肪酸的摄取和利用[28,29]。
PGC-1α与ERRα结合启动糖代谢相关基因转录,Ruas等[9]用腺病毒转染FL-PGC-1α-a基因到肌管中,发现葡萄糖转运载体4(GLUT-4)基因转录上调。而Miura等[30]在转FL-PGC-1α-a基因鼠上发现骨骼肌GLUT-4表达下调。上述研究结果提示a亚型PGC-1α与b、c亚型在糖代谢方面可能存在差异,详见4.2.1。
PGC-1α可以促进呼吸链相关蛋白基因转录。Ruas等[9]用腺病毒转染FL-PGC-1α-a基因到肌管中,发现细胞色素C(CytC)、细胞色素氧化酶Vb(CoxVb)基因上调。Tadaishi等[8]通过对转FL-PGC-1α-b基因鼠研究,发现COX2、COX4基因转录增加。呼吸链蛋白的表达增加有助于提高氧化磷酸化水平。
NT-PGC-1α由于缺失了NRF1、NRF2的结合域,因而其促进线粒体生物合成的功能弱[10]。Wen等[19]的研究中,采用pcDNA3.1为载体,将C2C12细胞转染NT-PGC-1α-a基因,发现NT-PGC-1α-a可以上调ATP合成酶5B(ATP synthase subunit beta,ATP5B)、细胞色素C氧化酶亚基5B(cytochrome c oxidase sub⁃unit 5B,COX5B)、细胞色素C1(cytochrome C iso⁃form 1,Cyc1),并且柠檬酸合成酶(citrate synthase,CS)活性提高,表明其具有促进线粒体生物合成的作用。而Thom等[10]从基因敲除鼠原代培养肌管细胞,并转染NT-PGC-1α-a基因,发现编码线粒体蛋白基因(cycs,cox5b,ATP5a,CS)、线粒体基因(TFAM)转录和复制仅有升高的趋势,但没有显著差异;且ATP合成酶5a(ATP synthase subunit alpha,ATP5a)和细胞色素C氧化酶亚基III(cytochrome c oxidase subunit III,COXIII)蛋白表达情况与mRNA相似。另外,Ruas等[9]在肌管细胞中转染NT-PGC-1α-b(或PGC-1α4),发现CytC、Cox5b、GLUT-4、CPT1b、MACD等基因的表达没有显著性变化,仅PDK4有所升高。因而,NT-PGC-1α在促进线粒体生物合成上的功能较弱。
综上所述,运动促进骨骼肌线粒体生物合成主要依赖FL-PGC-1α发挥作用。小强度运动即可促进骨骼肌线粒体生物合成增加。不同强度运动促进骨骼肌线粒体生物合成时效不同,小强度需要更长的运动时间,大强度运动需要的时间短一些。这些对于指导运动训练和健身锻炼负荷量的推荐具有重要的指导意义。
2.1.2 FL和NT-PGC-1α在促血管生成上的差异
PGC-1α具有促血管生成的作用[17]。它可以直接促进ERRα基因转录,也可与ERRα结合,促进血管内皮生长因子A(VEGFA)基因转录,VEGFA与血管生成密切相关[8,9,31]。Ruas等[9]用腺病毒将FL-PGC-1α-a基因转染到肌管中,发现VEGF、血小板衍生生长因子B亚基(PDGFB)基因转录水平升高。Thom等[10]从基因敲除鼠原代培养肌管细胞,分别转染FL-PGC-1α-a和NT-PGC-1α-a基因,发现均可以使VEGF-A转录增加。另外,该研究中还发现转NT-PGC-1α-b基因小鼠VEGF-A、血管生成素(Angpt2)、血小板-内皮细胞粘附分子(Platelet endothelial cell adhesion molecule-1,PECAM-1/CD31)基因转录也上调,且毛细血管密度是野生鼠的2倍[10]。Tadaishi等[8]的研究同样观察到转FL-PGC-1α-b基因小鼠毛细血管密度增加。
NT-PGC-1α N端的ERRα结合域仍存在,因此也具有促进血管生成的作用,并且有研究证实,NT-PGC-1α比FL-PGC-1α具有更强的促血管生成作用[10]。Thom等[10]从基因敲除鼠原代培养肌管细胞,分别转染FL-PGC-1α-a和NT-PGC-1α-a基因,发现转染FLPGC-1α-a基因的肌管细胞VEGF-A转录增加3~4倍,而转染NT-PGC-1α-a组约是前者的2倍。另外,该研究中还对内皮迁移情况进行了观察,发现转染FLPGC-1α-a基因的肌管细胞,内皮迁移约增加3倍,而转染NT-PGC-1α-a组内皮迁移约增加了15倍。
由上述可知,FL和NT-PGC-1α均具有促进血管生成的生物学作用,其中,NT-PGC-1α具有更强的促血管生成作用,这可能是大强度运动骨骼肌血管适应的重要机制。这些解释了运动强度在运动训练、特定人群(如高血压患者)运动锻炼中的重要作用。
2.1.3 FL和NT-PGC-1α在促肌肉肥大上的差异
FL-PGC-1α通过抑制叉头框蛋白O3(forkhead box O3,FoxO3),减少肌肉分解[32],发挥抗肌肉萎缩的功能。而NT-PGC-1α-b具有肌肉肥大的效应。研究表明其作用机制与诱导胰岛素样生长因子1(insulinlikegrowthfactor1,IGF-1)及其受体(IGFBP2、IBFBP3)基因转录上升,肌肉抑制素(Myostatin,MSTN)及其相关受体(ACVR2A、ACVR2B)基因转录下降,以及卵泡抑素(Follistatin,FSTN)基因转录下调有关[9]。也有研究发现,肌肉肥大主要是通过NT-PGC-1α-b上调GPR56受体(G protein-coupled receptor 56)发挥作用的[33]。当然,也有个别研究对NT-PGC-1α-b的肌肉肥大作用提出了质疑[34]。
此外,Wen等[19]在C2C12细胞上转染了NT-PGC-1α-a基因,同样观察到IGF-1的mRNA表达升高1.5倍,而Myostatin的mRNA表达下降,约为对照组的70%。但NT-PGC-1α-a是否具有肌肉肥大的效应,尚未见研究报道。
综上,FL-PGC-1α具有抵抗肌肉萎缩的功能,而NT-PGC-1α-b具有肌肉肥大的作用,NT-PGC-1α-a是否具有尚不明确。鉴于NT-PGC-1α-b的骨骼肌肥大作用,其对于抗肌萎缩药物开发具有重要的参考意义。
2.1.4 FL和NT--PGC-1α在细胞中位置和稳定性的差异
研究人员对FL和NT-PGC-1α在细胞中位置和蛋白稳定性进行了分析,Shen等[27]采用荧光标记法发现,C2C12肌管中90%的NT-PGC-1α位于肌浆,而FLPGC-1α主要在细胞核中。NT-PGC-1α的分布受PKA调控,激活PKA可以使NT-PGC-1α入核。由于NTPGC-1α的分子量小,它可以直接通过核膜,少部分需要经过核转运蛋白CRM1进入细胞核。而FL-PGC-1α则必须通过CRM1进出核膜。另外,Chang等[26]对PGC-1α不同亚型的稳定性进行了研究,发现NT-PGC-1α具有更长的半衰期,其中FL-PGC-1α降解半衰期时间为0.5小时,而NT-PGC-1α半衰期为7小时。其原因是NT-PGC-1α只有前半段的保守序列,缺失C端泛素连接酶结合的结构域,不易被降解[35,36]。
由上述可知,FL-PGC-1α与NT-PGC-1α在细胞中的位置和蛋白稳定性有所不同,因而可能进一步影响其生物学作用。其中,NT-PGC-1α在急性运动时,通过短时快速募集NT-PGC-1α入核,发挥生物学功能,并且通过更长的作用时间,发挥更为持久的生物学功能。FL-PGC-1α发挥生物学作用的时间较短。
2.2 a和b亚型PGC-1α的生物学功能差异
2.2.1 a和b亚型PGC-1α在糖代谢上的差异
a和b亚型PGC-1α的生物学功能较为一致,但它们在糖代谢上可能存在差异。肌管中转染FL-PGC-1α-a[9]或NT-PGC-1α-a[19]基因均可使GLUT-4 mRNA表达上调。GLUT-4的增加,有助于葡萄糖从胞外转运至胞内。在转FL-PGC-1α-a基因鼠上,也发现糖代谢相关酶的表达上调,如磷酸甘油酸变位酶(PGAM1)[32]。
而在转染NT-PGC-1α-b的肌管细胞中未见GLUT-4表达上调[9]。另外,转FL-PGC-1α-b基因鼠GLUT-4 mRNA表达下调,并且糖原至丙酮酸代谢的相关酶,特别是关键调节酶基因转录均下调,包括糖原分解的糖原磷酸化酶(PYGM)和糖酵解的磷酸果糖激酶(PFKM)、丙酮酸激酶(PKM),且转基因鼠出现在运动中糖原节省,运动后乳酸值低的现象[8]。
丙酮酸脱氢酶激酶4(pyruvate dehydrogenase ki⁃nase isozyme 4,PDK4)是调控糖和脂肪酸代谢的关键酶。当PDK4上升时,可以抑制丙酮酸脱羧酶(pyru⁃vate decarboxylase,PDC)的活性,从而抑制丙酮酸转化成乙酰辅酶A。Attia等[37]研究发现,FL-PGC-1α-a会上调PDK4。而在转FL-PGC-1α-b基因小鼠上,PDK4表达基本不增加[6]。Ruas等[9]的研究中,发现转染FLPGC-1α-a和NT-PGC-1α-b的肌管细胞均可以使PDK4基因转录上调,但幅度有差异。
此外,ERRα是调节糖代谢基因转录的核受体,PGC-1α亚型可能通过ERRα的基因转录影响糖代谢酶的表达。因而,a和b亚型PGC-1α在糖代谢方面可能存在差异,a亚型PGC-1α是否参与大强度运动时糖代谢供能调节?当前的研究均未明确。
2.2.2 a和b亚型PGC-1α在肌纤维类型转换上的差异
a和b亚型PGC-1α在肌纤维类型的转换上存在差异。在转FL-PGC-1α-a基因鼠中,发现肌纤维类型向I型转换[11],其转换的机制与钙调磷酸酶(calcineurin,CaN)去磷酸化活化T细胞核因子(nuclear factor of ac⁃tivated T cells,NFAT)有关,NFAT可促进肌纤维向氧化型转换。转染NT-PGC-1α-a的肌管中,肌球蛋白重链(myosin heavy chain,MHC)I、MHC IIa基因转录增加[19]。而在转FL-PGC-1α-b[8]和NT-PGC-1α-b[9]鼠上,MHC IIa、MHC IIx增加,MHC IIb减少。因而,在探讨PGC-1α对肌纤维类型转换的影响时,需从亚型的角度进行考虑。a亚型PGC-1α是否参与大强度运动时肌纤维类型的转换?以及其它PGC-1α亚型与肌纤维类型转换的机制都有待于后续的研究。
2.3 其它生物学功能差异
另外,Agudelo等[38]发现FL-PGC-1α-a在抗抑郁方面具有一定的作用。其机制是FL-PGC-1α-a使骨骼肌中犬尿氨酸转氨酶(kynurenine aminotransferase,KAT)表达增加,KATs将压力过程中形成的犬尿氨酸(kynurenine)转化为一种无法从血液运输至大脑的犬尿酸(kynurenic acid)。其它亚型是否具有相似的生物学功能,仍有待于研究。
此外,Ruas等[9]发现的PGC-1α2和PGC-1α3,分别可以激活110和69个基因。但未见相关生物学功能研究报道,目前对它们的生物学功能尚不清楚。c亚型PGC-1α从AP启动转录,但其表达量较少,相关的研究罕见,故其生物学功能是否存在差异尚不明确。
3 运动诱导骨骼肌PGC-1α亚型mRNA和蛋白表达
不同强度、不同形式运动均可以诱导骨骼肌表达各种PGC-1α亚型的mRNA和蛋白,且mRNA在运动后最初两小时最明显[21]。
3.1 不同运动强度诱导骨骼肌PGC-1α亚型mRNA和蛋白的表达
运动可以诱导骨骼肌表达PGC-1α,其基因转录主要从AP启动[16]。大强度运动时,也可诱导基因从PP开始转录。Tadaishi等[21]采用6周龄C57BL/6J小鼠进行30分钟不同跑速的跑台运动(10 m/min、20 m/min、30 m/min),发现中小强度运动即可诱导骨骼肌PGC-1α的mRNA表达,且增加的主要是FL-PGC-1α-b,增加的幅度随运动强度增加而增大。高强度运动时,FL-PGC-1α-a的mRNA表达才显著增加。Wen等[19]的研究中,同样观察到上述现象。此外,该研究还发现运动后2小时,NT-PGC-1α各亚型的转录趋势与FL-PGC-1α各亚型较为一致,并且FL-PGC-1α-a和NT-PGC-1αa mRNA也只在大强度运动(30 m/min)后才显著升高(图3)。
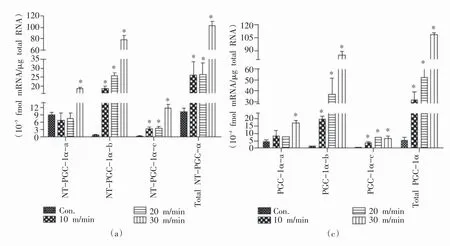
图3 不同强度诱导骨骼肌PGC-1α亚型mRNA表达[19]
运动诱导骨骼肌FL-PGC-1α和NT-PGC-1α mRNA的表达变化较为一致,主要诱导骨骼肌b亚型PGC-1α mRNA的表达。有研究发现,这与运动诱导AP启动子区组蛋白3第4位赖氨酸的三甲基化(tri⁃methylation of histone H3 at lysine 4,H3K4me3)升高有关[16]。蛋白表达情况与mRNA较为一致,耐力运动后FL-PGC-1α-b蛋白表达量最高[39]。此外,a亚型PGC-1α的表达与运动强度密切相关。
3.2 不同运动方式诱导骨骼肌PGC-1α亚型mRNA和蛋白表达的影响
不同运动方式均可诱导骨骼肌PGC-1α基因转录。Popov等[24]采用90 min 62%VO2max功率自行车运动,发现运动可以诱导FL-PGC-1α-b、FL-PGC-1α-c、NT-PGC-1α mRNA表达显著升高。Norrbom等[22]采用45分钟的伸膝练习,发现运动后2小时限制血流腿FLPGC-1α-a和FL-PGC-1α-b mRNA表达均升高,未限制血液腿仅FL-PGC-1α-b mRNA表达升高。Ruas等[9]、Ydfors等[23]和Silvennoinen等[40]就耐力运动和抗阻运动对PGC-1α亚型表达的影响进行了研究,发现耐力运动和抗阻运动均可使FL-PGC-1α(包括FL-PGC-1α-a和FL-PGC-1α-b)和NT-PGC-1α mRNA的表达升高。其中,Silvennoinen等[40]的研究还发现FL-PGC-1α-a mRNA的表达与耐力运动组相关。Ruas等[9]的研究还发现采用耐力+抗阻运动可使总PGC-1α和NTPGC-1b mRNA表达最高。Pugh等[41]采用抗阻+高强度间歇训练,发现运动前后FL-PGC-1α-a、FL-PGC-1αb mRNA变化量均高于单纯抗阻运动组。
综上,不同强度、不同方式运动均可诱导骨骼肌PGC-1α亚型表达,基因转录主要从AP启动,且b、c亚型PGC-1α的表达与运动强度呈剂量关系。其中,a亚型PGC-1α的表达在特定强度运动时才显著升高。但究竟多大的运动强度可以诱导骨骼肌a亚型PGC-1α的表达,尚没有明确的结论。不同强度运动使骨骼肌产生的适应很可能与不同PGC-1α亚型的性质和生物学功能等差异有关。
3.3 运动信号转导通路与PGC-1αmRNA亚型表达
运动可以通过多条信号转导通路诱导骨骼肌PGC-1α基因转录。目前,研究较为明确的有Ca2+/CaM⁃KII-PGC-1α[13,39,42,43]、AMPK-PGC-1α[44]、肾上腺素能受体-PKA-PGC-1α、p38MAPK-PGC-1α等。此外,运动中产生的自由基[45],包括一氧化氮(NO)、活性氧(ROS)、低氧诱导因子1(HIF1)等也可调控PGC-1α基因转录。运动诱导骨骼肌PGC-1α基因转录的信号转导通路如图4所示。
运动中分子信号转导通路与PGC-1α亚型表达密切相关。采用激动剂或抑制剂对信号转导通路上游的蛋白进行研究,明确了PGC-1α亚型蛋白表达与信号通路间的关系。
3.3.1 肾上腺素能受体信号转导通路与 b、c亚型PGC-1α mRNA的表达
运动会使循环中儿茶酚胺水平(包括肾上腺素和去甲肾上腺素)升高。采用肾上腺素能受体(β2AR)的特异性激动剂克伦特罗,可以诱导小鼠骨骼肌中FLPGC-1α-b、FL-PGC-1α-c mRNA的表达升高350倍,但不能诱导FL-PGC-1α-a的表达[6]。同样,NT-PGC-1α-b、NT-PGC-1α-c mRNA的表达也升高[19],而NTPGC-1α-a mRNA表达不升高。在大鼠和细胞水平的研究中[19,21],同样证实了上述观点。因此,运动可以通过肾上腺素能受体信号转导通路诱导骨骼肌b、c亚型PGC-1α mRNA表达。

图4 运动诱导骨骼肌PGC-1α基因转录的信号转导通路图[46]
3.3.2 AMPK信号转导通路与a亚型PGC-1αmRNA的表达
大强度运动时,a亚型PGC-1α的表达与AMPK信号转导通路密切相关[19,21]。Wen等[19]对C57BL/6J小鼠注射AMPK的激动剂5-氨基咪唑-4-甲酰胺核苷酸(AICAR,250 mg/kg BW),发现AICAR可以诱导各亚型PGC-1α的表达。由于AICAR也可使循环血中儿茶酚胺水平升高,采用肾上腺素能受体抑制剂(ICI 118551)预处理后,可以有效抑制b、c亚型mRNA的升高,但FL-PGC-1α-a mRNA表达仍升高[21]。此外,该研究中采用大鼠骨骼肌离体实验(不受儿茶酚胺的影响)进一步证实了AICAR可以诱导骨骼肌FL-PGC-1αa转录增加。如图5所示。另有研究在原代培养的人肌卫星细胞中加入AICAR,使FL-PGC-1α-a mRNA升高,但同时也使FL-PGC-1α-b mRNA的表达升高[22]。
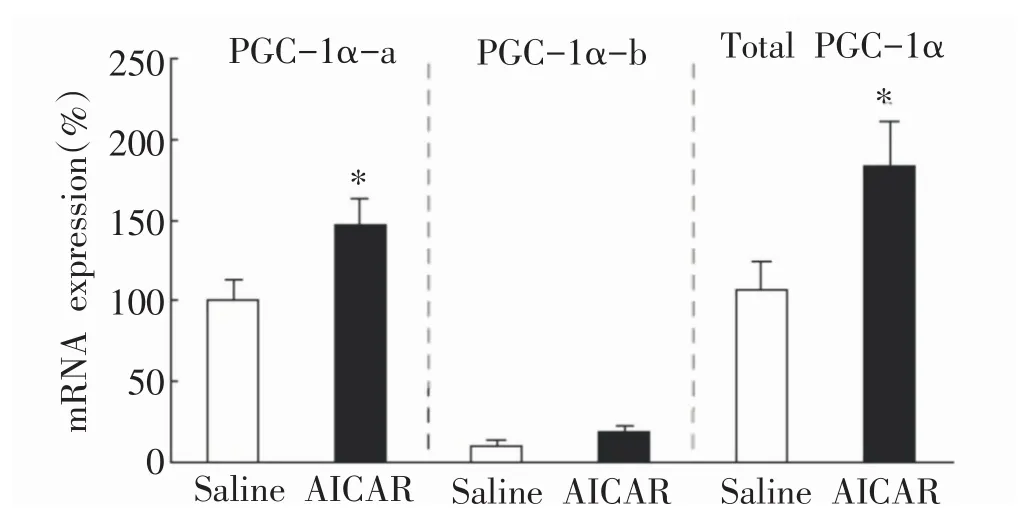
图5 AICAR处理离体骨骼肌细胞后PGC-1α亚型mRNA的表达[21]
这些研究明确了肾上腺素信号转导通路与b、c亚型PGC-1α mRNA,AMPK信号转导通路与a亚型PGC-1α mRNA表达的关系,但其表达的机制尚不清楚,升高的意义也尚未有研究探讨。关于其它分子信号转导通路与PGC-1α亚型表达的关系,因缺少相关的研究,目前尚不明确。了解PGC-1α各亚型与信号转导通路间的关系,对于“运动药丸”的开发和靶点的选择等具有重要的参考意义。
3.4 运动中的分子信号对PGC-1α的修饰及其转录活性的影响
运动中产生的分子信号不仅促进PGC-1α的基因转录,也通过修饰PGC-1α进一步调控蛋白的转录活性。其中,AMPK可以磷酸化PGC-1α Thr-177、Ser-538位点[47],提高PGC-1α的转录活性[13]。p38MAPK可以磷酸化PGC-1α Thr-262、Ser265、Thr-298位点[48],延长PGC-1α降解的半衰期,提高蛋白的稳定性。
沉默信息调节因子1(silent mating type informa⁃tion regulator 1,SIRT1)是一种保守的烟酰腺嘌呤二核苷酸(NAD+)依赖的组蛋白/非组蛋白的去乙酰化酶。运动过程中NAD+含量增加,会使SIRT1活性升高,其可以使PGC-1α去乙酰化,通过去掉蛋白上的赖氨酸残基提高PGC-1α的转录活性[39,49]。PGC-1α有较多的去乙酰化位点,包括Lys77、Lys144、Lys183、Lys253、Lys270、Lys277、Lys320、Lys346、Lys412、Lys441、Lys450、Lys757、Lys776。实验室前期的研究(尚未发表)也发现,不同强度的耐力运动均可使SIRT1蛋白表达升高。因此,SIRT1可能通过修饰PGC-1α调控其转录活性对骨骼肌适应发挥极其重要的作用。
此外,激活cAMP-PKA信号通路15 min即可出现PGC-1α乙酰化水平显著降低,主要是通过SIRT1磷酸化修饰 Ser434,该位点修饰后可迅速增强SIRT1的去乙酰化酶活性,提高其对PGC-1α去乙酰化修饰的能力[50]。PGC-1α修饰位点如图6所示:
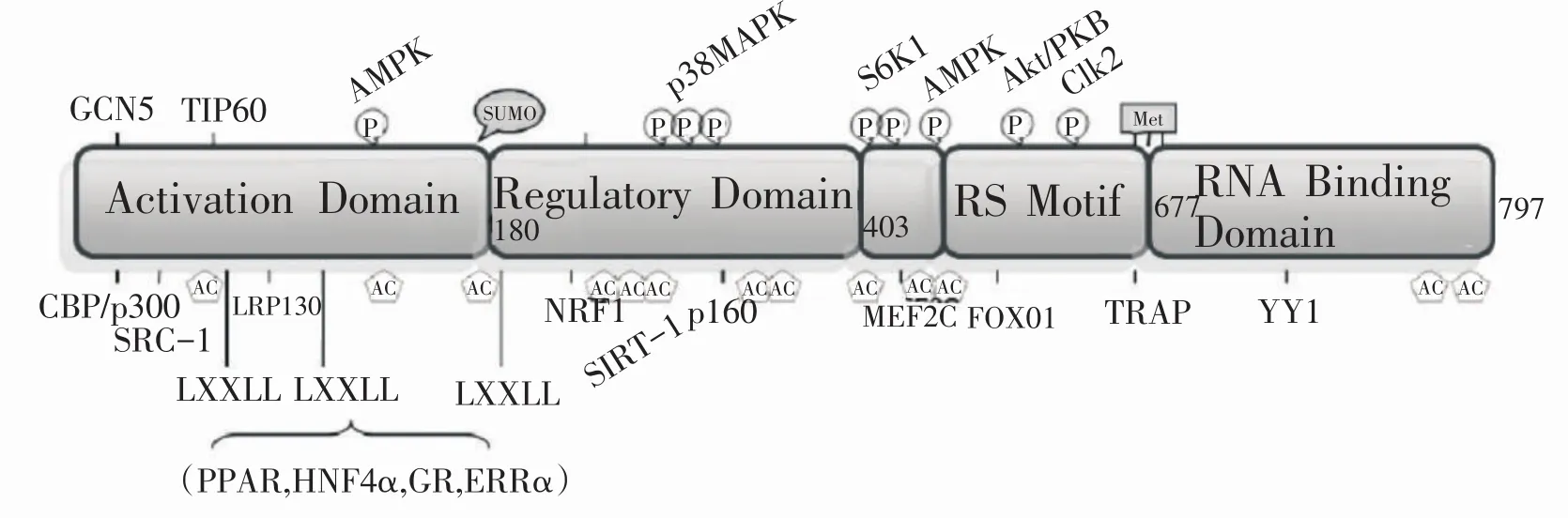
图6 FL-PGC-1α蛋白修饰位点示意图[13]
4 小结与展望
综上所述,不同PGC-1α亚型的生物学功能不同,不同的运动诱导PGC-1α亚型的表达不同,且PGC-1α亚型的表达与运动中信号转导通路密切相关。但不同PGC-1α亚型发挥生物学功能的确切机制尚不明确,引起PGC-1α亚型表达变化的有效运动负荷、运动方式尚不明确,运动影响PGC-1α亚型表达的信号调节机制尚不明确。
鉴于PGC-1α在改善糖尿病、代谢综合征、抗肌萎缩和抑郁等疾病中的潜在作用,运动诱导骨骼肌产生的PGC-1α已成为研究运动促进健康机制的热点之一。我们前期的研究发现运动可以通过影响骨骼肌PGC-1α通路对大鼠的心肺耐力产生影响,但不同运动强度产生的效果不同,其机制尚不清楚。开展运动诱导骨骼肌PGC-1α亚型表达及生物学功能差异的研究,将有利于明确不同运动产生不同健康效益的生物学机制,对于个性化运动处方的制定,“运动药丸”治疗靶点的选择具有重要的指导意义。
[1] Puigserver P,Wu Z,Park CW,et al.A cold-inducible co⁃activator of nuclear receptors linked to adaptive thermo⁃genesis[J].Cell,1998,92(6):829-839.
[2] Rowe GC,Safdar A,Arany Z.Running forward:new fron⁃tiers in endurance exercise Biology[J].Circulation,2014,129(7):798-810.
[3] 宋超,张竞文,薄海,等.PGC-1α参与调节向心运动中骨骼肌白介素6的抗炎效应[J].中国运动医学杂志,2015,34(4):329-333.
[4] 孙婧瑜,漆正堂,丁树哲.FAT/CD36、AMPK和PGC-1α在运动干预高脂饮食性肥胖中的作用机制[J].中国运动医学杂志,2013,32(2):174-178.
[5] Chan MC,Arany Z.The many roles of PGC-1alpha in muscle--recent developments[J].Metabolism,2014,63(4):441-451.
[6] Miura S,Kai Y,Kamei Y,et al.Isoform-specific increas⁃es in murine skeletal muscle peroxisome proliferator-acti⁃vated receptor-gamma coactivator-1alpha(PGC-1alpha)mRNA in response to beta2-adrenergic receptor activa⁃tion and exercise[J].Endocrinology,2008,149(9):4527-4533.
[7] Wu Z,Puigserver P,Andersson U,et al.Mechanisms con⁃trolling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1[J].Cell,1999,98(1):115-124.
[8] Tadaishi M,Miura S,Kai Y,et al.Skeletal muscle-specif⁃ic expression of PGC-1alpha-b,an exercise-responsive isoform,increases exercise capacity and peak oxygen up⁃take[J].PloS one,2011,6(12):e28290.
[9] Ruas JL,White JP,Rao RR,et al.A PGC-1alpha iso⁃form induced by resistance training regulates skeletal muscle hypertrophy[J].Cell,2012,151(6):1319-1331.
[10]Thom R,Rowe GC,Jang C,et al.Hypoxic induction of vascular endothelial growth factor(VEGF)and angiogene⁃sis in muscle by truncated peroxisome proliferator-activat⁃ed receptor gamma coactivator(PGC)-1alpha[J].J Biol Chem,2014,289(13):8810-8817.
[11]Lin J,Wu H,Tarr PT,et al.Transcriptional co-activator PGC-1 alpha drives the formation of slow-twitch muscle fibres[J].Nature,2002,418(6899):797-801.
[12]Felder TK,Soyal SM,Oberkofler H,et al.Characterization of novel peroxisome proliferator-activated receptor gamma coactivator-1alpha(PGC-1alpha)isoform in human liver [J].J Biol Chem,2011,286(50):42923-42936.
[13]闫春雷,黄欣,苏乐群.PGC-1α的转录调节和翻译后修饰[J].中国生物化学与分子生物学报,2015,31(1):12-19.
[14]Martinez-Redondo V,Pettersson AT,Ruas JL.The hitch⁃hiker's guide to PGC-1alpha isoform structure and biolog⁃ical functions[J].Diabetologia,2015,58(9):1969-1977.
[15]Wang ET,Sandberg R,Luo S,et al.Alternative isoform regulation in human tissue transcriptomes[J].Nature,2008,456(7221):470-476.
[16]Lochmann TL,Thomas RR,Bennett JP Jr,et al.Epigene⁃ tic modifications of the PGC-1alpha promoter during ex⁃ercise induced expression in mice[J].PloS one,2015,10(6):e0129647.
[17]Chinsomboon J,Ruas J,Gupta RK,et al.The transcrip⁃tional coactivator PGC-1alpha mediates exercise-induced angiogenesis in skeletal muscle[J].Proc Natl Acad Sci USA,2009,106(50):21401-21406.
[18]Zhang Y,Huypens P,Adamson AW,et al.Alternative mRNA splicing produces a novel biologically active short isoform of PGC-1alpha[J].J Biol Chem,2009,284(47):32813-32826.
[19]Wen X,Wu J,Chang JS,et al.Effect of exercise intensi⁃ty on isoform-specific expressions of NT-PGC-1 alpha mRNA in mouse skeletal muscle[J].BioMed Res Int,2014,2014:402175.
[20]Correia JC,Ferreira DM,Ruas JL.Intercellular:local and systemic actions of skeletal muscle PGC-1s[J].Trends Endocrinol Metab,2015,26(6):305-314.
[21]Tadaishi M,Miura S,Kai Y,et al.Effect of exercise in⁃tensity and AICAR on isoform-specific expressions of murine skeletal muscle PGC-1alpha mRNA:a role of beta(2)-adrenergic receptor activation[J].Am J Physiol Endo⁃crinol Metab,2011,300(2):E341-E349.
[22]Norrbom J,SallstedtEK,FischerH,etal.Alternative splice variant PGC-1alpha-b is strongly induced by exer⁃cise in human skeletal muscle[J].Am J Physiol Endocri⁃nol Metab,2011,301(6):E1092-E1098.
[23]Ydfors M,Fischer H,Mascher H,et al.The truncated splice variants,NT-PGC-1alpha and PGC-1alpha4,in⁃crease with both endurance and resistance exercise in hu⁃man skeletal muscle[J].Physiol Rep,2013,1(6):e00140.
[24]Popov DV,Bachinin AV,Lysenko EA,et al.Exercise-in⁃duced expression of peroxisome proliferator-activated re⁃ceptor gamma coactivator-1alpha isoforms in skeletal mus⁃cle of endurance-trained males[J].J Physiol Sci,2014,64(5):317-323.
[25]Soyal SM,Felder TK,Auer S,et al.A greatly extended PPARGC1A genomic locus encodes several new brainspecific isoforms and influences Huntington disease age of onset[J].Hum Mol Genet,2012,21(15):3461-3473.
[26]Chang JS,Huypens P,Zhang Y,et al.Regulation of NTPGC-1alpha subcellular localization and function by pro⁃tein kinase A-dependent modulation of nuclear export by CRM1[J].J Biol Chem,2010,285(23):18039-18050.
[27]Shen T,Liu Y,Schneider MF.Localization and regulation of the N terminal splice variant of PGC-1alpha in adult skeletalmuscle fibers[J].J Biomed Biotechnol,2012,2012:989263.
[28]Mehlem A,Palombo I,Wang X,et al.PGC-1alpha coordi⁃nates mitochondrial respiratory capacity and muscular fat⁃ty acid uptake via regulation of VEGF-B[J].Diabetes,2016,65:861-873.
[29]Hagberg CE,Falkevall A,Wang X,et al.Vascular endo⁃thelial growth factor B controls endothelial fatty acid up⁃take[J].Nature,2010,464(7290):917-921.
[30]Miura S,Kai Y,Ono M,et al.Overexpression of peroxi⁃some proliferator-activated receptor gamma coactivator-1alpha down-regulates GLUT4 mRNA in skeletal muscles [J].J Biol Chem,2003,278(33):31385-31390.
[31]Igarashi J,Okamoto R,Yamashita T,et al.A key role of PGC-1alpha transcriptional coactivator in production of VEGF by a novel angiogenic agent COA-Cl in cultured human fibroblasts[J].Physiol Rep,2016,4(6):e12742.
[32]Sandri M,Lin J,Handschin C,et al.PGC-1alpha pro⁃tects skeletal muscle from atrophy by suppressing FoxO3 action and atrophy-specific gene transcription[J].Proc Natl Acad Sci USA,2006,103(44):16260-16265.
[33]White JP,Wrann CD,Rao RR,et al.G protein-coupled receptor 56 regulates mechanical overload-induced mus⁃cle hypertrophy[J].Proc Nat1 Acad Sci USA,2014,111(44):15756-15761.
[34]Lundberg TR,Fernandez-Gonzalo R,Norrbom J,et al. Truncated splice variant PGC-1alpha4 is not associated with exercise-induced human muscle hypertrophy[J].Ac⁃ta physiol,2014,212(2):142-151.
[35]Trausch-Azar J,Leone TC,Kelly DP,et al.Ubiquitin pro⁃teasome-dependent degradation of the transcriptional co⁃activator PGC-1{alpha}via the N-terminal pathway[J].J Biol Chem,2010,285(51):40192-40200.
[36]Trausch-Azar JS,Abed M,Orian A,et al.Isoform-specif⁃ic SCF(Fbw7)ubiquitination mediates differential regula⁃tion of PGC-1alpha[J].J Cell Physiol,2015,230(4):842-852.
[37]Attia RR,Connnaughton S,Boone LR,et al.Regulation of pyruvate dehydrogenase kinase 4(PDK4)by thyroid hor⁃mone:role of the peroxisome proliferator-activated recep⁃tor gamma coactivator(PGC-1 alpha)[J].J Biol Chem,2010,285(4):2375-2385.
[38]Agudelo LZ,Femenia T,Orhan F,et al.Skeletal muscle PGC-1alpha1 modulates kynurenine metabolism and medi⁃ates resilience to stress-induced depression[J].Cell,2014,159(1):33-45.
[39]Baar K.Nutrition and the adaptation to endurance train⁃ing[J].Sports Med,2014,44(Suppl 1):S5-S12.
[40]Silvennoinen M,Ahtiainen JP,Hulmi JJ,et al.PGC-1 iso⁃forms and their target genes are expressed differently in human skeletal muscle following resistance and endur⁃ance exercise[J].Physiol Rep,2015,3(10):e12563.
[41]Pugh JK,Faulkner SH,Jackson AP,et al.Acute molecu⁃lar responses to concurrent resistance and high-intensity interval exercise in untrained skeletal muscle[J].Physiol Rep,2015,3(4):e12364.
[42]Wu H,Kanatous SB,Thurmond FA,et al.Regulation of mitochondrial biogenesis in skeletal muscle by CaMK[J]. Science,2002,296(5566):349-352.
[43]Gehlert S,Bloch W,Suhr F.Ca2+-dependent regulations and signaling in skeletal muscle:from electro-mechanical coupling to adaptation[J].Int J Mol Sci,2015,16(1):1066-1095.
[44]Zhang Y,Uguccioni G,Ljubicic V,et al.Multiple signal⁃ing pathways regulate contractile activity-mediated PGC-1alpha gene expression and activity in skeletal muscle cells[J].Physiol Rep,2014,2(5):e12008.
[45]Baldelli S,Lettieri Barbato D,Tatulli G,et al.The role of nNOS and PGC-1alpha in skeletal muscle cells[J].J Cell Sci,2014,127(Pt 22):4813-4820.
[46]Hoppeler H.Molecular networks in skeletal muscle plas⁃ticity[J].J Exp Biol,2016,219(Pt 2):205-213.
[47]Jager S,Handschin C,St-Pierre J,et al.AMP-activated protein kinase(AMPK)action in skeletal muscle via di⁃rect phosphorylation of PGC-1alpha[J].Proc Natl Acad Sci USA,2007,104(29):12017-12022.
[48]Puigserver P,Rhee J,Lin J,et al.Cytokine stimulation of energy expenditure through p38 MAP kinase activation of PPARgamma coactivator-1[J].Mol Cell,2001,8(5):971-982.
[49]Rodgers JT,Lerin C,Haas W,et al.Nutrient control of glucose homeostasis through a complex of PGC-1alpha and SIRT1[J].Nature,2005,434(7029):113-118.
[50]Gerhart-Hines Z,Dominy JE Jr,Blattler SM,et al.The cAMP/PKA pathway rapidly activates SIRT1 to promote fatty acid oxidation independently of changes in NAD+[J]. Mol Cell,2011,44(6):851-863.
2016.07.03
国家自然科学青年基金(31401017);北京体育大学自主科研课题(2016BS039)
第1作者:陈俊飞,Email:dreamfly08@163.com;
:严翊,Email:yanyi22@sina.com

