基因多态性对华法林剂量影响的研究进展
冯频频,彭文星,石秀锦,杜海燕,仇 琪,林 阳(首都医科大学附属北京安贞医院/北京市心肺血管疾病研究所药事部,北京 100029)
基因多态性对华法林剂量影响的研究进展
冯频频*,彭文星,石秀锦,杜海燕,仇 琪,林 阳#(首都医科大学附属北京安贞医院/北京市心肺血管疾病研究所药事部,北京 100029)
目的:了解基因多态性对华法林剂量的影响以及其在临床的应用研究,以期为华法林的精准用药提供参考。方法:查阅近年来国内外相关文献,对华法林基因多态性以及其在临床的应用研究进行归纳和总结。结果与结论:影响华法林剂量的主要基因为细胞色素P450(CYP)2C9和维生素K氧化物还原酶复合体1(VKORC1)。华法林主要由CYP2C9酶完成代谢,与其代谢最密切的突变型为CYP2C9*2和CYP2C9*3。携带CYP2C9*2、CYP2C9*3等位基因的患者比野生型CYP2C9*1/*1患者有更高的过度抗凝和出血风险,提示携带CYP2C9*2、CYP2C9*3等位基因的患者所需华法林的剂量低于野生型CYP2C9*1/*1患者。VKORC1的酶活性直接影响华法林的抗凝效果,VKORC1基因与华法林早期治疗的影响较大。CYP4F2、γ-谷氨酰基羟化酶(GGCX)、载体蛋白E(APOE)、微粒体环氧化物水纤酶编码基因(EPHX1)等基因与华法林的剂量均呈现一定的相关性。华法林基因检测的临床应用主要依据FDA建议的基因多态性与华法林初始剂量对照表和剂量计算公式,但与华法林的给药剂量相关的两项临床研究结果并不一致,检测基因并结合计算公式将华法林应用于临床是否具有意义仍存在争议。
华法林;药物基因组学;剂量;基因多态性
华法林为维生素K拮抗药,是目前临床应用最广的口服抗凝药,其作用于体内维生素K的氧化还原过程,抑制凝血因子的生成以发挥抗凝作用,常用于心房颤动、静脉血栓、肺栓塞和心瓣膜置换术后等抗凝治疗[1]。华法林为一线口服抗凝药,其治疗和预防血栓性疾病的疗效和经济性得到临床广泛认可。近年来,新型口服抗凝药为临床带来了更多抗凝选择[2],但华法林仍是临床抗凝治疗的首选药物。华法林治疗窗窄、个体差异大,临床需根据患者国际标准化比值(INR)调整其剂量,反复检测和长期剂量调整则会影响患者依从性,并可能会造成过度抗凝或抗凝不足[3-4]。华法林个体差异的原因包括遗传因素和非遗传因素(身高、体质量和饮食等),遗传基因多态性是华法林存在个体差异的主要因素。华法林的临床应用若结合患者基因型等个体因素对剂量进行调整,患者的依从性、疗效和预后将得以改善。笔者查阅近年来国内外相关文献,就基因多态性对华法林剂量的影响以及其在临床的应用研究进行归纳和总结,以期为华法林的精准用药提供参考。
1 华法林的代谢与作用机制
1.1 代谢
华法林是S-对映体和R-对映体组成的消旋体,其S-华法林抗凝活性是R-华法林的3~5倍,提供了华法林70%的抗凝活性[5]。R-华法林在体内主要通过细胞色素P450(CYP)超家族中的CYP1A1、CYP1A2、CYP3A4酶代谢,而85%以上的S-华法林由CYP2C9酶代谢[6],代谢产物为无活性的6-羟基华法林或7-羟基华法林。因此,CYP2C9酶的活性可显著影响华法林的抗凝效果。
1.2 作用机制
凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ需经过γ-羧化后才能具有生物活性,而这一过程需要维生素K参与。华法林作用于维生素K代谢中的限速酶——维生素K氧化物还原酶复合体1(VKORC1),抑制维生素K及其2,3-环氧化物(维生素K环氧化物)的相互转化,从而抑制凝血因子活化,达到抗凝效果。因此,VKORC1的活性也直接影响华法林的抗凝效果。
2 基因多态性与华法林剂量的相关性
研究表明,华法林相关基因的单核苷酸多态性(SNPs)与个体所需华法林剂量有关,还可能与抗凝不足或出血等不良反应的发生相关[4,7-8]。影响华法林剂量的主要基因为CYP2C9和VKORC1,其基因多态性能解释10%~45%的患者间的华法林剂量差异[1,9]。
2.1 CYP2C9基因多态性
CYP2C9酶是华法林肝代谢的关键酶,编码CYP2C9基因存在野生型CYP2C9*1和突变型CYP2C9* 2~CYP2C9*13。其中,与华法林代谢最密切的突变型为CYP2C9*2和CYP2C9*3,可解释约5%~22%的患者存在的华法林剂量差异[10-11]。这些基因突变后可改变代谢酶的结构,导致酶活性降低,使华法林代谢能力减弱[10-11]。
CYP2C9*2和CYP2C9*3等位基因在高加索白种人群中突变的频率较高,分别为12%和8%[12]。CYP2C9*2型基因在美洲黑种人群中突变的频率约为2%~4%,在亚洲黄种人群中的突变非常稀少。都丽萍等[13]的研究在纳入研究的411例中国汉族人群中仅检出1例受试者携带CYP2C9*1/*2基因。CYP2C9*3型基因在非洲黑种人群中突变的频率约为1%~2%,在亚洲黄种人群中为1%~6%。
Yang J等[14]的研究分析了22项研究共6 272名患者,发现携带CYP2C9*2、CYP2C9*3等位基因的患者比野生型CYP2C9*1/*1患者有更高的过度抗凝和出血风险,提示携带CYP2C9*2、CYP2C9*3等位基因的患者所需华法林的剂量低于野生型CYP2C9*1/*1患者。Wypasek E等[15]的研究发现,心瓣膜置换术后携带CYP2C9*2或CYP2C9*3等位基因的患者所需华法林剂量更低(21 mg/周vs.35 mg/周,P=0.02),且INR值达标天数占总治疗时间的比例也较低(56%vs.75.4%,P=0.03]。李杰等[16]的研究发现,肺栓塞患者基因预测剂量组调整华法林至稳定剂量需要的时间明显短于对照组,分别为(16.8±1.5)d和(25.6±1.8)d,中位时间分别为(11.0±1.0)d和(20.0±2.0)d,差异有统计学意义(P<0.001)。
2.2 VKORC1基因多态性
VKORC酶是华法林在体内作用的靶点,作为维生素K代谢循环中的限速酶,其编码基因VKORC1的多态性会导致人体对于华法林的抵抗,VKORC1-1639G>A的基因突变与否也与华法林剂量密切相关[17]。Ye C等[18]的研究纳入101名中国汉族受试者,发现VKORC1的等位基因GG、AG、AA的分布频率为1.0%、17.8%、81.2%,而在白种人群中VKORC1的等位基因GG、GA、AA的分布频率为39.8%、40.7%、19.5%,显示出明显的差异。
Aomori T等[19]的研究发现,VKORC1启动子区-1639GG或AG型个体与-1639AA型个体相比,服用华法林维持剂量更高(5 mg vs.3 mg),且达到维持剂量的时间也更长[2周vs.(9.5±5.3)d]。Ye C等[18]的研究还显示,VKORC1-1639 AA基因型的患者用药第4天的INR值较AG基因型患者高[(1.87±0.14)vs.(1.32± 0.15)]高,AA基因型的患者华法林维持剂量较AG基因型患者低[(2.4±0.7)mg/d vs.(4.83±0.7)mg/d]。但是,VKORC1的基因型对华法林剂量的影响主要在初始治疗的第1个月发挥作用,Yang J等[14]的研究就显示VKORC1基因对华法林早期治疗的影响较大。
2.3 其他基因多态性
2.3.1 CYP4F2基因多态性 CYP4F2酶是维生素K1在体内的主要代谢酶,编码CYP4F2基因对华法林给药剂量的影响仅次于VKORC1和CYP2C9基因。Giri AK等[20]的研究发现,CYP4F2*3的突变频率在印度人群中为0.30~0.44,在非裔美国人群中为0.12,在高加索人群中为0.34,在西班牙人群中为0.23,且CYP4F2*3与华法林的剂量相关。Li JH等[21]的研究发现,中国人群中CYP4F2 rs2108622C>T的C等位基因的分布频率为79.5%,T等位基因的分布频率为20.5%;CC型所需华法林剂量比CT型或TT型更低(CC型比TT型需要的华法林剂量低0.56 mg/d,P<0.05)。史长城等[22]的研究针对CYP4F2基因多态性的Meta分析纳入13项研究共2 958例患者,结果发现CYP4F2的3种基因型患者的华法林稳定剂量呈现TT型>CT型>CC型的关系(P<0.001),提示携带CYP4F2突变基因的患者所需华法林的剂量更小。
2.3.2 γ-谷氨酰基羧化酶(GGCX)基因多态性 GGCX基因编码的GGCX酶主要位于粗面内质网和高尔基体,是一种微粒体膜酶,可使凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ的γ-谷氨酸残基发生羧化,成为有活性的凝血因子。因GGCX参与维生素K循环,故其基因多态性可能会影响华法林的抗凝治疗效果。2015年,Sun Y等[23]的研究汇总了21项研究共6 957例患者,结果发现在亚洲人群中GGCX rs11676382C>T CC型的分布频率比高加索人群高(97.7%vs.86.9%,P<0.05),G等位基因携带者(GGCX rs11676382 CG或GGCX rs11676382 GG)比CC型患者所需华法林剂量低27%[95%置信区间(CI)为17%~37%,P<0.01]。但是,仍有研究发现GGCX的基因多态性与华法林剂量无显著相关性[24-25]。
2.3.3 载脂蛋白E(APOE)基因多态性 APOE基因编码的APOE是一种糖蛋白,广泛存在于乳糜微粒、极低密度脂蛋白、低密度脂蛋白和高密度脂蛋白中,通过影响维生素K循环途径对华法林维持剂量产生影响。APOE等位基因主要为ε2、ε3、ε4,亚洲人群的APOE基因型多为ε3/ε3(野生型)。Lal S等[26]的研究发现,不同的APOE基因型患者的华法林日剂量并没有统计学意义的差异。但是,黄胜文等[27]的研究纳入了249例汉族患者,发现ε2组患者的华法林有效维持剂量较ε3组和ε4组略高,但差异无统计学意义(F=1.848,P>0.05)。
2.3.4 微粒体环氧化物水解酶(mEH)编码基因(EPHX1)基因多态性 EPHX1基因编码的mEH可能是维生素K环氧化物还原酶复合体的亚单位[28]。Liu HQ等[29]的Meta分析显示,EPHX1 rs2292566 G>A基因突变与华法林的高剂量呈显著的相关性。Chan SL等[30]的研究发现,SNP rs1877724的突变纯合子组患者比野生纯合子、突变杂合子混合组所需华法林剂量低0.5 mg/d。
3 华法林基因检测的临床应用
3.1 背景
基于华法林在抗凝治疗中的个体化差异,美国食品与药物监督管理局(FDA)于2007年修订的华法林说明书[31]在警示部分标明CYP2C9和VKORC1基因的遗传差异可影响华法林的抗凝作用,建议在使用华法林治疗前进行CYP2C9和VKORC1的基因检测,并于2011年增加了根据基因分型选择华法林初始剂量的对照表[32],详见表1。
3.2 剂量计算公式
许多学者将基因多态性和临床影响因素(年龄、体质量和身高等)相结合,建立基于药物基因组学的华法林剂量计算公式来指导华法林的临床应用[33-34]。这种公式比FDA的剂量对照表更精确,可为患者提供更好的个体化给药服务。其中,国际华法林遗传药理学协会(IWPC)的华法林剂量计算公式[34]得到最为广泛的认可,但其临床应用依然存在争议。
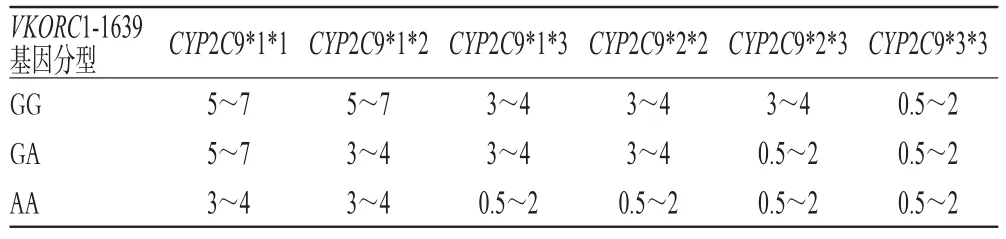
表1 FDA建议的基因多态性与华法林初始剂量对照表(mg/d)
3.3 基于预测剂量的临床研究
美国应用遗传学确定最佳抗凝疗法(COAG)[35]和欧盟遗传药物学和抗凝治疗(EU-PACT)[36]是关于华法林剂量计算公式最新的前瞻性多中心随机临床对照试验。COAG研究和EU-PACT研究的主要终点指标均为INR值在治疗范围内的时间占总时间的比值,基因指导组比临床剂量组的主要指标并没有统计学差异(P>0.05)。COAG研究和EU-PACT研究的内容比较见表2。

表2 COAG研究和EU-PACT研究的内容比较
COAG研究的内容更接近临床实践。两项研究最大的区别为对照组患者华法林的给药剂量:COAG研究并未给予负荷剂量,而EU-PACT研究给予了负荷剂量,这是造成两项研究的结果截然不同的主要原因。因此,检测基因并结合计算公式将华法林应用于临床是否具有意义仍存在争议。
4 结语
综上所述,影响华法林剂量的主要基因为CYP2C9和VKORC1。华法林主要由CYP2C9酶完成代谢,与其代谢最密切的基因突变型为CYP2C9*2和CYP2C9*3。携带CYP2C9*2、CYP2C9*3等位基因的患者比野生型CYP2C9*1/*1患者有更高的过度抗凝和出血风险,提示携带CYP2C9*2、CYP2C9*3等位基因的患者所需华法林的剂量低于野生型CYP2C9*1/*1患者。VKORC1的酶活性直接影响华法林的抗凝效果,VKORC1基因对华法林早期治疗的影响较大。CYP4F2、GGCX、APOE、EPHX1等基因对华法林的剂量均呈现一定的相关性。华法林基因检测的临床应用主要依据FDA建议的基因多态性与华法林初始剂量对照表和剂量计算公式,但与华法林的给药剂量相关的两项临床研究结果并不一致。检测基因并结合计算公式将华法林应用于临床是否具有意义仍存在争议。华法林是药物基因组学研究中的热门药物,但临床研究较少,且多为国外研究。我国的相关研究多为维持剂量的回顾性研究,针对亚洲人群或者汉族人群的负荷剂量、维持剂量的基因型与剂量计算公式的研究较少,且缺乏前瞻性研究的验证,仍需大量的深入研究指导华法林的精准用药。
[1] Jorgensen AL,FitzGerald RJ,Oyee J,et al.Influence of CYP2C9 and VKORC1 on patient response to warfarin:a systemic review and meta-analysis[J].PLoS One,2012,7(7):e44064.
[2] Sattari M,Lowenthal DT.Novel oral anticoagulants in development:dabigatran,rivaroxaban and apixaban[J].Am J Ther,2011,18(4):332-338.
[3] Hylek EM.Complications of oral anticoagulant therapy:bleeding and nonbleeding,rates and risk factors[J].Semin Vasc Med,2003,3(3):271-278.
[4] Wadelius M,Pirmohamed M.Pharmacogenetics of warfarin:current status and future challenges[J].Pharmacogenomics J,2007,7(2):99-111.
[5] Hirsh J,Fuster V,Ansell J,et al.American Heart Association/American College of Cardiology Foundation guide to warfarin therapy[J].J Am Coll Cardiol,2003,41(9):1633-1652.
[6] Redman AR.Implications of cytochrome P4502C9 polymorphism on warfarin metabolism and dosing[J].Pharmacotherapy,2001,21(2):235-242.
[7] Rieder MJ,Reiner AP,Gage BF,et al.Effect of VKORC1 haplotypes on transcriptional transcriptional regulation and warfarin dose[J].N Engl J Med,2005,352(22):2285-2293.
[8] Aithal GP,Day CP,Kesteven PJ,et al.Association of polymorphisms in the cytochrome P450CYP2C9 with warfarin dose requirement and risk of bleeding complications [J].Lancet,1999,353(353):717-719.
[9] Wadelius M,Chen LY,Lindh JD,et al.The largest prospective warfarin-treated cohort supports genetic forecasting[J].Blood,2008,113(4):784-792.
[10] Niinuma Y,Saito T,Takahashi M,et al.Functional characterization of 32 CYP2C9 allelic variants[J].Pharmacogenomics J,2014,14(2):107-114.
[11] Perera MA,Gamazon E,Cavallari LH,et al.The missing association:sequencing-based discovery of novel SNPs in VKORC1 and CYP2C9 that affect warfarin dose in African Americans[J].Clin Pharmacol Ther,2011,89(3):408-415.
[12] Cooper GM,Johnson JA,Langaee TY,et al.A genomewide scan for common genetic variants with a large influ-ence on warfarin maintenance dose[J].Blood,2008,112(4):1022-1027.
[13] 都丽萍,梅丹,刘昌伟,等.CYP2C9及VKORC1基因多态性对华法林剂量和抗凝效果的影响[J].中国药学杂志,2010,45(21):1628-1633.
[14] Yang J,Chen Y,Li X,et al.Influence of CYP2C9 and VKORC1 genotypes on the risk of hemorrhagic complications in warfarin-treated patients:a systematic review and meta-analysis[J].Int J Cardiol,2013,168(4):4234-4243.
[15]Wypasek E,Cieśla M,Suder B,et al.CYP2C9 polymorphism and unstable anticoagulation with warfarin in patients within the first 3 months following heart valve replacement[J].Adv Clin Exp Med,2015,24(4):607-614.
[16] 李杰,刘双,杨京华,等.维生素K环氧化物还原酶复合体亚单位1与细胞色素P450酶2C9基因型肺血栓栓塞患者华法林剂量预测算法的随机对照研究[J].中华结核和呼吸杂志,2013,36(12):950-953.
[17] Limdi NA,Wadelius M,Cavallari L,et al.Warfarin pharmacogenetics:a single VKORC1 polymorphism is predictive of dose across 3 racial groups[J].Blood,2010,115(18):3827-3834.
[18] Ye C,Jin H,Zhang R,et al.Variability of warfarin dose response associated with CYP2C9 and VKORC1 gene polymorphisms in Chinese patients[J].J Int Med Res,2014,42(1):67-76.
[19] Aomori T,Obayashi K,Fujita Y,et al.Influence of CYP2C9 and vitamin K oxide reductase complex(VKORC)1 polymorphisms on time to determine the warfarin maintenance dose[J].Pharmazie,2011,66(3):222-225.
[20] Giri AK,Khan NM,Grover S,et al.Genetic epidemiology of pharmacogenetic variations in CYP2C9,CYP4F2 and VKORC1 genes associated with warfarin dosage in the Indian population[J].Pharmacogenomics,2014,15(10):1337-1354.
[21] Li JH,Ma GG,Zhu SQ,et al.Correlation between single nucleotide polymorphisms in CYP4F2 and warfarin dosing in Chinese valve replacement patient[J].J Cardiothorac Surg,2012,27(7):97.
[22] 史长城,田港,楼江,等.中国人群CYP4F2基因多态性对华法林维持剂量影响的系统评价[J].中国药房,2015,26(27):3803-3805.
[23] Sun Y,Wu Z,Li S,et al.Impact of gamma-glutamyl carboxylase gene polymorphisms on warfarin dose requirement:a systematic review and meta-analysis[J].Thromb Res,2015,135(4):739-747.
[24] Zhong SL,Liu Y,Yu XY,et al.The influence of genetic polymorphisms and interacting drugs on initial response to warfarin in Chinese patientswith heart valvereplacement [J].Eur J Clin Pharmacol,2011,67(6):581-590.
[25] Luxembourg B,Schneider K,Sittinger K,et al.Impact of pharmacokinetic(CYP2C9)and pharmacodynamic(VKORC1,F7,GGCX,CALU,EPHX1)gene variants on the initiation and maintenance phases of phenprocoumon therapy[J].Thromb Haemost,2011,105(1):169-180.
[26] Lal S,Sandanaraj E,Jada SR,et al.Influence of APOE genotypes and VKORC1 haplotypes on warfarin dose requirements in Asian patients[J].Br J Clin Pharmacol,2008,65(2):260-264.
[27] 黄盛文,陈保林,向道康,等.载脂蛋白E基因多态性与华法林维持剂量的相关性[J].中南大学学报(医学版),2011,36(3):212-216.
[28] Loebstein R,Vecsler M,Kurnik D,et al.Common genetic variants ofm icrosomal epoxide hydrolase affect warfarin dose requirements beyond the effect of cytochrome P4502C9[J].Clin Pharmacol Ther,2005,77(5):365-372.
[29] Liu HQ,Zhang CP,Zhang CZ,et al.Influence of two common polymorphisms in the EPHX1 gene on warfarin maintenance dosage:a meta-analysis[J].Biomed Res Int,2015,2015:564149.
[30] Chan SL,Thalamuthu A,Goh BC,et al.Exon sequencing and association analysis of EPHX1 genetic variants with maintenance warfarin dose in a multiethnic Asian population[J].Pharmacogenet Genomics,2011,21(1):35-41.
[31] Finkelman BS,Gage BF,Johnson JA,et al.Genetic warfarin dosing:tables versus algorithms[J].J Am Coll Cardiol,2011,57(5):612-618.
[32] Princeton,NJ:Bristol-Myers Squibb[EB/OL].[2016-04-20].http://www.accessdata.fda.gov/drugsatfda_d-ocs/label/ 2010/009218s108lbl.pdf.
[33] Gong IY,Tirona RG,Schwarz UI,et al.Prospective evaluation of a pharmacogenetics-guided warfarin loading and maintenance dose regimen for initiation of therapy[J]. Blood,2011,118(11):3163-3171.
[34] Gage BF,Eby C,Johnson JA,et al.Use of pharmacogenetic and clinical factors to predict the therapeutic dose of warfarin[J].Clin Pharmacol Ther,2008,84(3):326-331.
[35] Stephen EK,Benjamin F.Pharmacogenetic versus a Clinical Algorithm for Warfarin Dosing[J].New Engl J Med,2013,369(24):2283-2293.
[36] Munir P,Girvan B,Niclas E,et al.A randomized trial of genotype-guided dosing of warfarin[J].New Engl J Med,2013,369(24):2295-2303.
(编辑:陶婷婷)
R969.3
A
1001-0408(2017)11-1581-04
2016-05-05
2016-11-08)
*硕士研究生。研究方向:临床药学。电话:010-64456609。E-mail:fengpinpin19@126.com
#通信作者:主任药师,硕士生导师,博士。研究方向:临床药学。电话:010-64456609。E-mail:linyang3623@163.com
DOI10.6039/j.issn.1001-0408.2017.11.41

