P2X2受体在肝郁脾虚证小鼠模型前额皮质中的表达
刘 燕 丁秀芳 严志祎 李晓娟 刘玥芸 邹小娟 丁凤敏 余 涛 陈家旭,
(1 湖北中医药大学,武汉,430065; 2 河南中医药大学,郑州,450046; 3 北京中医药大学,北京,100029)
P2X2受体在肝郁脾虚证小鼠模型前额皮质中的表达
刘 燕1,2丁秀芳3严志祎3李晓娟3刘玥芸3邹小娟1丁凤敏1余 涛1陈家旭1,3
(1 湖北中医药大学,武汉,430065; 2 河南中医药大学,郑州,450046; 3 北京中医药大学,北京,100029)
目的:研究胞外ATP特异性P2X2受体的表达与肝郁脾虚证发生之间的关系,为深入了解胞外ATP的释放现象与肝郁脾虚证的发生机制之间的关系奠定基础。方法:48只C57BL/6J小鼠随机分为正常组、模型组、逍遥散组和氟西汀组,除正常组外其余各组小鼠均接受复合应激21 d,建立肝郁脾虚证小鼠模型。采用免疫组化、western blot和实时荧光定量PCR方法检测各组小鼠前额皮质P2X2受体蛋白和基因的表达。结果:与正常组比较,模型组小鼠前额皮质P2X2受体蛋白表达显著下降(P<0.05),而P2X2受体mRNA表达差异无统计学意义,但存在一定的下降趋势(P>0.05);与模型组比较,逍遥散组和氟西汀组小鼠前额皮质P2X2受体蛋白表达显著升高(P<0.05),氟西汀组小鼠前额皮质P2X2受体mRNA表达显著升高(P<0.05)。结论:本研究结果表明基于复合应激的肝郁脾虚证小鼠前额皮质P2X2受体的表达存在减少的趋势,其可能是诱导肝郁脾虚证发生的一个重要原因。
P2X2受体;肝郁脾虚证;小鼠模型;前额皮质
肝郁脾虚证指由于肝气郁结,疏泄失司,导致脾胃功能紊乱,出现肝木克脾土的情况,表现为消极、适应能力低下、泄泻、体重降低、饮食减少等[1]。现代生活节奏的加快,工作压力、社会竞争、起居调摄失宜等原因,造成人们心里负荷加重,情志抑郁,气机失于调达,而致肝郁脾虚证成为临床的常见证候。长期以来,中医研究者们一直试图从多系统、多层次、多角度来诠释肝郁脾虚证的实质,挖掘其临床变化的物质基础。
大量研究证实P2X2受体在动物中枢神经系统分布广泛。P2X2受体具有多种生理功能,主要包括神经递质释放、细胞因子和趋化因子表达和释放的调控,介导炎性反应和免疫反应,诱导细胞损伤和凋亡等[2-3]。大量研究证实神经递质异常[4]、免疫反应[5]等均与肝郁脾虚证的发生密切相关。由此,可推测P2X2受体表达异常可能是肝郁脾虚证发生的上游机制。本研究通过检测肝郁脾虚证模型小鼠前额皮质组织中P2X2受体表达水平,并对P2X2在肝郁脾虚证发生中的作用机制进行探讨。
1 材料与方法
1.1 材料
1.1.1 动物 成年C57BL/6J小鼠48只,10周龄,购于北京维通利华实验动物技术有限公司,动物许可证号:NO.11400700088123。饲养于北京中医药大学SPF级动物房,温度(22±2)℃,湿度30%~40%,各组小鼠常规饲养,自由进水。适应性饲养1周后按随机数字表法分为正常组,模型组,逍遥散组和氟西汀组,每组12只,正常组6只一笼,其余3组单笼孤养,除正常组外,其余各组小鼠接受复合应激造模和相应药物灌胃。
1.1.2 药物 《太平惠民和剂局方》逍遥散:北柴胡30 g,当归30 g,炒白术30 g,茯苓30 g,白芍30 g,薄荷10 g,甘草15 g,干姜10 g。逍遥散55剂均购自北京同仁堂(亳州)饮片有限责任公司,并由中日友好医院制剂室精制成逍遥散药粉共3 200 g,用时以蒸馏水稀释至所需浓度。盐酸氟西汀胶囊(Patheon Fance公司,批号:2061A,规格:20 mg/粒)。每周定点测量各组小鼠体重,并调整灌胃浓度。
1.1.3 试剂与仪器 抗P2X2受体兔多克隆抗体(购自Abcam公司,规格:100 μL,批号:ab10266);抗β-Actin鼠单克隆抗体(购自康为世纪公司,规格:20 μL,批号::CW0281);超敏二步法免疫组化检测试剂盒(购自中山金桥公司,规格:18 mL,批号:PV-9001);AMV一步法RT-PCR试剂盒(购自Invitrogen公司,规格:500T,批号:L1500-01)。36012型光学显微镜(OLYMPUS公司);RM2245石蜡切片机(LEICA公司);Powerpac Basi电泳仪(BIO-RAD公司);Tanon-5200型全自动化学发光成像分析系统(Tanon公司);PICO17型台式高速离心机(Thermo公司);1600型凝胶成像系统(Tanon公司);ABI ViiA7 Real Time PCR System(Applied Biosystems)
1.2 方法
1.2.1 模型制备 以复合应激方法建立肝郁脾虚证小鼠模型,采用新环境抑制进食实验、旷场实验、高架十字迷宫实验、血清D木糖检测等方法对肝郁脾虚证小鼠模型进行评价[6]。
1.2.2 标本采集与制备 21 d造模和药物干预结束后,以3%的戊巴比妥钠(40 mg/kg)腹腔注射麻醉小鼠,每组随机选取5只小鼠,以4%的多聚甲醛进行灌流固定,取全脑放入4%多聚甲醛溶液中备用切片,剩余的小鼠直接开颅取前额皮质组织放入冻存管,标记并冻存于-80 ℃备用。
1.2.3 免疫组化检测 免疫组化染色采用二步法。将各组小鼠前额皮皮质置于二甲苯和梯度乙醇中脱蜡和水化后,于枸橼酸盐缓冲液中高压抗原修复10 min,待自然冷却后,滴加3% H2O2灭活内源性过氧化物酶,采用山羊血清工作液4 ℃封闭过夜后,滴加适当稀释的抗P2X2受体多克隆抗体(1∶500)湿盒内4 ℃孵育过夜,其余步骤按照试剂说明书进行操作。以PBS代替一抗做阴性对照。图像采集和分析:CellSens Dimension1.11图像采集系统进行观察和拍照,并采用Court & Measure Full cellSens 1.11系统对图片进行分析,计算阳性细胞数和平均光密度(Optical Density,OD)值。
1.2.4 Western blot检测小鼠前额皮质P2X2受体蛋白表达 细胞裂解法提取小鼠前额皮质总蛋白,BCA法测定总蛋白浓度,SDS-PAGE凝胶电泳,转膜(湿转法),孵育一抗、二抗,ECL化学发光法显色,Tanon-5200型全自动化学发光成像分析系统曝光自动获取蛋白条带图像。用系统自带GIS1D 4.2图像分析软件对图像灰度值进行采集,以相同蛋白样品的灰度值为标准对各孔灰度值进行归一化处理,然后以P2X2受体蛋白灰度值比相应的β-actin灰度值的表示P2X2受体蛋白的相对表达量。
1.2.5 实时荧光定量PCR方法检测肝郁脾虚证小鼠前额皮质P2X2 mRNA的表达 Trizol法提取小鼠前额皮质总RNA,分光光度法测定260 nm与280 nm的OD值,用且RNA纯度为A260/A280比值,范围在1.8~2.1之间。按AMV一步法RT-PCR试剂盒说明进行反转录和荧光定量PCR扩增。每次扩增设置无模板的阴性对照和GAPDH阳性对照,上面实时荧光定量重复3次,得到3次Ct,并算出平均Ct值。引物设计与合成:序列参照Gene Bank数据库中各目的基因的序列,引物由ABI公司的Primer Express Software v2.0设计,由华大基因公司合成(见表1)。SDS软件系统导出数据模块,根据RQ=2-△△Ct方法对P2X2 mRNA的表达进行相对定量分析。公式:△Ct实验组=Ct靶基因-Ct管家基因;△Ct对照组=Ct靶基因-Ct管家基因;△△Ct=△Ct实验组-△Ct对照组。


表1 小鼠P2X2引物序列
2 结果
2.1 小鼠前额皮质P2X2受体蛋白表达情况 免疫组化结果显示:与正常组比较模型组小鼠前额皮质P2X2受体蛋白OD值和阳性细胞数显著降低(P<0.05;P<0.01);与模型组比较逍遥散组小鼠前额皮质P2X2受体蛋白OD值和阳性细胞数显著升高(P<0.01;P<0.05),氟西汀组小鼠前额皮质P2X2受体蛋白OD值著升高(P<0.05)。见表2和图1。

表2 各组小鼠前额皮质P2X2受体蛋白免疫组化OD值及阳性细胞数的统计学描述±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
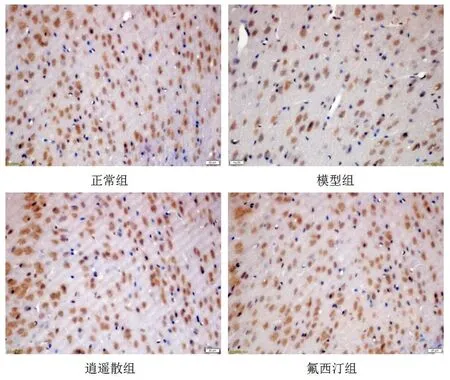
图1 各组小鼠前额皮质PrL区P2X2蛋白表达免疫组化图(400×)
Western Blot检测结果显示:与正常组比较,模型组小鼠前额皮质P2X2受体蛋白表达显著降低(P<0.05);与模型组比较逍遥散组和氟西汀组小鼠前额皮质P2X2受体蛋白表达显著升高(P<0.01,P<0.05)。

表3 各组小鼠前额皮质P2X2受体蛋白表达的统计学描述±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
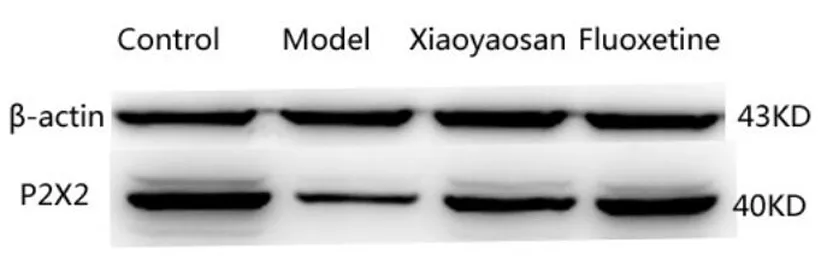
图2 各组小鼠前额皮质P2X2受体蛋白表达
2.2 小鼠前额皮质P2X2受体mRNA表达情况 实时荧光定量PCR检测结果显示:与正常组比较,模型组、逍遥散组和氟西汀组小鼠前额皮质P2X2受体mRNA表达差异无统计学意义(P>0.05);与模型组比较,氟西汀组小鼠前额皮质P2X2受体mRNA表达显著升高(P<0.05)。

表4 各组小鼠前额皮质P2X2受体 mRNA表达的统计学描述±s)
注:与模型组比较,*P<0.05。
3 讨论
在中枢神经系统中,胞外ATP是一种重要的信号转导分子,在细胞外环境中,ATP可以结合到其特异性P2受体上,从而介导各种作用,由于大规模的ATP释放现象一般出现在各类应激、脑缺血、脑损伤之后,由于其具有细胞外营养功能,因此,可以认为细胞外ATP在中枢神经系统中扮演者非常复杂的角色,具有神经系统疾病治疗靶点的潜能[7]。
既往研究显示ATP特异性P2受体在全身多个组织、器官、和系统中均可被检测到。其中P2X2受体在大脑皮质、海马、缰核、下丘脑腹正中核、三叉神经中脑核、迷走神经背核和孤束核等部位均存在大量表达[8]。另外现代医学认为,肝郁脾虚证的病因学基础与情志反应密不可分,神经中枢—丘脑下部—脑干植物神经系统—效应器作为情志反应的作用轴,而前额皮质脑区作为情绪控制、认知、感觉和运动等多级协调体系的高级中枢,其形态和功能的改变均与肝郁脾虚证的发生发展存在着密切的联系[9-10]。因此,本研究基于复合应激肝郁脾虚证小鼠模型对肝郁脾虚证小鼠前额皮质P2X2受体蛋白和基因的表达情况及逍遥散的调节作用进行了观察,以了解胞外ATP特异性P2X2受体的表达与肝郁脾虚证发生之间的关系,为深入了解胞外ATP的释放现象与肝郁脾虚证的发生机制之间的关系奠定基础。
本次研究通过免疫组化和Western blot技术观察到肝郁脾虚证模型小鼠前额皮质P2X2受体蛋白表达较正常组均存在显著减少的现象,而逍遥散和氟西汀2种药物均能显著改善这种现象。另外本次研究通过实时荧光定量PCR技术对肝郁脾虚证小鼠前额皮质P2X2受体mRNA的表达进行了观察,结果显示较正常小鼠,模型组小鼠前额皮质P2X2受体mRNA的表达无显著差异,但存在一定的下降趋势,而逍遥散和氟西汀这2种药物也均有改善这种现象的趋势,体现了2种药物对肝郁脾虚证小鼠的治疗作用。从方证对应角度来看,逍遥散为肝郁脾虚证之代表方剂,其在模型小鼠前额皮质P2X2蛋白和基因表达方面均体现出较好的改善和治疗作用,因此,根据方证对应原理,我们可以判定首先此肝郁脾虚证动物模型的建立是成功的,另外研究结果表明基于复合应激的肝郁脾虚证小鼠前额皮质P2X2受体的表达存在减少的趋势,其可能是诱导肝郁脾虚证发生的一个重要原因,另外P2X2是胞外ATP的特异性受体,胞外ATP的释放与应激有着密切的关系,那么肝郁脾虚证是否还与胞外ATP的含量以及ATP释放机制紊乱有着密切的联系?有待进一步深入研究。
[1]李晓红,李晶晶,刘玥芸,等.从慢性应激探讨肝郁脾虚证的中枢神经生物学机制[J].中西医结合学报,2012,10(1):1-6.
[2]Fountain SJ.Primitive ATP-activated P2X receptors:discovery,function and pharmacology[J].Front Cell Neurosci,2013,7(2):247-249.
[3]Yang Z,Liu X,Yin Y,et al.Involvement of 5-HT(7)receptors in the pathogenesis of temporal lobe epilepsy[J].Eur J Pharmacol,2012,685(1-3):52-58.
[4]敖俪元.肝郁脾虚模型大鼠海马体内单胺类神经递质及其代谢产物的影响[D].北京:北京中医药大学,2011.
[5]赵荣华,谢鸣,李聪,等.肝郁、脾虚和肝郁脾虚证模型大鼠的免疫功能变化[J].北京中医药大学学报,2013,36(12):821-824.
[6]刘燕,邹小娟,丁秀芳,等.基于复合应激的肝郁脾虚证小鼠模型的建立与评价[J].中华中医药杂志,2016,31(5):1840-1844.
[7]Jie Tu,Li-Ping Wang.Therapeutic potential of extracellular ATP and P2 receptors in nervous system diseases[J].Neurosci Bull,2009,25(1):27-32.
[8]Saul A,Hausmann R,Kless A,et al.Heteromeric assembly of P2X receptors as targets for the treatment of status[J].Front Cell Neurosci,2013,7(2):250-270.
[9]夏亮.F2G2对创伤后应激障碍模型大鼠星形胶质细胞和突触可塑性的作用[D].西安:第四军医大学,2013.
[10]Sultana R,Banks WA,Butterfield DA.Decreased levels of PSD95 and two associated proteins and increased levels of bcL-2 and caspase 3 in hippocampus from subjects with amnestic mild cognitive impairment:Insights into their potential roles for loss of synapses and memory,accumulation of Abeta,and neurodegeneration in a prodromal stage of Alzheimer′s disease[J].J Neurosci Res,2010,88(3):469-477.
(2017-02-20收稿 责任编辑:洪志强)
The expression of P2X2 receptor in prefrontal cortex of mice with syndrome of liver depression and spleen deficiency
Liu Yan1,2, Ding Xiufang3, Yan Zhiyi3, Li Xiaojuan3, Liu Yueyun3, Zou Xiaojuan1, Ding Fengmin1, Yu Tao1, Chen Jiaxu1,3
(1HubeiUniversityofChineseMedicine,Wuhan430036,China; 2HenanUniversityofChineseMedicine,Zhengzhou450046,China; 3BeijingUniversityofChineseMedicine,Beijing100029,China)
Objective:To study the relationship between the expression of specific P2X2 receptor of ATP and occurrence of syndrome of liver depression and spleen deficiency, in order to lay the foundation for the study on relationship between the release phenomenon of ATP and occurrence of syndrome of liver depression and spleen deficiency. Methods:A total of 48 C57BL/6J mice were randomly divided into 4 groups as normal group, model group, Xiaoyaosan group, and Fluoxetine group. All the mice, except the normal group, received multiple stresses for 21 days to establish the mice model of syndrome of liver depression and spleen deficiency. Immunohistochemical technique, Western blot, and qPCR were used to test the expression of protein and mRNA of P2X2 receptor in prefrontal cortex of mice. Results:Compared with the normal group, the expression of protein of P2X2 receptor of mice in model group decreased significantly (P<0.05), and the expression of mRNA of P2X2 receptor of mice in model group declined, although it was not significant (P>0.05). Compared with model group, the expression of protein of P2X2 receptor of mice in Xiaoyaosan and Fluoxetine groups increased significantly (P<0.05), and the expression of mRNA of P2X2 receptor of mice in Fluoxetine group also increased (P<0.05). Conclusion:Induced by multiple stresses, the expression of P2X2 receptor in prefrontal cortex of mice with syndrome of liver depression and spleen deficiency tends to be reduced, which might be an important reason of occurrence of syndrome of liver depression and spleen deficiency.
P2X2 receptor; Syndrome of liver depression and spleen deficiency; Mice model; Prefrontal cortex
国家自然科学基金项目(编号:81630104;81473597);北京市自然科学基金项目(编号:7152093)
陈家旭,男,教授,博士研究生导师,北京市朝阳区北三环东路11号北京中医药大学中医学院中医诊断系83号信箱,邮编:100029,Tel:(010)64286656,E-mail:chenjx@bucm.edu.cn
R228
A
10.3969/j.issn.1673-7202.2017.03.008

