肝脏ESWAN与血清铁蛋白定量评价肝纤维化的实验研究
王丹,陈天武,刘启榆,张小明,易光明
肝纤维化是因为肝细胞内存在炎症刺激及坏死时,以胶原纤维为主的细胞外基质合成增多,而过多的细胞外基质沉积于肝内导致肝纤维化的发生[1]。目前肝纤维化治疗指南[2]表明早期肝纤维化是可以逆转的,因此诊断早期肝纤维化尤为重要。而肝穿刺活检由于各种原因致其临床应用受限[3],因此磁共振成像(magnetic resonance imaging,MRI)作为一项无创、并发症少且重复性高的成像方法得到广泛的应用,在诊断肝纤维化中扮演着重要的角色。
重度T2
*加权的三维梯度回波成像序列(enhanced T2star weight angiography,ESWAN)的成像原理是由于组织间存在磁敏感性差异,这种差异多由顺磁性物质引起,如铁、去氧血红蛋白以及部分血液产物等。ESWAN最初用于检测颅内出血灶[4],随着技术的发展逐渐应用于肝脏。肝纤维化过程中,铁与其进展密切相关,铁诱导的氧化应激损伤可以促进肝细胞坏死、肝星状细胞激活,导致肝纤维化发生[5];同时在肝功能受损严重的肝硬化患者中,肝脏内微循环发生改变,导致肝内组织缺氧,引起去氧血红蛋白增加[6],随着肝内铁及去氧血红蛋白的增加,导致局部磁场发生改变,从而使ESWAN成像。
国内研究报道,ESWAN可以间接评估肝内铁含量[7],及ESWAN较磁共振常规序列能更敏感、更准确地检测肝脏铁沉积结节[8],但没有关注肝纤维化各期与ESWAN参数之间的相关性,同时多定性研究幅度值和相位值。因此本研究的目的是探讨T2
*值、幅度值和血清铁蛋白能否用于定量诊断肝纤维化的存在和评估肝纤维化的严重程度及其对比研究。
1 材料与方法
1.1 实验动物及方法
实验新西兰大白兔64只,6~8月龄,体重2.0~3.0 kg,雄性。建模分2批进行,每批共32只,正常组4只,实验组28只,实验组分为4小组,每小组7只。第2批建模较第1批推迟2个月进行,分组方案同第1批。根据Zhang等[9]的方法及采用纯四氯化碳(CCl4)[10]建造兔肝纤维化模型。实验组兔每周2次纯CCL4腹腔注射,剂量为0.1 ml/kg,对照组进行同剂量的、同时间的生理盐水腹腔注射。
1.2 MR检查
造模第 6、8、10及12周随机抽取1只对照组兔和1只实验组兔进行MR检查,使用美国GE Discovery MR750 3.0 T超导型MR机,膝关节线圈。扫描前兔8 h禁食,4 h禁水;使用麻醉机(美国Matrx,VIP3000;麻醉药:异氟烷)对动物进行麻醉。兔取俯卧位固定,用腹带控制动物呼吸动度。扫描完成取出肝脏做病理学检查,由两名高年资的病理学教授对标本进行肝纤维化METAVIR分期。
扫描序列如下:(1) T1LAVA-Flex:TR/TE=5.2/2.0 ms,带宽166.67 KHz,FOV=20 cm×20 cm,矩阵=128×128,层厚3 mm,激励次数1.0;(2) T2WI:TR/TE=3158/104 ms,带宽83.34 KHz,FOV=14 cm×14 cm,矩阵=320×320,层厚4 mm,激励次数2.0;(3) ESWAN:回波数为8个,TR=28.5 ms,TE=3.9~17.5 ms,翻转角为20°,层厚3 mm,无间隔扫描,带宽125 KHz,FOV=16 cm×16 cm,矩阵=256×256。
1.3 MR图像及血清铁蛋白
使用GE Advantage Workstation 4.6工作站测量ESWAN中的T2*值和幅度值。两名放射学医师采用双盲法在图像上勾画出感兴趣区(region of interest,ROI),选取图像质量较佳、肝脏较大的3个层面勾画ROI,每个层面随机勾画3个ROI(图1),每个兔肝脏共9个ROI,每个ROI面积为12~28 mm2。勾画ROI应尽量避开大血管、胆管、伪影等,同时与肝脏边缘保持足够的距离。9个数据的平均值用于统计分析。
两名病理学教授对肝脏标本进行肝纤维化METAVIR分期。抽取2 ml兔动脉血,3000 r/min离心10 min,收集上层血清。按照ELISA试剂盒说明书操作,得到血清铁蛋白浓度。
1.4 统计分析
使用SPSS 13.0统计分析实验数据。P<0.05表示差异有统计学意义。兔肝T2*值和幅度值用x±s表示。
两名放射科医师测量的参数间和第1名医生两次测量参数间的一致性检验均用组间变异系数(coefficient of variation,CV)表示,CV(%)=(s/x)×100[11]。
2 结果
2.1 动物造模结果
64只新西兰大白兔,8只正常对照组,56只构建肝纤维化模型。造模过程中共死亡19只,2只未造模成功(F0期),共造模成功35只。肝脏纤维化分期结果见表1,各期肝纤维化Masson染色见图2。

表1 各分组肝纤维化分期结果Tab.1 Results of stage of METAVIR in each group

表2 肝纤维化各期的ESWAN参数和血清铁蛋白值Tab.2 Parameters of ESWAN and serum ferritin values at various stages of hepatic fi brosis
2.2 T2*值、幅度值和血清铁蛋白与不同肝纤维化分期的关系
各期肝纤维化的T2*值、幅度值及血清铁蛋白见表2、图3。肝纤维化组的T2*值和幅度值均小于正常组,随着肝纤维化的进展,T2*值(r=-0.588,P<0.05)和幅度值(r=-0.388,P<0.05)呈下降的趋势。T2*值能区分正常组分别与F2、F3、F4期(P<0.05),以及F1期分别与F4期、F2~4期(P<0.05);幅度值能鉴别正常组和F4期、F1期和F4期、F1~3期和F4期(P<0.05)。
肝纤维化组血清铁蛋白值较正常组高,随着肝纤维化的进展,血清铁蛋白值呈上升趋势(r=0.409,P<0.05)。血清铁蛋白能区分正常组分别与F3、F4期(P<0.05),同时与T2*值和幅度值均没有相关性。
2.3 观察者间、观察者内差异性分析
两名医师测量的T2*值和幅度值之间的差异性用CV表示,2 w后两名医师分别再次测量数据,并进行观察者内差异性分析。两者CV值超过和低于10%的数据见表3。
2.4 ROC曲线分析
3 讨论
铁在肝纤维化发展过程中非常重要[5]。肝脏是人体铁最主要的代谢和储存器官,肝脏的铁浓度可以反映体内铁浓度,因为血清铁蛋白不能准确评估体内的铁含量[12],因此MRI被应用于测量肝内铁含量[3]。有研究报道,ESWAN可以定性诊断肝脾内铁沉积结节[13-14]。


图1 A~D分别代表正常和F1~F4期肝纤维化的肝脏MR图 图2 A~D分别代表肝纤维化F1~F4期,蓝色区域为肝纤维化(Masson染色,1100倍) 图3 A~C分别表示T2*值、幅度值和血清铁蛋白在各肝纤维化期的分布Fig.1 A—D represents the liver MR map of normal and F1-F4 stage liver fi brosis, respectively. Fig.2 A—D represents hepatic fi brosis stage F1-F4,and blue region is liver fi brosis (Masson staining, ×1100). Fig.3 A—C indicated the distribution of fi brosis stage.
本研究发现,幅度值能区分正常组与F4期、F1期和F4期、F1~3期和F4期。幅度图像对局部磁场的不均匀比较敏感[14]。肝纤维化过程中,肝内铁含量增加,使局部磁场发生改变、局部磁场不均匀,从而使幅度值发生改变,随着肝纤维化程度的加重,铁也愈加增多,因此幅度值呈下降的趋势。但是在正常组分别与F1、F2、F3期纤维化比较中,幅度值差异没有统计学意义,可能是由于差异不明显导致。
本研究发现血清铁蛋白能分别区分正常组与F3、F4期。有研究报道血清铁蛋白的水平能辅助诊断肝纤维化[18]。血清铁蛋白是铁储存的最主要方式,因此铁过载时,组织内和血循环中的血清铁蛋白都将增加[19]。肝脏中铁持续增加导致肝纤维化程度加重,同时血循环中的血清铁蛋白也逐渐增加。因此血清铁蛋白随着肝纤维化程度的加重呈上升趋势;然而血清铁蛋白不能区分正常对照和早期肝纤维化,究其缘由可能是因为早期肝纤维化时,肝脏的代偿能力较强,两者之间差异较小所导致。
通过ROC分析得出,在鉴别正常对照组和F4期肝纤维化中,幅度值和T2*值的AUC均≥0.825,其中T2*值的诊断效能较高。在各期肝纤维化之间比较中,幅度值与T2*值能鉴别F1期和F4期,且AUC均≥0.8,其中幅度值的诊断效能较高;T*2值能鉴别F1期和F2~4期肝纤维化,AUC值为0.74;而幅度值能鉴别F1~3期和F4期纤维化,AUC值为0.822。血清铁蛋白较ESWAN的参数诊断价值稍低,仅能区别正常对照组分别与F3期、F4期肝纤维化,AUC值分别为0.873、0.886。综上所述,T*2值较幅度值与血清铁蛋白的诊断效能高。
本实验有几点不足:(1)本实验未进行相位值分析,有报道相位值可以评估铁含量[20],在将来笔者将进一步进行这方面的研究。(2)本实验不是临床研究而是动物实验。
T2
*值、幅度值及血清铁蛋白能定量诊断肝纤维化以及评估肝纤维化的严重程度,其中T2*值诊断价值较高。
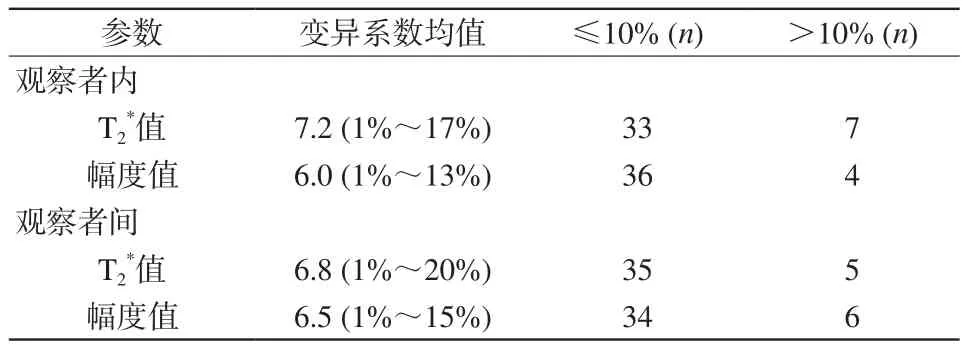
表3 观察者内及观察者间的ESWAN参数的变异系数比较Tab.3 Comparison of interobserver and intraobserver variability of parameters of ESWAN

表4 ESWAN参数值与血清铁蛋白的ROC曲线诊断肝纤维化Tab.4 Parameters of ESWAN and serum ferritin values in stages of fi brosis
参考文献 [References]
[1] Jiang HQ, Zhang XL. Pathogenesis of hepatic fi brosis. World Chin J Diges, 2000, 8(6): 687-689.姜慧卿, 张晓岚. 肝纤维化的发生机制. 世界华人消化杂志, 2000,8(6): 687-689.
[2] Heintges T, Mohr L, Hensel F, et al. Value of liver biopsy prior to interferon therapy for chronic viral hepatitis. Diges Dis & Sci, 1998,43(7): 1562-1565.
[3] Zamani F, Razmjou S, Akhlaghpoor S, et al.imaging of the liver in thalassemic patients in Iran. World J Gastroenterol, 2011, 17(4): 522-525.
[4] Zhang J. ESWAN in the detection of diffuse axonal injury related hemorrhagic lesions and the investigation of imaging parameters.Wuhan: Huazhong University of Science and Technology, 2010.张菁. ESWAN序列对DAI出血灶的检出及其参数研究. 武汉: 华中科技大学, 2010.
[5] Ramm GA, Ruddell RG. Iron homeostasis, hepatocellular injury,and fi brogenesis in hemochromatosis: the role of in fl ammation in a nonin fl ammatory liver disease. Seminars in Liver Dis, 2010, 30(3):271-287.
[6] Haque M, Koktzoglou L, Li W, et a1. Functional MRI of liver using BOLD MRI: effect of glucose. J Magn Reson Imaging, 2010, 32(4):988-991.
[7] Zhu NY, Yan FH, Wang H. Preliminary study on using IDEALQUANT, and ESWAN imaging technique for evaluating iron deposition in liver fibrosis. J Diagn Concepts Pract, 2014, 13(2):146-151.朱乃懿, 严福华, 王鹤. MR IDEAL-QUANT及ESWAN成像技术评估肝纤维化铁质沉积的初步研究. 诊断学理论与实践, 2014,13(2): 146-151.
[8] Ding JR, Pan JL, Mi YC. Application of ESWAN technique in detection siderotic nodules in the cirrhotic liver. J Clin Chin Med Imaging, 2014, 25(9): 664-666.丁建荣, 潘璟琍, 米玉成. ESWAN在检测肝硬化铁沉积结节中的价值. 中国临床医学影像杂志, 2014, 25(9): 664-666.
[9] Zhang L, Duan YY, Yin JK, et al. Grey scale enhancement by a new self-made contrast agent in early cirrhotic stage of rabbit liver. BMC Gastroenterol, 2007, 7(1): 32.
[10] Zeng Y, Zhao JN, Wu W, et al. Establishment of liver fibrosis in rabbit model and quantitative study on hepatic perfusion with dynamic whole liver 3D MR imaging. Chin J Hepatol, 2009, 17(5):350-353.曾燕, 赵建农, 吴伟, 等. 家兔肝纤维化模型的建立及三维全肝动态磁共振灌注成像对纤维化分期的量化价值. 中华肝脏病杂志,2009, 17(5): 350-353.
[11] Data BN. Intraobserver and interobserver variations in liver biopsy interpretation in patients with chronic hepatitis C. Hepatology, 2010,20(1): 15-20.
[12] Anwar M, Wood J, Manwani D, et al. Hepatic iron quanti fi cation on 3 Tesla magnetic resonance (MR): technical challenges and solutions.Radiol Res Pract, 2013, 2013: 628150.
[13] Yuan ZG, Shen Z, Guo LF, et al. Improving detection of sideroticnodules in patients with liver disease using 2D ESWAN technique. Acad Radiol, 2014, 21(8): 971-976.
[14] Ouyang HQ, Gong ZJ, Zha YF, et al. Splenic siderotic nodules in patients with liver cirrhosis. Exp Ther Med, 2013, 6(2): 445-450.[15] Chung YE, Park MS, Kim MS, et al. Quantification of superparamagnetic iron oxide-mediated signal intensity change in patients with liver cirrhosis using T2and T2*mapping: A preliminary report. J Magn Reson Imaging, 2010, 31(6): 1379-1386.
[16] Jin N, Deng J, Chadashvili T, et al. Carbogen gas-challenge BOLD MR imaging in a rat model of diethylnitrosamine-induced liver fi brosis. Radiology, 2010, 254(1): 129-137.
[17] Zhao JY, Li YW, Li L. The role of iron and hepcidin in hepatic fi brosis. Prog Physiol Sci, 2010, 41(3): 183-188.赵晋英, 李艳伟, 李琳. 铁和铁调素在肝纤维化中的作用. 生理科学进展, 2010, 41(3): 183-188.
[18] Manousou P, Kalambokis G, Grillo F, et al. Serum ferritin is a discriminant marker for both fibrosis and inflammation in histologically proven non-alcoholic fatty liver disease patients. Liver Int, 2011, 31(5): 730-739.
[19] Angulo P, George J, Day CP, et al. Serum ferritin levels lack diagnostic accuracy for liver fi brosis in patients with nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol, 2014, 12(7):1163-1169.
[20] Sun LL, Li K, Fu L, et al. Study of phase value from ESWAN in astrocytictumor grading. Chin Comput Med Imag, 2013, 19(2):111-114.孙琳琳, 李克, 付玏, 等. ESWAN序列相位值在星形细胞肿瘤分级中的应用. 中国医学计算机成像杂志, 2013, 19(2):111-114.

