3.0 T磁共振体素内不相干运动成像参数在直肠癌与直肠管状绒毛状腺瘤鉴别诊断中的应用
王灵华,李勇刚
直肠管状绒毛状腺瘤属于直肠腺瘤的一种,包含腺管状结构及绒毛状结构,也叫混合性腺瘤,发生于直肠粘膜上皮,常覆盖有黏液,可出现假癌性浸润,即良性形态的腺体成分出现在粘膜下层,甚至肌层和浆膜下[1]。绝大多数直肠管状绒毛状腺瘤为单发,体积较大,直径大多在1 cm以上,大部分基底较宽,其常规磁共振成像(magnetic resonance imaging,MRI)表现与直肠癌重叠较大,鉴别起来比较困难。体素内不相干运动(intravoxel incoherent motion,IVIM)成像是用于描述体素微观运动的一种成像方法,其双指数模型可以精确描述扩散加权成像(diffusion weighted imaging,DWI)组织信号衰减与b值间的关系,分别获取反映组织扩散和微循环毛细血管灌注效应的参数[2],包括真实扩散系数(D值)、灌注分数(f值)、灌注相关扩散系数(D*值)及表观扩散系数(apparent diffusion coefficient,ADC)。本研究旨在通过比较直肠癌与直肠管状绒毛状腺瘤D、D*、f及ADC值,探讨IVIM对直肠癌与直肠管状绒毛状腺瘤的鉴别诊断价值,为两者的鉴别诊断提供一种新的参考依据。
1 材料与方法
1.1 研究对象
收集2016年6月至2017年6月在苏州大学附属第一医院就诊的直肠病变患者50例,术前均行常规直肠磁共振及IVIM检查,并在检查后1~2 w手术,术后病理证实为直肠癌或直肠管状绒毛状腺瘤。排除标准:①磁共振检查前进行放化疗干预的患者;②因患者移动或其他原因造成MRI图像质量较差的患者;③病灶较小,在IVIM图像上显示不清的患者。最后共纳入41例患者,直肠癌组(30例),其中男性18例,女性12例,中位年龄65岁;管状绒毛状腺瘤组(11例),其中男性6例,女性5例,中位年龄60岁。
1.2 检查方法
1.2.1 检查前准备
所有患者磁共振检查前1~2 h使用一支开塞露,排空直肠内容物,于检查前10 min行250 ml生理盐水(0.9%氯化钠溶液)经肛门保留灌肠。
1.2.2 扫描序列和方法
采用3.0 T MRI扫描仪(MAGNETOM Skyra,Siemens Healthcare,Erlangen,Germany)对患者行MRI检查,检查时先进行矢状位快速自旋回波T2WI扫描,再以矢状位T2WI来定位,行轴位高分辨T2WI及常规轴位T1WI扫描,最后行轴位IVIM扫描,其定位与轴位T2WI保持一致,IVIM扫描采用单次激发平面回波序列,b值分别选取0、50、100、150、200、600、800、1000 s/mm2。扫描参数见表1。
1.3 图像处理及分析
由两名5年以上MRI阅片经验的放射科诊断医师共同阅片,应用第三方软件MITK Diffusion对IVIM图像进行后处理,结合T2WI图像,在肿瘤层面手动勾画感兴趣区(region of interest,ROI),尽量避开肿瘤边缘、囊变及坏死区域,测得真实扩散系数(D)、灌注相关扩散系数(D*)及灌注分数(f),ADC值在b=1000 s/mm2时的ADC图上测量,所有参数均测量3次取平均值。
1.4 统计学分析
采用SPSS 21.0统计分析软件对数据进行处理,所有计量资料均先验证正态性及方差齐性,以均数±标准差(x±s)表示。两名医师测量结果的组内一致性采用Kappa检验,Kappa<0.4,说明一致程度不够理想,Kappa≥0.75,说明取得相当满意的一致程度,Kappa越大,说明一致性越好。采用独立样本t检验比较两组的D、D*、f及ADC值,采用受试者工作特性曲线(receive operating characteristic curve,ROC曲线)分析D、D*、f及ADC值对管状绒毛状腺瘤与直肠癌的鉴别诊断效能。P<0.05为差异有统计学意义。
2 结果
2.1 两组病例的MRI表现
直肠癌患者的MRI表现为肠壁局限性结节状、环形、半环形增厚,肠腔不规则狭窄,在T2WI序列上呈稍高信号,DWI呈高信号,ADC图上呈均匀低信号。直肠癌癌肿IVIM序列各参数伪彩图上,红色代表参数值较高,蓝色代表参数值较低(见图1)。直肠管状绒毛状腺瘤轴位T1WI和T2WI可见由肠壁突向肠腔的软组织肿块,边缘尚光滑,呈等T1、等或稍高T2信号,DWI上呈高信号,ADC图上肿块呈不均匀低信号(见图2)。
2.2 两组IVIM定量参数比较
两名医师分别测量两组的f、D、D*及ADC值,Kappa检验示两名医师测量的结果均具有较好的一致性(表2),各组参数均呈正态分布且满足方差齐性。独立样本t检验分析显示直肠癌组D值、ADC值低于直肠管状绒毛状腺瘤组,且差异均有统计学意义(P<0.05)。D*值的平均值高于直肠管状绒毛状腺瘤组,但差异无统计学意义(P>0.05)。两组间f值差异无统计学意义(P>0.05),具体参数比较见表2。
2.3 ROC曲线分析结果
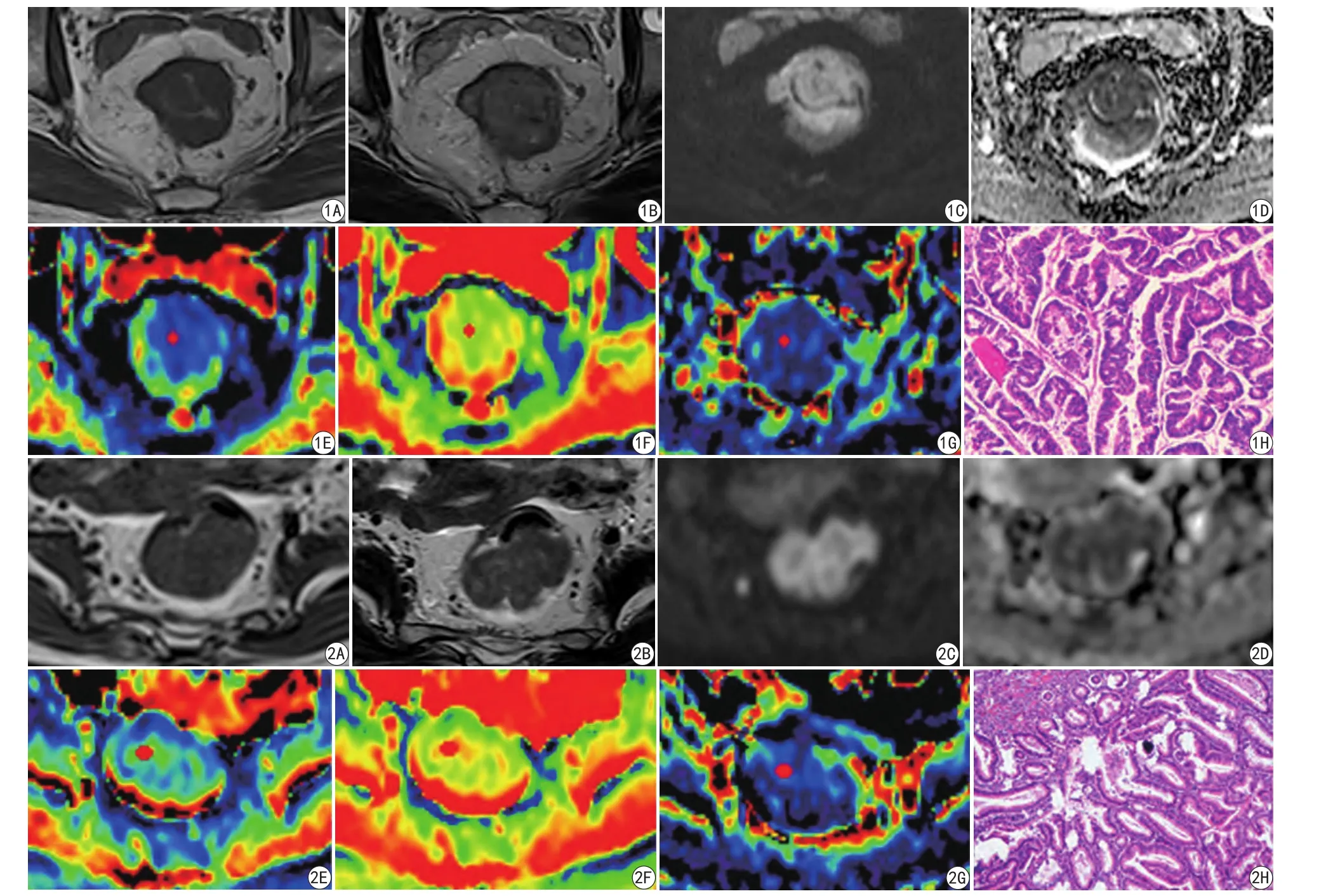
图1 男性,61岁,直肠癌患者。A为轴位T1WI序列,显示直肠肠壁不规则增厚,形成肿块,呈等信号;B为轴位T2WI序列,肿块呈等及稍高信号;C为DWI图,肿块呈明显高信号;D为ADC图,肿块呈低信号;E~G分别为IVIM序列D、D*及f参数伪彩图(红色代表参数值较高,蓝色代表参数值较低);H为术后病理图,证实为直肠中分化腺癌 图2 女性,52岁,直肠管状绒毛状腺瘤患者。A、B分别为轴位T1WI、轴位T2WI序列,显示由直肠壁突向肠腔的软组织肿块,呈等T1、等T2信号;C为DWI图,肿块呈明显高信号;D为ADC图,肿块呈不均匀低信号;E~G分别为IVIM序列D、D*及f参数伪彩图(红色代表参数值较高,蓝色代表参数值较低);H为术后病理图,证实为直肠管状绒毛状腺瘤Fig.1 Male, sixty-one-year-old, patient with rectal cancer. A was the axial T1-weighted imaging sequence, showing irregular rectal intestinal wall thickening, the formation of mass, was the equal signal; B was the axial T2-weighted imaging sequence, the tumor was equal and slightly higher signal;C was the DWI map, the tumor was signi fi cantly high signal; D was the ADC diagram, the tumor was low signal; E—G were IVIM sequence D, D* and f parameters pseudo-color map (red on behalf of the higher value of the parameters, blue represents the lower value); H was postoperative pathology,con fi rmed as the differentiation adenocarcinoma of rectal. Fig.2 Female, fi fty-two-year-old, patient with rectal tubulovillous adenoma. A and B were axial T1-weighted imaging and T2-weighted imaging sequence, showing the soft tissue mass of the rectal wall protruding into the intestine, all were equal signal;C was the DWI map, the tumor was signi fi cantly high signal; D was the ADC diagram, the tumor was uneven low signal; E—G were IVIM sequence D, D*and f parameters pseudo-color map (red on behalf of the higher value of the parameters, blue represents the lower value); H was postoperative pathology,con fi rmed as rectal tubulovillous adenoma.
鉴别诊断直肠管状绒毛状腺瘤与直肠癌时,ADC的曲线下面积为0.783,D值曲线下面积为0.842;以ADC<1.026×10-3mm2/s作为诊断直肠癌的阈值时,其敏感性和特异性分别为81.8%、70%;以D值<0.788×10-3mm2/s作为诊断直肠癌的阈值时,其敏感性和特异性分别为87.9%、71.1%,见图3。
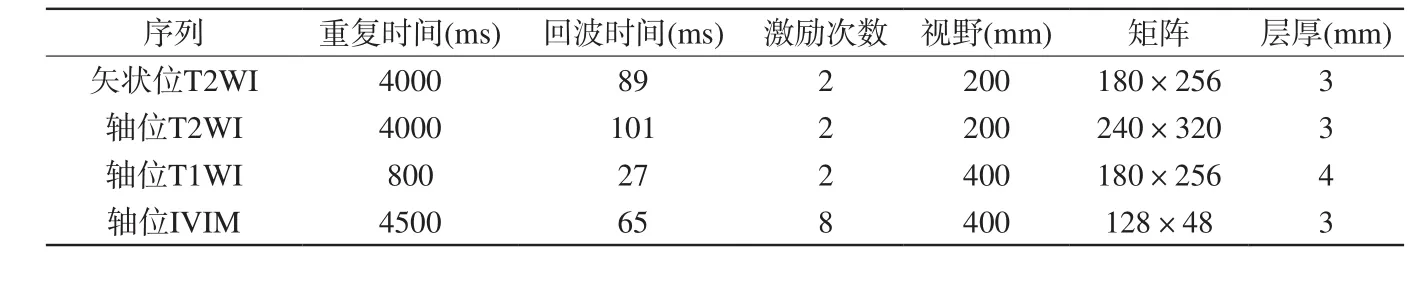
表1 矢状位T2WI、轴位T2WI、轴位T1WI及IVIM序列扫描参数Tab.1 Sagittal T2WI, axial T2WI, axial T1WI and IVIM sequence scan parameters
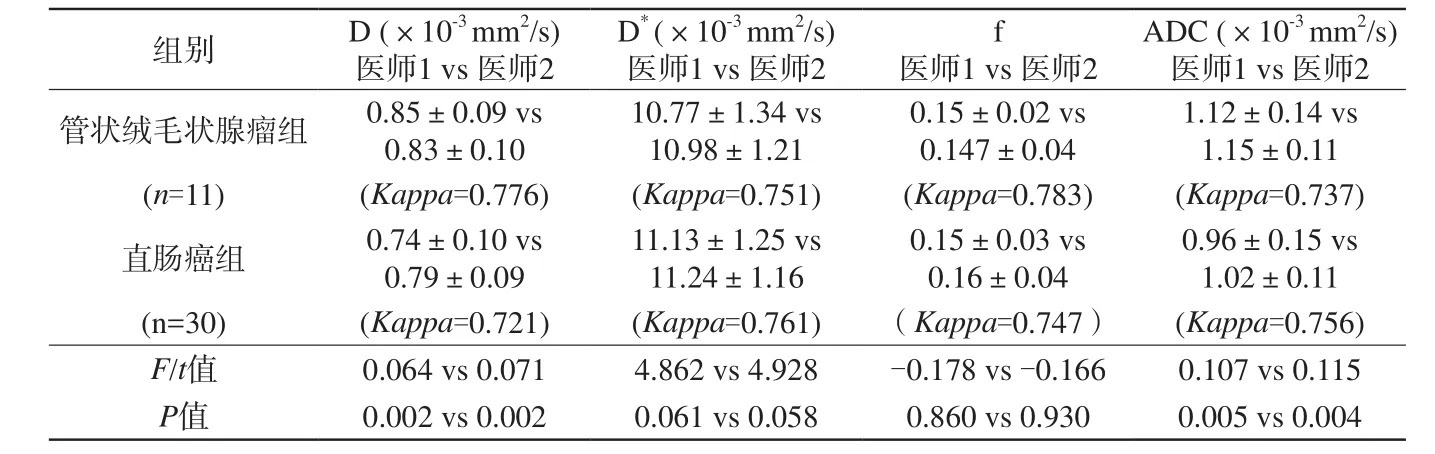
表2 直肠癌组与直肠管状绒毛状腺瘤组IVIM参数值比较(x±s)Tab. 2 Comparison of IVIM parameters between rectal cancer and rectal tubulovillous(x±s)
3 讨论
3.1 IVIM的基本原理与应用
DWI反映的是人体组织内水分子随机布朗运动的特点,进而间接反映组织内微观结构的变化及特点[3]。然而活体组织中不仅有水分子的扩散,还受微循环毛细血管灌注的影响。Le等[2,4]在20世纪80年代提出了IVIM成像的概念,它是一种非有创性技术,可以同时获得活体组织内真实水分子扩散运动和组织微循环灌注信息。IVIM序列采用双指数模型,运用多个b值进行扩散信号的采样,通过非线性最小二乘法整合得出真实扩散系数(D)、灌注相关扩散系数(D*)及灌注分数(f)。D值可以相对较为真实地反映组织血管外的自旋和细胞间液的运动,即能够反映组织内真实水分子的扩散[5];D*反映的是血管内水(即血液中掺杂的水)的运动,这种水随血液一起快速运动,故称为假扩散运动,即反映组织的微循环灌注特性;f反映D和D*两者之间的权重,即在体素中毛细血管容积占整个组织容积的比值,大小介于0~1 之间。IVIM最早应用于中枢神经系统,随着影像技术的发展,IVIM逐渐开始应用于腹部[6],比如Leng等[7]应用IVIM鉴别前列腺癌与前列腺增生,Chao等[8]使用IVIM评估胰腺癌的侵袭性以及各参数与预后的关系,还有研究表明IVIM在宫颈癌肿瘤异质性评估上具有一定的价值[9]。国内外关于IVIM在直肠癌方面的研究也越来越广泛,并取得了一系列成果[10-13]。
3.2 IVIM定量参数及ADC值对直肠癌与直肠管状绒毛状腺瘤鉴别的意义
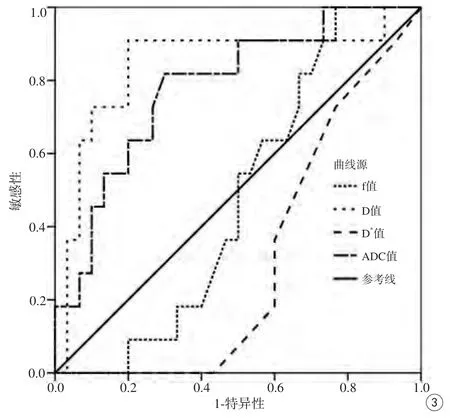
图3 IVIM鉴别诊断直肠管状绒毛状腺瘤与直肠癌各参数ROC曲线Fig.3 IVIM parameters ROC curve for differential diagnosis of rectal tubulo villous adenoma and rectal cancer.
本研究发现直肠癌组D值低于管状绒毛状腺瘤组,且差异有统计学意义。这可能是因为与腺瘤相比,直肠腺癌细胞增殖活跃,细胞核增大,核浆比例增高,癌细胞增多且排列紧密,微血管密度增高,使细胞内外间隙均较正常细胞减小,导致肿瘤组织内水分子扩散受限,从而引起D值减低。D*与毛细血管灌注相关,受血流速度和毛细血管几何形态影响,本研究中直肠癌组D*值要高于腺瘤组,但两组之间差异无统计学意义,两组间f值差异也无统计学意义。ADC主要反映细胞内外及血管内水分子的扩散,能够定量反映分子的扩散特性,与细胞密度、细胞内外体积比及细胞膜完整性相关[14]。本研究结果显示直肠管状绒毛状腺瘤组的ADC值高于直肠癌组,且差异均有统计学意义,这与刘艳等[15]的研究结果一致。说明直肠癌癌肿扩散较直肠管状绒毛状腺瘤明显,这可能是因为相对于直肠管状绒毛状腺瘤,直肠癌属于恶性肿瘤,癌肿血液循环增加,癌细胞增殖快,细胞结构致密,排列更加紊乱。本研究中关于ROI的选取,笔者首先在b=1000 s/mm2的DWI图像上找到病灶显示最高信号,然后在其所对应的ADC图像上信号最低的部位手动画取ROI,这样可重复性相对较高[16]。
3.3 ROC曲线对直肠癌与直肠管状绒毛状腺瘤鉴别诊断的意义
通过ROC曲线分析发现,鉴别诊断直肠癌与直肠管状绒毛状腺瘤时,以ADC值为1.026×10-3mm2/s为临界点,可鉴别诊断直肠癌与直肠管状绒毛状腺瘤,当ADC<1.026×10-3mm2/s时,该肿块更倾向于直肠癌;以D值为0.788×10-3mm2/s为临界点时,当D值<0.788×10-3mm2/s时,肿块早更倾向于直肠癌。此外,可以发现ADC值较D值要高,且鉴别诊断直肠癌与直肠管状绒毛状腺瘤时,D值较ADC值的敏感性更高,但特异性差别不大,这可能是因为D值反映的是肿块的真实水分子扩散系数,除外了肿块灌注相关扩散的影响。
本研究的不足:(1)样本量较少,可能会使统计结果有偏差,存在假阳性;(2)所选直肠癌病例分化程度不一,未对其分期、分级作进一步研究,这将是今后的研究重点;(3) b值的选择没有统一的标准。
综上所述,IVIM参数可以区分直肠癌与直肠管状绒毛状腺瘤,D值及标准ADC值对两者的鉴别具有较高的诊断效能,且D值的诊断效能更高。
参考文献 [References]
[1] Wang QX, Wang XM, Wang QZ, et al. Digestive tract tumor diagnosis pathology. Shanghai: Second Military Medical University Press, 2013: 110-111.王强修, 王新美, 王启志, 等. 消化道肿瘤诊断病理学. 上海: 第二军医大学出版社, 2013: 110-111.
[2] Le Bihan D, Breton E, Lallemand D, et al. MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders. Radiology, 1986, 161(2): 401-407.
[3] Chen CC, Yuan ZL, Guo XF, et al. Relationship between ADC value and tumor differentiation in rectal tubular adenocarcinoma by magnetic resonance diffusion weighted imaging. J Prac Radiol, 2014,30(11): 1848-1850.陈长春, 袁子龙, 郭小芳, 等. 直肠管状腺癌磁共振扩散加权成像ADC值与肿瘤分化程度的关系. 实用放射学杂志, 2014, 30(11):1848-1850.
[4] Bihan DL, Breton E, Gueron M. Separation of perfusion and diffusion in intra-voxel incoherent motion (IVIM) MR imaging.Radiology, 1988, 168(2): 497-505.
[5] Li FP, Lu Q, Liu J, et al. Correlation between diffusion weighted imaging parameters of double exponential model and TNM staging in nasopharyngeal carcinoma. J Shandong Med, 2015, 55(2): 11-13.李飞平, 卢强, 刘军, 等. 双指数模型扩散加权成像参数与鼻咽癌TNM分期的相关性. 山东医药, 2015, 55(2): 11-13.
[6] Le BD. Intravoxel incoherent motion perfusion MR imaging: a wakeup call. Radiology, 2008, 249(3): 748.
[7] Leng XM, Han XR, Zhao M, et al. IVIM-DWI in the differential diagnosis of prostate cancer and prostate hyperplasia and its correlation with Gleason score. Radiologic Practice, 2016, 31(8): 760-763.
[8] Chao M, Li Y, Li W, et al. Intravoxel incoherent motion DWI of the pancreatic adenocarcinomas: monoexponential and biexponential apparent diffusion parameters and histopathological correlations.Cancer Imaging, 2017, 17(1): 12.
[9] Perucho J, Lee E, Chan Q. Tumour heterogeneity assessment using histogram analysis of IVIM-based diffusion and perfusion characteristics of cervical cancer. Exhibition of the International Society for Magnetic Resonance in Medicine, ISMRM, 2016.
[10] Han S, Wang L, Shao N, et al. Assessment of introvoxel incoherent motion sequence in preoperative staging of rectal cancer. J Clin Radiol, 2015, 34(12): 1929-1934.
[11] Yu XP, Lu W, Jing H, et al. Discrimination between metastatic and nonmetastatic mesorectal lymph nodes in rectal cancer using intravoxel incoherent motion diffusion-weighted magnetic resonance imaging. Acad Radiol, 2016, 23(4): 479-485.
[12] Surov A, Meyer HJ, Hhn AK, et al. Correlations between intravoxel incoherent motion (IVIM) parameters and histological fi ndings in rectal cancer: preliminary results. Oncotarget, 2017, 8(13): 21974-21983.
[13] Wen L, Hou J, Lu Q, et al. The diagnostic value of MR IVIM-DWI and DCE-MRI for benign and malignant of rectal cancer mesangial lymph nodes. J Prac Radiol, 2017, 33(2): 221-225.文露, 侯静, 卢强, 等. MR IVIM-DWI及DCE-MRI对直肠癌系膜淋巴结良恶性的诊断价值. 实用放射学杂志, 2017, 33(2): 221-225.
[14] Xiao Q, Jin J, Ye F, et al. Application of diffusion weighted imaging in the diagnosis and evaluation ef fi cacy of radiotherapy and chemotherapy of rectal cancer. Chin J Radiat Oncol, 2013, 22(3): 260-263.肖琴, 金晶, 叶枫, 等. 弥散加权成像在直肠癌诊断及放化疗疗效预测中的应用. 中华放射肿瘤学杂志, 2013, 22(3): 260-263.
[15] Liu Y, Zhu LN, Yang AM, et al. Application of 3.0 T magnetic resonance dynamic contrast enhancement and diffusion weighted imaging in the identification of tubulovillous adenoma and rectal cancer. J Xinjiang Med Univ, 2016, 9(12): 1530-1533.刘艳, 朱丽娜, 杨爱梅, 等. 3.0 T磁共振动态对比增强及扩散加权成像在绒毛状腺瘤和直肠癌鉴别中的应用. 新疆医科大学学报,2016, 9(12): 1530-1533.
[16] Hu YC, Yan LF, Wu L, et al. Intravoxel incoherent motion diffusionweighted MR imaging of gliomas: ef fi cacy in preoperative grading.Sci Rep, 2014, 12(4): 7208.

