微米级CuFe/CuFeO2的制备及其类Fenton催化性能
杨文彪,丁耀彬,唐和清
中南民族大学资源与环境学院,湖北武汉 430074
微米级CuFe/CuFeO2的制备及其类Fenton催化性能
杨文彪,丁耀彬,唐和清*
中南民族大学资源与环境学院,湖北武汉 430074
采用两步法,采用水热法以Fe(NO3)3·9H2O、Cu(NO3)2·5H2O作为前驱体,水为溶剂,正丙醛为还原剂,制备了CuFeO2微米颗粒.为进一步提高其催化活化H2O2的性能,使用硼氢化钠对其进行了还原处理制备微米CuFe/CuFeO2催化剂.利用XRD、SEM和XPS对其进行了物相,形貌和表面元素的表征,结果表明所制备的材料为Cu、Fe和CuFeO2的微米级复合物.以罗丹明B(RhB)为目标污染物,评价了其Fenton催化性能.结果表明:在25℃,CuFe/CuFeO2催化剂用量为0.5 g/L,H2O2浓度为40 mmol/L,RhB浓度为10 μmol/L,初始pH=5.0时,CuFe/CuFeO2催化剂在30 min内可降解94.4%的RhB,表观速率常数是相同条件下未处理CuFeO2的11.6倍.这说明CuFe和CuFeO2复合可明显增强其催化活化H2O2的能力.
CuFe/CuFeO2;硼氢化钠;Fenton;降解
染料在纺织、印染、造纸、制革等诸多领域应用广泛,过去几十年,由此带来的环境问题日益严重.由于染料稳定的化学结构使其生物降解难、毒性大,纺织印染废水的处理已引起了人们极大的关注[1-3].在印染行业中,罗丹明B(RhB)是一种常用的稳定阳离子染料,作为一种含氮染料,其能在自然厌氧条件下还原降解生成具有致癌性的芳香胺类化合物[4],增加了治理难度.由于其潜在的致癌性、高毒性、及难生物降解,水体中RhB的去除对环境保护具有重要意义.
现已有很多方法用于处理罗丹明B染料废水,如吸附法[5]、光降解[6]、离子交换[7]、化学絮凝[8]等,但一般染料废水中染料浓度都较高,这些方法在应用时去除效率并不高.近年来,基于Fenton反应处理难降解有机污染物的高级氧化技术受到人们广泛关注.但是,H2O2自身氧化能力有限,通常需要在体系中引入Fenton试剂或过氧化氢酶等加速H2O2分解生成更多的·OH等活性物种增强体系的氧化能力.然而,传统的均相Fenton体系在应用时存在很多的不足,比如,反应的pH适用范围窄,需要在pH值较低(pH<3)的条件下操作,且随着反应的进行pH值不断升高易形成大量难处理的铁泥,给污水处理带来诸多不便;为了克服以上不足,拓宽反应的pH适用范围、避免铁泥的形成,人们尝试对均相体系进行改性,在体系中引入EDTA、草酸根、柠檬酸根和酒石酸根等[9-12]有机配体来固定铁离子,但改性体系还是不能有效加速Fe3+/Fe2+的循环,且配体引入提高了处理成本并容易带来二次污染.
针对以上问题,目前研究重点多集中在多相类Fenton体系的构建,其中以铁氧化物作为多相类Fenton催化剂的研究居多.Zhang等[13]构建H2O2-Fe3O4体系降解处理苯酚,反应3 h后,苯酚(3 mmol/L)的降解率在80%以上.Luo等[14]采用溶胶-凝胶法制备了纳米BiFeO3颗粒,将其用于活化H2O2降解染料RhB,反应90 min可降解95%的RhB.Wang等[15]采用超声辅助法制备纳米Fe3O4材料,用于活化H2O2降解染料RhB,发现在较宽的pH范围内(3~9),反应1 h,RhB去除率高达90%以上.但相较均相Fenton反应其降解速率明显要慢很多,为进一步提高非均相Fenton反应的催化效果,人们将微波和紫外光辐射等辅助能量引入反应体系来增强体系的氧化能力,但同时带来了反应条件苛刻、能耗高等问题,不便应用于实际废水处理,故开发处理成本低、环境友好且高效的类Fenton催化剂是当前的研究趋势.
最近采用水热法制备了铜铁复合氧化颗粒物CuFeO2,发现其Fenton催化活性优于纳米Fe3O4颗粒和微米Cu2O[16].本文采用硼氢化钠对微米CuFeO2颗粒进行还原处理制备CuFe/CuFeO2微米级复合物,希望通过零价Cu和Fe加速CuFeO2中Fe(III)和Cu(II)的还原,再生Fe(II)和Cu(I)的Fenton催化活性位点,进一步增强CuFeO2的Fenton活性.
1 实验部分
1.1 试剂与材料
九水硝酸铁[Fe(NO3)3·9H2O]、五水硝酸铜[Cu(NO3)2·5H2O]、氢氧化钠、硼氢化钠、正丙醛、30%过氧化氢、硝酸、叔丁醇和罗丹明B(RhB).所用化学药品均为国药化学试剂,分析纯,实验用水为超纯水,电导率为18.2 MΩ/cm.
德国布鲁克公司X射线衍射仪(D8 AD-VANCE型,射线源为CuKα靶射线,石墨单色器滤波,2θ为10°~80°),美国热电公司X射线光电子能谱仪(VG Multilab 2000型),超纯水仪(Micro-pure UV,Thermo scientific),紫外可见分光光度计(EVOLVTION 201,Thermo scientific).
1.2 实验方法
1.2.1 微米CuFeO2的制备及还原处理准确称取0.01 mol Fe(NO3)3·9H2O和0.01 mol Cu(NO3)2· 5H2O于25 mL蒸馏水中,室温下搅拌约2 h至完全溶解.准确称取0.2 mol的NaOH,加入50 mL蒸馏水溶解,待溶液冷却后,将上述Fe(NO3)3·9H2O和Cu(NO3)2·5H2O的混合溶液缓慢滴加到NaOH溶液中,边滴加边搅拌.然后,加入1 mL正丙醛并搅拌均匀.最后,将该悬浊液转移至水热反应釜中,180℃反应24 h.自然冷却至室温后,弃去上层溶液,用蒸馏水反复洗涤产品,抽滤,并将其分散到一定体积的蒸馏水中,保存备用.
准确称取一定量NaBH4于50 mL蒸馏水中,加入一定体积上述制备的CuFeO2储备液(含250 mg CuFeO2),25℃下水浴搅拌至反应完全,用蒸馏水多次洗涤,然后加入一定体积蒸馏水中保存备用.
1.2.2 催化降解实验降解实验在25℃下,于100 mL反应器中进行.准确称取25 mg CuFe/Cu-FeO2微米级复合物分散于50 mL 0.01 mmol/L RhB反应液中,调节溶液初始pH,机械搅拌20 min至吸附平衡后加入H2O2引发反应,定时取样,立即加入50 mL叔丁醇(·OH淬灭剂)淬灭,离心分离后,取上清液通过紫外可见分光光度计测其在最大吸收波长λmax=551 nm处的吸光度值.
2 结果与讨论
2.1 物相和表面元素的表征
图1是样品的XRD图谱.由XRD图谱可以看出,处理前样品位于2θ=31.24°,35.70°,40.20°,55.21°,61.01°和64.82°处的衍射峰分别对应于CuFeO2的(006),(012),(104),(018),(110)和(1010)晶面,表明采用水热法制备的样品为纯相的CuFeO2(JCPDS File No.75-2146).样品衍射峰狭窄,表明所制备的样品具有较高的结晶度.相较于CuFeO2样品,采用1 000 mg硼氢化钠处理后样品(CuFe/CuFeO2)的晶体结构发生了明显的变化,在2θ=43.32°,50.45°和74.12°处出现的新衍射峰分别对应于金属Cu(JCPDS File No.85-1326)的(111),(200)和(220)晶面,表明处理后样品中有部分Cu+被还原为Cu0.

图1 CuFeO2和CuFe/CuFeO2的X射线衍射图谱Fig.1XRD patterns of CuFeO2and CuFe/CuFeO2
图2为CuFeO2处理前后样品的XPS表征图谱.如图2(a)XPS谱图所示,处理前后样品表面的组成元素并未改变,都是O,C,Fe和Cu.C是样品接触空气的无定形碳.图2(b)是CuFeO2处理前后Cu 2p的XPS谱图.如图所示,对于CuFeO2,位于951.8 eV和932.1 eV的峰分别归属于Cu+的Cu 2p1/2和Cu 2p3/2自旋轨道;处理后,这两处的结合能分别移动到952.7 eV和932.8 eV,说明样品表面形成了Cu0,与XRD结果一致.图2(c)是CuFeO2处理前后Fe 2p的XPS谱图.711.2 eV和725.0 eV处的峰以及在719.0 eV处的卫星峰,表明CuFeO2样品表面的Fe为Fe3+.处理后,位于713.7 eV和 720.2 eV的新峰归属于Fe0的Fe 2p3/2自旋轨道,表明经过处理后样品表面有部分Fe0生成.图2(d)是CuFeO2处理前后O1s的XPS谱图.OI(530.0 eV)的特征峰归属于CuFeO2的晶格氧.如图2(d)所示,样品表面的晶格氧含量发生了显著的降低,表明在处理过程中,样品被还原.

图2 CuFeO2处理前后的XPS谱图:(1)CuFeO2,(2)CuFe/CuFeO2复合物Fig.2XPS spectra of(1)CuFeO2and(2)CuFe/CuFeO2composites:(a)wide survey,(b)Cu 2p,(c)Fe 2p and(d)O 1s
图3是CuFeO2和CuFe/CuFeO2样品的SEM图.由SEM图可见,所制备的CuFeO2为菱形六面体,表面光滑,颗粒大小约为3 μm.而采用硼氢化钠处理后,样品表面变得粗糙,被大小约为200 nm的颗粒所覆盖.根据XRD和XPS表征结果,可以推测所制备的CuFeO2表面生成的纳米颗粒即为Cu0和Fe0.通过以上XRD,SEM和XPS的表征,表明所制备的样品为CuFe/CuFeO2复合物.

图3 (a)CuFeO2和(b)CuFe/CuFeO2的扫描电镜图Fig.3SEM images of(a)CuFeO2and(b)CuFe/CuFeO2
2.2 CuFe/CuFeO2复合物Fenton催化性能
不同用量NaBH4处理制备的CuFe/CuFeO2复合物Fenton降解RhB效果如图4所示.反应条件为反应温度25℃,CuFe/CuFeO2催化剂0.5 g/L,H2O2浓度40 mmol/L,RhB 10 μmol/L,pH=5.0.用200 mg NaBH4处理制备的CuFe/CuFeO2复合物为催化剂,相对于CuFeO2,RhB的降解速率和去除率均得到了明显的提高.当NaBH4用量持续增至1 000 mg时,RhB的降解率进一步增加,30 min RhB的降解率接近95%.当进一步提高NaBH4用量至2 000 mg时,90 min RhB的降解率为94%.优化的NaBH4用量为1 000 mg,此条件下制备的催化剂为CuFe/ CuFeO2复合物具有最优的Fenton催化活性.

图4 NaBH4用量对制备的CuFe/CuFeO2复合物Fenton降解RhB效果的影响Fig.4Effect of dose of NaBH4on Fenton degradation of RhB by CuFe/CuFeO2composites
催化剂用量对RhB降解效果的影响见图5.由图5可见,随着催化剂用量的增加,RhB的降解率逐渐提高.这是因为催化剂浓度的增加提供了更多的活性位点,加速了H2O2的分解产生更多的羟基自由基;当催化剂用量增加至1.0 g/L时,RhB降解速率和降解率提高并不明显,表明0.5 g/L CuFe/CuFeO2复合物已足够催化活化H2O2,因此选择0.5 g/L为最佳催化剂用量.

图5 催化剂用量对RhB降解效果的影响Fig.5Effects of catalyst dose on degradation of RhB
H2O2浓度对RhB降解效果的影响见图6.由图6可见,当H2O2浓度由2 mmol/L增加至40 mmol/L时,RhB的降解速度和降解率均得到了显著的提高,这是因为H2O2浓度的增加使反应体系产生更多的羟基自由基,将RhB进行快速降解.当H2O2浓度为40 mmol/L时,30 min内可将10 μmol/L的RhB完全降解,因此,H2O2最佳浓度确定为40 mmol/L.
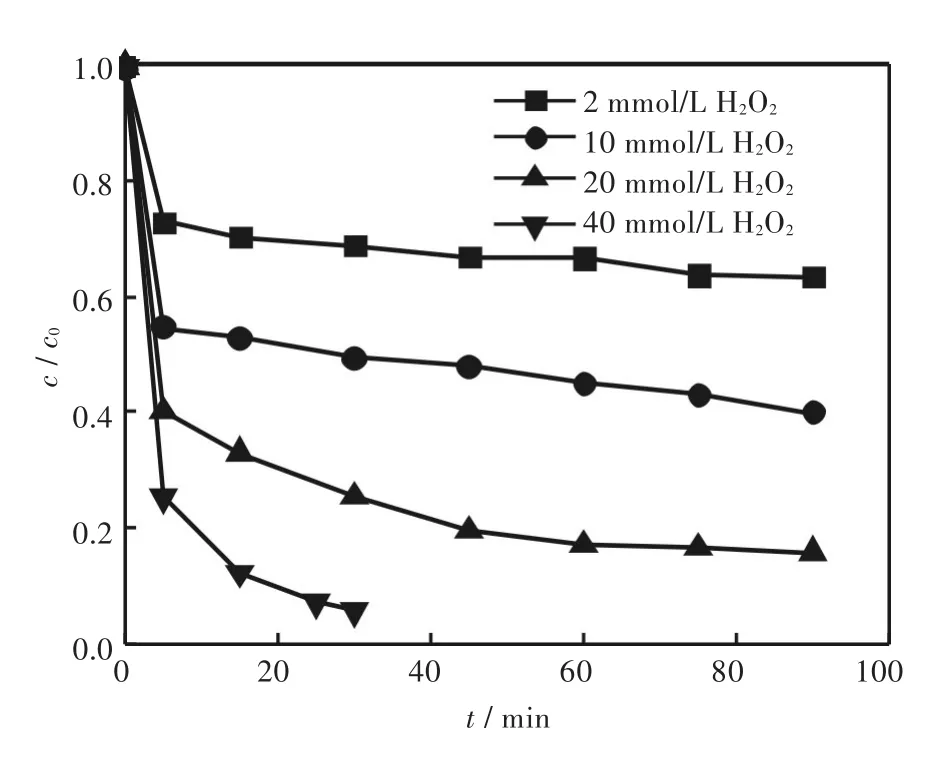
图6 H2O2浓度对RhB降解效果的影响Fig.6Effects of H2O2concentration on degradation of RhB
溶液pH是类Fenton反应的重要影响因素.如图7所示,随着溶液初始pH值的降低,RhB的降解效率逐渐增高.当溶液pH大于6.0时,RhB的降解率有所下降,但是相对于均相Fenton反应,该体系在近中性条件下对RhB具有更高的降解率,因此,这更有利于实际应用.

图7 初始pH值对RhB降解效果的影响Fig.7Effects of initial solution pH on degradation of RhB
2.3 活性自由基的鉴定
基于铁氧化物的多相类Fenton反应对污染物的降解机理已有不少报道,一般认为·OH的作用占主导地位,叔丁醇(TBA)常常作为Fenton反应中·OH的淬灭剂,为了鉴定该反应体系中的活性物种是否为·OH,在反应开始时加入一定浓度的TBA.结果如图8所示,当加入100 mmol/L的TBA时,反应30 min,RhB的降解反应几乎受到了完全的抑制.这表明·OH是该体系中主要的活性物种.
2.4 CuFeO2催化活化H2O2的机理探究
根据Zhang等[16]的研究推测,CuFeO2催化活化H2O2的机理大致可分为3部分:

图8100 mmol/L叔丁醇加入对CuFe/CuFeO2-H2O2体系降解RhB的影响Fig.8Effects of added TBA(100 mmol/L)on degradation of RhB in the system of CuFe/CuFeO2-H2O2
1)H2O2首先与CuFeO2表面的(≡FeIII)复合生成≡FeIIIH2O2,新生的≡FeIIIH2O2可通过分子内电子转移作用可生成HO2·和(≡FeII),见反应式(1)-(2);生成的·HO2还原≡FeIII再生≡FeII,≡FeII与溶液中H2O2发生表面Fenton反应产生·OH,见反应式(3),进而将有机污染物进行降解矿化.
2)≡Cu+可以与H2O2反应生成·OH,见反应式(7),生成的Cu2+被H2O2和·HO2/O2·-还原为Cu+,完成催化剂的再生,见反应式(9)-(11).
3)Cu2+/Cu+的标准还原电极电势为0.17 V,低于Fe3+/Fe2+的标准还原电极电势(0.77 V),所以理论上,Cu+还原Fe3+的反应热力学可行的,见反应式(6).≡FeII的再生利用高效活化H2O2产生·OH并将污染物降解矿化.反应方程式如下:
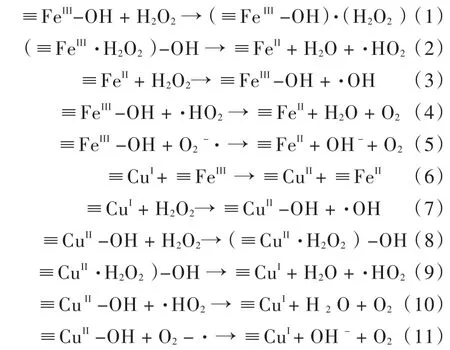
采用NaBH4处理后,在CuFeO2表面生成了Cu0和Fe0.生成的Cu0和Fe0可催化活化H2O2产生大量的·OH,见反应式(12).同时,表面生成的Cu0和Fe0可作为电子供体还原反应产生的≡CuI和≡FeII,加速Cu和Fe的Fenton催化循环,见反应式(13)-(14),进一步增强CuFe/CuFeO2的Fenton活性.

3 结语
以Fe(NO3)3·9H2O、Cu(NO3)2·5H2O作为前驱体,水为溶剂,正丙醛为还原剂,采用水热法成功制备了CuFeO2微米颗粒.通过硼氢化钠还原处理后,在CuFeO2表面生成了Cu0和Fe0.生成的Cu0和Fe0可加速其催化活化H2O2产生大量的·OH.同时,表面生成的Cu0和Fe0可作为电子供体还原反应生成的Cu2+和Fe3+,加速Cu和Fe的Fenton催化循环,进一步增强CuFe/CuFeO2的Fenton活性,高效降解污染物.该催化反应对设备要求不高,室温下即可快速反应,且对环境友好,在处理含染料废水方面具有较高的应用价值.
[1]SALAZAR R,BRILLAS E,SIRÉS I.Finding the best Fe2+/Cu2+combination for the solar photoelectro-Fenton treatmentofsimulatedwastewatercontainingthe industrial textile dye Disperse Blue 3[J].Applied Catalysis B:Environmental,2012,115:107-116.
[2]TIAN S,ZHANG J,CHEN J,et al.Fe2(MoO4)3as an effective photo-Fenton-like catalyst for the degradation of anionic and cationic dyes in a wide pH range[J]. Industrial&Engineering Chemistry Research,2013,52(37):13333-13341.
[3]CAI C,ZHANG H,ZHONG X,et al.Electrochemical enhanced heterogeneous activation of peroxydisulfate by Fe-Co/SBA-15 catalyst for the degradation of Orange II in water[J].Water Research,2014,66:473-485.
[4]HORIKOSHIS,HOJOF,HIDAKAH,etal. Environmental remediation by an integrated microwave/ UV illumination technique.8.Fate of carboxylic acids,aldehydes,alkoxycarbonyl and phenolic substrates in a microwave radiation field in the presence of TiO2particlesunderUVirradiation[J].Environmental Science&Technology,2004,38(7):2198-2208.
[5]余响林,刘琼,黎汪周,等.可循环利用介孔SiO2材料的制备及其对染料的吸附性能[J].武汉工程大学学报,2011,33(5):8-11.
YU X L,LIU Q,LI W Z,et al.Preparation and research on adsorption to dyes of mesoporous silica materials[J].JournalofWuhanInstituteof Technology,2011,33(5):8-11.
[6]刘东,余军霞,黄彪,等.TiO2纳米管降解罗丹明B[J].武汉工程大学学报,2011,33(1):15-18.
LIU D,YU J X,HUANG B,et al.TiO2nanotubes degradation of Rhodamine B[J].Journal of Wuhan Institute of Technology,2011,33(1):15-18.
[7]LABANDA J,SABATÉ J,LLORENS J.Experimental and modeling study of the adsorption of single and binary dye solutions with an ion-exchange membrane adsorber[J].Chemical Engineering Journal,2011,166(2):536-543.
[8]KANG Q,GAO B,YUE Q,et al.Residual color profiles of reactive dyes mixture during a chemical flocculation process[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2007,299(1):45-53.
[9]李春娟,马军,余敏,等.EDTA催化Fe3+/H2O2降解水中孔雀石绿[J].环境科学,2008,29(5):1255-1260.
LI C J,MA J,YU M,et al.Degradation of malachite green in aqueous solution by Fe3+/H2O2catalyzed with EDTA[J].Environmental Science,2008,29(5):1255-1260.
[10]MONTEAGUDOJM,DURÁNA,LÓPEZALMODÓVARC.Homogeneusferrioxalate-assisted solar photo-Fenton degradation of Orange II aqueous solutions[J].Applied Catalysis B:Environmental,2008,83(1):46-55.
[11]RASTOGI A,Al-ABED S R,DIONYSIOU D D. Effect of inorganic,synthetic and naturally occurring chelatingagentsonFe(II)mediatedadvanced oxidationofchlorophenols[J].WaterResearch,2009,43(3):684-694.
[12]KWON B G,KIM E,LEE J H.Pentachlorophenol decomposition by electron beam process enhanced in the presence of Fe(III)-EDTA[J].Chemosphere,2009,74(10):1335-1339.
[13]ZHANG J,ZHUANG J,GAO L,et al.Decomposing phenol by the hidden talent of ferromagnetic nanoparti-cles[J].Chemosphere,2008,73(9):1524-1528.
[14]LUO W,ZHU L,WANG N,et al.Efficient removal of organic pollutants with magnetic nanoscaled BiFeO3as a reusable heterogeneous Fenton-like catalyst[J]. Environmental Science&Technology,2010,44(5):1786-1791.
[15]WANG N,ZHU L,WANG D,et al.Sono-assisted preparation of highly-efficient peroxidase-like Fe3O4magnetic nanoparticles for catalytic removal of organic pollutants with H2O2[J].Ultrasonics Sonochemistry,2010,17(3):526-533.
[16]ZHANG X,DING Y,TANG H,et al.Degradation of bisphenol A by hydrogen peroxide activated with CuFeO2microparticles as a heterogeneous Fenton-like catalyst:efficiency,stability and mechanism[J]. Chemical Engineering Journal,2014,236:251-262.
本文编辑:张瑞
Fenton-Like Catalytic Activity of CuFe/CuFeO2Micro-Composites Prepared from Treatment of CuFeO2by NaBH4
YANG Wenbiao,DING Yaobin,TANG Heqing*
College of Resources and Environmental Science,South-Central University for Nationalities,Wuhan 430074,China
CuFe/CuFeO2micro-composites were prepared via a two-step route.CuFeO2microparticles were first prepared through a modified hydrothermal method with Fe(NO3)3·9H2O and Cu(NO3)2·5H2O as precursors in the presence of distilled water and propionaldehyde,and then CuFe/CuFeO2micro-composites were obtained from the controllable reduction of the as-prepared CuFeO2microparticles by NaBH4.The structure,morphology and surface element composition of CuFe/CuFeO2micro-composites were characterized by X-ray diffraction,scanning electron microscopy and X-ray photoelectron spectroscopy.It was found that as-prepared products were a microscaled composite of Cu,Fe and CuFeO2.The Fenton-like catalytic activity of CuFe/CuFeO2micro-composites was evaluated via the degradation of rhodamine B(RhB)as a model pollutant.It was found that 94.4%RhB(10 μmol/L)can be degraded in 30 min at initial pH 5.0 and concentration of 0.5 g/L CuFe/CuFeO2and 40 mmol/L H2O2.The first-order reaction kinetic constant for the degradation of RhB by CuFe/CuFeO2is 11.6 times that by CuFeO2.These results show that the H2O2-activating ability of CuFe/CuFeO2significantly enhances by the composite of CuFe and CuFeO2.
CuFe/CuFeO2;NaBH4;fenton;degradation
X703
A
10.3969/j.issn.1674-2869.2017.02.008
1674-2869(2017)02-0147-06
2016-12-29
国家自然科学基金(21507168,21377169)
杨文彪,硕士研究生.E-mail:1239009767@qq.com
*通讯作者:唐和清,博士,教授.E-mail:tangheqing@mail.scuec.edu.cn
杨文彪,丁耀彬,唐和清.微米级CuFe/CuFeO2的制备及其类Fenton催化性能[J].武汉工程大学学报,2017,39(2):147-152.
YANG W B,DING Y B,TANG H Q.Fenton-like catalytic activity of CuFe/CuFeO2micro-composites prepared from treatment of CuFeO2by NaBH4[J].Journal of Wuhan Institute of Technology,2017,39(2):147-152.

