雷帕霉素干预对左旋多巴诱发的异动症大鼠行为学的影响
张丙天,陈志斌,陈小武,缪茂军,何晓阔,曹学斌
雷帕霉素干预对左旋多巴诱发的异动症大鼠行为学的影响
张丙天,陈志斌,陈小武,缪茂军,何晓阔,曹学斌
目的 研究雷帕霉素干预对左旋多巴诱发的异动症(LID)的行为学的影响。方法 通过6-羟基多巴胺颅内立体定向注射制作偏侧大鼠帕金森病模型。给予左旋多巴腹腔注射1周制作LID大鼠模型。将LID大鼠分为LID对照组(LID组)和雷帕霉素干预观察组(RAPA组)。继续左旋多巴腹腔注射2周,RAPA组大鼠每天于左旋多巴注射前45 min腹腔注射雷帕霉素,低剂量0.25 mg/(kg·d)、中剂量0.35 mg/(kg·d)、高剂量0.5 mg/(kg·d),每周注射4 d,持续2周。对照组同时给予等体积生理盐水腹腔注射。记录大鼠异常不自主运动(AIM)评分并对比分析。结果 RAPA低剂量亚组未观察到有意义的行为学改变;RAPA高剂量亚组在雷帕霉素给药后数天出现精神萎靡、食欲减退、血尿等症状,5~10 d左右逐渐死亡,经尸体解剖及病理切片发现,动物死亡原因与肺炎、肝肾损害等原因密切相关。RAPA中剂量亚组行为学改变比较理想,且动物耐受性较好,没有出现死亡。RAPA干预治疗开始起,RAPA中剂量亚组大鼠每天AIM评分均较LID组大鼠明显降低(均P<0.05)。左旋多巴注射第20 d,RAPA中剂量亚组大鼠左旋多巴治疗后120 min 内AIM评分均较LID组大鼠明显降低(均P<0.05)。结论 雷帕霉素治疗能显著改善LID大鼠行为学表现,改善LID大鼠不自主运动症状。
帕金森病;左旋多巴诱发的异动症;雷帕霉素;行为学
研究[1]表明,哺乳动物雷帕霉素靶蛋白(mTOR)信号通路和左旋多巴诱发的异动症(LID)的发生相关。其上游的一种小型G蛋白Rhes基因可以激活mTOR信号通路。在LID动物模型中,缺乏Rhes基因的小鼠表现出异动症状会得以减轻[2]。活化的mTOR激活其下游两个重要的靶蛋白:核糖体S6蛋白激酶(s6kinase,p70S6K,S6K)和真核细胞始动因子4E结合蛋白(4E-BP1)活化后可促进核糖体蛋白质翻译,调节蛋白的合成。4E-BP1通常与真核细胞始动因子4E(elF-4E)结合并抑制其括性,进而抑制翻译的开始。当活化的mTOR将4E-BP1磷酸化后,解除elF-4E/4E-BP1的结合,促进帽子结构依赖性翻译的起始,进而调控蛋白质的合成。在6-羟基多巴胺(6-OHDA)制作的帕金森病(PD)的小鼠模型中,雷帕霉素可以实现抗运动障碍效应,mTOR抑制剂CCI-779能够改善LID大鼠的行为学表现[3]。为证实雷帕霉素在大鼠LID模型的抗运动障碍效应,本研究以6-OHDA立体定位注射制备偏侧PD大鼠模型,给偏侧PD大鼠模型腹腔注射左旋多巴胺+苄丝肼制作LID模型,同时用雷帕霉素对LID大鼠模型进行干预,观察LID大鼠经雷帕霉素治疗后的行为学变化,为进一步探讨LID发病机制和药物治疗奠定基础。
1 材料和方法
1.1 材料
1.1.1 实验动物 普通级Sprague-Daewley 大鼠,由武汉大学实验动物中心提供,体质量200~220 g,雄性。实验期间,保持动物房良好通风,室温在24℃左右,相对湿度40%~70%,12 h照明12 h黑暗,动物自由进食,自由饮水。
1.1.2 主要药品与试剂 水合氯醛(固体)为国药控股公司产品,6-OHDA、阿朴吗啡、左旋多巴甲酯、盐酸苄丝肼均为sigma公司产品,雷帕霉素(DMSO溶解,-20°储存)为cayman chemical公司产品。
1.2 方法
1.2.1 PD动物模型制备 大鼠经12 h以上禁食(不禁水)后称重,7%水合氯醛0.05 ml/kg,腹腔注射麻醉。麻醉后固定于立体定向仪,剪去头顶毛发,局部碘伏消毒,切开头皮,刮开骨膜,30%双氧水局部涂擦以充分显露前囟。以前囟为原点确定坐标,以右侧内侧前脑束(MFB)为靶区立体定向注射6-OHDA制作偏侧PD大鼠模型。钻颅坐标:AP:-4.4 mm; ML:1.4 mm;DV:-7.8 mm,制作偏侧PD大鼠模型。钻开颅骨后,将针尖调至接触硬脑膜,读取硬脑膜高度并记录,抽取4 μl 6-OHDA溶液,穿破硬脑膜,缓慢进针至硬脑膜下-7.8 mm处,按0.5 μl/min 速度向MFB注射[4],注射完毕留针5 min,以1 mm/min缓慢退针,缝合皮肤,置笼饲养。手术2周后,按照0.05 mg/kg的剂量,阿朴吗啡颈部皮下注射诱导动物向对侧旋转,5~10 min后,记录每5 min旋转次数,共30 min,大于平均7 r/min的大鼠作为成功PD大鼠模型。本实验中PD大鼠造模成功率约75%。
1.2.2 LID模型制作及分组 给成功的PD大鼠模型每天腹腔注射左旋多巴 10 mg/kg +苄丝肼2.5 mg/kg,连续1周,制作LID模型。待大鼠出现异常不自主运动(AIM)表现,达到典型LID标准后(单日AIM评分≥16分)[5],根据AIM评分,均衡分为LID对照组和雷帕霉素干预观察组(RAPA组)。RAPA组又随机分为低剂量亚组、中剂量亚组、高剂量亚组。自左旋多巴治疗第2周开始,RAPA组大鼠每天于左旋多巴注射前45 min腹腔注射雷帕霉素,低剂量0.25 mg/(kg·d)、中剂量0.35 mg/(kg·d)、高剂量0.5 mg/(kg·d),每周注射4 d,持续2周。对照组同时给予等体积生理盐水腹腔注射。
1.2.3 行为学观察 各组大鼠于药物注射后,参照文献[5]报道的方法进行AIM 评分,评定左旋多巴治疗后120 min 内AIM总分数,每30 min 1 次,共4次(其中第20 d每20 min 1 次,共6次)。将AIM 分为4个部分(上肢 AIM、 口面部 AIM、 轴性 AIM、运动AIM)进行评定。每部分又根据其有无和严重程度分5个等级(0~4分):0=无;1=偶尔出现,<50%的时间;2=经常出现,≥50%的时间;3=持续存在,刺激能停止;4=持续存在,刺激不能停止。理论上1只大鼠1次用药后每个评分时间点最大得分为16分,120 min最大评分为96分。
2 结 果
2.1 LID大鼠模型制作结果 挑选出合格的PD大鼠,经左旋多巴治疗1周后,70%的动物出现AIM,行为学评分达到LID评分标准。PD大鼠AIM出现的时间不一,平均为(2±1)d,另外约30%的大鼠始终未出现AIM或AIM评分达不到LID评分标准。LID 的行为学改变主要表现为对侧旋转行为和刻板动作,如头颈部和躯体向对侧扭转, 下颌及对侧上肢的刻板舔吮动作,或对侧上肢的节律性拍打、抖动等。这些现象在单次注射药物后30~60 min达到高峰,持续2 h左右;治疗全程中,5~7 d达到典型LID标准,2~3周达到高峰。
2.2 RAPA组大鼠行为学改变情况 经过观察,RAPA低剂量亚组未观察到有意义的行为学改变。RAPA高剂量亚组在雷帕霉素给药后数天出现精神萎靡、食欲减退、血尿等症状,5~10 d左右逐渐死亡,经尸体解剖及病理切片证实,动物死亡原因与肺炎、肝肾损害等原因密切相关,其中肺炎尤其多见 (图1~3)。RAPA中剂量亚组行为学改变比较理想,且动物耐受性较好,没有出现死亡。
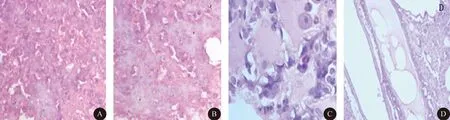
图1 RAPA高剂量亚组大鼠肺组织石蜡切片示肺炎。A:大量中性粒细胞浸润肺泡腔;B:肺泡腔内纤维素;C:肺水肿液及巨噬粒细胞;D:支气管内可见大量水肿液(HE染色,×400)
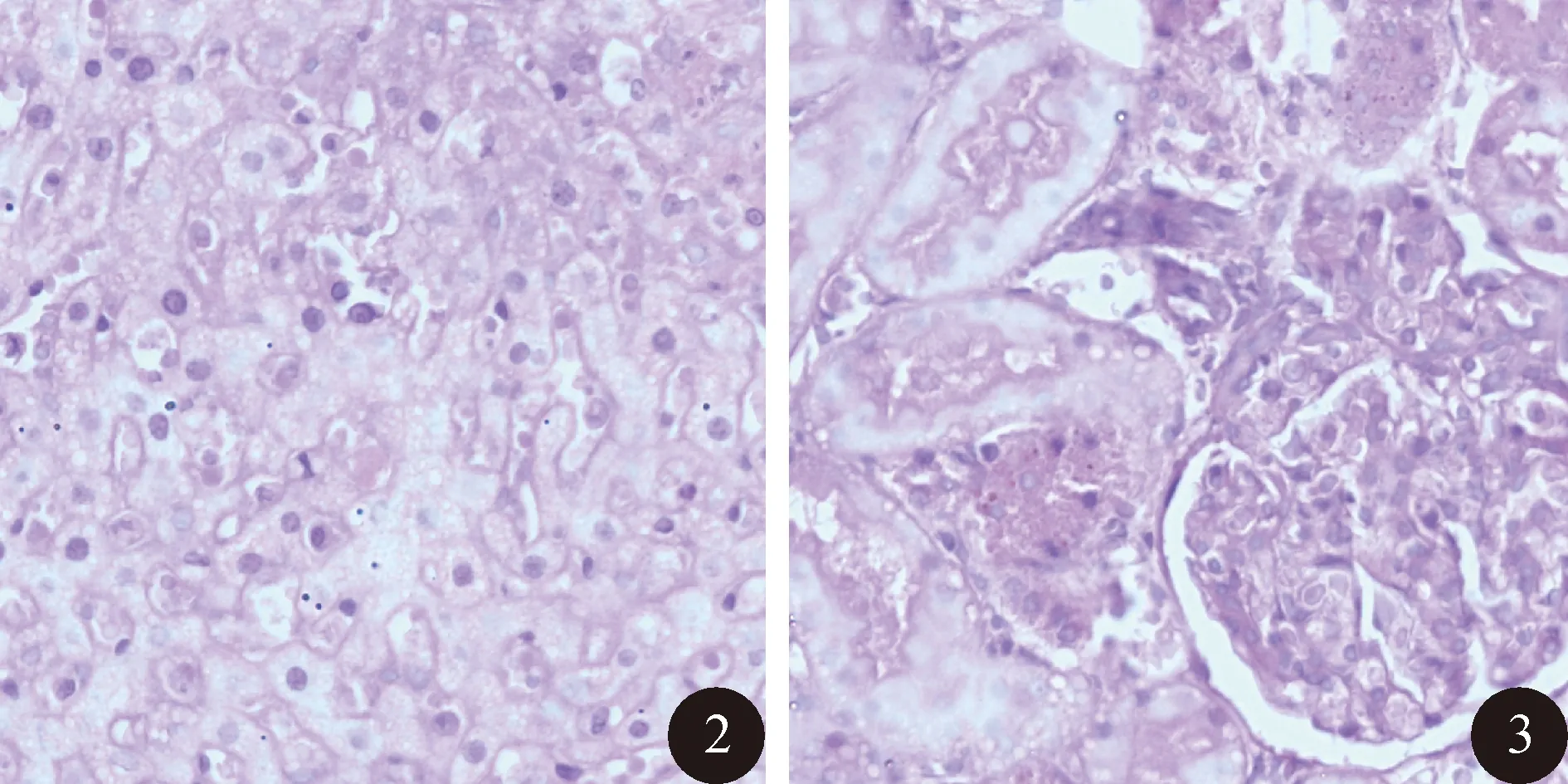
图2 RAPA高剂量亚组大鼠肝组织内可见局部片状局灶性水样变形(HE染色,×200) 图3 RAPA高剂量亚组大鼠肾组织石蜡切片示部分肾小球增生,肾小管上皮细胞水样变性,脱落,细胞核消失(HE染色,×200)
2.3 RAPA中剂量亚组与LID组大鼠AIM评分的比较 见表1、表2。左旋多巴注射第8 d起,即RAPA干预治疗开始起,RAPA中剂量亚组大鼠每天AIM评分均较LID组大鼠明显降低,差异有统计学意义(均P<0.05)。左旋多巴注射第20 d,RAPA中剂量亚组大鼠左旋多巴治疗后120 min 内6次AIM评分均较LID组大鼠明显降低,差异有统计学意义(均P<0.05)。

表1 左旋多巴注射后各时间点RAPA中剂量亚组与LID组大鼠AIM评分的比较(x±s)时间LID组RAPA中剂量亚组第1d16.6667±4.457214.6667±12.3720第3d20.8333±6.369222.0000±10.2372第5d29.1667±5.741728.8333±10.0083第7d37.5000±9.669537.0000±16.1493第8d43.0000±8.221923.0000±6.4807*第10d43.3333±7.966617.8333±15.0654*第12d53.3333±20.752518.0000±17.6862*第14d44.3333±7.685531.0000±10.9362*第16d51.1667±8.975925.3333±9.8725*第18d48.1667±21.627919.5000±9.8944*第20d53.8333±12.254323.1667±10.8520* 注:与LID组同时间点比较*P<0.05
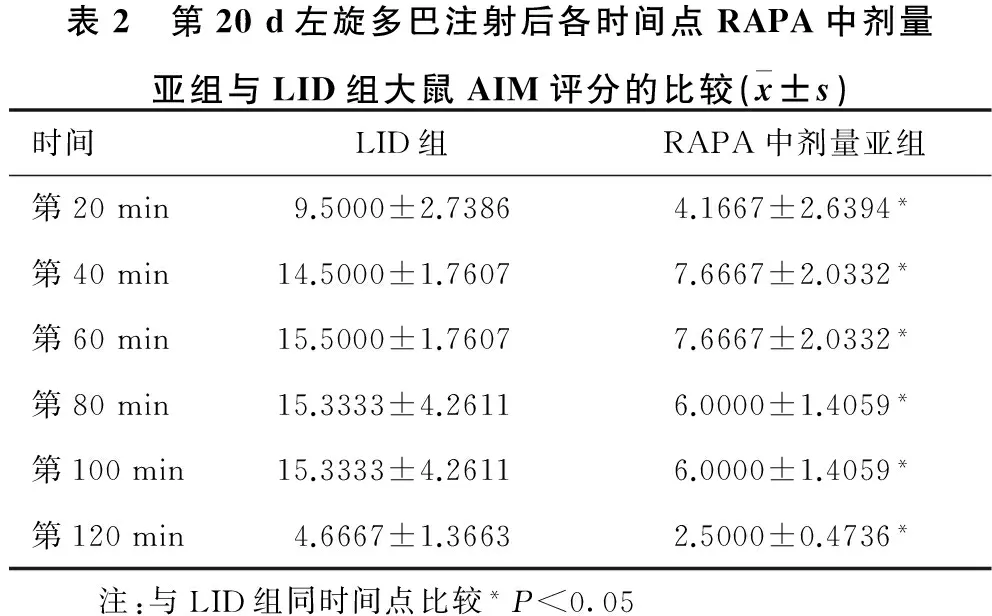
表2 第20d左旋多巴注射后各时间点RAPA中剂量亚组与LID组大鼠AIM评分的比较(x±s)时间LID组RAPA中剂量亚组第20min9.5000±2.73864.1667±2.6394*第40min14.5000±1.76077.6667±2.0332*第60min15.5000±1.76077.6667±2.0332*第80min15.3333±4.26116.0000±1.4059*第100min15.3333±4.26116.0000±1.4059*第120min4.6667±1.36632.5000±0.4736* 注:与LID组同时间点比较*P<0.05
3 讨 论
雷帕霉素是mTOR特异性抑制剂。最初,雷帕霉素作为低毒性抗真菌抗生素,后来发现它对自身免疫性疾病有免疫抑制作用,因而又被作为动物实验及临床应免疫抑制剂使用[6-7]。mTOR与细胞增殖和凋亡关系密切,其异常活化与多种人类肿瘤的发生发展有关,也被广泛运用于肿瘤疾病的研究[8-9]。进一步研究[10-11]发现,雷帕霉素通过抑制mTOR,促进自噬,对神经退行性疾病有治疗作用及神经保护作用,能延缓诸如Alzheimer’s病和PD之类的神经退化性疾病的发展,因而为神经科所重视。
研究[12-13]显示,由于能够阻断RTP801/REDD1/Ddit4的翻译表达,在细胞试验和神经毒剂毁损制作的PD模型中,雷帕霉素都表现出了保护神经而使其免于死亡的效果,被认为对许多神经退行性疾病都有肯定的作用。本研究发现,左旋多巴注射第8 d起,即RAPA干预治疗开始起,RAPA中剂量亚组大鼠每天AIM评分均较LID组大鼠明显降低,差异有统计学意义(均P<0.05)。左旋多巴注射第20 d,RAPA中剂量亚组大鼠左旋多巴治疗后120 min 内6次AIM评分均较LID组大鼠明显降低,差异有统计学意义(均P<0.05)。说明雷帕霉素能有效减轻LID大鼠AIM的严重程度,而且已经产生的异动症也有望经过雷帕霉素治疗得以减轻。雷帕霉素治疗LID的价值有待更多的实验研究予以证实,其治疗机制也有待进一步深入探索。
雷帕霉素的水溶性极差,且性质不稳定。关于雷帕霉素的给药途径,根据动物种属和研究目的不同,文献[14-17]报道的方法主要有颅内置管、腹腔注射、灌胃、皮下注射等方法,剂量从1 μg/kg~20 mg/kg不等。但结合本研究特点,综合考虑实验效率、性价比、药代动力学等因素,腹腔注射是比较合适的给药途径。至于给药剂量,有学者[15]在实验中使用2 mg/kg的剂量,但据本实验证实,大于0.5 mg/kg的剂量,大鼠并不能很好的耐受,不适宜较长时间给药,尤其对于需要长期观察行为学的动物实验。药物剂量过高,动物不能耐受;剂量过低,不能实现有意义的行为学改变,均达不到理想的实验效果。除此之外,还有研究[18-19]发现,雷帕霉素能激活胰岛素受体底物蛋白1,使实验动物出现糖耐量减低、机体胰岛素敏感性下降、胰岛素分泌功能受损、胰岛素抵抗现象。这也可能给动物生存造成一定的影响,本研究鉴于时间因素,暂未行进一步探讨。不同种属动物之间吸收存在很大的差异。由于雷帕霉素半衰期比较长,再加上大鼠解剖结构中没有胆囊,所有药物全须经肝肾代谢,这就增加了肝肾毒性风险。本研究结果发现,大鼠给予雷帕霉素后肝肾毒性多见,推测这是大鼠的雷帕霉素耐受量和小鼠有明显差异的主要原因之一。
[1]Santini E, Heiman M, Greengard P, et al. Inhibition of mTOR signaling in Parkinson’s disease prevents l-DOPA-induced dyskinesia [J].Sci Signal, 2009, 2: ra36.
[2]Subramaniam S, Napolitano F, Mealer RG, et al. Rhes, a striatal-enriched small G protein, mediates mTOR signaling and L-DOPA-induced dyskinesia [J].Nat Neurosci, 2012, 15: 191.
[3]Ravikumar B, Vacher C, Berger Z, et al. Inhibition of mTOR induces autophagy and reduces toxicity of polyglutamine expansions in fly and mouse models of Huntington disease [J].Nat Genet, 2004, 36: 585.
[4]Cao X, Yasuda T, Uthayathas S, et al. Striatal overexpression of delta FosB reproduces chronic levodopa-induced involuntary movements [J].J Neurosci, 2010, 30: 7335.
[5]Monville C, Torres EM, Dunnett SB. Validation of the l-dopa-induced dyskinesia in the 6-OHDA model and evaluation of the effects of selective dopamine receptor agonists and antagonists [J].Brain Res Bull, 2005, 68: 16.
[6]Stepkowski SM,Chen H,Daloze P,et al.Rapamycin,a potent immunosuppressive drug for vascularized heart,kidney,and small bowel transplantation in the rat[J].Transplantation,1991,51:22.
[7]Granger DK, Cromwell JW, Chen SC, et al. Prolongation of renal allograft survival in a large animal model by oral rapamycin monotherapy [J].Transplantation, 1995, 59: 183.
[8]Gomez-Martin C, Rubio-Viqueira B, Hidalgo M. Current status of mammalian target of rapamycin inhibitors in lung cancer [J].Clin Lung Cancer, 2005, 7 (Suppl 1): S13.
[9]Konings IR, Verweij J, Wiemer EA, et al.The applicability of mTOR inhibition in solid tumors [J]. Curr Cancer Drug Targets, 2009, 9: 439.
[10]Rubinsztein DC. The roles of intracellular protein-degradation pathways in neurodegeneration [J].Nature, 2006, 131: 1969.
[11]Carrieri LC, M Biagioli AB, Zucchelli S. Long non-coding antisense RNA controls Uchl1 translation through an embedded SINEB2 repeat [J].Nature, 2012, 491: 454.
[12]Malagelada C, Jin ZH, Jackson-Lewis V, et al. Rapamycin Protects against Neuron Death in In Vitro andIn Vivo Models of Parkinson’s Disease [J].J Neurosci, 2010, 30: 1166.
[13]Bove J, Martinez-Vicente M, Vila M. Fighting neurodegeneration with rapamycin: mechanistic insights [J]. Nat Rev Neurosci, 2011, 12: 437.
[14]Jobim PF, Pedroso TR, Christoff RR, et al. Inhibition of mTOR by rapamycin in the amygdala or hippocampus impairs formation and reconsolidation of inhibitory avoidance memory [J]. Neurobiol Learn Mem, 2012, 97: 105.
[15]Houde VP, Brulé S, Festuccia WT, et al. Chronic rapamycin treatment causes glucose intolerance and hyperlipidemia by upregulating hepatic gluconeogenesis and impairing lipid deposition in adipose tissue [J].Diabetes, 2010, 59: 1338.
[16]Kline WO, Panaro FJ, Yang HY,et al. Rapamycin inhibits the growth and muscle-sparing effects of clenbuterol [J].J Appl Physiol, 2007, 102: 740.
[17]戎赞华,段惠军,郝军,等. 雷帕霉素抑制IgA肾病大鼠肾小球信号蛋白STAT3的活化[J].基础医学与临床, 2008, 28: 460.
[18]牛燕媚, 刘彦辉, 李慧阁,等. 胰岛素受体底物蛋白1及其丝氨酸磷酸化活性在胰岛素抵抗发生中的作用[J].中国糖尿病杂志, 2012, 20: 136.
[19]周迎生, 王丽娟, 等. 雷帕霉素对小鼠葡萄糖代谢水平的影响[J].中国实验动物学报, 2012, 20: 1.
Effect of Rapamycin treatment on the behavioristics of levodopa induced dyskinesia rats
ZHANGBing-tian,CHENZhi-bin,CHENXiao-wu,etal.
DepartmentofNeurologicalRehabilitation,ShiyanTaiheHospitalofHubeiProvince(TaiheHospitalAffiliatedtoHubeiMedicalCollege),Shiyan442000,China
Objective To evaluate the effect of Rapamycin treatment on the behavioristics of levodopa induced dyskinesia (LID) rats. Methods Hemi-parkinsomism rat models were made by 6-hydraxydopamine microinjection stereotaxically into medial forebrain bundle. Then LID rat models were established by intraperitoneal injection of levodopa for a week. The LID rats were randomly divided into the LID control group (LID group) and Rapamycin treatment observation group (RAPA group). Then all of the rats were treated with levodopa by intraperitoneal injection for 2 weeks, and the rats in RAPA group were treated with Rapamycin by intraperitoneal injection 45 min before levodopa injection, with low dose of 0.25 mg/(kg·d), middle dose of 0.35 mg/(kg·d) and high dose of 0.5 mg/(kg·d), 4 d a week for 2 weeks. The control group was given the same volume of normal saline. The abnormal involuntary movement (AIM) scores of rats were ecorded and analyzed. Results There was no significant behavior changes recorded in RAPA low dose subgroup. Rats in RAPA high dose subgroup appeared some problems such as listlessness, loss of appetite and hematuria after administration of Rapamycin for a few days, and died in about 5-10 d. The autopsy and pathologic diagnosis approved that the animals died due to pneumonia, liver and kidney function damage. The behavioral changes in RAPA middle dose subgroup were satisfying, and the animals showed well tolerance without rats died. After RAPA treatment, the dayly total AIM scores of the rats in RAPA middle dose subgroup were significantly lower than that in LID group (allP<0.05). The AIM scores of the RAPA middle dose subgroup within 120 min at 20 d after levodopa treatment were significantly lower than LID group (allP<0.05). Conclusion Rapamycin therapy can significantly improve the behavioral performance of LID rats, improve the involuntary movement symptoms of LID rats.
Parkinson’s disease;levodopa induced dyskinesia;Rapamycin;behavioristics
国家自然科学基金(31260241)
442000湖北省十堰市太和医院(湖北医药学院附属太和医院)神经康复科(张丙天,何晓阔);江苏省宝应县人民医院神经内科(缪茂军);海南医学院附属医院神经内科(陈小武,陈志斌);华中科技大学同济医学院附属协和医院神经内科(曹学斌)
陈志斌
R742.5
A
1004-1648(2017)02-0116-04
2016-03-29
2016-05-09)
——雷帕霉素

