农杆菌侵染条件对玉米单倍体遗传转化的影响
赵爱菊,陈希勇,高增玉,王江浩
(河北省作物遗传育种实验室,河北省农林科学院粮油作物研究所,河北 石家庄 050035)
利用转基因技术对农作物性状进行改良是目前转基因技术在农业上的重要应用,该技术可以突破物种间的遗传障碍、跨越物种间的不亲和性、丰富作物的基因资源,从而达到改良农作物性状的目的[1]。转基因玉米是全球种植面积较大、商业化较早的转基因作物之一,其遗传转化一直备受人们关注[2~8]。到目前为止,虽然对农杆菌介导玉米的遗传转化有很多报道,但大多以幼胚等二倍体为受体材料,且转基因植株需经若干代的自交筛选才能得到纯合的转基因植株,育种程序复杂。随着单倍体和转基因技术的成熟,国内外开始了以单倍体为受体的转基因研究,并且在小麦[9]、水稻[10]、烟草[11]和亚麻[12]等植物上得到了成功应用。玉米的胚芽鞘[13]和茎尖组织[14]等单倍体受体也已经实现了基因转化,但由于植株生长势弱,移栽不易存活,因而未能成为主流的转基因受体。陈琦[15]利用玉米单倍体幼胚和成熟胚为受体材料进行转基因研究,开拓了单倍体转基因的新方向。
玉米单倍体的遗传转化是一个复杂过程,受到多种因素的影响。侵染条件的优化对提高其转化效率具有重要作用。通过继代可以让愈伤组织长时间保持胚性,而胚性愈伤组织是进行侵染的先决条件。截至目前,该方面的报道内容多集中于如何高频率地诱导愈伤组织,而对于继代条件的研究很少。菌株选择是影响转化效率的关键。农杆菌菌株的侵染力在不同玉米基因型之间存在很大差异,因而,不同的玉米自交系对应存在着最为敏感的农杆菌菌株[16]。权瑞党等[17]和庄志扬等[18]认为,高浓度的农杆菌有利于玉米细胞转化,但菌液浓度过高会导致转化率降低。侵染时间过短,农杆菌未吸附或吸附的农杆菌少,会导致转化率不高;而侵染时间过长,则会因农杆菌过度繁殖而造成抑菌困难,也会导致转化率降低。因此,确定农杆菌的最佳侵染条件十分重要。
以HHI69诱导系对改58-2、A220、A218自交系诱导的单倍体为受体材料,在现有二倍体受体材料高效再生的基础上,对影响农杆菌介导玉米单倍体遗传转化的侵染条件进行研究,旨为建立农杆菌介导单倍体遗传转化体系奠定基础。
1 材料与方法
1.1 试验材料
试验用的单倍体幼胚由骨干自交系改58-2、A220和A218与HHI69诱导系杂交得到。待诱导系花粉授粉后9~15 d,幼胚大小为2 mm时摘取玉米果穗。
本研究的农杆菌菌株为LBA4404和EHA105,携带载体质粒为pCAMB IA3300,该质粒带有组成型启动子CaMV35S。所用目的基因及质粒表达载体,均由中国农业大学倪中福老师提供。
1.2 试验方法
1.2.1 试验设计 本研究分3个试验完成。
1.2.1.1 菌株种类对玉米单倍体愈伤组织侵染力的影响。以自交系改58-2、A220和A218与HHI69诱导系杂交得到的单倍体胚为受体材料,用携带相同载体的LBA4404和EHA105菌株侵染玉米愈伤组织并进行共培养2.5 d。取愈伤组织进行GUS染色,根据GUS染色率判断不同菌株的侵染力。
1.2.1.2 侵染浓度和侵染时间对玉米单倍体愈伤组织侵染力的影响。使用携带载体的EHA105,将自交系改58-2与HHI69杂交的单倍体愈伤组织浸泡在OD600(侵染浓度) 分别为0.4、0.5、0.6、0.7、0.8的菌液中侵染10、20、30 min,用无菌纸将愈伤表面残余菌液吸干,置培养基(100 mg/L AS) 上25℃共培养2.5 d。将愈伤组织转入含有250 mg/L羧苄青霉素的恢复培养基上,暗培养14 d。取愈伤组织进行GUS染色,根据GUS染色率判断不同侵染浓度和侵染时间的侵染力。
1.2.1.3 继代时间对遗传转化的影响。将诱导的愈伤组织继代培养,将继代不同时间(4、6、8、10、12、15 d) 的愈伤组织浸泡在OD600为0.7~0.8的侵染液中侵染30 min,经筛选后统计抗性愈伤组织的数目,计算抗性愈伤组织率。
1.2.2 GUS染色 参照Jefferson[19]的方法,取共培养过的愈伤组织放入GUS染色液中,37℃温浴4~6 h,统计GUS表达的愈伤数。根据公式,计算愈伤组织的GUS瞬时表达率∶
GUS瞬时表达率=GUS表达的愈伤数/愈伤总数×100%
2 结果与分析
2.1 菌株种类对玉米单倍体愈伤组织侵染力的影响
相同菌株条件下,改58-2单倍体愈伤组织的GUS瞬时表达率均明显高于自交系A220和A218(图1),表明侵染力在不同的玉米基因型之间存在差异。相同玉米基因型条件下,EHA105菌株的侵染力均>LBA4404菌株,且使用EHA105菌株侵染的愈伤组织表面的蓝斑面积明显大于使用LBA4404菌株侵染(图2),表明使用EHA105菌株侵染转移到玉米愈伤组织中的T-DNA量大于使用LBA4404菌株侵染。但是,EHA105菌株侵染在提高瞬间表达率的同时,也有可能对玉米单倍体愈伤组织造成的伤害比使用LBA4404菌株侵染要大。因此,在后期的共培养中,应严格控制共培养环境,避免农杆菌过度生长。

图1 菌株种类对玉米单倍体愈伤组织侵染力的影响Fig.1 Effects of infectivity of different agrobacterium strains to maize haploid callus

图2 不同菌株侵染的玉米单倍体愈伤组织的蓝斑面积Fig.2 The area of blue spot of maize haploid callus infected by different agrobacterium strains
2.2 侵染浓度和侵染时间对玉米单倍体愈伤组织侵染力的影响
在农杆菌介导转化中,侵染过程直接影响到转化成功与否。侵染时间为10 min时,GUS染色率随着菌液OD600的增大而逐渐提高;侵染时间为20和30 min时,GUS染色率均随菌液OD600的增大呈先升高后降低的变化趋势,且均以菌液OD600=0.7时最大。侵染时间为20 min条件下,菌液OD600=0.7时的GUS染色率(最大值) 为55.86%,菌液OD600=0.8时GUS染色率较菌液OD600=0.7时略有下降;侵染时间为30 min条件下,菌液OD600=0.7时的GUS染色率(最大值) 为65.31%,菌液OD600=0.8时GUS染色率下降到55.26%。表明菌液浓度过高、侵染时间过长会引起农杆菌过度生长而抑制愈伤组织的正常生长,致使染色出现下降。
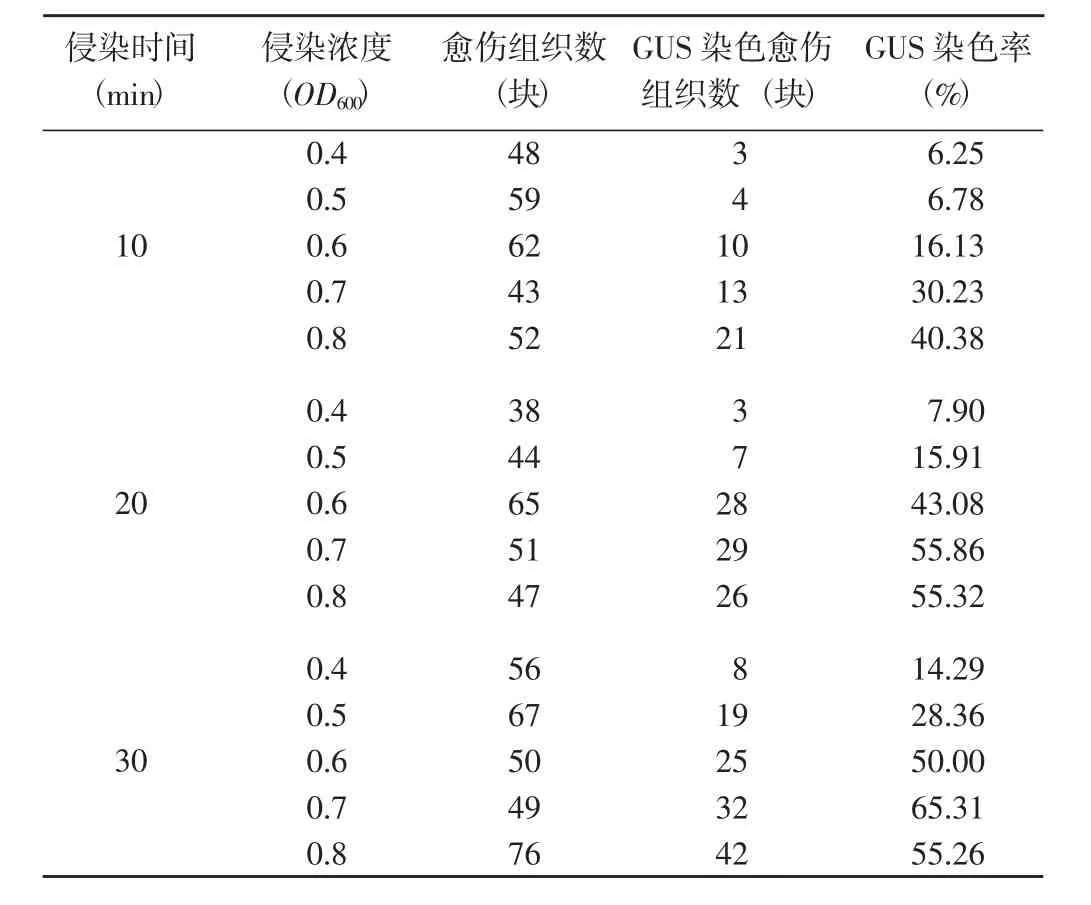
表1 侵染时间和侵染浓度对玉米单倍体愈伤组织侵染力的影响Tabel 1 Effects of different infection time and concentration on the infectivity of maize haploid callus
2.3 继代时间对玉米愈伤组织遗传转化的影响
抗性愈伤组织率随着愈伤组织继代天数的增加呈先上升后降低的变化趋势,且不同继代天数处理的差异较大(图3)。表明胚性愈伤组织状态的差异直接影响遗传转化的效果。其中,继代8 d的抗性愈伤组织率最高,达到了60.7%;当继代10 d后再进行侵染,其抗性愈伤组织率下降到55.2%;继代12和15 d的胚性愈伤组织转化后抗性愈伤组织率分别为38.1%和14%,明显低于继代8 d的抗性愈伤率。可以看出,继代8 d后的胚性愈伤组织最适宜农杆菌转化。

图3 继代时间对抗性愈伤组织率的影响Fig.3 Effect of subculture time on resistant callus rate
3 结论与讨论
以单倍体为转基因受体,得到的阳性植株经染色体加倍便可得到纯合的二倍体植株,避免了基因沉默、基因丢失等现象的发生。因此,以单倍体为受体的转基因技术越来越受到人们的关注。但农杆菌介导单倍体的遗传转化是一个复杂过程,受多种因素的影响。因此,需要对转化条件进行优化,以使其达到最好的转化效果。以玉米单倍体的幼胚作为受体,针对影响转化的因素进行了研究。重点是利用毒力较强的EHA105菌株在合适的菌液浓度和侵染时间条件下侵染处于生长高峰的愈伤组织,以提高GUS基因的瞬时表达率和抗性愈伤组织率。研究结果显示,相同玉米基因型条件下,EHA105菌株的GUS染色率高于LBA4404菌株,侵染的愈伤组织的蓝斑面积也较LBA4404菌株大,这与Rashid等[20]和Huang等[21]的研究结果相同。这可能是由EHA105所携带的Ti质粒pTiBo542决定的[22]。由于EHA105菌株毒力高,所以在后期的共培养中,应严格控制共培养环境,避免农杆菌过度生长。
侵染阶段是影响单倍体遗传转化效率的重要阶段,因为单倍体愈伤组织的细胞壁较二倍体厚,所以农杆菌的侵染浓度和侵染时间较二倍体会有所不同,需要进一步摸索。本研究结果表明,单倍体愈伤组织在OD600=0.7的菌液中侵染30 min条件下侵染效果最理想。
Vasil等[23]研究显示,随着培养时间的延长,愈伤组织的再生能力会逐渐下降。袁鹰等[24]研究结果表明,农杆菌侵染继代5 d左右的愈伤组织效果最佳;侵染继代时间过短或过长,侵染效果均不理想。状态优良的愈伤组织是进行侵染的关键时期。本研究条件下,在继代过程中愈伤组织在继代培养的第8天左右出现长势的小高峰,是进行侵染的最好时期。
参考文献:
[1]李建生.玉米分子研究进展[J].中国农业科技导报,2007,9 (2)∶10-13.
[2] Ishida Y,Saito H,Ohta S,Hiei Y,Komari T,Kumashiro T.High efficiency transformation of maize(Zea maysL.)mediated byAgrobacterium tumefaciens[J].Nat Biotechnol,1996,14∶745-750.
[3]黄 璐,卫志明.农杆菌介导的玉米遗传转化[J].实验生物学报,1999,32∶381-389.
[4]张 荣,王国英,张晓红,赵虎基.根癌农杆菌介导的玉米遗传转化体系的建立[J].农业生物技术学报,2001,19(1)∶45-48.
[5] Huang X Q,Wei Z M.High frequency plant regeneration through callus initiation from mature embryos of maize(Zea maysL.)[J].Plant Cell Rep, 2004, 22 (11)∶793-800.
[6] Sidorov V,Gilbertson L,Addae P,Duncan D.Agrobacterium mediated transformation of seedling derived maize callus[J].Plant Cell Rep,2006,25 (4)∶320-332.
[7]钱丹丹,焦 丽,邓 川,李晓薇,张 艳,王庆钰,李景文.玉米胚性愈伤组织继代及侵染条件的优化[J].作物杂志,2011,(2)∶71-74.
[8]王宏伟,梁业红,史振声,张世煌.共培养环境对玉米遗传转化的影响[J].西北农业学报,2011,20(9)∶40-42.
[9]赵爱菊,刘玉平,李亚军,程孟恩,李 辉,王江浩,陈希勇.农杆菌介导小麦花药遗传转化影响因素的研究[J].河北农业科学,2011,15 (2)∶85-87,91.
[10]杨长登,唐克轩.农杆菌介导将雪莲凝集素(GNA) 基因转入釉稻单倍体微芽的初步研究机[J].中国水稻科学,1998,12(3)∶129-133.
[11]王逸群,赵仁贵,王玉兰,孙珊珊.豌豆凝集素基因转化单倍体烟草[J].吉林农业大学学报,2001,23(2)∶21-23.
[12]康庆华,许修宏,李柱钢,徐 涵,关凤芝,刘文萍,张利国.亚麻单倍体抗逆基因的转化[J].中国麻业科学,2006,28(6)∶291-296.
[13]化亚欧,潘光堂,江 舟,杨 珊,林海建,彭焕伟,张志明,罗 旭,马浪浪,李婉蓉,张 兵.单倍体玉米茎尖为受体的转基因育种方法∶中国,CN2012104481 46.3[P].2012.
[14] Zhao C H,Zhang L J,Chao G E.Establishment and optimization of the regeneration system of mature embroyos of maize (Zea maysL.)[J].Agricaltural Sciences in China,2008,7 (9)∶1046-1051.
[15]陈 琦.玉米孤雌生殖单倍体胚遗传转化体系建立的初步研究[D].雅安∶四川农业大学,2015.
[16] PM Bramley, A Mackenzie.Regulation of carotenoid biosynthesis[J].Current Topics in Cellular Regulation,1988,43 (29)∶291-343.
[17]权瑞党,尚 梅,张举仁.农杆菌介导的玉米自交系愈伤组织的转化[J].山东农业科学,2003,(2)∶3-6.
[18]庄志扬,王汉宁,张金文,温睿婷,李永生,郑 琪.农杆菌介导玉米幼胚愈伤组织遗传转化体系的优化[J].甘肃农业大学学报,2010,12(6)∶49-54.
[19] Jefferson RA.Assaying chimeric genes in plants∶ the GUS gene fusion system [J].Plant Mol Biol Rep,1987, (5)∶387-405.
[20] Rashid H,Yokoi S,Toriyama k,Hinata K.Transgenic plant production mediated by agrobacterium in indica rice[J].Plant Cell Rep,1996,15∶727-730.
[21] Huang X,Wei Z.High-frequency plant regeneration through callus inintiation from mture embryos of maize(ZeamaysL.)[ J].Plant Cell Tissue Oran Cult,2004,83∶187-200.
[22] EE Hood,SB Gelvin,LS Melchers,A Hoekema.New agrobacterium helper plasmids for gene transfer to plants[J].Transgenic Research,1993,2 (4)∶208-218.
[23] Vasil I K,Vasil V.Cell culture and somatic cell genetics of plants(vol3)[M].London∶ Academic Press,1986∶121-150.
[24]袁 鹰,李启云,郝文媛,谭 化,孔祥梅,张光弟,刘德璞.农杆菌介导玉米遗传转化影响因子的研究[J].分子植物育种,2006,4(2)∶228-232.

