水酶法提取丝瓜籽油的工艺研究
胡 滨赵 勤刘 勇陈一资张志清苏 赵(四川农业大学食品学院,雅安 6504)(四川农业大学理学院,雅安 6504)
水酶法提取丝瓜籽油的工艺研究
胡 滨1赵 勤1刘 勇2陈一资1张志清1苏 赵1
(四川农业大学食品学院1,雅安 625014)
(四川农业大学理学院2,雅安 625014)
以丝瓜籽为原料,研究水酶法提取丝瓜籽油的最佳工艺并对其脂肪酸组成、理化特性进行分析。经单因素试验与混料试验,确定了水酶法提取丝瓜籽油的分步酶解条件为:首先添加2.0%的复合酶(其中维素酶、果胶酶、半纤维素酶的配比为0.663∶0.237∶0.100),在pH 4.8、温度45℃、液料比7∶1条件下,酶解2.5 h;再加入1.0%的中性蛋白酶,在pH 6.8、温度45℃条件下,酶解1.5 h,最终丝瓜籽油提取率达到93.85%。该油富含不饱和脂肪酸,其酸价、过氧化值等指标符合国家食用油卫生标准。水酶法提取丝瓜籽油是一种有效的油脂提取方法。
丝瓜籽油 水酶法 混料设计 脂肪酸组成 理化特性
丝瓜又名天罗瓜或天吊瓜,是葫芦科一年生攀缘草本植物,原产于印度,在唐末宋初引种到我国。由于它产量高和品质好,既可作蔬菜又可作药用,在我国各地普遍种植。丝瓜籽含有多种营养成分,特别是油脂含量丰富,具有很高的应用价值[1]。随着丝瓜络作为洁具的广泛开发利用,我国有多个省市如浙江、江苏、江西等地大量栽培丝瓜络,所产生的大量丝瓜籽除少数药用以外,大部分被丢弃,造成资源浪费。因此,加快丝瓜籽油提取工艺的研究,不仅能够解决我国食用植物油料资源短缺问题,还可以提供新的优质食用油脂。目前,有关丝瓜籽油提取方法的报道相对较少,已有研究主要集中在溶剂提取法、超声波辅助提取法、及微波辅助提取法等方面[2-3],但采用水酶法提取丝瓜籽油的方法还鲜见报道。水酶法是将酶制剂应用于油脂提取的方法,在对油料种子机械破碎基础上利用酶的降解作用提高油脂的出油率。该法提取油脂反应条件温和,无有机溶剂残留,可同时得到油和蛋白质,目前应用广泛[4]。混料设计是一种特殊的回归设计,它是要合理的选择试验点,通过不同百分比的组合试验,得到试验指标成分百分比的最优回归方程,来探索响应曲面来估计多分量系统的内在规律,现已在多学科领域广泛应用[5]。为此,本试验以丝瓜籽为原料,在单因素试验基础上,采用混料设计优化水酶法提取丝瓜籽油,并对其脂肪酸组成和理化特性进行分析,以期为丝瓜籽油的综合开发利用提供参考。
1 材料与方法
1.1 试验材料
丝瓜籽:成都市国际商贸城中药材专业市场。
纤维素酶(酶活:≥400 U/mg)、果胶酶(酶活:≥500 U/mg)、半纤维素酶(酶活:≥5 U/mg)、酸性蛋白酶(酶活:≥50 U/mg)、中性蛋白酶(酶活:≥50 U/mg)、碱性蛋白酶(酶活:≥200 U/mg):上海瑞永生物科技有限公司。
氢氧化钾、碘化钾、三氯甲烷、冰醋酸等常规试剂均为分析纯。
FW135型中草药粉粹机:天津市泰斯特仪器有限公司;DF-101S型集热式磁力加热搅拌器:金坛市白塔新宝仪器厂;PHS-25型pH计:上海雷磁科学仪器有限公司;LD5-2A型离心机:上海医用离心机厂;7890A型气相色谱仪:安捷伦科技(中国)有限公司。
1.2 试验方法
1.2.1 丝瓜籽主要成分的测定
蛋白质:按照GB 5009.5—2010,采用凯氏定氮法测定;脂肪:按照GB/T 5009.6—2003,采用索氏提取法测定;淀粉:按照GB/T 5009.9—2008,采用酶解法测定;灰分:按照GB 5009.4—2010,采用高温灼烧法测定;水分:按照GB 5009.3—2010,采用直接干燥法测定。
1.2.2 丝瓜籽油的提取方法
1.2.2.1 操作要点
将丝瓜籽去壳后恒温干燥至质量恒定,经粉碎过80目筛,称取一定质量丝瓜籽粉置于三角瓶,加入一定体积蒸馏水,先加入复合酶(纤维素酶、果胶酶、半纤维素酶按一定比例混合),再加入中性蛋白酶,采用分步酶解法提油。酶解结束后,在沸水浴灭酶10 min,经离心(离心转速3 500 r/min,20 min)后,收集上层游离油,再将游离油在105℃下干燥后称量,计算提取率。
丝瓜籽油提取率=(游离油质量/原料脂肪质量)×100%
1.2.2.2 复合酶酶解条件的确定
以提取率为指标,首先研究不同种类酶对提取率的影响;再研究复合酶(设定纤维素酶、果胶酶、半纤维素酶的配比为0.33∶0.33∶0.33,3种酶比例之和为1)在不同pH、温度、液料比、时间及酶添加量条件下对提取率的影响,以确定复合酶的酶解条件。
1.2.2.3 复合酶适宜配比的优化
在单因素试验基础上,按照Design-expert 9.0软件中混料试验设计原理,对复合酶(纤维素酶、果胶酶、半纤维素酶)的不同混合比例进行优化,以确定3种酶的适宜配比。
1.2.2.4 中性蛋白酶酶解条件的确定
为进一步提高提取率,在确定复合酶提取丝瓜籽油的最优参数基础上,进行二次酶解。研究中性蛋白酶在不同pH值、温度、时间和酶添加量条件下对提取率的影响,以确定中性蛋白酶的酶解条件。
1.2.3 丝瓜籽油脂肪酸组成的测定
丝瓜籽油脂肪酸的甲酯化制备按照 GB/T 17376—2008进行;丝瓜籽油脂肪酸的组成分析按照GB/T 17377—2008进行。
GC分析条件:HP-FFAP型石英毛细管柱(30 m×0.32 mm×0.25 μm);载气为高纯氮气(纯度≥99.999%);恒流模式,流量为2 mL/min;尾吹气为氮气,流量为28 mL/min;检测器温度为300℃,空气流量为400 mL/min,氢气流量为30 mL/min;升温程序:初始温度60℃,以10℃/min速率升至220℃,保持10 min;进样口温度为220℃,进样量1 μL,分流进样,分流比10∶1。
1.2.4 丝瓜籽油理化指标的测定
水分及挥发物含量:按照GB/T 5528—2008《动植物油脂水分及挥发物含量测定》测定;相对密度:按照GB/T 5526—1985《植物油脂检验比重测定法》测定;皂化值:按照GB/T 5534—2008《动植物油脂皂化值的测定》测定;碘值:按照GB/T 5532—2008《动植物油脂碘值的测定》测定;酸价和过氧化值:按照GB/T 5009.37—2003《食用植物油卫生标准的分析方法》测定。
2 结果与分析
2.1 丝瓜籽主要成分分析
丝瓜籽主要成分分析结果见表1。

表1 丝瓜籽主要成分含量
2.2 酶的种类对提取率的影响
在预试验基础上,将原料粉粹过80目筛,分别研究不同种类酶对提取率影响。具体酶解条件为:纤维素酶添加量2.0%、pH 4.5、时间2.0 h、温度45℃、液料比6∶1;果胶酶添加量2.0%、pH 5.0、时间2.0 h、温度50℃、液料比6∶1;半纤维素酶添加量2.0%、pH 4.5、时间2.0 h、温度45℃、液料比6∶1;酸性蛋白酶添加量2.0%、pH 3.5、时间2.0 h、温度55℃、液料比6∶1;中性蛋白酶添加量2.0%、pH 7.0、时间2.0 h、温度45℃、液料比6∶1;碱性蛋白酶添加量2.0%、pH 8.0、时间2.0 h、温度50℃、液料比6∶1。结果见图1。
由图1知,在相同的酶添加量条件下,不同酶在各自较适宜酶解条件下对丝瓜籽油的提取率差异较大。其中纤维素酶提取效果较好,果胶酶、中性蛋白酶次之。由于植物细胞壁是以纤维素为骨架,并与半纤维素、果胶及蛋白质等大分子结合而成,单一酶无法将细胞壁完全破裂,单独使用效果有限,故考虑将酶复配使用,以提高提油率[6]。Zhang等[7]在研究水酶法提取月桂树叶油时也认为,单一酶很难将细胞壁完全分解,将酶复配后使用可明显提高提取率。此外,细胞壁内侧还有一层由蛋白质和脂类组成的细胞膜,使得部分油脂以脂蛋白形式存在。彭瑶瑶等[8]在研究水酶法提取牡丹籽油时也认为,分步酶解法可以显著提高提取率。因此本试验采用分步酶解法提取丝瓜籽油,先加入复合酶(纤维素酶、果胶酶、半纤维素酶按一定比例混合)破壁,再加入中性蛋白酶降解蛋白质,这样能使细胞壁中的油脂得到充分释放,以提高提取率。

图1 不同种类酶对提取率的影响
2.3 复合酶酶解条件的确定
2.3.1 pH对提取率的影响
在温度45℃、液料比6∶1、时间2.0 h、复合酶(设定纤维素酶、果胶酶、半纤维素酶的配比为0.33∶0.33∶0.33,3种酶的比例之和为1)添加量2%条件下,研究不同pH对提取率影响,结果见图2。
由图2知,在pH 4.0~4.8范围内,提取率随着酶解pH的升高而迅速增加;在pH 4.8时达到最高,提取率为61.38%;但当pH超过4.8时,提取率随pH升高而下降。这可能与复合酶的最适酶解pH有关,当酶解pH偏离其最适pH时酶活下降,对细胞壁破裂效果降低,不利于油脂释出。因此,本试验适宜酶解pH为4.8。

图2 不同pH和温度对提取率的影响
2.3.2 酶解温度对提取率的影响
在pH 4.8、液料比6∶1、时间2 h、复合酶添加量2%条件下,研究不同酶解温度对提取率影响,结果见图2。
由图2知,酶解温度由40℃升至45℃时,提取率上升;在45~50℃范围内,提取率最高;但温度超过50℃时,提取率随着温度升高而降低。这是因为在一定温度范围内,随着反应温度升高反应物能量增加,分子间接触频率在单位时间内增加,反应速度加快;当反应体系温度高于酶的最适温度时,能量被酶分子过量吸收,酶蛋白变性,其活性减弱甚至丧失催化活性,从而降低酶解反应速度。林莉等[9]在采用水酶法提取薏米糠油也时证实,酶解过程中若温度过高,提取率下降。因此,本试验适宜酶解温度为45℃。
2.3.3 液料比对提取率的影响
在pH 4.8、温度45℃、时间2 h、复合酶添加量2%条件下,研究不同液料比对提取率影响,结果见图3。
由图3知,当液料比在5∶1至7∶1的范围内,随着液料比增加,提取率快速上升;在液料比为7∶1时达到最高,为63.83%。这可能是酶解时随着水分的不断加入有利于酶和酶解物质的扩散,对酶解有利。当液料比大于7∶1时,提取率反而有所下降,可能是加水过量降低了酶与底物的浓度,使得酶与底物的碰撞概率下降,提取率降低。李静等[10]在采用水酶法提取牡丹籽油时也证实,随着液料比增加,提取率先上升后下降,与本研究结论类似。因此,在本试验适宜液料比为7∶1。

图3 不同液料比和时间对提取率的影响
2.3.4 酶解时间对提取率的影响
在pH 4.8、温度45℃、液料比7∶1,复合酶添加量2%条件下,研究不同酶解时间对提取率影响,结果见图3。
由图3知,在酶解的前2.5 h内,随着酶解时间延长提取率增加;在2.5 h达到最高值66.68%;但在2.5 h以后,提取率增加缓慢。这是由于当酶解反应进行到一定时间以后,由于底物减少,使得酶与底物的反应已基本完成,提取率不再增加。徐凤敏等[11]在采用水酶法提取枸杞籽油时也证实,随着酶解时间延长,提取率上升一定程度后不再增加,与本研究结论类似。因此,本试验适宜酶解时间为2.5 h。
2.3.5 复合酶添加量对提取率的影响
在pH 4.8、温度45℃、液料比7∶1、时间2.5 h条件下,研究复合酶不同添加量对提取率影响,结果见图4。由图4知,酶添加量由1.0%增加至2.0%时,提取率显著增加;酶量在2%时,提取率达到最高值;当超过2%以后,继续增加酶量,对提取率影响不大。这是由于混合酶可降解细胞壁中的纤维素、果胶、半纤维素等物质,酶量增加,反应速率加快,细胞壁破溃彻底,越有利于细胞壁内油脂释放。但酶量增至一定量后,由于底物浓度不变,继续增加酶量对提取率影响不大。祖亭月等[12]在采用水酶法提取橡胶籽油时证实,随着复合酶用量增加,提取率上升至一定程度后趋于稳定,与本研究结论类似。因此,本试验适宜的复合酶添加量为2%。

图4 复合酶的不同添加量对提取率的影响
2.3.6 混料试验
2.3.6.1 混料试验模型的建立
采用Design-expert 9.0软件中混料试验设计,选择纤维素酶添加比例(A)、果胶酶添加比例(B)和半纤维素酶添加比例(C)为自变量,以提取率(Y)为响应值,将三种酶百分含量分别限定在0.1≤A<1,0.1≤B<1,0.1≤C<1范围内,且A+B+C=1 (100%)。经过软件自动优化处理后,生成各因素的试验方案进行试验,结果见表2。
由软件对表2数据优化分析,得到Y与A、B和C回归方程模型:
Y=57.98A+61.12B+56.51C+62.65AB+ 45.98AC-2.60BC-103.77ABC+156.07(A-B)+ 14.36(A-C)+48.56(B-C)
2.3.6.2 混料试验模型的显著性检验
对混料回归方程模型进行方差分析和可信度分析,结果见表3。
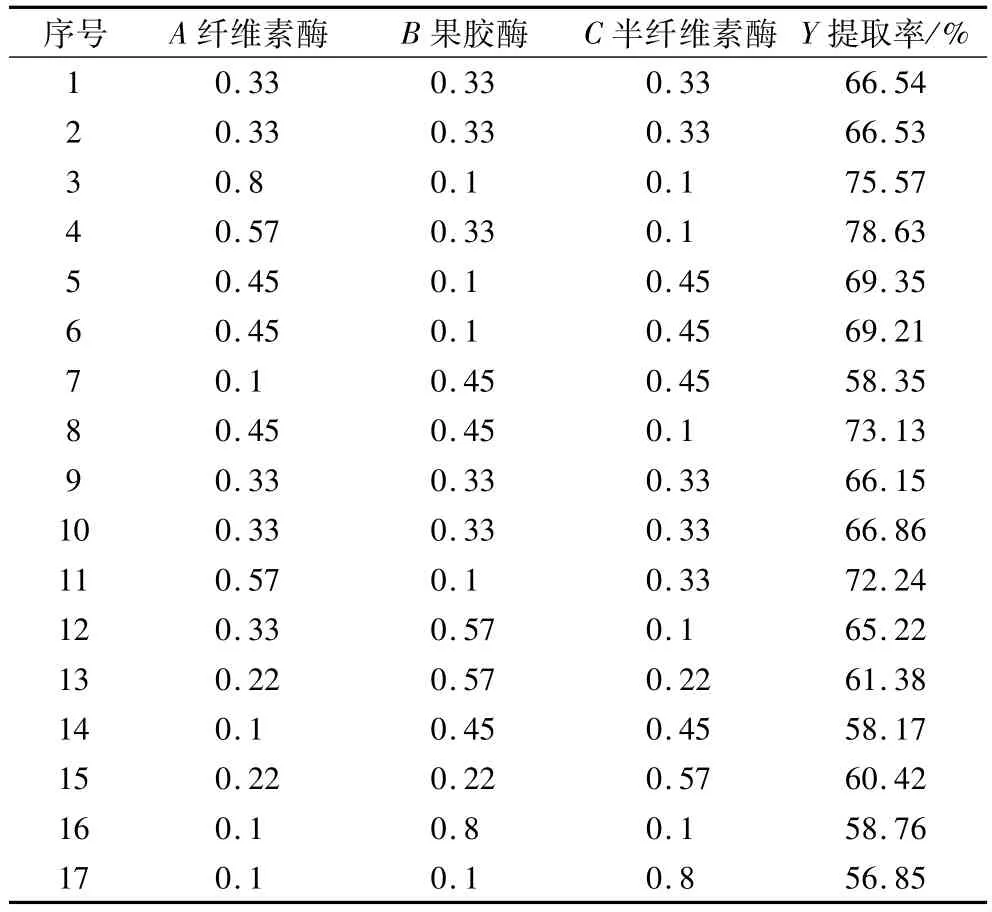
表2 混料设计试验方案及结果
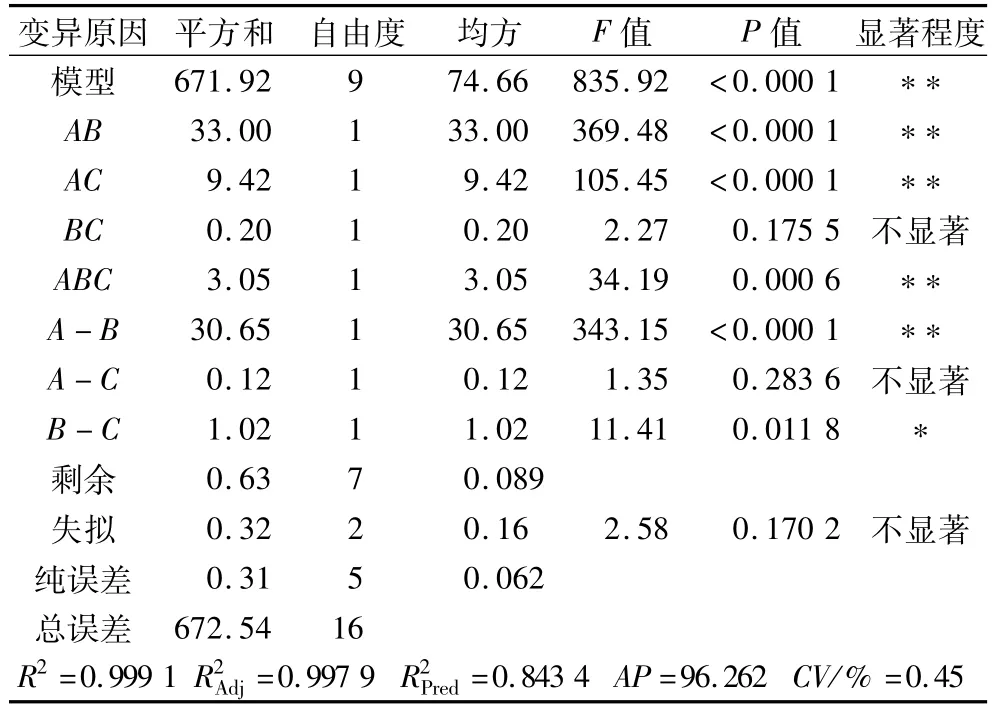
表3 回归方程方差分析结果
由表3可知,该回归方程模型极显著(P<0.01),失拟项不显著(P>0.05),表明该回归方程拟合度好,误差小,可以用该方程对不同条件下的提取效果进行分析和预测。
通过对回归方程进行可信度分析表明,R2(回归方程相关系数)为0.999 1,(回归方程的校正决定系数)为0.997 9,(预测复相关系数)为0.843 4,表明该方程可以解释响应值变化的99.91%;AP(信噪比)为96.262,远大于4,且 CV(变异系数)为0.45%,表明回归方程的拟合度和可信度均很高。通过P值可知ABC三因素间的交互作用对试验结果影响极显著(P<0.01)。3种酶交互作用的等高线图和响应面图见图5。

图5 三因素交互作用对提取率影响的等高线图和响应面图
由图5可知,当果胶酶用量较高,纤维素酶和半纤维素酶用量较少,或半纤维素酶用量较高,纤维素酶和果胶酶用量较少时,提取率大概在60%左右。而当纤维素酶用量较高,果胶酶和半纤维素酶用量较少时,提取率较高,为80%左右。这表明3种酶在酶解过程中,纤维素酶起到了主导作用,但是果胶酶和半纤维素酶对提取率同样有所贡献。由于响应面图出现了曲面,说明3种酶之间存在交互作用。因此在酶解过程中,将3种酶适宜配比后组成的混合酶系对油脂提取可产生协同作用,显著提高提取率。2.3.6.3 验证试验
通过Design expert 9.0软件求解方程,得出理想的混合酶配比为:纤维素酶添加比例0.663、果胶酶添加比例0.237及半纤维素酶添加比例0.100,此时理论提取率为80.91%。为验证该配比的可靠性,进行3次验证试验,提取率平均值为80.62%,与理论预测值基本吻合。这也表明将纤维素酶、果胶酶和半纤维素酶按比例混合后进行酶解,其提取率明显高于单一酶的提取率。
2.4 中性蛋白酶酶解条件的确定
为进一步提高提取率,在上述复合酶最优酶解条件下,研究中性蛋白酶的最佳酶解条件。
2.4.1 pH对提取率的影响
在温度45℃,时间1.0 h、酶添加量1.0%条件下,研究不同pH对提取率影响,结果见图6。
由图6知,在pH 6.0~6.8范围内,随着pH增加,提取率逐渐增加,当pH在6.8时提取率有最大值;而后随着pH增加,提取率逐渐降低。这可能是由于中性蛋白酶的最适pH在6.8附近,此时酶活最高,酶对底物的作用效果明显,提取率较高。因此,本试验适宜pH为6.8。
2.4.2 温度对提取率的影响
在pH 6.8,时间1.0 h、酶添加量1.0%条件下,研究不同温度对提取率影响,结果见图6。
由图6知,酶解温度在45℃附近时提取率出现最大值,这可能是中性蛋白酶适宜的酶活温度,酶催化活性最强。但温度过高会使酶变性,酶活降低。此外,较高温度会使丝瓜籽油的某些成分挥发或者造成丝瓜籽油的分解,导致提取率下降。因此,本试验适宜酶解温度为45℃。
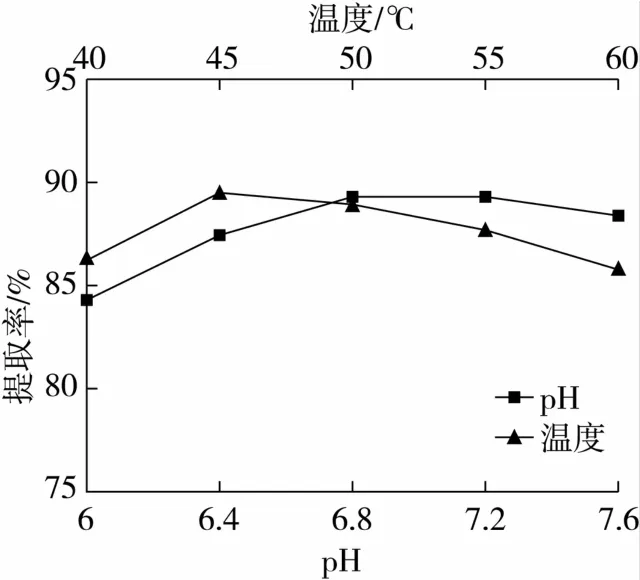
图6 不同pH和温度对提取率的影响
2.4.3 时间对提取率的影响
在pH 6.8,温度45℃、酶添加量1.0%条件下,研究不同时间对提取率影响,结果见图7。
由图7知,在酶解1.5 h之前提取率随酶解时间的延长上升,但酶解1.5 h之后提取率变化不明显。这说明随着酶解进行,反应底物不断减少,油脂释放不再增加。因此,本试验适宜酶解时间为1.5 h。
2.4.4 酶添加量对提取率的影响
在pH6.8,温度45℃、时间1.5 h条件下,研究酶不同添加量对提取率影响,结果见图7。
由图7知,当酶添加量为1.0%时,提取率最高,达到93.85%;当酶添加量超过1.0%时,提取率下降。由此可见,蛋白酶的添加能进一步提高提取率。因为蛋白酶不仅能进入到脂质体内,对脂蛋白起到水解作用,有利于油脂释放;还可对水解过程中形成的、包裹在油滴外由磷脂和蛋白质结合的蛋白膜进行降解,产生破乳作用,实现油水分离而增加提取率。但蛋白酶添加过量,可使酶分子间产生竞争抑制效应和自溶反应,会导致提取率下降[13]。韩宗元等[14]在采用水酶法提取大豆油时证实,随着蛋白酶用量增加,提取率先上升后下降,与本研究结论类似。因此,本试验适宜的酶添加量为1.0%。
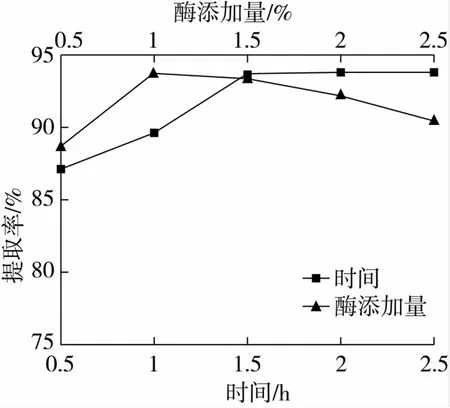
图7 不同时间和酶添加量对提取率的影响
2.5 丝瓜籽油的脂肪酸组成
将水酶法提取得到的丝瓜籽油,经甲酯化处理后进行GC分析,得到总离子流色谱图如图8所示。
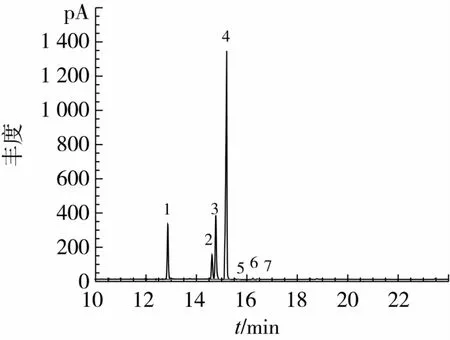
图8 丝瓜籽油GC的总离子流图
由图8知,丝瓜籽油共分离鉴定出7个峰,采用峰面积归一法确定了各组分的相对含量,结果见表4。
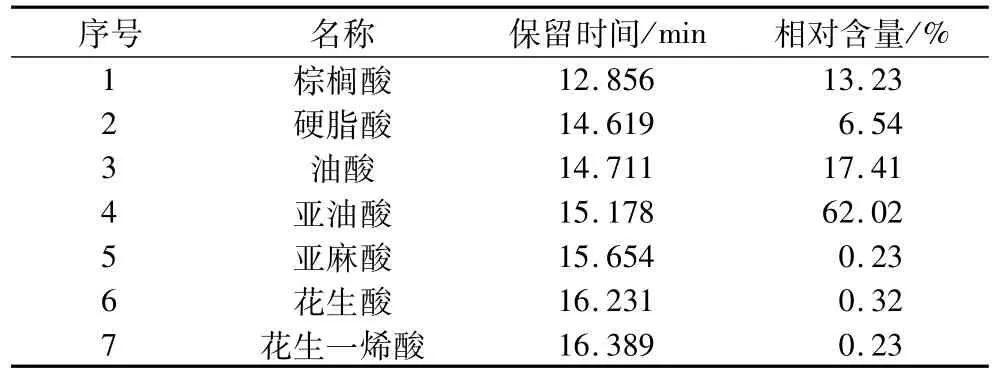
表4 丝瓜籽油的主要脂肪酸组成及含量
由表4知,本试验得到的丝瓜籽油中不饱和脂肪酸含量超过80%,尤其亚油酸含量高达62.02%。这与董海洲等[15]采用浸提法提取、曹秀军等[16]分别采用溶剂法和超声波辅助提取法得到的脂肪酸组成相类似,说明本工艺没有对瓜籽油脂肪酸组成产生影响,表明本工艺提油具有可行性。
2.6 丝瓜籽油的理化指标检测
由表5可知,丝瓜籽油的水分及挥发物含量较低,相对密度值在0.90~0.97的正常范围之内。皂化值为182.68 mg/g,说明其分子质量中等。碘值为96.73,属于不干性油,这主要与其富含亚油酸和油酸有关。酸价和过氧化值指标符合均符合GB 2716—2005,表明本试验获得的丝瓜籽油新鲜程度高,品质较好。

表5 丝瓜籽油的理化指标测定结果
3 结论
3.1 通过单因素试验和混料试验,确定了水酶法提取丝瓜籽油的分步酶解条件为:首先添加2.0%的复合酶(其中维素酶、果胶酶、半纤维素酶的配比为0.663∶0.237∶0.100),在pH 4.8、温度45℃、液料比7∶1条件下,酶解2.5 h;再加入1.0%的中性蛋白酶,在pH 6.8、温度45℃条件下,继续酶解1.5 h,最终丝瓜籽油提取率达到93.85%。通过验证试验,证实了该工艺具有可靠性。
3.2 将本试验条件下获得的丝瓜籽油进行脂肪酸组成分析,其不饱和脂肪酸含量较高,尤其亚油酸含量高达62.02%,同时还含有一定量的油酸,表明丝瓜籽油具有较高的营养价值。该油的酸价、过氧化值等指标均符合GB 2716—2005《食用植物油卫生标准》,无须精炼,节约了油脂加工成本,这也表明水酶法提取丝瓜籽油作为食用油开发具有很大潜力。
所以,混料设计辅助水酶法提取丝瓜籽油,具有工艺设备简单、提取条件温和、操作安全等特点,应用前景广阔。
[1]吕名秀,王秀娟,卢奎,等.丝瓜籽蛋白提取工艺的研究[J].中国油脂,2013,38(8):18-21 Lu Mingxiu,Wang Xiujuan,Lu Kui,et al.Extraction of luffa seed protein[J].China Oils And Fats,2013,38(8):18-21
[2]闵嗣璠,周雯雯,王纯荣.不同方法提取丝瓜籽油的工艺研究[J].中国粮油学报,2010,25(4):34-37 Min Fifan,Zhou Wenwen,Wang Chunrong.Extraction of luffaseed oil by different methods[J].Journal of the Chinese Cereals and Oils Association,2010,25(4):34-37
[3]杨杰,张金生,李丽华,等.响应面法优化微波辅助提取丝瓜籽油的研究[J].林产化学与工业,2013,33(4):128-132 Yang Jie,Zhang Jinsheng,Li Lihua,et al.Optimization of microwave-assisted extraction of luffa seed oil by response surface analysis[J].Chemistry and Industry of Forest Products,2013,33(4):128-132
[4]Teixeiraa C B,Macedo G A,Macedo J A,et al.Simultaneous extraction of oil and antioxidant compounds from oil palm fruit (Elaeis guineensis)by an aqueous enzymatic process[J]. Bioresource Technology,2013,129:575-581
[5]Sarteshnizi R A,Hosseini H,Bondarianzadeh D,et al.Optimization of prebiotic sausage formulation:effect of using βglucan and resistant starch by D-optimal mixture design approach[J].LWT-Food Science and Technology,2015,62 (1):704-710
[6]Yusoff M M,Gordon M H,Niranjan K.Aqueous enzyme assisted oil extraction from oilseeds and emulsion de-emulsifying methods:A review[J].Trends in Food Science and Technology,2015,41(1):60-82
[7]Zhang Y L,Li S,Yin C P,et al.Response surface optimisation of aqueous enzymatic oil extraction from bayberry(Myrica rubra)kernels[J].Food Chemistry,2012,135(1):304-308
[8]彭瑶瑶,王千千,王爱梅,等.水酶法提取牡丹籽油的研究[J].中国油脂,2014,39(6):12-17 Peng Yaoyao,Wang Qianqian,Wang Aimei,et al.Aqueous enzymatic extraction of paeonic suffruticosa seed oil[J].China Oils And Fats,2014,39(6):12-17
[9]林莉,秦礼康,刘荣林,等.响应面法优化水酶法提取薏米糠油工艺研究[J].中国油脂,2015,40(4):1-5 LinLi,Qin Likang,Liu Ronglin,et al.Optimization of aqueous enzymatic extraction of adlay bran oil by response surface methodology[J].China Oils And Fats,2015,40(4):1-5
[10]李静,姚茂君,李俊,等.响应面法优化牡丹籽油的水酶法提取工艺[J].中国油脂,2014,39(10):14-18 Li Jing,Yao Maojun,Li Jun,et al.Optimization of aqueous enzymatic extraction of peony seed oil by response surface methodology[J].China Oils And Fats,2014,39(10):14-18
[11]徐凤敏,赵扬.水酶法提取枸杞籽油工艺优化[J].食品与机械,2014,30(2):219-213 Xu Fengmin,Zhao Yang.Optimization of aqueous enzymatic method extraction of lycium seed oil by quadratic orthogonal rotation design[J].Food and Machinery,2014,30(2):219-213
[12]祖亭月,何美莹,张连富.水酶法提取橡胶籽油的工艺研究[J].中国粮油学报,2013,28(2):37-42 Zu Tingyue,He Meiying,Zhang Lianfu.Study on aqueous enzymatic extraction of oil from rubber seeds[J].Journal of the Chinese Cereals and Oils Association,2013,28(2):37-42
[13]Rosenthal A,PyleD L,Niranjan K.Aqueous and enzymatic processes for edible oil extraction[J].Enzyme and Microbial Technology,1996,19(6):402-420
[14]韩宗元,江连洲,李杨,等.水酶法提取大豆油的扩大试验研究[J].中国粮油学报,2015,30(2):37-43 Han Zongyuan,Jiang Lanzhou,Li Yang,et al.Scale-up of soybean oil from enzyme-assisted aqueous extraction Pcocessing[J].Journal of the Chinese Cereals and Oils Association,2015,30(2):37-43
[15]董海洲,刘传富,王强.丝瓜籽油浸提最佳工艺条件及其理化特性的研究[J].中国粮油学报,2009,24(9):61-65 Dong Haizhou,Liu Chuanfu,Wang Qiang.Extraction technology of luffa seed oil[J].Journal of the Chinese Cereals and Oils Association,2009,24(9):61-65
[16]曹秀军,卢文昱,倪英萍.超声波辅助提取法对丝瓜籽油的理化性质及成分的影响[J].阜阳师范学院学报:自然科学版,2011,28(3):62-65. Cao Xiujun,Lu Wenyu,Ni Yingping.Influence on physicochemical properties and ingredient of luffa cylindrica seed oil By ultrasound assisted extraction[J].Journal of Fuyang Teachers College(Natural Science),2011,28(3):62-65.
Research on Process of Aqueous Enzymatic Extraction of Luffa Seed Oil
Hu Bin1Zhao Qin1Liu Yong2Chen Yizi1Zhang Zhiqing1Su Zhao1
(College of Food,Sichuan Agricultural University1,Yaan 625014)
(College of Science,Sichuan Agricultural University2,Yaan 625014)
Research on optimal process of aqueous enzymatic extraction of luffa seed oil was done based on taking luffa seed as raw material and analysis of its composition of fatty acid and physicochemical property was done.On the basis of single-factor test and mixture experiment,the step-by-step enzymolysis conditions of aqueous enzymatic extraction of luffa seed oil were determined:firstly adding 2.0%of complex enzyme(where rate of cellulose,pectinase and hemicellulose:0.663∶0.237∶0.100)in the case of pH value of 4.8,temperature of 45℃ and ratio of material and solution of 7∶1,enzymolysis for 2.5 h was done,followed by use of dosage of neutral protease 1.0%,in the case of pH value of 6.8 and temperature of 45,enzymolysis for 1.5 h was done.In the end,optimal extraction rate of luffa seed oil reached 93.85%.The oil was rich in unsaturated fatty acids and its acid value,peroxide value,etc.conformed to national hygiene standard for edible vegetable oil.Aqueous enzymatic extraction of luffa seed oil was an effective way for oil extraction.
luffa seed oil,aqueous enzymatic extraction,mixture design,fatty acid composition,physicochemical property
TS229
A
1003-0174(2017)03-0061-08
四川省教育厅课题(2014-450-55)
2015-07-22
胡滨,男,1975年出生,副教授,营养与食品卫生学
张志清,男,1976年出生,教授,粮油食品加工工艺学

