油茶籽油甘三酯组成的NARP-HPLC-EISD分析及其在高温处理过程中的降解研究
王进英 钟海雁 冯 纳 周 波(中南林业科技大学食品科学与工程学院;稻谷及副产物深加工国家工程实验室;经济林育种与栽培国家林业局重点实验室,长沙 410004)
油茶籽油甘三酯组成的NARP-HPLC-EISD分析及其在高温处理过程中的降解研究
王进英 钟海雁 冯 纳 周 波
(中南林业科技大学食品科学与工程学院;稻谷及副产物深加工国家工程实验室;经济林育种与栽培国家林业局重点实验室,长沙 410004)
油茶籽油甘三酯在优化条件下得到良好分离,在14种甘三酯中含量水平前三的分别为OOO +SLO(74.21%)、OOP(10.64%)和OOL+SLL(5.19%)。方差分析表明来自不同产地的油茶籽油甘三酯分布情况存在差异。油茶籽油在深层煎炸过程(180℃)中甘三酯的总体损失率为47.85%,ECN40、ECN42、ECN44、ECN46、ECN48和ECN50区的甘三酯损失率分别为86.73%、91.52%、75.97%、45.01%和55.30%。LLL和PPL历经40 h煎炸后完全降解。与深层煎炸油样相比,加热(180℃)样品中甘三酯的降解程度相对降低。偏相关分析表明油茶籽油甘三酯在深层煎炸过程中的降解速率与极性组分的生成速率呈负相关。
油茶籽油 甘三酯 无水反相高效液相色谱-蒸发光散射检测器 高温处理
甘三酯是通过酯键将脂肪酸连接到甘油骨架上组成的,它是油脂的主要成分(95%~98%)。甘三酯的总碳原子数,脂肪酸不饱和程度,双键位置及脂肪酸在甘油骨架上的立体异构等特性决定了油脂的理化及生物学特性。油脂中的甘三酯组成分析是一项艰巨的任务。应用不同的分离技术如薄层色谱[1]、固相萃取[2]和制备型高效液相色谱[3]对甘三酯进行纯化。纯化或未纯化的的甘三酯随后通过不同的色谱方法如高效液相色谱[4]、高温气相色谱[5]和薄层色谱[1]等进行分离,其中高效液相色谱是最常用的方法。甘三酯高效液相色谱分析中可用的检测器有紫外[6-7]、示差[8-9]、蒸发光散射[10]和质谱[11]等。其中,蒸发光散射检测器不仅对流动相没有吸收还可以进行梯度洗脱,而且其灵敏度仅次于质谱。在分析甘三酯众多的方法中,无水反相高效液相色谱-蒸发光散射检测器(NARP-HPLC-ELSD)法是最常用的。
油脂甘三酯分析在油脂分析中应用广泛,如将甘三酯分析与统计学结合可解决油脂品种[12],产地[13],不同处理的品质[14]等的识别及掺伪[15]研究。此外,甘三酯在高温处理过程中历经氧化,水解,异构化及聚合等作用后会产生挥发性组分,水解产物,氧化三酰甘油单体,环化物,反式结构化合物,聚合物等物质。了解高温处理条件下甘三酯降解的反应机制及其产物,有助于阐明甘三酯的热氧化稳定性,从而控制油脂高温处理操作。本试验在优化油茶籽油中甘三酯分析条件的基础上,对不同产地油茶籽油的甘三酯分布及其在深层煎炸中的降解进行了研究。
1 材料与方法
1.1 试验材料
研究所用的油茶籽油样品如表1所示。

表1 油茶籽油样品信息表
1.2 仪器与试剂
1.2.1 仪器
Shimadzu LC-20AD高效液相色谱仪(配备有CMB-20A控制器、LC-20AD二元泵、SIL-20A自动进样器和CTO-10AS柱温箱):日本Shimadzu公司;2000ES-蒸发光散射检测器:美国奥泰科技(中国)有限公司;ZORBAX SB-C18分析型色谱柱(4.6 mm×250 mm;5 μm),美国Agilent公司;XW-80A涡旋混合器:上海金科实业有限公司:HY-81煎炸锅(50~200℃):广州港洋机电设备有限公司;AL204型电子天平:Mettler Toledo仪器(上海)有限公司;DW-86L628型超低温冰箱:海尔公司。
1.2.2 标准品与试剂
三亚油酸甘油酯(LLL)、三肉蔻酸甘油酯(MMM)、1,2-亚油酸-3-油酸甘油酯(LLO)、1,2-油酸-3-亚油酸甘油酯(OOL)、1-棕榈酸-2-油酸-3-亚油酸甘油酯(POL)、三油酸甘油酯(OOO)、1,2-油酸-3-棕榈酸甘油酯(OOP)、1,3-硬脂酸-2-亚油酸甘油酯(SLS)及1,3-硬脂酸-2-油酸甘油酯(SOS)(纯度为99%):上海甄准生物科技有限公司;乙腈,丙酮,异丙醇:色谱纯,美国TEDIA天地试剂公司。
1.3 试验方法
1.3.1 高温处理过程
将新鲜土豆去皮切条(40~50 mm ×10 mm × 10 mm),浸泡于冷水中。在煎炸锅中倒入5 L的油茶籽油样品G,打开电源开关预热(30 min)至(185± 5)℃后将准备好的土豆条(125 g)浸没于油样中进行煎炸。煎炸1 h为1组,每组煎炸4批次,每批次煎炸4 min,隔11 min后进行下一批次煎炸。完成每组煎炸后,在室温条件下冷却煎炸油至60℃再进行下一组的煎炸处理。每2 h取50 g油样与棕色瓶中在-20℃条件下贮藏待分析。每天煎炸6 h,煎炸周期为7 d。煎炸过程中不添加新鲜油样。在相同的条件下用同样的步骤制备加热样品,只是在加热过程中没有煎炸土豆的批处理。
1.3.2 极性组分测定
极性组分测定步骤结合国际纯粹与应用化学协会的标准方法IUPAC 2.507[16]和我国的GB/T 5009. 202—2003[17]标准进行。
1.3.3 样品制备
准确称量油茶籽油样品(0.05±0.01)g溶于异丙醇定容至10 mL,用均质机混匀约1 min。用一次性注射器取1 mL经0.45 μm滤膜过滤后进样20 μL在优化液相色谱条件下进行分析。
1.3.4 甘三酯液相色谱分析条件
油茶籽油甘三酯分析条件为:流动相组成为乙腈和异丙醇,流速及洗脱梯度见表2;柱温25℃;蒸发光散射检测器参数为:漂移管温度80℃、空气流速2.8 L/min、增益为1。
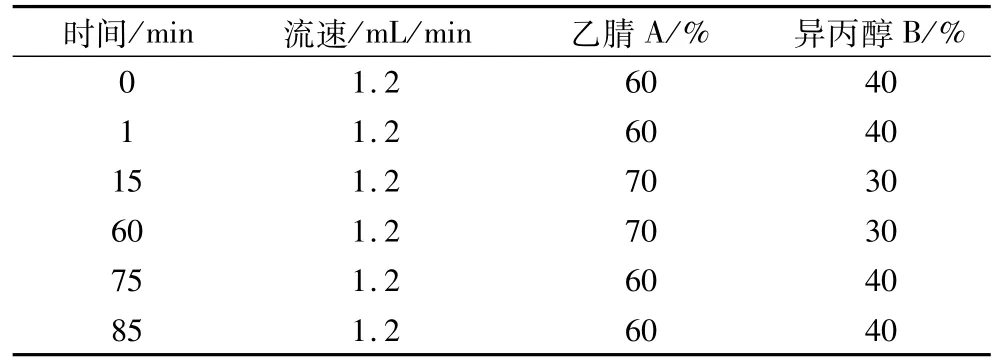
表2 油茶籽油甘三酯分析梯度洗脱参数
1.4 数据分析
利用Microsoft Excel 2007和SPSS 17.0对试验数据进行方差分析和偏相关分析。
2 结果与讨论
2.1 甘三酯分析条件的优化
2.1.1 流动相组成,流速及洗脱梯度
分别用乙腈-丙酮和乙腈-异丙醇对油茶籽油中的甘三酯进行等度(25∶75)洗脱,发现前者的洗脱时间是后者的3倍。此外,考虑到异丙醇的强洗脱能力,对甘三酯的良好选择性及低毒性,选择乙腈-异丙醇为流动相。在1 mL/min的流速下以不同配比的乙腈-异丙醇对油茶籽油进行洗脱,随着流动相中异丙醇比列的降低油茶籽油中甘三酯的分离度提高,但分析时间延长至。因此,将流速提高至1.2 mL/min。结合流动相配比和流速对油茶籽油甘三酯分离效果的影响进行梯度洗脱。最终优化梯度为:0~1 min,40%;1~15 min,40%~30%B;15~60 min,30% B;60~75 min,30%~40% B;75~85 min,40%B。
2.1.2 柱温
在不同柱温(25、30、35、40、45℃)条件下分析样品C。柱温为25℃时,油茶籽油中的甘三酯分离度良好。虽然较高的柱温会缩短分析时间,但对甘三酯的选择性也会随之降低。
2.1.3 检测器参数
以油茶籽油C为样品,在不同的漂移管温度(70、75、80、85、90、95℃)和空气流速(2.8、2.6、2.4、2.2、2.0、1.8 L/min)进样分析,选择可获得良好分离度和噪声较小基线的参数为最终选择。结果表明,漂移管温度和空气流速的最佳参数分别为80℃和2.8 L/min。检测器的增益设定为1,因为噪声水平会随增益的增大而升高并且油茶籽油的甘三酯的相应信号可达到定性定量分析的要求。
2.2 油茶籽油中甘三酯的定性与定量分析
由甘三酯标品的相对保留时间完成油茶籽油甘三酯组成的初步定性分析。图1为TAG标品(a)和油茶籽油C(b)甘三酯组成色谱图,经对比可发现油茶籽油中含LLL、LLO、OOL、POL、OOO、OOP、SLS及7种未知的甘三酯(峰10、11、12、13、14、15和16)。在油脂甘三酯分析中,还可根据甘三酯分布情况已知的油脂来确认甘三酯组成未知的样品。根据大豆油中甘三酯的分布情况,可确定峰10、11、12和13分别为LLLn、OLLn、PLL和PPL[6-9],这与Alam Zeb[18]和张东[19]等的研究相符。虽然目前PPL在茶油中的分布没有相关报道,但在橄榄油、葡萄籽油、榛子油、花生油大豆油和玉米油中PPL均存在[14]。同样的,根据其他植物油甘三酯的分布情况可确定峰14、15和16分别为POP[20-21],SOO[21]和 POS[12]。
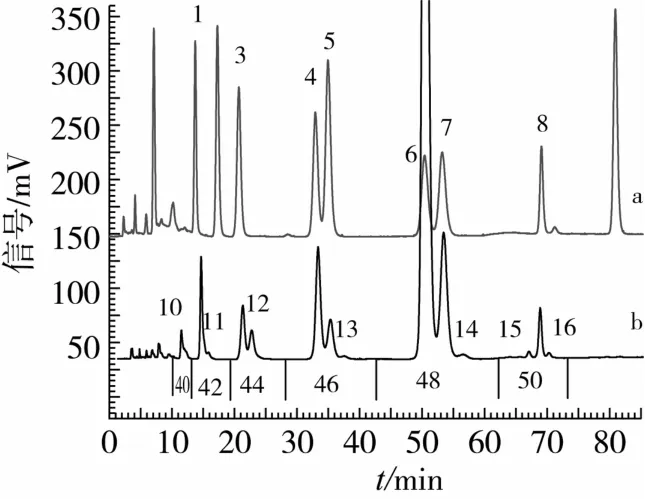
图1 TAG标品(a)和油茶籽油C(b)甘三酯组成色谱图
等价碳原子数(ECN)是甘三酯分析中很重要的一个参数,ECN=CN(碳原子数)-2DN(双键数目)。从图1可以看出,在优化分析条件下甘三酯按照ECN由小到大的顺序分离,可根据ECN将油茶籽油中的甘三酯分为6个区。值得注意的是,ECN相同的甘三酯可能存在共洗脱峰,如在峰4中除了OOL还存在SLL[4],这与张东等的研究结果一致[19]。在峰6中可能含有SLO,虽然在茶油中没有相关报道,但在橄榄油中这2种物质为共洗脱物[21]。此外,在共洗脱峰中还可能存在同一物质的位置异构体如LLO/OLL/LOL。而这些相同ECN的甘三酯可通过 Logα来鉴别,Logα是相应的甘三酯的相对保留时间与三油酸甘油酯的相对保留时间比值的对数。以Logα为纵坐标,以甘三酯中双键数目为横坐标作图(图2),从图2可根据甘三酯中的双键数目推断出甘三酯相应的相对保留时间,从而达到定性的目的。

图2 Logα与甘三酯双键数目
利用内部归一化法进行定量,将洗脱出的所有甘三酯峰面积总和设定为100%。每种甘三酯的相对百分比由式(1)计算得到。

2.3 方法精密度验证
按照1.3.3步骤制备样品C,在优化色谱条件下连续测定6次,测得甘三酯各组分的保留时间和峰面积的RSD,以考察方法的精密度。如表3所示,8种物质的保留时间和峰面积的RSD分别小于2.58% 和3.58%,可达到分析要求。

表3 油茶籽油中甘三酯保留时间和峰面积精密度试验结果(n=6)
2.4 不同产地油茶籽油甘三酯组分分析
由表4可以看出,油茶籽油甘三酯总体分布不同区中 ECN48区的百分比最高,其次为 ECN46,ECN44、ECN50和ECN42的含量水平相近,ECN40甘三酯在总体分布中的水平最低。在组成油茶籽油的14种甘三酯中含量水平在前三的分别为以OOO+SLO、OOP和OOL+SLL。
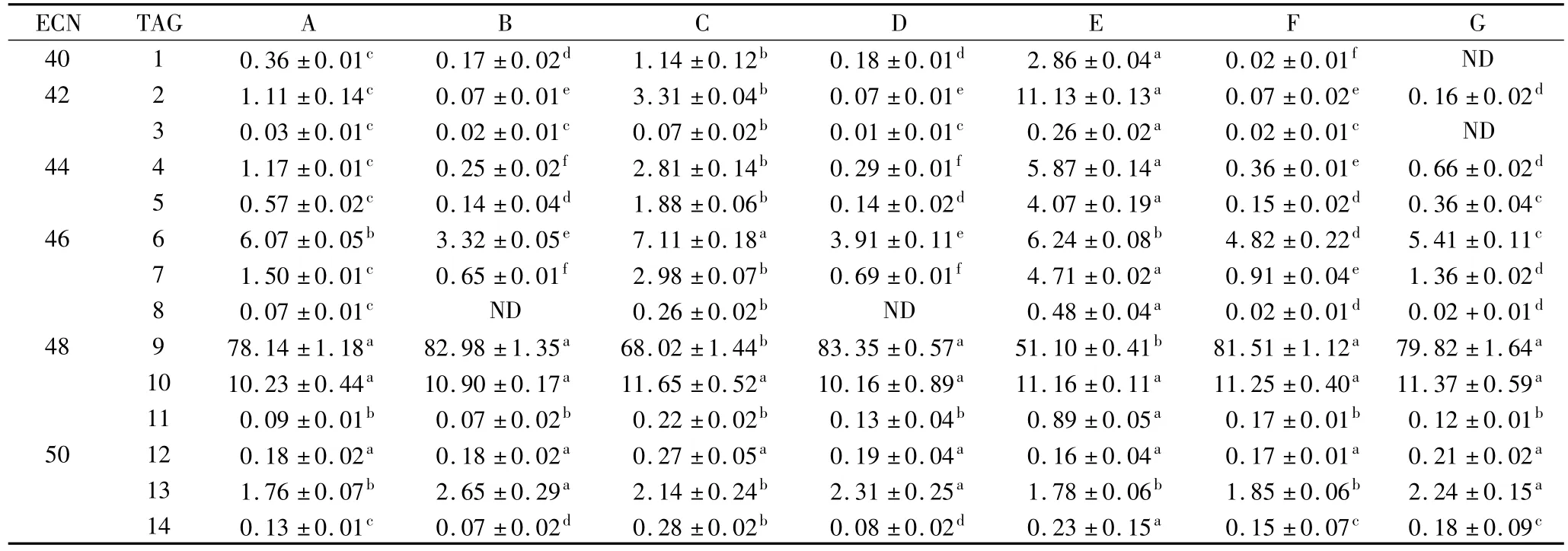
表4 不同产地油茶籽油中甘三酯分布情况/%
在7个油茶籽油样品中,样品 E中 ECN46、ECN50、ECN42和ECN40区的甘三酯含量明显高于其他6个油样。样品A、C和E中ECN46甘三酯含量均超过平均水平,样品B中含量最低。样品C、E和A中ECN44和ECN42甘三酯的含量较高,尤其是样品E,其含量分别为均值的4和5倍。ECN40甘三酯在各油样中的含量以样品E含量最高,其次为样品C,而在样品G中没有检测到ECN40甘三酯的存在。由表3的多重比较结果可看出,甘三酯的总体分布中,ECN48和ECN50区的甘三酯在不同地区的油茶籽油中差异不显著,其他4个区差异性显著且ECN40、ECN42和ECN44区的甘三酯分布差异显著性高于ECN46区。
方差分析结果(表4)表明不同产地的油茶籽油中处在同一区的甘三酯分布也存在差异。在ECN42区,主要成分是 LLL,其中以样品 E中含量最高。OLLn在各油样中的含量很低,在样品G中没检测到OLLn的存在。LLO是ECN44区主要的甘三酯,其含量约为PLL的2倍。OOL和SLL是ECN46区的主要甘三酯,而PPL的含量较低。ECN48区是油茶籽油中甘三酯含量最高的,这归因于油茶籽油甘三酯组成中含量在前两位的OOO+SLO和OOP,这与张东等[19]的研究结果一致。在样品C和E中OOO+SLO的含量水平相对较低,但这2个油样中OOP却是最高的。ECN50区主要由SLS组成(2%),SOO和POS的含量水平相近。
2.5 油茶籽油甘三酯在煎炸过程中的降解
油茶籽油甘三酯在深层煎炸过程中的损失率为47.85%。极性组分(变性甘三酯)的测定结果表明,油茶籽油在深层煎炸过程中其生成率为38.11%。偏相关分析表明,在油茶籽油的深度煎炸过程中甘三酯的降解速率与极性组分的生成速率呈负相关(-0.36>-0.992,P<0.05),图3为油茶籽油在高温处理过程中甘三酯和极性组分的变化趋势图。

图3 油茶籽油在深层煎炸过程中甘三酯和极性组分的变化趋势
如表5和表6所示,样品G中的LLL和PPL分别在煎炸32 h和14 h后未检测到,而在加热油中,经历40 h加热后完全损失的只有PPL。LLO的损失率在煎炸和加热样品中都位于第二,但其在深层煎炸条件下的降解速率是加热条件的1.42倍。在加热样品中,OOL+SLL的降降解速率比LLL快,而在煎炸样品中却是相反的。OOO的损失速率低于同一区的POL。处在ECN50的3种甘三酯煎炸条件下的降解速率分别是加热条件的1.92、1.94和1.62倍。此外,在油茶籽油中含量较低的POP在深层煎炸过程中较稳定,损失率为44.3%,在加热油中损失率仅为23.36%。

表5 油茶籽油甘三酯在煎炸过程中的变化/%(n=3,RSD=2.35%)

表6 油茶籽油甘三酯在加热过程中的变化/%(n=3,RSD=2.80% )
甘三酯历经高温处理后会发生氧化、聚合及水解反应,从而产生挥发性组分,游离脂肪酸,氧化三酰甘油单体,环化物,反式结构化合物及聚合物等产物。根据Alarm[18]的研究,图4中a区中是一些单酯及二酯类化合物,b区为一些环氧基或单个的氧化甘三酯。值得注意的是峰C是油茶籽油在深层煎炸过程中形成的一类累计速率很快的产物,具体结构有待于进一步分析。
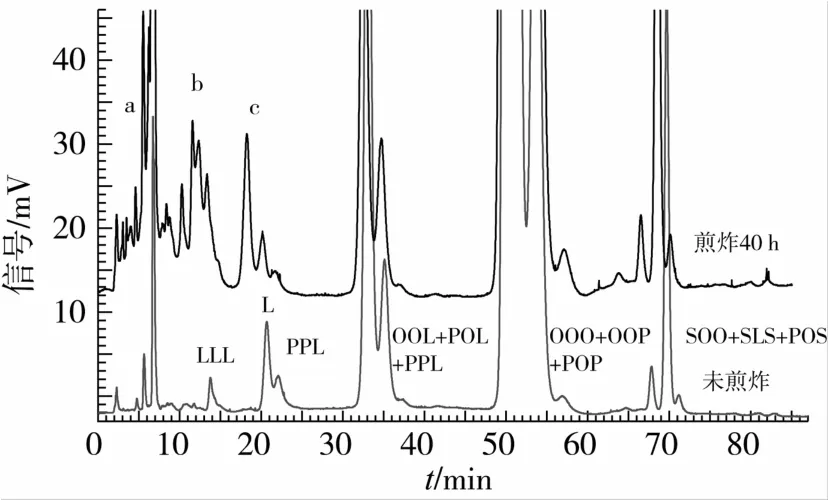
图4 油茶籽油深层煎炸前后对比图
3 结论
油茶籽油甘三酯在优化条件下得到良好分离,在组成油茶籽油的6个区的14种甘三酯中含量水平在前三的分别为以 OOO+SLO(74.21%)、OOP (10.64%)和OOL+SLL(5.19%)。此外,还有5种含量水平在1%以上的甘三酯和6种含量水平在1%以下的甘三酯。方差分析结果表明来自不同产地的油茶籽油甘三酯分布情况存在差异。
样品G在深层煎炸过程中甘三酯的总体损失率为47.85%,5个区甘三酯的损失率依次为86.73%、91.52%、75.97%、45.01%和55.30%。样品G中的LLL和PPL历经40 h煎炸后完全降解。LLO在深层煎炸过程中降解速率达高到86.73%,POP较稳定,损失率为44.3%。与深层煎炸样品相比,加热样品中甘三酯的降解程度相对较低。油茶籽油甘三酯在深层煎炸过程中的降解速率与极性组分的生成速率呈负相关。
[1]Fuchs B,Süß R,Teuber K,et al.Lipid analysis by thinlayer chromatography-A review of the current state[J]. Journal of Chromatography A,2011,1218(19):2754-2774
[2]COI/T.20/DOC.NO25.Improved HPLC analysis of triglycerides by oven terperature gradient[S]
[3]Wojtusik M J,Brown P R,Turcotte J G.Semi-preparative HPLC fractionation of consumer fish oil(Triacylglycerols)[J].Journal of liquid chromatography,1998,11:2091-2107
[4]COI/T.20/DOC.NO20/Rev.2.Difference between actual and theoretical content of triacylglycerols with ECN 42[S]
[5]Samblasa C R,Gonzalez A C,Rodriguez L C,et al.Application of selected ion monitoring to the analysis of triacylglycerols in olive oil by high temperature gas chromatographymass spectrometry[J].Talanta,2010,82(1):255-260
[6]IUPAC Method 2.324.Standard methods for the analysis of oils,fats and derivatives[S]
[7]AOCS Official Method Ce 5b-89:Sampling and analysis of commercial fats and oils-triglycerides in vegetable oils by HPLC[S]
[8]IUPAC Method 2.325.Standard methods for the analysis of oils,fats and derivatives[S]
[9]AOCS Official Method Ce 5c-93:Sampling and analysis of commercial fats and oils-individual triacylgrycerides in oils and fats by HPLC[S]
[10]皇甫志鹏,薛雅琳,刘元法,等.甘三酯指纹图谱相似度在芝麻油掺混检测中的应用[J].中国粮油学报,2013,28(2):117-22 Huangfu Zhipeng,Xue Yalin,Liu Yuanfa,et al.Application of similarity of triacylglycerol fingerprint to discriminate blended sesame oil[J].Journal of the Chinese Cereals and Oils Association,2013,28(2):117-22
[11]Kalpio M,Nylund M,Linderborg K M,et al.Enantioselective chromatography in analysis of triacylglycerols common in edible fats and oils[J].Food Chemistry,2015,172:718-724
[12]Lerma-Garcia M J,Barberan M V,Herrero-Martinez J M,et al.Acrylate ester-based monolithic columns for capillary electrochromatography separation of triacylglycerols in vegetable oils[J].Journal of Chromatography A,2011,1218:7528-7533
[13]Samblás C R,Rodríguez L C,Casado A G,et al.Multivariate analysis of HT/GC-(IT)MS chromatographic profiles of triacylglycerol for classification of olive oil varieties[J]. Anal Bioanal Chem,2011,399:2093-2103
[14]Bosque-Sendraa J M,Cuadros-Rodrigueza L,Ruiz-Samblasa C,et al.Combining chromatography and chemometrics for the characterization and authentication of fats and oils from triacylglycerol compositional data-A review[J]. Analytica Chimica Acta,2012,724:1-11
[15]Salghi R,Armbruster W,Schwack W.Detection of argan oil adulteration with vegetable oils by high-performance liquid chromatography-evaporative light scattering detection [J].Food Chemistry,2014,153:387-392
[16]IUPAC standard method 2.508.Determination of polar compounds in frying fats[S]
[17]GB/T 5009.202—2003食用植物油煎炸过程中的极性组分(PC)的测定[S]GB/T 5009.202—2003 Determination of polar compouds in edible vegetable oils used in frying food[S]
[18]Alam Zeb.Triacylglycerols composition,oxidation and oxidation compounds in camellia oil using liquid chromatogra-phy-mass spectrometry[J].Chemistry and Physics of Lipids,2012,165:608-614
[19]张东,龙伶俐,薛雅琳,等.液质联用分析常见植物油甘
油三酯[J].粮油食品科技,2012,20(6):33-37 Zhang Dong,Long Lingli,Xue Yalin,et al.Analysis of triglycerides in vegetable oil by HPLC-Q/TOF[J].Science and Technology of Cereals,Oils and Foods,2012,20(6):33-37
[20]L′ısa a M,Lynen F,Holˇcapek M,et al.Quantitation of triacylglycerols from plant oils using charged aerosol detection with gradient compensation[J].Journal of Chromatography A,2007,1176:135-142
[21]COI/T.20/DOC.NO 25/Rev.1.Global method for the detection of extraneous in olive oil[S].
Analysis of NARP-HPLC-EISD Composed by Camellia Oleosa Seed Oil Triacylglycerol and Degradation Research During High-Temperature Processing
Wang Jinying Zhong Haiyan Feng Na Zhou Bo
(College of Food Science and Engineering,Central South University of Forestry and Technology;National Engineering Laboratory of Rice and by-products Deep Processing,Changsha;Key laboratory of Economic Forest Breeding and Cultivation of State Forestry Administration of the People′s Republic of China,Changsha 410004)
The camellia oleosa seed oil triacylglycerol was separated completely under optimistic condition,in which OOO+SLO(74.21%),OOP(10.64%)and OOL+SLL(5.19%)were top three compounds among 14 triacylglycerol triacylglycerols.The analysis of variance showed that the difference happened to camellia oleosa seed oil triacylglycerols from different production areas.The overall loss ratio of camellia oleosa seed oil during deep frying (180℃)were 47.85%,and the loss ratio of triacylglycerols in each partition(ECN40,ECN42,ECN44,ECN46,ECN48and ECN50)were 86.73%,91.52%,75.97%,45.01%and 55.30%,respectively.LLL and PPL were totally decomposed after frying treatment for 40 h.Compared with deep frying samples,the degradation level of heating (180℃)oil was relatively lower.Partial correlation analysis showed that a negative correlation between the degradation ratio of camellia oleosa seed oil triacylglycerol during deep frying and generation ration of polar compounds existed.
camellia oleosa seed oil,triacylglycerol,NARP-HPLC-EISD,high temperature processing
TS221
A
1003-0174(2017)03-0054-07
国家自然科学基金(31070612),湖南省研究生科技创新基金(CX2015B283)
2015-08-12
王进英,女,1989年出生,博士,木本粮油品质保持及高效利用
钟海雁,男,1963年出生,教授,木本粮油品质保持及高效利用

