小麦-近缘物种染色体系耐盐性鉴定及分子标记筛选
韩 冉,宫文萍,宋健民,李豪圣,李根英,刘爱峰,曹新有,程敦公,赵振东,刘 成,刘建军
(山东省农业科学院作物研究所/农业部黄淮北部小麦生物学与遗传育种重点实验室/小麦玉米国家工程实验室,山东济南 250100)
小麦-近缘物种染色体系耐盐性鉴定及分子标记筛选
韩 冉,宫文萍,宋健民,李豪圣,李根英,刘爱峰,曹新有,程敦公,赵振东,刘 成,刘建军
(山东省农业科学院作物研究所/农业部黄淮北部小麦生物学与遗传育种重点实验室/小麦玉米国家工程实验室,山东济南 250100)
为挖掘小麦-近缘物种耐盐种质,对215份小麦-近缘物种染色体系进行了耐盐性筛选与鉴定。结果表明,小麦-高大山羊草6Sl附加系和小麦-纤毛披碱草1Yc附加系的萌发期耐盐性显著优于普通小麦中国春(CS),但仅后者的幼苗期耐盐性显著优于CS,说明纤毛披碱草1Yc染色体上可能含有耐盐基因。为了获得1Yc染色体特异标记,以小麦-纤毛披碱草1Yc附加系及CS为材料,筛选染色体第一同源群PLUG引物,结果显示,TNAC1007、TNAC1028和TNAC1034为耐盐小麦-纤毛披碱草1Yc附加系的特异引物,扩增条带大小分别为500 bp、700 bp和500 bp。利用上述3对引物对一套小麦-纤毛披碱草附加系进行扩增,结果发现,上述3个多态性PLUG片段为纤毛披碱草1Yc和1Sc染色体共有的分子标记,可用于辅助筛选与鉴定小麦-纤毛披碱草1Yc或1Sc染色体重组体。
小麦;耐盐性;近缘物种染色体系;分子标记
我国有盐碱化耕地约930万hm2[1],提高其生产水平对全国粮食增产具有十分重要意义[2-3]。
小麦近缘物种中含有丰富的耐盐基因,是小麦育种的优异基因源。沙融山羊草(Aegilopssharonensis)、二角山羊草(Ae.bicornis)、窄颖赖草(Leymusangustus)、披碱草(Elymusdahuricus)、彭提卡偃麦草(Thinopyrumponticum)、智利大麦(Hordeumchlense)等物种均具有较好的耐盐性[4]。通过远缘杂交可将这些物种中的优良基因导入普通小麦[5]。小麦-近缘物种染色体系(包括附加系、代换系和易位系等)是向小麦转育近缘物种优异基因的良好载体和中间桥梁[6-7]。鉴定清楚小麦-近缘物种染色体系的耐盐性是定位耐盐基因所在小麦近缘物种染色体(片段)的基础。作物萌发期和苗期鉴定能有效反映其综合耐盐性[8],利用该方法已筛选出了部分耐盐小麦种质[9-13]。本研究利用萌发期和幼苗期耐盐性鉴定对引进的215 份小麦-近缘物种染色体系进行了耐盐性鉴定,并对鉴定出耐盐性较好的染色体系进行了分子标记开发,以期为筛选和鉴定耐盐小麦-近缘物种染色体易位系打下基础。
1 材料与方法
1.1 供试材料
供试材料总计224份,包括215份小麦-近缘物种染色体系和9份普通小麦。小麦-近缘物种染色体系来源见文献[6-7]。普通小麦包括中国春(CS)、济南17(JN17)、济麦19(JM19)、济麦20(JM20)、济麦21(JM21)、济麦22(JM22) 、济麦23(JM23)、济麦262(JM262)和济麦229(JM229)。中国春由电子科技大学生命科学与技术学院杨足君教授提供,济麦系列品种由本研究团队育成。
1.2 萌发期耐盐小麦鉴定
大多研究均以1.5%~2.0%的NaCl溶液对小麦萌发期耐盐性进行鉴定[9,11-12]。本研究的预试验发现,用1.8%~2.0%的NaCl溶液处理中国小麦和小麦-近缘物种染色体系,其相对耐盐指数差异不显著,在2.2%的盐浓度下可以对材料耐盐性进行有效鉴定(结果未给出)。因此,本研究用2.2%的NaCl溶液处理215份小麦-近缘物种染色体系和普通小麦中国春。试验设1个对照组(无盐胁迫)和1个处理组(2.2% NaCl胁迫),重复3次。每个重复均挑选 50 粒饱满无损伤的种子用0.1% HgCl2消毒10 min,灭菌水冲洗2次后置于铺有2层滤纸的培养皿中。对照组每个培养皿加入10 mL灭菌去离子水,处理组每个培养皿中加入10 mL灭菌去离子水配置的2.2% NaCl溶液。置于温度25 ℃的恒温箱中,在光、暗时间各12 h下培养7 d。相对盐害指数为对照与盐处理种子平均发芽率的差值占对照种子平均发芽率的百分比,相对盐害指数越大,表示耐盐性越小。
1.3 幼苗期耐盐性鉴定
根据萌发期鉴定结果,选择相对盐害指数小于中国春的材料,参考文献[12]进行幼苗期耐盐性鉴定,方法略作改动。为了保证幼苗期种子的生长一致,先将种子在蒸馏水中吸涨催芽2 d,挑选发芽情况一致的15粒种子置于20目的筛网上。筛网四周粘有塑料泡沫,使筛网能悬浮在液体表面。将筛网放入与其配套的塑料盒中。在塑料盒中加入含盐2.2%的Hoagland营养液,处理7 d;对照组中加入Hoagland营养液培养7 d。培养条件为25 ℃,光、暗时间各 12 h。每个处理和对照均随机选取9株测量芽长、根长。计算不同材料的相对生长量,相对芽长=处理芽长/对照芽长;相对根长=处理根长/对照根长。
1.4 PLUG-PCR分析与分子标记建立
以萌发期和幼苗期耐盐性均显著优于中国春的小麦-近缘物种染色体系和中国春为材料筛选PLUG (PCR-based landmark unique gene)引物。相比中国春,选择能在小麦-近缘物种染色体系中扩增出多态性的引物,并用于扩增供试的济麦系列品种和所涉及近缘物种的整套染色体系分析。反应体系(20 μL)包含2.0 μL 10 × PCR buffer(Mg2+)、2.0 μL 2.5 mmol·L-1dNTP、上下游引物各1 μL(10 μmol·L-1)、0.2 μL 5 U·μL-1Taq酶、50~100 ng基因组DNA,加ddH2O补至20 μL。反应程序:94 ℃预变性3 min;94 ℃变性45 s,57 ℃退火45 s,72 ℃延伸2 min,35个循环;72 ℃延伸10 min。PCR产物分别用TaqⅠ和HaeⅢ酶进行酶切,酶切产物用2%琼脂糖凝胶电泳进行检测。
2 结果与分析
2.1 盐胁迫对供试材料萌发期耐盐性的影响
鉴定结果显示,中国春的相对盐害指数为62%;供试材料中相对盐害指数低于中国春的有11份,相对盐害指数为39%~61% (表1)。在这11份材料中,仅中国春-高大山羊草6Sl#2(6B)代换系(TA6516)和中国春-纤毛披碱草1Yc附加系(TA7584)的相对盐害指数与中国春差异显著(P<0.05),说明TA6516和TA7584芽期耐盐性显著高于中国春。
2.2 供试材料幼苗期的耐盐性
幼苗期耐盐性鉴定结果表明,在11份中国春-近缘物种染色体系中,仅中国春-纤毛披碱草1Yc附加系(TA7584)的相对根长显著高于中国春(图1),而中国春-高大山羊草6Sl#2(6B)代换系(TA6516)、中国春-帝国黑麦5R附加系(TA3606)、中国春-卵穗山羊草1Ug#1附加系(TA7662)、中国春-卵穗山羊草3Mg#1附加系(TA7657)和中国春-希尔斯山羊草5Ss#1附加系(TA3584)的相对根长显著或极显著低于中国春。
表1 萌发期相对盐害指数低于中国春的材料
Table 1 Materials with higher relative salt-tolerance than CS at germination stage
*P<0.05表示供试材料与中国春的差异显著。
* indicates significant difference between tested materials and CS.

*和**分别表示供试材料与中国春在0.05和0.01水平上差异显著。
* and ** indicate significant difference between tested materials and CS at 0.05 and 0.01 levels,respectively.
图1 中国春-近缘物种染色体系幼苗根和芽的相对长度
Fig.1 Relative length seedling root and shoot of salt tolerance of wheat-alien species chromosome lines under salt stress
相对芽长显著高于中国春的有中国春-希尔斯山羊草6Ss#1(6D)代换系(TA6566)和中国春-卵穗山羊草1Ug#1附加系(TA7662)。中国春-帝国黑麦5R附加系(TA3606)的相对芽长显著低于中国春。
2.3 耐盐性分子标记的筛选结果
利用染色体第一同源群的53对PLUG引物对中国春-纤毛披碱草1Yc附加系(其萌发期和幼苗期耐盐性均显著高于中国春)、中国春和济麦系列品种进行扩增,结果表明,引物TNAC1007、TNAC1028和TNAC1034能在中国春-纤毛披碱草1Yc附加系中分别扩增出(或PCR酶切出)分子量约为500 bp、700 bp和500 bp的多态性条带,而中国春和济麦系列品种均未扩增出这些条带(图2),说明这三个DNA片段是纤毛披碱草1Yc染色体特异片段,即可以作为分子标记检测小麦背景中的1Yc染色体。3个多态性标记相关信息见表2。
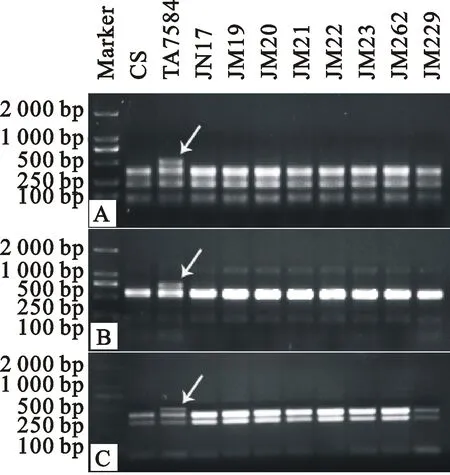
图2 引物TNAC1007(A)、TNAC1028(B)和TNAC1034(C)的扩增结果
Table 2 PLUG markers specific for group 1 homoeologous chromosome ofE.ciliaris

标记名称Markername引物序列(5′⁃3′)Primersequence(5′⁃3′)所在小麦染色体位置Wheatchromosomallocation所在纤毛鹅冠草染色体位置LocationonE.ciliarischromosome所用限制性内切酶Enzyme标记长度Fragmentsize/bpTNAC1007⁃PLUGF:AGCTCGTGTGCTGAGAAGAAAR:GAAAGGTTGCCCTAGGATCTG1A1Yc1ScTaqI500TNAC1028⁃PLUGF:GTCGTATGTTGTCGTGGGATTR:TGCCAGTAGTTCTTTGCTTTCA1A1D1Yc1ScTaqI700TNAC1034⁃PLUGF:CGGTCGACCAACAAGTCAGTAR:TGCTAGTTATCGATCCAATGC1D1Yc1Sc-500
2.4 耐盐性分子标记的特异性
用TNAC1007、TNAC1028和TNAC1034分别对中国春-纤毛披碱草2Sc、3Sc、7Sc、5Yc和7Yc附加系(TA7705-TA7709)和中国春-纤毛披碱草1Sc附加系(TA7583)进行扩增,结果表明,三对引物均能在中国春-纤毛披碱草1Sc附加系(TA7583)和中国春-纤毛披碱草1Yc附加系(TA7584)中扩增出分子量大小一致的多态性带,而其余供试材料扩增不出对应多态性带(图3),说明上述3对引物所扩增出的多态性带不仅是纤毛披碱草1Yc染色体特异标记,也是1Sc染色体特异标记。
3 讨 论
在小麦近缘物种耐盐性鉴定方面,Colmer等[14]认为,偃麦草(Thinopyrumspp.)和海滨大麦(H.marinum)的耐盐性显著好于栽培小麦。Gorham等[15]发现,盐胁迫下小伞山羊草和顶芒山羊草的叶片钠离子含量较其他物种低得多,因此具有更好的耐盐性。马小廷对中间偃麦草(Th.intermedia)、长穗偃麦草及两者正反交F1代进行耐盐性鉴定,四者的耐盐性:长穗偃麦草>反交种F1>正交种F1>中间偃麦草[16]。Mahmood和Quarrie[17]认为,长穗偃麦草3E染色体和百萨偃麦草5J染色体具有降低小麦叶片钠离子含量的作用。Forster等[18]研究表明,百萨偃麦草2J染色体具有降低小麦叶片钠离子含量的作用。Omielan等[19]发现,长穗偃麦草3E染色体导入小麦后,其叶片钠离子含量确实有所降低即增强了小麦的耐盐性。本研究中,中国春-长穗偃麦草3E染色体附加系的相对盐害指数与中国春没有显著差异(表1),该结果和Omielan等[19]的研究结果并不冲突,因为小麦种子发芽是一个复杂过程,仅依据钠离子含量一个性状尚不足以说明长穗偃麦草3E染色体导入中国春后会显著影响其相对盐害情况。

箭头所指为多态性条带。 Arrows indicate polymorphic bands.
在小麦-近缘物种耐盐种质创制方面,Islam等[20]合成了小麦-海滨大麦(H.marinum)双二倍体,但未见后续向小麦转育其耐盐性的报道。张 蕾等[2]鉴定了小麦-中间偃麦草(Th.intermedium)耐盐种质。Yuan和Tomita创制了耐盐碱的小麦-彭提卡偃麦草(Th.ponticum)染色体易位系[5]。夏光敏将长穗偃麦草(E.elongata)的染色体小片段整合到普通小麦品种济南177基因组中,获得了一系列的细胞杂种渐渗系,并从中选育出耐盐高产新品种山融3号[21]。截至目前,未见有关小麦-纤毛披碱草种质的耐盐报道。本研究对包括小麦-纤毛披碱草附加系在内的215 份小麦-近缘物种染色体系进行耐盐性筛选和鉴定,结果表明,中国春-纤毛披碱草1Yc染色体附加系的萌发期和幼苗期耐盐性均显著高于对照材料中国春,说明在纤毛披碱草1Yc染色体上存在耐盐基因,因此该材料值得通过染色体工程进行开发利用。
在披碱草物种染色体分子标记建立方面,鲁玉柱[22]建立了披碱草(E.rectisetus)染色体RAPD标记。Wang等[23]和Cainong等[24]先后建立了筑紫披碱草(Elymustsukushiensis)染色体RFLP和CAPS标记。Okito等[25]建立了披碱草属物种Y基因组的STS标记。刘 成等[26]建立了披碱草属物种St基因组SCAR标记。宫文萍等[27]建立了粗穗披碱草1HtS染色体特异CAPS标记。然而未见纤毛披碱草1Yc染色体分子标记建立的报道。本研究建立了纤毛披碱草1Yc染色体PLUG分子标记3个。由于RAPD标记的可重复性差,RFLP标记涉及放射性,CAPS和SCAR标记建立的前提是需要预先对相应序列进行测定,而PLUG方法具有重复性好、不涉及放射性、不依赖序列测定和可用于分析不同物种染色体上的基因共线性(即将标记定位于染色体相应区段)等优点,可以被广泛地应用于育种选择。本研究建立的纤毛披碱草1Yc染色体PLUG分子标记为后续筛选和鉴定耐盐小麦-纤毛披碱草1Yc染色体易位系打下了基础。
[1] 全国土壤普查办公室.中国土壤[M].北京:中国农业出版社,1998:211.
The National Soil Survey Office.Soils of China [M].Beijing:China Agriculture Press,1998:211.
[2] 张 蕾,侯雅静,张晓军,等.小偃麦渗入系耐盐性鉴定及其在F2群体中的遗传分析[J].山西农业科学,2016,44(3):281.
ZHANG L,HOU Y J,ZHANG X J,etal.Identification and genetic analysis for salt-tolerance of wheat-Thinopyrumintermediumintrogression line and its F2population [J].JournalofShanxiAgriculturalSciences,2016,44(3):281.
[3] 李翠玲.小麦渐渗系新品种山融3号耐盐表达谱和耐盐相关基因研究[D].济南:山东大学,2008:9.
LI C L.Analysis on transcriptional profiles and salt responsive genes in an introgression cultivar of common wheat [D].Jinan:Shandong University,2008:9.
[4]NEVO E,Chen G X.Drought and salt tolerances in wild relatives for wheat and barley improvement [J].PlantCell&Environment,2010,33(4):670.
[5]YUAN W Y,TOMITA M.Thinopyrumponticumchromatin-integrated wheat genome shows salt-tolerance at germination stage [J].InternationalJournalofMolecularSciences,2015,16(3):4512.
[6] 刘 成,闫红飞,宫文萍,等.小麦叶锈病新抗源筛选[J].植物遗传资源学报,2013,14(5):936.
LIU C,YAN H F,GONG W P,etal.Screening for new resistance sources of wheat leaf rust [J].JournalofPlantGeneticResources,2013,14(5):936.
[7] 韩 冉,隋新霞,杨洪美,等.小麦-近缘物种染色体系的高分子量麦谷蛋白亚基组成及白粉病抗性[J].麦类作物学报,2015,35(11):1494.
HAN R,SUI X X,YANG H M,etal.High molecular weight glutenin composition and powdery mildew resistance of wheat-alien chromosome lines [J].JournalofTriticeaeCrops,2015,35(11):1494.
[8]YOSHIRO M,KAZUYOSHI T.Mapping quantitative trait loci for salt tolerance at germination stage and the seeding stage in barely(HordeumvulgareL.) [J].Euphytica,1997,94(3):263.
[9] 王萌萌,姜奇彦,胡 正,等.小麦品种资源耐盐性鉴定[J].植物遗传资源学报,2012,13(2):189.
WANG M M,JIANG Q Y,HU Z,etal.Evaluation for salt tolerance of wheat cultivars [J].JournalofPlantgeneticResources,2012,13(2):189.
[10] 马雅琴,翁跃进.引进春小麦种质耐盐性的鉴定评价[J].作物学报,2005,31(1):58.
MA Y Q,WENG Y J.Evaluation for salt tolerance in spring wheat cultivars introduced from abroad [J].ActaAgronomicaSinica,2005,31(1):58.
[11] 刘 旭,史 娟,张学勇,等.小麦耐盐种质的筛选鉴定和耐盐基因的标记[J].植物学报,2001,43(9):948.
LIU X,SHI J,ZHANG X Y,etal.Screening salt tolerance germplasms and tagging the tolerance gene(s) using microsatellite(SSR) markers in wheat [J].ActaBotanicaSnica,2001,43(9):948.
[12] 张巧凤,陈宗金,吴纪中,等.小麦种质芽期和苗期的耐盐性鉴定评价[J].植物遗传资源学报,2013,14(4):620.
ZHANG Q F,CHEN Z J,WU J Z,etal.Screening for salinity tolerance at germination and seedling stages in wheat germplasm [J].JournalofPlantgeneticResources,2013,14(4):620.
[13] 吴纪中,刘妍妍,王 冲,等.人工海水胁迫下小麦种质资源的耐盐性筛选与鉴定[J].植物遗传资源学报,2014,15(5):948.
WU J Z,LIU Y Y,WANG C,etal.Screening and identification of wheat germplasm for salt tolerance using artificial sea water [J].JournalofPlantgeneticResources,2014,15(5):948.
[14]COLMER T D,MUNNS R,Flowers T J.Improving salt tolerance of wheat and barley:Future prospects [J].AustralianJournalofExperimentalAgriculture,2005,45:1425.
[15]GORHAM J,BRISTOL A,YOUNG E M,etal.The presence of the enhanced K/Na discrimination trait in diploidTriticumspecies [J].TheoreticalandAppliedGenetics,1991,82:729.
[16] 马小廷.中间偃麦草、长穗偃麦草及其杂种F1的形态特征和抗逆性研究[D].呼和浩特:内蒙古农业大学,2010:25.
MA X T.Studies on the morphology characters and stress resistance ofElytrigiaintermedium,E.elongataand their hybrids [D].Huhehaote:Inner Mongolia Agricultural University,2010:25.
[17]MAHMOOD A,QUARRIE S A.Effects of salinity on growth,ionic relations and physiological traits of wheat,disomic addition lines fromThinopyrumbessarabicumand two amphiploids [J].PlantBreeding,1993,110:265.
[18]FORSTER B P,MILLER T E,LAW C N.Salt tolerance of two wheat-Agropyronjunceumdisomic addition lines [J].Genome,1988,30:559.
[19]OMIELAN J A,EPSTEIN E,DVORAK J.Salt tolerance and ionic relations of wheat as affected by individual chromosomes of salt-tolerantLophopyrumelongatum[J].Genome,1991,34:961.
[20]ISLAM S,MALIK A I,ISLAM A K,etal.Salt tolerance in aHordeummarinum-Triticumaestivumamphiploid,and its parents [J].JournalofExperimentalBotany,2007,58(5):1219.
[21]WANG M C,PENG Z Y,LI C L,etal.Proteomic analysis on a high salt tolerance introgression strain ofTriticumaestivum/Thinopyrumponticum[J].Proteomics,2008,8:1470.
[22] 鲁玉柱.披碱草(Elymus.rectisetu)遗传物质导入普通小麦的分子标记研究[D].杨凌:西北农林科技大学,2001:27.
LU Y Z.The research of molecular marker on genetic material ofE.rectisetusshifted into ordinary wheat [D].Yangling:North West Agriculture and Forestry University,2001:27.
[23]WANG S L,QI L L,CHEN P D,etal.Molecular cytogenetic identification of wheat-Elymustsukushiensisintrogression lines [J].Euphytica,1999,107(3):217.
[24]CAINONG J C,BOCKUS W W,FENG Y,etal.Chromosome engineering,mapping,and transferring of resistance toFusariumhead blight disease fromElymustsukushiensisinto wheat [J].TheoreticalandAppliedGenetics,2015,128(6):1019.
[25]OKITO P,MOTT I W,WU Y J,etal.A Y genome specific STS marker inPseudoroegneriaandElymusspecies(Triticeae:Gramineae) [J].Genome,2009,52(4):391.
[26] 刘 成,杨足君,刘 畅,等.小麦族中含St 染色体组物种的特异分子标记的建立[J].遗传,2007,29(10):1271.
LIU C,YANG Z J,LIU C,etal.Analysis of St-chromosome-containing triticeae polyploids using specific molecular markers [J].Hereditas,2007,29(10):1271.
[27] 宫文萍,刘 成,李光蓉,等.粗穗披碱草1H~tS染色体的蛋白质二硫键异构酶基因CAPS标记[J].麦类作物学报,2013,33(3):409.
GONG W P,LIU C,LI G R,etal.Cleaved amplified polymorphic sequence(CAPS) marker for protein disulfide isomerase gene located onElymustrachycaulus1HtS chromosome [J].JournalofTriticeaeCrops,2013,33(3):409.
Salt Tolerance Identification and Molecular Markers Screening of Wheat-Alien Species Chromosome Lines
HAN Ran,GONG Wenping,SONG Jianmin,LI Haosheng,LI Genying,LIU Aifeng,CAO Xinyou,CHENG Dungong,ZHAO Zhendong,LIU Cheng,LIU Jianjun
(Crop Research Institute,Shandong Academy of Agricultural Sciences/Key Laboratory of Wheat Biology and Genetic Improvement in the North Yellow & Huai River Valley,Ministry of Agriculture/National Engineering Laboratory for Wheat & Maize,Jinan,Shandong 250100,China)
In order to explore salt tolerant wheat-alien species germplasm,a total of 215 wheat-alien species chromosome lines were screened and identified. The results showed that the salt tolerance at germination stage of wheat-Aegilopslongissima6Sladdition line and wheat-Elymusciliaris1Ycaddition line are significantly superior to wheat control. However,only the salt tolerance at seedling stage of the latter addition line is significantly superior to wheat control. Therefore,chromosome 1YcofE.ciliarismay possess salt tolerant gene. In order to develop molecular markers specific for chromosome 1Yc,PCR were performed on wheat-E.ciliaris1Ycaddition line and wheat controls by screening group 1 homoeologous chromosome with PLUG primers. The results showed that primers TNAC1007,TNAC1028 and TNAC1034 could generate polymorphic bands at about 500 bp,700 bp and 500 bp,respectively. Subsequently,the above three primer pairs were used to amplify a set of wheat-E.ciliarisadditions to locate the polymorphic bands. The result indicates that three polymorphic PLUG segments are not only located on chromosome 1Yc,but also on chromosome 1ScofE.ciliaris. Therefore,these markers can be used in screening and identifying wheat-E.ciliarischromosome recombinants with 1Ycor 1Scinvolved.
Wheat; Salt tolerance; Wheat-alien species chromosome line; Molecular marker
时间:2017-03-07
2016-09-08
2016-10-10
国家自然科学基金项目(31201203);国家现代农业产业技术体系建设专项(CARS-03-1-8);山东农科院青年拔尖人才计划项目(1-18-024);泰山学者种业计划和山东省自主创新重大关键技术项目(1-5-12,2-5-68)
E-mail:hr022cn@aliyun.com
刘 成(E-mail: lch6688407@163.com);刘建军(E-mail: ljjsaas@163.com)
S512.1;S330
A
1009-1041(2017)03-0301-06
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170307.1637.008.html

