紫外分光光度法测定辣木酒总黄酮含量
郎定常,卢斌,邓亚红,何昆,王用普,何翠容
(四川省酒类科研所,四川成都610017)
紫外分光光度法测定辣木酒总黄酮含量
郎定常,卢斌,邓亚红,何昆,王用普,何翠容
(四川省酒类科研所,四川成都610017)
建立紫外分光光度计测定辣木酒中总黄酮含量的方法。酒样直接与NaNO2、A l(NO3)3、NaOH发生反应,在波长510 nm处测定吸光度值。方法的平均回收率为104.38%,酒样总黄酮含量测定值的相对标准偏差为1.97%,该方法操作简便,稳定性好,可运用于辣木酒总黄酮含量的测定。
辣木酒;总黄酮;分光光度法
辣木(Moringa oleifera)来源于印度北部,是一种热带多功能植物,生长迅速,营养丰富,被誉为“生命之树”“植物中的钻石”,辣木的叶片含矿物质[1]、维生素[2]、氨基酸[3]、黄酮[4]等多种物质,其中黄酮类化合物具有重要的生物活性功能,如抗氧化、抗肿瘤、保护心血管[5]等。为促进四川省白酒产业转型升级,调整产品结构,四川省酒类科研所与峨眉雪芽酒业有限公司联合研制开发辣木系列养生酒,黄酮类物质的含量是此产品养生功能的重要指标之一,本文对酒样总黄酮的测定方法进行深入探讨。
目前鲜有关于辣木酒总黄酮测定的相关报道,本实验以辣木酒为研究对象,确定检测波长与显色反应的平衡时间点,研究不同样品处理方法对测定结果的影响,通过测定回收率验证方法的准确度,建立辣木酒总黄酮含量的测定方法,为产品质量控制提供依据。
1 材料与方法
1.1 材料、试剂及仪器
样品:酒样,市售。
仪器设备:INESA 752N紫外分光光度计,0.0001 g电子天平。
5%NaNO2溶液:称取2.5 g NaNO2(分析纯),加适量蒸馏水溶解并定容至50m L,现配现用。
10%Al(NO3)3溶液:称取5.0 g Al(NO3)3(分析纯),加适量蒸馏水溶解并定容至50 m L,现配现用。
4%NaOH溶液:称取4.0 g NaOH(分析纯),加适量蒸馏水溶解并定容至100m L。
256μg/m L芦丁标准溶液:准确称取已烘至恒重的芦丁标准品(中国药品生物制品检定所)0.0128 g,加50%乙醇水溶液超声溶解,转移至50m L容量瓶,定容到刻度,摇匀备用。
1.2 测定方法
1.2.1 标准曲线
吸取芦丁标准溶液0.00、2.00 m L、4.00 m L、6.00m L、8.00m L、10.00m L,分别置于50m L容量瓶(芦丁质量相当于0、512μg、1024μg、1536μg、2048μg、2560μg),按如下步骤进行显色反应:加入2.0m L的5%NaNO2溶液,摇匀,放置6 min;加2.0 m L 10%A l(NO3)3溶液,摇匀,放置6 m in;加20.0m L的4%NaOH溶液;加水定容至刻度摇匀,静置28min后,于波长510 nm处测定紫外吸收值,以吸光度A为纵坐标,样品质量为横坐标,得到回归方程y=0.0002x-0.0002,线性相关系数R2= 0.9997。
1.2.2 样品测定
量取4.00 m L酒样作为显色的反应液。按照1.2.1的方法进行显色反应,测定得到样品吸光度值A。
1.2.3 空白试验
量取4.00m L酒样置于50m L容量瓶中,按照1.2.1的操作,其中10%Al(NO3)3溶液用蒸馏水代替,测定得到吸光度值A0,以A-A0作为样品吸光度,从标准曲线上查出或用回归方程计算出样品溶液中总黄酮的质量m。
1.2.4 计算公式

式中:m——样品溶液中总黄酮的质量,μg;v——酒样体积,m L。
2 结果与讨论
2.1 最大吸收波长的选择
黄酮分子含有邻二酚羟基,与NaNO2作用生成邻二醌类物质,在碱性条件下,与A l3+络合反应生成有色物质,该物质在500 nm处附近具有最大吸收波长。取待测液在480~540 nm随同空白扫描,结果见图1,待测液的最大吸收峰出现在510 nm,故选择510 nm为测试波长。

图1 最大吸收波长
2.2 显色反应平衡时间的测定
按照1.2.1的方法处理样品,记录随时间延长紫外吸光度的变化,结果见图2。反应前28min,样品吸光度呈不断下降的趋势;28~36m in吸光度值趋于一致,36m in之后吸光度开始缓慢降低。反应初期显色络合物逐渐形成,吸光度随之发生变化;反应平衡时络合物形成,吸光度相对稳定;继续延长反应时间,络合物易分解,吸光度发生变化,导致测定结果不准确[6]。本实验中,显色反应时间在28~36m in之间达到平衡,这与已经报道的银杏酒[7]、莲子酒[8]的平衡时间有差异,可能是辣木酒含有其他物质或黄酮的种类不同等原因造成的。为使反应完全,提高测定效率,缩短测定时间,本试验样品选择放置时间为28m in。
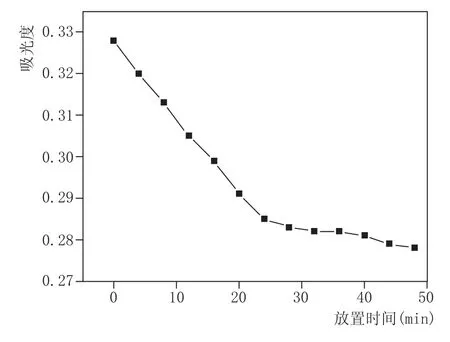
图2 样品吸光度随时间的变化
2.3 芦丁标准曲线及回归方程的建立
按照1.2.1的方法,以芦丁对照液的质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线。结果见图3,得到线性回归方程y=0.0002x-0.0002,线性相关系数R2=0.9997。该参数大于0.9990,说明此方法测定的吸光度值在标准曲线浓度范围内与总黄酮的质量成正相关。
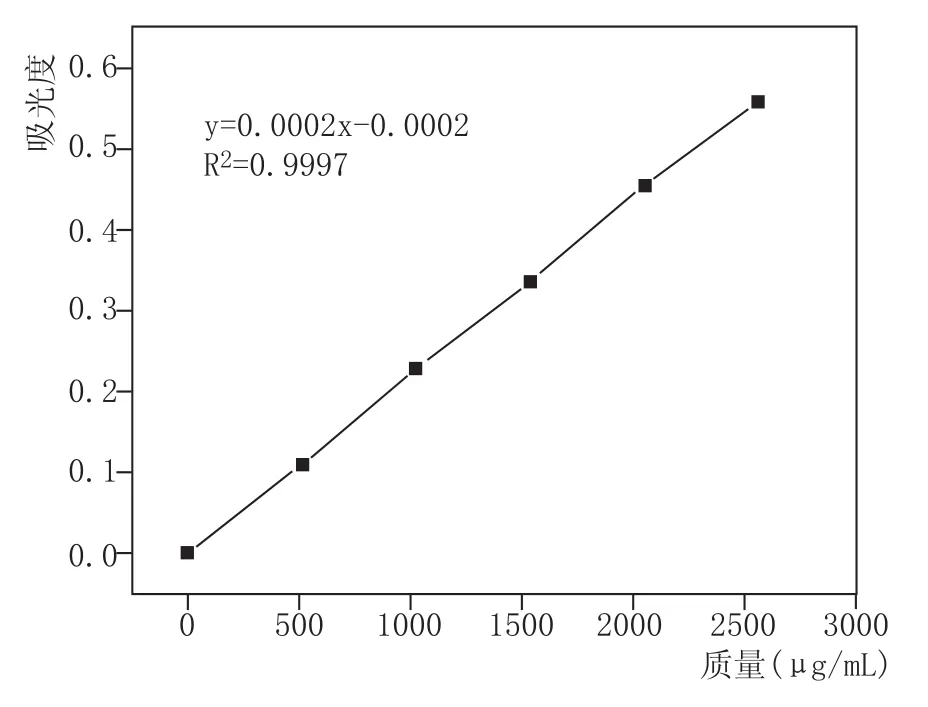
图3 芦丁标准曲线
2.4 样品处理
由于黄酮类化合物的醇溶性大于水溶性,故选用甲醇或者乙醇作为提取溶剂;同时辣木酒样的酒精度为45%vol,据此本实验选择如下的样品处理方式。一是90℃水浴蒸干酒样,用75%甲醇溶液或者75%乙醇溶液溶解蒸干物,蒸馏水定容后通过显色反应测定总黄酮的含量;二是酒样无需处理,利用显色反应直接测定。每种样品制备方式测定3个样,测定结果见表1。
用75%的甲醇或75%的乙醇溶解蒸干物,测定数据的重复性不好,稳定性不高,主要是由于凝固在蒸发皿上的固体物质呈黏稠的胶状,不易溶解。乙醇溶液对蒸干物的溶解性不如甲醇溶液,延长2种溶液对蒸干样品的处理时间,总黄酮的测定数值变大;但甲醇具有挥发性和毒性,延长样品前处理时间,增加操作难度。
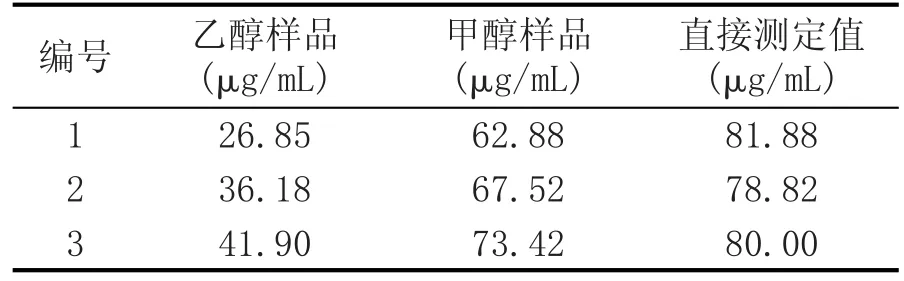
表1 不同样品制备方式对测定结果的影响
样品直接测定结果的重现性好,操作方便,测定过程中不会涉及有毒试剂,综上选择酒样不经处理,直接测定。
2.5 准确度实验
为验证方法的准确度,对辣木酒进行回收率实验。取辣木酒样品6份,每2份1组,共3组。分别精确加入芦丁标准溶液1.00m L、1.26m L、1.51m L,按照1.2.1的方法进行显色反应,在波长510 nm下测定结果(见表2)。由表2可知,加标样的平均回收率为104.38%,表明方法的回收率良好,满足定量分析要求。
2.6 精密度实验
取同一批次辣木酒酒样,按照1.2.1的显色方法测得吸光度值,根据标准曲线计算得到辣木酒总黄酮含量,结果见表3。同一个样品测定结果RSD为1.97%,表明该方法对测定辣木酒中总黄酮含量的精密度较高,满足实验要求。
3 结论
本研究建立辣木酒中总黄酮含量的测定方法,在测定波长为510 nm下,辣木酒样无需处理,直接进行显色反应,反应时间在28~36m in之间达到平衡,吸光度值相对稳定。在此条件下测定样品回收率为104.38%,酒样中总黄酮测定结果的RSD值为1.97%,测定方法操作简便,结果可靠,为辣木酒控

表2 辣木酒中总黄酮回收率实验
制质量提供参考依据,对辣木酒的保健性能指标提供数据支持。
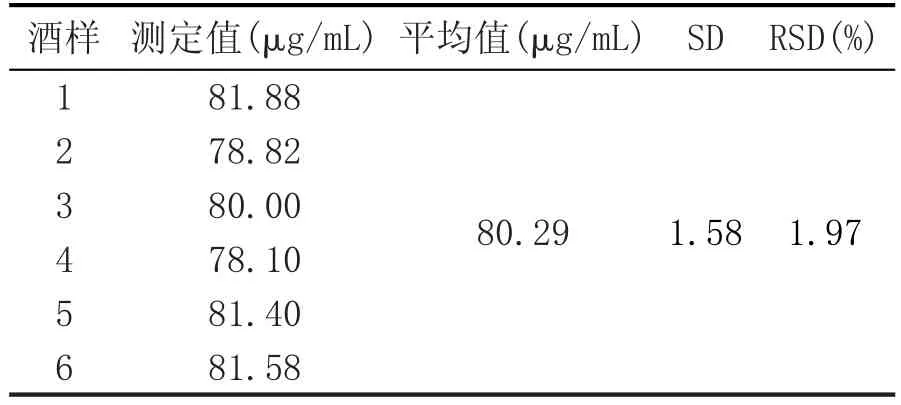
表3 样品中总黄酮含量测定的结果
[1]任广旭,伊素芹,张鸿儒,等.辣木功效的研究现状[J].食品研究与开发,2016,37(16):228-231.
[2]马李一,余建兴,张重权,等.不同干燥方法对辣木叶营养价值的影响[J].食品科学,2008,29(9):302-304.
[3]初雅洁,符史关,龚加顺.云南不同产地辣木叶成分的分析比较[J].食品科学,2016,37(2):178-182.
[4]罗晓波,汪开毓,吉莉莉,等.辣木叶的价值及其开发利用研究进展[J].开发与利用,2016,32(11):84-88.
[5]刘一杰,薛永常.植物黄酮类化合物的研究进展[J].中国生物工程杂志,2016,36(9):81-86.
[6]苏银法.雪莲酒中总黄酮的含量测定[J].海峡药学,2002, 14(4):51-52.
[7]吴婷,张丽.分光光度法测定银杏酒中总黄酮的含量[J].南京中医药大学学报,2005,21(2):129-130.
[8]吴灿,夏延斌,唐鑫.分光光度法测定莲子酒中的总黄酮[J].农产品加工(学刊),2013(4):48-50.
Determ ination of Total FlavonoidsContent in Moringa oleifera Liquor by Spectrophotometry
LANGDingchang,LU Bin,DENGYahong,HEKun,WANGYongpu and HECuirong
(Sichuan Research Institute of A lcoholic Drinks,Chengdu,Sichuan 610017,China)
A method for determ ining flavonoids content in Moringa oleifera liquor by spectrophotometry had been developed.Wine samples directly reacted w ith NaNO2,A l(NO3)3and NaOH,and the absorbance valuewasmeasured atwavelength of 510 nm.The average recovery of suchmethod was104.38%and RSD was1.97%.Suchmethod was simple to operatew ith good stability,and suitable for the determ ination of total flavonoids content in Moringa oleifera liquor.
Moringa oleifera liquor;total flavonoids;spectrophotometry
TS262.91;TS261.7
A
1001-9286(2017)04-0103-03
10.13746/j.njkj.2017009
2017-01-13
郎定常,男,高级工程师,四川省酒类科研所副所长,主要从事酒类研究工作。

