门静脉灌注80%乙醇建立猪肝硬化门静脉高压模型
李红彬,王 磊,董成宾,邱 斌,唐小龙,吴一凡,范振华,刘福全
(首都医科大学北京世纪坛医院介入治疗科, 北京 100038)
门静脉灌注80%乙醇建立猪肝硬化门静脉高压模型
李红彬,王 磊,董成宾,邱 斌,唐小龙,吴一凡,范振华,刘福全*
(首都医科大学北京世纪坛医院介入治疗科, 北京 100038)
目的 探讨门静脉灌注80%乙醇建立猪肝硬化门静脉高压动物模型的可行性。方法 选取健康贵州小型香猪13只,随机分为3组:实验1组(5只)、2组(5只)及对照组(3只),实验1、2组门静脉分别灌注80%乙醇5 ml及10 ml,对照组灌注生理盐水10 ml,对所有实验猪于灌注前、灌注后即刻、灌注后6周行直接门静脉造影测量门静脉压力及直径;灌注前及灌注后6 h内、术后1~6周行肝组织活检;灌注前及灌注后6周分别行增强CT;灌注后6周解剖所有实验猪,对肝脏各叶标本进行组织学检查。结果 实验1组及对照组实验猪灌注前、后门静脉直径及压力的差异无统计学意义(P均>0.05)。实验2组灌注后即刻、灌注后6周与灌注前比较,门静脉直径及压力的差异均有统计学意义(P均<0.05)。实验1、2组灌注后所有实验猪均形成肝纤维化,灌注后6周实验1组2只、实验2组5只纤维化METAVIR评分达4级。结论 经门静脉灌注80%乙醇更适宜构建肝硬化门静脉高压动物模型。
乙醇;门静脉灌注;肝硬化;高血压门静脉;动物模型
应用小动物建立肝硬化模型已有较多报道[1-3],建立大动物特定肝硬化或门静脉高压模型亦有报道[4-5],但通过肝动脉或门静脉栓塞建立肝硬化模型还处于探索阶段[6-8],尚不能完全模拟最常见的炎性及酒精性肝硬化发生发展的病理过程。本研究经门静脉灌注乙醇建立具有与人类相似的早期病理发展过程的猪肝硬化门静脉高压模型,结果报告如下。
1 材料与方法
1.1实验动物 健康贵州小型香猪13只,3月龄,体质量31~35 kg,平均(32.5±1.9)kg,随机分为3组:实验1组(5只)、实验2组(5只)及对照组(3只),实验动物由北京世纪坛医院实验动物房购置于北京科兴实验动物厂,本实验通过北京世纪坛医院科学伦理委员会审查同意。
1.2动物模型的建立 自猪耳缘静脉穿刺建立静脉通路,注射氯胺酮13 mg/kg体质量、咪唑安定0.1 mg/kg体质量、阿托品0.05 mg/kg体质量复合液进行基础麻醉。应用一步法经皮肝穿刺门静脉成功后,门静脉内留置6F端侧孔猪尾导管,导管的体外部分固定于实验猪的侧腹壁皮下。若穿刺门静脉失败,先经脾动脉间接门静脉造影,标记后再穿刺门静脉。实验1、2组实验猪经门静脉主干分别以0.3 ml/s流速灌注80%乙醇5 ml及10 ml;对照组以相同流速灌注生理盐水10 ml。
1.3评价指标
1.3.1影像学检查 ①门静脉造影:采用Siemens Artis Zee AX2IOM血管造影系统。对比剂采用碘海醇,于灌注前、灌注后即刻及灌注6周后行门静脉造影,测量门静脉压力及直径。②腹部增强CT:灌注前及灌注后6周采用Dyna-CT于MIP模式下行腹部增强CT检查,记录肝、脾体积。
1.3.2实验室检查 灌注前及灌注后第6周均行血常规、血生化(肝功能)、凝血功能及血氨检测。
1.3.3病理学检查 ①活检病理:术前及术后6 h内、术后1~6周进行肝组织多部位、多点活检,行病理学检查及METAVIR评分。②大体标本病理:术后6周解剖所有实验猪。取出肝、脾、食管、胃、心、肺及肾脏,均行病理学检查。对肝脏各叶进行多点组织采样及病理染色,应用图像分析软件将肝组织纤维化的程度分为4级,0级为无纤维化;1级,纤维化比例<10%;2级,纤维化比例为10%~20%;3级,纤维化比例为21%~50%;4级,纤维化比例≥51%。

2 结果
所有实验猪术后均予抗感染、抗凝处理,无死亡,至术后6周体质量增加3.9~5.8 kg,平均(4.9±0.8)kg。
2.1影像学结果
2.1.1门静脉 实验1组3只动物灌注后即刻出现门静脉分支轻微减少(门静脉4级以下血管减少),门静脉主干及大分支未见血栓形成,无肝内门静脉侧支及肝外门—体侧支循环形成;灌注前、灌注后即刻、灌注后6周门静脉直径及压力的差异无统计学意义(P均>0.05)。见表1。
实验2组灌注后即刻与灌注前相比较,全部动物门静脉分支明显减少(门静脉3级以下血管减少),门静脉主干及大分支见血栓形成(图1A、1B)、门静脉直径增宽(t=11.200,P<0.001)、门静脉压力升高(t=7.129,P<0.001)。灌注后6周与灌注前相比较,肝内门静脉出现不同程度的侧支血管(图1C),门静脉主干直径大于灌注前(t=5.108,P=0.001),门静脉压力高于灌注前(t=4.603,P=0.002)。见表1。
表1 3组灌注前后门静脉直径和压力变化±s)
注:*:与同组灌注前比较P<0.05
对照组:所有动物灌注前后门静脉直径及压力的差异无统计学意义(P均>0.05)。
2.1.2肝脾体积 实验1组及对照组灌注前后肝脾体积无明显变化(P均>0.05)。实验2组动物灌注后6周肝脾体积较灌注前增大(肝脏:t=2.64,P=0.030;脾脏t=2.63,P=0.030;表2),但密度均匀,边缘整齐(图2)。
2.2实验室检查 实验1、2组及对照组实验动物灌注前与灌注后6周氨基转移酶的差异均无统计学意义(P均>0.05,表2),余血常规、凝血功能及血氨检查结果差异均无统计学意义(P均>0.05)。
2.3病理学改变 灌注不同浓度乙醇6 h内实验实验猪肝活检组织病理变化见表3、图3。实验1组2只、实验2组5只实验猪出现肝脏微小血管内血栓形成、内皮细胞损伤、肝细胞变性坏死及炎细胞浸润等早期病理学变化。对照组均无明显变化。
实验1组灌注后所有实验猪均形成肝纤维化,随着时间的延长,纤维化的级别不同,2只实验猪在不同时间形成肝硬化;实验2组所有实验猪肝纤维化均达到4级,并较早形成肝硬化;对照组所有实验猪均无纤维化改变(表4)。实验1组2只、实验2组5只实验猪肝大体标本显示早期肝硬化的基本特征:体积增大、组织变硬、弹性差(图4A、4B)、肝脏表面出现均匀的再生小结节(图4C)。发生肝硬化的7只实验猪脾脏均合并不同程度的脾淤血(图4D),其余实验猪的脾、心、肺、肾及胃组织学均正常。
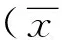
表2 3组灌注前及灌注后6周肝脾体积及转氨酶变化±s)
注:*:与同组灌注前比较,P<0.05;ALT:丙氨酸氨基转移酶;AST:天门冬氨酸氨基转移酶
图1 实验2组门静脉造影 A.灌注前直接门静脉造影示门静脉分支清晰; B.灌注后即刻造影示门静脉分支明显减少,主干增粗; C.灌注后6周肝内门静脉大量不规则侧支循环形成 图2 实验2组CT图像 A.灌注前CT图像; B.灌注后6周CT示肝脏体积明显增大

表3 灌注乙醇6 h内实验猪肝活检组织病理变化(只,n=5)

表4 实验1、2组门静脉灌注后肝脏METAVIR评分(只,n=5)
3 讨论
建立肝硬化动物模型的方法较多,主要有口服、吸入、皮下注射、腹腔内注射制模药物或外科手术等[9-11],制模药物经血液循环进入肝脏或外科手术明显改变解剖关系,引起肝损害的同时,也会对其他组织器官产生损伤,甚至导致死亡。小型动物建模不宜同时做多项血液指标测定及影像学检查,难以测定门静脉变化,更不利于外科手术及活检等操作,无法连续观察模型肝病理变化[12-13]。尽管有学者[4-5]对犬、狒狒等大型动物建立特定的肝硬化或门静脉高压模型,但其与人类常见的肝炎性或酒精性肝硬化门静脉高压病理过程相差甚远。另外,
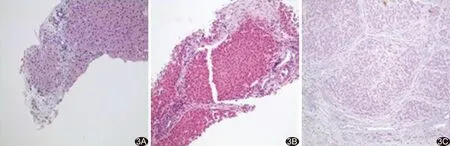
图3 实验2组病理图 A.灌注后3周假小叶形成,血窦扩张,未见血栓及明显变性坏死(HE,×100); B.灌注后4周假小叶形成,周围散在炎性细胞,肝细胞未见明显变性坏死(HE,×200); C.灌注后6周肝细胞内纤维组织增生,假小叶形成,周围炎细胞浸润,并可见大片坏死(HE,×100)
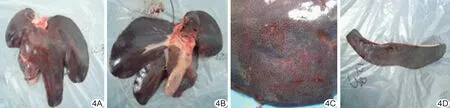
图4 实验2组大体标本 A、B.灌注后6周肝脏膈面及腹面,示肝脏组织较硬、弹性差、各叶均匀增大; C.局部放大图像显示肝脏表面均匀的再生小结节; D.灌注后6周脾脏质硬、颜色不均匀,呈淤血状态
有研究[9,14]报道形成肝硬化的时间一般长达8周以上。本研究于实验猪门静脉内缓慢灌注80%乙醇,其随血流均匀进入肝脏微循环系统,作为永久性末梢栓塞剂,于微循环水平进行栓塞,致使门静脉小分支、肝窦、肝静脉小分支闭塞、血栓形成及内皮细胞损伤,进一步引起肝细胞变性、坏死、再生、纤维化、门静脉增宽、压力增高及肝内门静脉侧支形成等典型的早期肝硬化病理变化,与人类肝炎性及酒精性肝硬化早期病理过程特点相似。另外,本方法用时短,实验2组灌注80%乙醇10 ml,3周后即均成功建立肝硬化门静脉高压模型,成模时间适中,且无死亡动物。
肝动脉或门静脉栓塞建立肝硬化模型仍处于探索阶段,Pavcinik等[6]采用经皮肝穿技术向实验猪门静脉内注射聚乙烯醇颗粒以栓塞门静脉分支构建门静脉高压,但实验后1周门静脉压力回降至正常水平,亦未形成肝硬化;Madoff等[7]于门静脉注入聚乙烯醇颗粒及线圈栓塞肝左叶及左中叶,栓塞后28天组织病理学显示栓塞节段门静脉区及小叶间隔萎缩,而纤维化不明显。有研究[8]表明猪肝动脉内注射碘化油和乙醇比例为3∶1的栓塞剂,术后6~8周肝组织病理可见纤维间隔和假小叶形成,但形成的肝硬化比较局限,分布不均匀,各部位纤维化分级亦不一致。本研究实验2组的实验猪于灌注后6周均形成肝硬化,3只伴门静脉高压,肝纤维化均达到4级;肝脏各叶表面均观察到较均匀的硬化结节,且门静脉主干及大分支未见血栓形成。表明于门静脉灌注80%乙醇对肝脏的损伤作用均匀、有效。
总之,门静脉内灌注80%乙醇可建立猪肝硬化或门静脉高压模型,并有典型的早期人类肝炎性或酒精性肝硬化病理发展过程,对其他脏器和组织损伤轻微或无损伤,为肝硬化门静脉高压的基础研究提供了一种安全可靠的造模方法。本实验中门静脉内灌注80%乙醇10 ml较适宜,更合适的乙醇浓度及用量仍需进一步深入研究。
[1] Truong HN, Nguyen HN, Nguyen T, et al. Establishment of a standardized mouse model of hepatic fibrosis for biomedical research. Biomed Res Ther, 2014,1(2):212-215.
[2] Takeuchi-Yorimoto A, Noto T, Yamada A, et al. Persistent fibrosis in the liver of choline-deficient and iron-supplemented L-amino acid-defined diet-induced nonalcoholic steatohepatitis rat due to continuing oxidative stress after choline supplementation. Toxicol Appl Pharmacol, 2013,268(3):264-277.
[3] Sakamoto M, Nakamura T, Torimura T, et al. Transplantation of endothelial progenitor cells ameliorates vascular dysfunction and portal hypertension in Carbon tetrachloride-induced rat liver cirrhotic model. J Gastroenterol Hepatol, 2013,28(1):168-178.
[4] Jin W, Deng L, Zhang Q, et al. A canine portal hypertension model induced by intra-portal administration of Sephadex microsphere. J Gastroenterol Hepatol, 2010,25(4):778-785.
[5] Lieber CS, Leo MA, Cao Q, et al. Silymarin retards the progression of alcohol-induced hepatic fibrosis in baboons. J Clin Gastroenterol, 2003,37(4):336-339.
[6] Pavcnik D, Saxon RR, Kubota Y, et al. Attempted induction of chronic portal venous hypertension with polyvinyl alcohol particles in swine. J Vasc Interv Radiol, 1997,8(1 Pt 1):123-128.
[7] Madoff DC, Gupta S, Pillsbury EP, et al. Transarterial versus transhepatic portal vein embolization to induce selective hepatic hypertrophy: A comparative study in swine. J Vasc Interv Radiol, 2007,18(1 Pt 1):79-93.
[8] Avritscher R, Wright KC, Javadi S, et al. Development of a large animal model of cirrhosis and portal hypertension using hepatic transarterial embolization: A study in swine. J Vasc Interv Radiol, 2011,22(9):1329-1334.
[9] Chang CC, Chuang CL, Lee FY, et al. Sorafenib treatment improves hepatopulmonary syndrome in rats with biliary cirrhosis. Clin Sci (Lond), 2013,124(7):457-466.
[10] Kawai H, Ishibashi T, Kudo N, et al. Behavioral and biochemical characterization of rats treated chronically with thioacetamide: Proposal of an animal model for hepatic encephalopathy associated with cirrhosis. J Toxicol Sci, 2012,37(6):1165-1175.
[11] Starkel P, Leclercq IA. Animal models for the study of hepatic fibrosis. Best Pract Res Clin Gastroenterol, 2011,25(2):319-333.
[12] 李银燕,苏雪娇,王学梅,等.实时超声弹性成像半定量分析大鼠肝纤维化.中国医学影像技术,2012,28(7):1259-1262.
[13] 马春梅,郭启勇,廖伟,等.CT灌注成像在兔肝纤维化模型的研究.中国医学影像技术,2007,23(5):641-644.
[14] Snowdon VK, Fallowfield JA. Models and mechanisms of fibrosis resolution. Alcohol Clin Exp Res, 2011,35(5):794-799.
Establishes model of liver cirrhosis with portal hypertension by portal infusion of 80% alcohol in swines
LIHongbin,WANGLei,DONGChengbin,QIUBin,TANGXiaolong,WUYifan,FANZhenhua,LIUFuquan*
(DepartmentofInterventionalTherapy,BeijingShijitanHospital,CapitalMedicalUniversity,Beijing100038,China)
Objective To explore the feasibility of establishing a swine model of liver cirrhosis with portal hypertension by portal infusion of 80% alcohol. Methods A total of 13 Guizhou miniature pigs were randomly divided into three groups, experiment group 1 (n=5), experiment group 2 (n=5) and control group (n=3). Experiment groups of pigs received portal infusion of 80% alcohol in volumes of 5 ml in group 1, and 10 ml in group 2, and the pigs in control group received portal perfusion of saline in volumes of 10 ml. All animals were performed direct portal angiography, the portal vein pressures and diameter were also detected before, immediately and 6 weeks after the infusion. All animals underwent liver biopsies before and 6 hours, 1—6 weeks after operation. And contrast-enhanced abdominal CT was performed before and 6 weeks after operation. All animals were dissected 6 weeks after operation, and each leaf of liver specimens were performed histological examination. Results There was no statistically significant difference of the portal venous pressure and diameter before infusion and 6 weeks after infusion in the experiment group 1 and control group (allP>0.05). In the experiment group 2, compared with pre infusion, the portal vein pressure and diameter were higher than those of immediately and 6 weeks after infusion (allP<0.05). In both experiment group 1 and group 2, all pigs had developed into liver fibrosis, the METAVIR score of 2 pigs in group 1 and 5 pigs in group 2 respectively were up to grade 4. Conclusion Portal infusion of 80% alcohol is more suitable for establishing a swine model of liver cirrhosis with portal hypertension.
Alcohol; Portal infusion; Cirrhosis; Hypertension, portal; Animal model
李红彬(1989—),男,河南安阳人,在读硕士,医师。研究方向:肿瘤介入治疗。E-mail: lihongbin2012@foxmail.com
刘福全,首都医科大学北京世纪坛医院介入治疗科,100038。E-mail: lfuquan@yahoo.com.cn
2016-09-08
2017-01-18
R445; R-332
A
1672-8475(2017)04-0247-05
10.13929/j.1672-8475.201609015

