颈动脉内膜剥脱术治疗高龄颈动脉狭窄患者的疗效分析
陈宇,刘暴,邵江,刘志丽,宋小军,郑月宏
(中国医学科学院北京协和医院血管外科,北京 100730)
颈动脉内膜剥脱术(carotid endarterectomy,CEA)是治疗动脉硬化性颈动脉狭窄、预防缺血性脑卒中的标准方法。高龄(≥70岁)患者是脑血管病的高发人群,但由于高龄颈动脉狭窄患者动脉硬化程度严重,且往往合并冠心病、高血压、糖尿病等多种疾病,手术及麻醉风险较大,现实中很多高龄患者选择颈动脉支架或是保守治疗。笔者回顾分析了行CEA治疗的722例颈动脉狭窄患者的临床资料,探讨CEA治疗高龄颈动脉狭窄患者的安全性及有效性。
1 对象与方法
1.1 研究对象
回顾性分析2010年1月至2015年12月在北京协和医院血管外科接受CEA治疗的722例颈动脉狭窄患者的临床资料,并根据年龄将他们分为≥70岁组和<70岁组。所有患者均经颈动脉超声、经颅多普勒(transcranial doppler ultrasound,TCD)、计算机断层摄影血管成像术(computed tomographic angiography,CTA)和(或)数字剪影血管造影(digital substraction angiography,DSA)确诊。颈动脉狭窄率判断标准参照北美症状性颈动脉内膜剥脱试验(North American symptomatic carotid endarterectomy trial,NASCET)的标准[1]。
1.2 术前评估
所有患者都做好充分的术前风险评估。对于≥70岁组患者,术前联合麻醉科、心内科、呼吸内科、重症监护室对患者进行详细评估,包括18导联心电图、心脏超声、肺功能及血气分析等,评估患者麻醉耐受性及手术对血流动力学的影像,必要时行冠状动脉CT成像评估心脏风险。
1.3 方法
所有患者术前均给予口服阿司匹林100 mg至少1周。手术均在全身麻醉下进行,采用胸锁乳突肌前缘斜切口,牵开胸锁乳突肌显露颈动脉鞘,游离显露颈总动脉、颈内动脉及颈外动脉,注意保护迷走神经、舌下神经、喉上神经等。全身肝素化后,先后阻断颈内动脉、颈外动脉及颈总动脉。根据术中情况决定是否放置转流管。沿颈总动脉做纵行切口并延至颈内动脉病变段以远,完整剥除增生的颈动脉内膜及斑块,清除剥离面碎片和浮动内膜,取聚四氟乙烯(polytetrafluoroethylene,PTFE)或涤纶(Dacron)人工血管补片,修剪成合适形状,用血管缝线连续缝合修补血管壁。缝合完成后依次开放颈外动脉、颈总动脉及颈内动脉,确切止血后放置伤口内引流管,逐层缝合切口。术后继续给予每日口服阿司匹林100 mg。
统计患者性别、年龄、伴随疾病、颈动脉狭窄程度、是否症状性及是否合并对侧病变等临床基线资料。其中伴随疾病包括高血压、冠心病、糖尿病、高血脂症、吸烟史和高同型半胱氨酸(homocysteine, HCY)血症。高血压、冠心病、糖尿病、高脂血症病史定义为既往明确诊断或目前正在服用相应药物;吸烟史定义为既往曾吸烟及目前正在吸烟;高HCY定义为入院检查血清HCY高于正常高限(>15 μmol/L)。
分别统计患者术后并发症及不良反应,包括术后30 d内出现的手术相关死亡、缺血性卒中、急性心肌梗死及脑过度灌注综合征(cerebral hyperperfusion syndrome,CHS)等。缺血性卒中诊断参照WHO标准[2],急性心肌梗死定义为至少具备下列三条标准中的两条:(1)缺血性胸痛的临床病史;(2)心电图的动态演变;(3)心肌坏死的血清心肌标志物浓度的动态改变[3]。诊断CHS需同时符合以下三个条件:(1)颈动脉干预术后发生严重头痛、癫痫、意识障碍和(或)发展为局灶性神经症状如幻视、运动障碍等;(2)TCD监测术后大脑中动脉流速增加>100%;(3)除外任何脑缺血病灶[4]。
1.4 术后随访
患者出院后分别在1、3、6和12个月,以及其后每年进行门诊或电话随访。内容包括系统症状、彩色多普勒超声或CTA等检查资料,明确手术部位术后再狭窄情况。术后再狭窄定义为手术侧颈动脉超声或CTA提示血管狭窄≥50%。
1.5 统计学处理
2 结 果
2.1 患者基线资料
2010年1月至2015年12月,本院血管外科共收治颈动脉狭窄患者722例,其中≥70岁组 279例,年龄(76±5)岁,<70岁组443例,年龄(61±9)岁。≥70岁组患冠心病比例明显低于<70岁组,两组在其他伴随疾病及性别比例方面差异无统计学意义;在颈动脉狭窄程度和有无临床症状方面差异亦无统计学意义(表1)。
2.2 治疗效果及并发症情况
所有患者均顺利完成手术。≥70岁组术后30 d 内出现3例(1.1%)缺血性卒中:其中1例麻醉苏醒后意识障碍,立即行颈动脉造影显示补片远端颈内动脉夹层,再次给予颈动脉支架植入后神志逐渐恢复,未遗留明显后遗症;余2例在麻醉清醒后出现肢体无力症状,均给予保守治疗。4例(1.4%)急性心肌梗死:1例行急诊冠状动脉支架植入术、3例给予保守治疗。19例(6.8%)术后CHS:1例在术后第6天因脑出血死亡,余18例给予严格控制血压、20%甘露醇降颅压后缓解。<70岁组术后30 d出现4例缺血性脑卒中,5例急性心肌梗死,均给予保守治疗。14例术后CHS,给予严格控制血压、甘露醇降颅压后逐渐缓解。患者手术相关死亡率、神经系统和心脏并发症及CHS发生率详见表2。
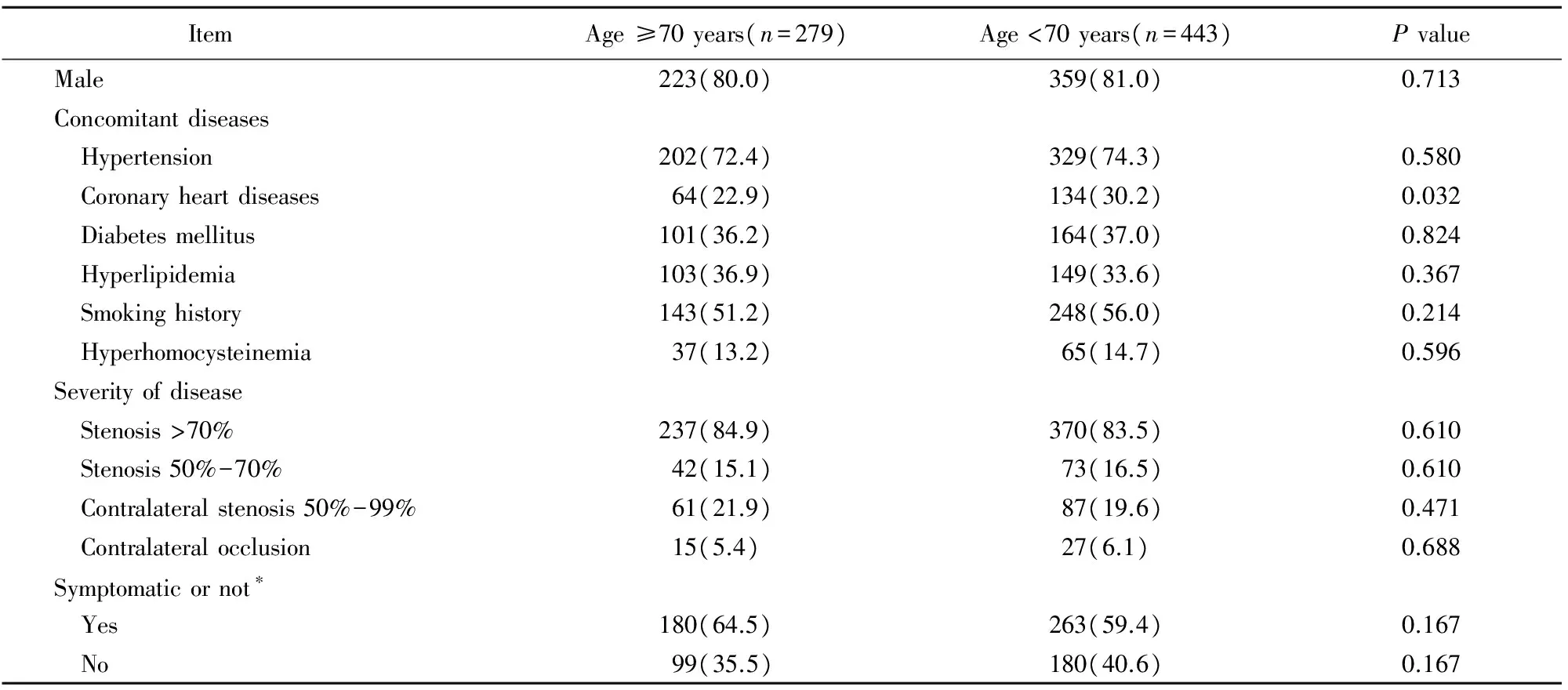
表1 两组患者基线情况Table 1 Comparison of baseline data between two groups [n(%)]
*“Symptomatic” means the patient suffers from transient ischemic attack or non-disabled stroke due to carotid stenosis in the last 6 months

表2 患者术后30 d内并发症Table 2 Postoperative complications within 30 days in two groups [n(%)]
CHS: cerebral hyperperfusion syndrome
2.3 随访情况
所有患者都完成至少1年随访,并在术后3个月、6个月、1年完成颈动脉超声或CTA检查。≥70岁组术后1年内出现术侧颈动脉再狭窄8例,其中中度狭窄5例,重度狭窄3例;出现术侧缺血性卒中3例。<70岁组术后1年内出现术侧颈动脉再狭窄15例,其中中度狭窄10例,重度狭窄5例;出现术侧缺血性卒中6例。两组比较,差异均无统计学意义(P>0.05)。
3 讨 论
颈动脉狭窄是导致缺血性脑卒中的重要原因。据统计,20%~25%的缺血性脑卒中是由颈动脉狭窄引起[5]。CEA作为预防缺血性脑卒中的有效治疗方式始于上世纪50年代,其有效性和安全性业已得到广泛论证,目前已成为治疗颈动脉狭窄的“金标准”[6,7]。但对于高龄颈动脉狭窄,CEA是否仍为首选,目前尚存在争议。部分研究显示,高龄患者身体状态大多较差,对麻醉和手术创伤的耐受能力降低,术后死亡和心肌梗死等发病率较高,故建议采用颈动脉支架成形术(carotid artery stent,CAS)[8]。但近年来,更多的研究结果表明,相对于颈动脉支架成形术,高龄颈动脉狭窄患者更能从CEA中获益。Rothwell等[9]总结了欧洲颈动脉外科试验(European Carotid Surgery Trial,ECST)和北美症状性颈动脉内膜剥脱试验(North American Symptomatic Carotid Endarterectomy Trial,NASCET)数据,认为年龄>75岁的患者相对于年龄<65岁的患者更能从CEA中获益。颈动脉血运重建内膜剥脱术对比支架置入术试验(Carotid Revascularization EndarterectomyvsStenting Trial,CREST)也表明,相对于CAS,≥70岁患者行CEA获益更大[10]。国际颈动脉支架研究(International Carotid Stenting Study,ICSS)表明,≥70岁患者CEA术后不良事件发生率低于颈动脉支架成形术[11]。Khatri等[12]回顾分析了美国在2005年至2008年间接受手术治疗的495 331名颈动脉狭窄患者,发现≥70岁患者分别行CAS和CEA术后,CAS组患者脑卒中发生率显著高于CEA组。
本研究对比了 ≥70岁 和 <70岁颈动脉狭窄患者CEA术后并发症发生率,发现两组在术后30 d内死亡、缺血性脑卒中、急性心肌梗死的发生率差异均没有统计学意义。这说明在术前做好充分的神经系统及心肺功能评估的情况下,高龄并不明显增加CEA的手术风险。而正是由于严格的术前评估,一部分合并冠状动脉严重病变的高龄患者没有施行CEA,导致≥70岁组患者合并冠状动脉粥样硬化性心脏病的比例较<70岁组显著降低。随访1年数据表明,CEA术后颈动脉再狭窄率及同侧卒中率也没有显著差异。
≥70岁组患者术后出现CHS的概率显著高于低龄组,这符合以往文献报道。CHS是颈动脉狭窄再通术后的严重并发症。通常认为,长期颈动脉狭窄、颅内灌注相对不足导致血管自我调节机制受损。当狭窄血管被开通之后,过高的血压增加脑灌注压,破坏了原已受损的脑血管屏障,引起液体渗漏至组织间隙产生脑水肿,甚至导致血管破裂,从而引起CHS[13]。而高龄颈动脉狭窄患者往往病史较长,动脉壁弹性差,脑血管自身调节能力减弱,CEA术后脑血流量明显增多,较年轻患者更容易发生过度灌注,严重者甚至出现脑出血[14]。因此对于高龄患者,术后血压控制要更严格,在不影响脑、心脏、肾脏等重要脏器血供的前提下,尽量把血压控制在基础血压或略低水平,保持血压平稳,避免波动。文献统计,CEA术后CHS发生率为0.2%~18.9%[15],本研究中高龄组患者CHS发生率为6.8%,尽管高于低龄组,但仍处于可接受范围。
综上所述,经过充分的术前评估及正确的围手术期处理,≥70岁颈动脉狭窄患者行CEA并不增加手术风险,术后颈动脉再狭窄率及患侧再卒中率较<70岁患者也没有显著增加。但本研究是单中心回顾性研究,且仅有1年的随访数据,研究结果有待于大样本、多中心、随访时间更长的随机研究的证实。
【参考文献】
[1] North American Symptomatic Carotid Endarterectomy Trial Collabo-rators. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis[J]. N Engl J Med, 1991, 325(7): 445-453. DOI: 10.1056/NEJM199108153250701.
[2] Stroke — 1989. Recommendations on stroke prevention, diagnosis, and therapy. Report of the WHO Task Force on Stroke and other Cerebrovascular Disorders[J]. Stroke, 1989, 20(10): 1407-1431. DOI: 10.1161/01.STR.20.10.1407.
[3] 中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 急性心肌梗死诊断和治疗指南[J]. 中华心血管病杂志, 2001, 29(12): 705-720.
Chinese Society of Cardiology, Editorial Committee of Chinese Journal of Cardiology. The guideline for the diagnosis and treatment of acute myocardial infarction[J]. Chin J Cardiol, 2001, 29(12): 705-720.
[4] Ogasawara K, Sakai N, Kuroiwa T,etal. Intracranial hemorrhage associated with cerebral hyperperfusion syndrome following carotid endarterectomy and carotid artery stenting: retrospective review of 4494 patients[J]. J Neurosurg, 2007, 107(6): 1130-1136. DOI: 10.3171/JNS-07/12/1130.
[5] Moulakakis KG, Mylonas SN, Sfyroeras GS,etal. Hyperperfusion syndrome after carotid revascularization[J]. J Vasc Surg, 2009, 49(4): 1060-1068. DOI: 10.1016/j.jvs.2008.11.026.
[6] Silver FL, Mackey A, Clark WM,etal. Safety of stenting and endarterectomy by symptomatic status in the Carotid Revascularization EndarterectomyversusStenting Trial(CREST)[J]. Stroke, 2011, 42: 675-680. DOI: 10.1161/STROKEAHA.110.610212.
[7] Rockman C, Loh S. Carotid endarterectomy: still the standard of care for carotid bifurcation disease[J]. Semin Vasc Surg, 2011, 24(1): 10-20. DOI: 10.1053/j.semvascsurg.2011.03.005.
[8] Yadav JS, Wholey MH, Kuntz RE,etal. Protected carotid-artery stentingversusendarterectomy in high-risk patients[J]. N Engl J Med, 2004, 351(15): 1493-1501. DOI: 10.1056/NEJMoa-040127.
[9] Rothwell PM, Eliasziw M, Gutnikov SA,etal. Analysis of pooled data from the randomized controlled trials of endarterectomy for symptomatic carotid stenosis[J]. Lancet, 2003, 361(9352): 107-116.
[10] Mantese VA, Timaran CH, Chiu D,etal. The Carotid Revascularization EndarterectomyversusStenting Trial (CREST): stentingversuscarotid endarterectomy for carotid disease[J]. Stroke, 2010, 41(10 Suppl): 31-34. DOI: 10.1161/STROKEAHA.110.595330.
[11] International Carotid Stenting Study Investigators. Carotid artery stenting compared with endarterectomy in patients with symptomatic carotid stenosis(International Carotid Stenting Study): an interim analysis of a randomized controlled trial[J]. Lancet, 2010, 375(9719): 985-997.DOI: 10.1016/S0140-6736110160239-5.
[12] Khatri R, Chaudhry SA, Vazquez G,etal. Age differential between outcomes of carotid angioplasty and stent placement and carotid endarterectomy in general practice[J]. J Vasc Surg, 2012, 55(1): 72-78. DOI: 10.1016/j.jvs.2011.08.007.
[13] Karapanayiotides T, Meuli R, Devuyst G,etal. Postcarotid endarterectomy hyperperfusion or reperfusion syndrome[J]. Stroke, 2005, 36: 21-26. DOI: 10.1161/01.STR.0000149946.86087.e5.
[14] Moulakakis KG, Mylonas SN, Sfyroeras GS,etal. Hyperperfusion syndrome after carotid revascularization[J]. J Vasc Surg, 2009, 49(4): 1060-1068. DOI: 10.1016/j.jvs.2008.11.026.
[15] Lieb M, Shah U, Hines GL. Cerebral hyperperfusion syndrome after carotid intervention: a review[J]. Cardiol Rev, 2012, 20(2): 84-89. DOI: 10.1097/CRD.0b013e318237eef8.

