基于学生的认知序优化教学过程
李晓明
摘要:以“氯气和水、碱反应”的教学为例,在分析教材序和常规教学设计的基础上对教学过程进行优化以促进学生认知结构的发展和转变。提出化学课堂的教学过程设计要服从学生的认知序,适当调整教材内容,找准知识的出发点,而不能盲目地依据教材序组织教学活动,以达到创造性使用教材的目的的观点。
关键词:认知序;氯气和水、碱反应;教材序;教学过程
文章编号:1005–6629(2017)3–0049–05 中图分类号:G633.8 文献标识码:B
1 问题的提出
教材序指的是教材内容以不同的栏目形式、一定的学科逻辑予以呈现,往往体现了编者对课程内容的理解及学生身心发展规律。认知序指的是与学习者学习水平、认知特点相适应的学习路径。组织与优化教学过程是实现有效教学的基础和前提,优化认知序是实现有效教学的关键和核心[1]。在实际的教学中,我们要以教材内容的编排顺序为基础,创新教学设计,着眼于学生最近发展区,促进学生主动、自主的建构认知结构,不能受限于教材序,而要创造性地使用教材,契合学生的认知发展规律,以优化教学过程。
2 “氯气和水、碱反应”教学分析
2.1 教材序分析
氯气和水、碱反应的教学内容在教材[2]中是以“活动与探究”栏目形式呈现,首先提出探究性问题,并提供四组实验方案,前三组实验方案设计的目的分别是要说明氯气没有漂白性而氯水有漂白作用、氯水呈酸性和氯水中存在Cl-。然后告知:“研究证明,溶解在水中的部分氯气能与水发生反应,生成盐酸和次氯酸”。并介绍说明次氯酸具有漂白、杀菌和不稳定性。通过第四组实验来说明氯气与NaOH溶液可以反应,工业生产中和实验室常用氢氧化钠溶液吸收氯气尾气,并介绍氯气与石灰乳为原料制造漂白粉以及漂白粉应密封保存的原理,最后介绍“氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。自来水的消毒、农药的生产、药物的合成的等都需要用到氯气”。教材中知识的呈现体现了生活化,且按照“性质→制备→应用”的次序呈现。教材中的内容安排如图1所示。
从教材中“活动与探究”的实验内容来看,其目的是为了研究氯气与水、碱的反应,同时认识氯水的漂白性。但是学生没有经过自身的思考分析过程来明确为什么要做这些实验?此外,既然是已经由教材设定好的实验方案,何来探究呢?设计实验4的目的在于说明氯气与碱可发生化学反应,但这个事实在氯气的制备学习过程中学生就已经得知,何须再通过实验来证明?在建构“氯气和水、碱反应”的知识结构时,学生的已有认知与新信息并没有发生相互作用,没有充分调动已有认知和经历主动思考过程又何谈知识的自主建构呢?
2.2 依据教材序的常见教学过程分析
为了让教材中的实验更好地为教学服务、为学生的知识建构服务,教师会对教材实验栏目进行深度加工,創造目的明确、探究实在、形式开放的探究实验。并根据学生在“氯气的性质”第一课时中,已经学习了氯气的物理性质及氯气和单质(Na、Fe、Cu、H2)的反应,学生已经知道氯气在这一系列变化中的共同特点是化合价降低,生成-1价Cl,同时学生对H+和Cl-检验的基本方法也是熟知的,化合价有升必有降的氧化还原基本原理学生也已掌握。根据上述学生的认知序设计教学思路:让学生思考氯气与水若能发生化学反应,可能会产生何种物质?学生会根据氯气与金属、非金属化合时呈-1价先推测出氯水中可能含有盐酸,此时再通过交流讨论、设计实验方案验证其猜想。当用指示剂或pH试纸检验氯水酸性时,会出现褪色的异常现象,得出氯水具有漂白性的结论,通过设计实验证明盐酸和干燥氯气没有漂白性从而得出氯水中应还有其他具有漂白性的物质。然后再根据化合价有升必有降判断出是氯元素的化合价升高,给出次氯酸的化学式为HClO,再根据氯气与水的反应类比与碱的反应,并利用该反应制取漂白粉。整个教学过程仍是按照教材内容顺序进行设计,可用图2来表示。
但采用上述教学过程时次氯酸(HClO)的引入显得牵强,尽管按照氧化还原的规律,化合价应该有降有升,因此氯元素的化合价也就上升为+1价,同时也就形成了次氯酸(HClO)。这样的讲解绝大多数学生听起来觉得很有道理,也很容易理解,但只要思维缜密的学生都会提出质疑,如果反应中氯元素化合价能升高,氧元素的化合价为什么不能升高呢?氯元素化合价要升高,一定升高到+1价吗?+1价的含氧酸一定是HClO形式吗(次磷酸中P的化合价为+1价,其化学式为H3PO2)?这些都说明单单从化合价角度分析,得出氯气与水反应生成次氯酸(HClO)的结论是不严谨的,只能让学生感觉到教师在刻意传授知识,设计的痕迹太重[3]。由于氯水中HClO的分解耗时长,实验效果不明显,教材中并没有安排HClO的稳定性实验,所以教师也没有提供相关素材来佐证HClO会分解这样的客观事实。同时,对于为什么次氯酸在溶液中主要以分子形式存在?为什么HClO的酸性弱于碳酸?教师并没有把这些问题的思考过程真实地呈现给学生,是由教师直接告知,这样就造成了学生认知建构的不连续,出现了认知发展的断裂现象。
3 更切合学生认知序的“氯气和水、碱反应”的再设计
3.1 设计思路
在初中学生已经知道了较强酸制取较弱酸的复分解反应原理,也知道有水生成是复分解反应发生的条件之一,反应前后原子的种类和数目不变的质量守恒观念也已建立。进入高中后学生首先就对物质的分类进行了学习;在物质的分离和提纯中学习了萃取的方法和原理;在学习氯气的实验室制备时,学生已经知道氯气与碱会发生化学反应,但并不知道会生成何种产物。在电解质与非电解质的学习时,学生知道了酸与水均为电解质,结合初中对水的认知,学生知道在水中大量存在的是水分子,少量存在的是H+和OH-,水是一种难电离的电解质。学生对生活中的事物和现象有着强烈的探究的兴趣和愿望,学生期待将所学知识用来解决生活、社会中的实际问题是学生主动认知的强大内驱力,所以从“应用→性质→制备”的顺序开展教学更能调动学生的认知欲。
基于学生以上认知基础,在教学中将教材中氯气先与水再与碱反应的内容安排顺序进行倒置,从氯气与碱的反应进行切入,再到氯气与水的反应,其教学思路如下:先介绍氯气在生产生活中的应用,由生活中常见的“84消毒液”和“漂白粉”的漂白、制备原理引出HClO及其他的漂白杀菌性,根据增强“84消毒液”的漂白杀菌原理来说明HClO具有的弱酸性及其和水相似的电离能力。提供数字化实验数据分析HClO的不稳定性及分解产物。由氯气与碱的反应类比、推测氯气与水的反应产物,通过设计实验进行验证推测。
3.2 教学过程
3.2.1 “84消毒液”的使用说明——次氯酸的漂白、杀菌性和弱酸性
首先投影展示氯气在生产生活中的应用:聚氯乙烯、药物(如马兰酸氯苯那敏片)、制纯硅、制氯化物(如盐酸)、消毒剂(如84消毒液)、自来水的消毒。
展示“84消毒液”,并投影“84消毒液”的说明书,见图3。
从说明书中可知“84消毒液”主要成分是次氯酸钠,并向学生介绍化学式为NaClO。在使用消毒液时只能对白色衣物进行消毒,不能使用在有色织物上,说明次氯酸钠不仅具有杀菌消毒的效果还具有漂白性。此时,向学生说明漂白一般是指使有机色素褪色的过程,常见的有机色素包括酸碱指示剂、有机染料等。然后演示实验:取 2mL 84消毒液于试管中,滴加2~3滴紫色石蕊(现象:紫色石蕊试剂先变蓝后褪色,但褪色不明显)。难道次氯酸钠没有漂白性吗?然后再向上述还未褪色的试管中滴加几滴稀硫酸(现象:马上褪为无色)。为什么加入硫酸后会明显褪色?是稀硫酸有漂白性吗(学生根据初中对稀硫酸的认知可否定这种猜测)?是否是NaClO与稀硫酸发生反应的产物具有漂白性?若是两者发生复分解反应则产物是什么?学生会根据较强酸制较弱酸以及NaClO属于含氧酸盐,推出其对应的酸为次氯酸,化学式为HClO,进而写出反应的化学方程式:2NaClO+H2SO4=Na2SO4+2HClO。此时,学生明确了HClO具有漂白、杀菌性,再由HClO属于酸类物质,可知其必有酸的通性。

3.2.2 “84消毒液”和“漂白粉”的制备——氯气与碱的化学反应
“84消毒液”的生产原理是什么?就是利用Cl2与碱发生反应(制取氯气时的尾气就是用NaOH溶液来吸收的)。Cl2+NaOH—NaClO+?此时再根据化合价有升必有降可判断出产物有NaCl,根据质量守恒可知有H2O(在分析为什么不是+1价的H降低到0价生成H2时,学生已经在前一节的学习中知道了Cl2与H2混合光照下会发生爆炸产生HCl,从而该推测不合理)。
介绍另一种可用来漂白、杀菌的产品——漂白粉,其主要成分为次氯酸钙,再由学生自主写出该反应的化学方程式:2Cl2+2Ca(OH)2=Ca(ClO)2+ CaCl2+2H2O,这样学生就对氯气与碱反应有了知识上的归纳概括(会生成次氯酸盐和盐酸盐)。通过引导再让学生写出漂白粉起漂白效果的化学方程式:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO(需要说明的是,该反应不能说明H2CO3的酸性强于HClO [4])
3.2.3 氯气与碱的化学反应——氯气与水的化学反应
氯气可溶于水,1体积水可溶解2体积氯气,氯气溶于水的过程中会与水发生反应吗?若反应其产物是什么?学生通过氯气与碱的化学反应这一思考的起点出发自然可推测出氯气与水反应会生成HClO和HCl。氯气与碱的反应可以理解为氯气先与水反应生成HClO和HCl,然后两种酸再与碱分别生成次氯酸盐和盐酸盐。
再引发探究性问题:如何设计实验来证明上述猜测?学生经交流讨论,提出多种实验方法见表1。
学生通过分组实验验证了氯气与水反应会生成盐酸和次氯酸的假设猜想。展示一瓶呈黄绿色的氯水,为什么呈黄绿色?说明有Cl2,氯气与水会反应为什么还会残留有氯分子呢?可逆反应概念的提出此刻就顺其自然了。既然氯水中有氯分子也有盐酸,如何设计实验证明氯水的漂白不是由上述两种物质产生的呢?学生会设计出在盐酸中滴加石蕊和干燥氯气中加入有色纸条的实验方案。继续提出问题,若没有干燥的氯气,只有氯水和四氯化碳的情况下,又如何检验Cl2没有漂白性呢?学生根据物质的分离提纯中萃取的原理,会设计出用四氯化碳萃取出氯水中的Cl2,然后再将缠有有色纸条的玻璃棒深入试管中,发现插入四氯化碳层中的纸条不褪色而插入水层的纸条褪色。至此,氯气与水反应的产物已经确定,氯气在自来水消毒中的应用也就适时地引入了。再引导学生发现问题:为什么氯气与水是可逆反应,氯气没有全部与水反应,而氯气与碱反应却能反应完全呢?此时可渗透平衡移动的原理,因为HClO与HCl不断被消耗,为弥补产物损失,反应物会持续反应直至消耗完全,这也为后续氯水的变质做知识性的铺垫。
3.2.4 数字实验提供数据——次氯酸的不稳定性
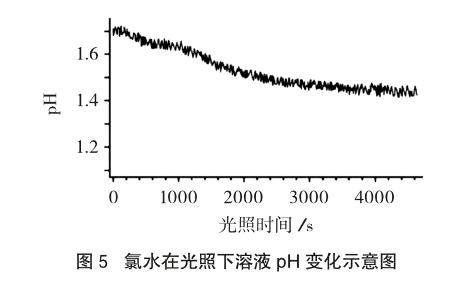
提供新制氯水与久置氯水的对比图片。再予以说明氯分子之所以會减少是因为氯气与水反应生成的产物盐酸或次氯酸的含量减少,为了弥补损失,氯分子会不断与水发生反应,从而使氯分子消耗。若用强光照射氯水,利用数字化传感技术对氯水的pH变化、O2浓度变化进行测定。实验数据记录见图4、图5。

学生根据图4中氧气浓度随时间变化关系可判断有氧气生成,再根据质量守恒可知HClO会分解产生O2,根据化合价升降规律可知另一产物为盐酸(2HClO光照= O2↑+2HCl),图5中光照后酸性增强的事实也可以佐证这个结论。此时,氯水、“84消毒液”和“漂白粉”的保存方法自然水到渠成(避光阴暗处,密封保存)。学生也理解了为什么没有直接含有HClO的产品,要先制成次氯酸盐。
3.2.5 氯水使滴有酚酞的NaOH溶液褪色原因探究——知识的深化
学生已经在上述教学活动中认知了氯水具有酸性和漂白性,据此设计实验:取少量烧碱溶液滴加几滴无色酚酞,再向其中逐滴滴加氯水,红色最终褪去。其原因是什么?学生经讨论可提出两种猜想:猜想1是氯水中的H +与碱中的OH-中和导致褪色;猜想2是氯水的HClO分子漂白破坏了酚酞的结构导致褪色。如何设计实验证明是哪种原因?方案1:向褪色后的溶液中滴加NaOH,若溶液变红则说明是中和导致褪色,若不变红则是漂白导致褪色;方案2:向褪色后的溶液中滴加酚酞,若溶液变红则说明是HClO分子的漂白导致褪色,若不变红则说明是中和导致褪色。最后通过实验证明氯水的漂白是导致褪色的主要原因。当然,教师在评价时,要说明在向红色酚酞溶液中加入氯水的过程中,必然会发生酸碱中和的过程,开始没有漂白,是由于HC1O大部分都被碱中和成NaC1O了,当溶液的碱性明显减弱时,加入氯水中的HC1O就可以发生漂白反应了,最终漂白的结果也包含了酸碱中和的贡献。以避免学生产生非此即彼的孤立看问题的错误观念。
4 教学反思
经过优化重组后的“氯气和水、碱反应”的教学过程,打乱了苏教版教材的内容编排顺序,取得了良好的教学效果。在充分分析了学生前认知的基础上,找准了知识的起点,遵循了学生的认知序,通过创设体现化学价值观的问题情境,引起学生好奇心和学习兴趣,发挥学生的主观能动性,将知识学习、生活经验、问题解决有机地结合起来,创造性地使用了教材,使教材内容在我们的设计中散发出它独有的魅力。同时在教学过程优化了实验教学,培养学生的思维能力、实验设计能力、分析推理能力、类比分析能力,真正让学生自主、主动参与学习的全过程,让学生经历了有意义的学习过程。
教材作为学习素材和工具,我们在使用教材时首先要对化学教材进行编排意图、任务活动与学习目标等方面的分析;然后,对教材呈现的素材的内涵进行挖掘,理清其中蕴涵的化学知识,以及这些化学知识之间的联系;接着,着重进行学生认知结构分析等;最后,综合教材分析和学生认知结构分析,以学生最易接受的认知方式组织教学流程,或调整内容呈现顺序,或改变呈现方式,或改进活动设计等,以期能更有效地引导学生构建化学知识结构,并达到教学过程的最优化和提升教师使用化学教材的水平。
参考文献:
[1]郭君瑞.化学課堂教学内容的组织与优化策略[J].中学化学教学参考,2016,(6):8.
[2]王祖浩主编.普通高中课程标准实验教科书·化学1(必修)(第6版)[M].南京:江苏凤凰教育出版社,2014:42~44.
[3]李发顺.为学生找思考的梯子[J].中学化学教学参考,2015,(1~2):20.
[4]严宣申.化学原理选讲[M].北京:北京大学出版社,2012:245.

