甘蓝型油菜雄性不育系312A形态学及细胞学研究
葛璞玉,崔贵梅,王耀辉,王景雪,杜春芳,孙毅
(1.山西大学生命科学学院,山西太原030006;2.山西省农业科学院生物技术研究中心,山西太原030031;3.山西省农业科学院棉花研究所,山西运城044000)
甘蓝型油菜雄性不育系312A形态学及细胞学研究
葛璞玉1,崔贵梅2,王耀辉1,王景雪1,杜春芳3,孙毅2
(1.山西大学生命科学学院,山西太原030006;2.山西省农业科学院生物技术研究中心,山西太原030031;3.山西省农业科学院棉花研究所,山西运城044000)
研究甘蓝型油菜(Brassica napus L.)雄性不育系312A及其保持系312B的花器官形态差异和312A的花药败育特点等,为312A的进一步利用提供理论根据。结果表明,312A与312B的花器官性状存在着极显著差异,其中,312A花药在发育过程中体积较小、干瘪,成熟后花丝较短,不能释放有活力的正常花粉;312B花药体积较大、相对比较饱满,最终可以释放大量鲜黄色的成熟花粉。花蕾石蜡切片观察发现,312A的花药败育发生在3个时期,即小孢子孢原细胞期、造孢细胞分化期和二核花粉期,其中,前2个时期败育属于无花粉囊型败育;二核花粉期败育则是花药发育至二核花粉粒时期,已接近成熟,但2个细胞核的核膜消失,核开始解体直至消失,形成无效的败育花粉粒。这是迄今为止首次在甘蓝型油菜中发现二核期败育类型。
甘蓝型油菜;细胞质雄性不育系;细胞学;花粉败育
油菜是我国重要的油料作物,油菜的杂种优势利用是高产育种的重要途径[1]。因此,油菜雄性不育系的发现和研究也颇受育种家重视。目前,已经发现的甘蓝型油菜细胞质雄性不育(CMS)类型主要有:Ogura CMS,Nap CMS,Polima CMS,Shan2ACMS,Hau CMS,NCa CMS,Nsa CMS,NEACMS等[2]。其中,Polima CMS不育性稳定,成功地在甘蓝型油菜中找到了恢复系,是第1个实现三系配套的不育系类型[3]。因此,其在油菜杂种优势利用中起着重要的作用。目前,我国甘蓝型油菜生产上使用的油菜杂交种约70%为细胞质雄性不育杂种[4],且主要来自Polima CMS和Shan2ACMS[5]。关于油菜的雄性不育系花粉发育的细胞学特征,前人已有一些研究[6-15],结果表明,不育系花药败育可能发生在花粉发育的每一个阶段,败育的高峰期是小孢子四分体至单核花粉期;不育系的来源和类型不同,其花药败育发生的时期有所不同;不同材料花药败育的细胞学差异受基因型控制。余凤群等[6]按照花药败育发生的时期和方式的不同,将甘蓝型油菜雄性不育类型分为3类:即无花粉囊型、花粉母细胞败育型和单核败育型。对Polima CMS不育系的细胞学研究结果证明,Polima CMS的雄性败育发生在孢原细胞时期,属于无花粉囊败育型雄性不育系[6,9-10]。
312A的选育是以外引不育系26A(Polima CMS来源)为母本,与山西省农业科学院棉花研究所油菜育种课题组自选的优良品系20001519测交并连续回交5代,定向选育而成。312A不育株率达100%,不育度在95%以上。低温早期有轻微死蕾,盛花后花瓣开放正常,具有不育性稳定、温度影响较小、配合力高等特点,是山西省甘蓝型油菜杂交种晋油10号、晋油11号的主要亲本材料。
本研究对312A雄性不育系进行小孢子发育过程中形态学和细胞学观察,研究其败育发生的时期和类型,旨在为进一步开展优良杂交种的选育提供理论依据。
1 材料和方法
1.1 试验材料
供试材料为甘蓝型油菜不育系312A和保持系312B。供试材料播种于山西省农业科学院棉花研究所试验田内。
1.2 试验方法
1.2.1 花冠形态学观察方法在油菜盛花期,采集312A和312B新鲜开放的花各30朵,观察拍照对比,用游标卡尺测量花冠径、花瓣长、花瓣宽、花柄长、花丝长、雌蕊长、四强雄蕊长、二弱雄蕊长、四强花药长、二弱花药长,并记录数据。采用SPSS 18.0软件分析差异显著性。
1.2.2 花粉发育过程细胞学试验方法2015年4月初,参考龙欢等[10]的方法,在油菜开花期,分别从不育系312A和保持系312B植株上摘取花蕾长度<0.5,≥0.5<1,≥1<2,≥2<3,≥3<4,≥4<5,≥5<6,≥6<7,≥7 cm等一系列不同大小的花蕾,迅速投入卡诺氏固定液中(V(无水酒精)∶V(冰醋酸)=3∶1)固定24 h,然后转到70%乙醇中保存备用。花粉发育的细胞学观察采用常规石蜡切片,埃氏苏木精整体染色法,Olympus BH2显微镜观察,冷CCD摄影,并统计败育率。
2 结果与分析
2.1 油菜312A花器官性状特点
由表1可知,从苗期至现蕾期,312A和312B的花器官没有明显的形态差异,抽薹至开花期,312A和312B的花朵在外观形态方面开始呈现明显的差异,所检测的全部花器官性状中,312A与312B均有极显著的差异。与312B相比,312A花瓣的长度明显变小,宽度明显变窄;雄蕊明显退化,无论是四强雄蕊还是二弱雄蕊,312A的雄蕊长度都明显小于312B。312A的花冠正面看不到雄蕊,从雄蕊外形来看,花丝长度明显变短,无论是四强花药还是二弱花药,312A的花药长度都明显小于312B,而且花药干瘪,呈三角型。由于花丝过短致使花药的高度不及柱头的高度;花药颜色淡黄发白,不能产生正常花粉粒。与312B大且饱满的鲜黄色花药,形成了明显的对比。这与田保明等[16]对细胞质雄性不育系384A的花器官性状研究结果一致。
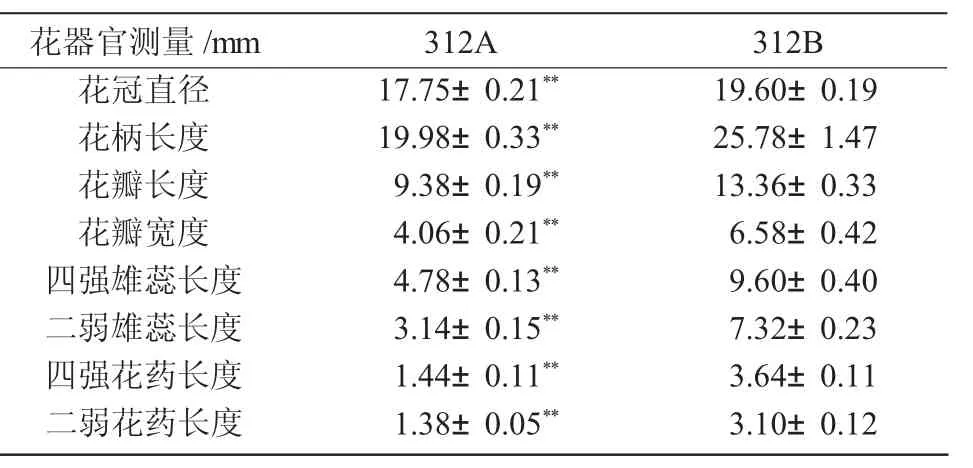
表1 开花期312A和312B的花器性状比较
2.2 油菜312B花药发育过程
2015年春在油菜初花期,对雄性不育系312A的保持系312B不同大小的花蕾进行了取样固定和制作石蜡切片,观察了312B正常花粉发育过程中细胞学变化,结果确定了甘蓝型油菜保持系312B花药发育过程为:在花蕾长度小于0.5 cm时,花药开始分化,最初花药横切面呈肾形,并且所有的细胞染色均匀,在花药表皮下分化出的孢原细胞清晰可见,即孢原细胞时期(图1-A);随后,孢原细胞平周分裂形成初生壁细胞和初生造孢细胞,初生造孢细胞经过有丝分裂产生次生造孢细胞,即造孢细胞时期(图1-B),此时花药的形状逐渐变成规则的蝶形,在蝶形花药4个角隅各出现一片染色较深的区域,可以明显地分为3层,即表皮层、中层和药室内壁,都是由初生壁细胞分裂后进一步发育形成的。药室内壁中的细胞也同样被染色,且很均匀,次生造孢细胞经多次分裂形成一定数量的花粉母细胞。初期花粉囊空间较小,花粉母细胞紧密连接在一起没有明显间隔,后期随着花粉囊的空间增大,花粉母细胞间的胞间层充满胼胝质,光镜下呈透明物质,似花粉母细胞之间的间隙。
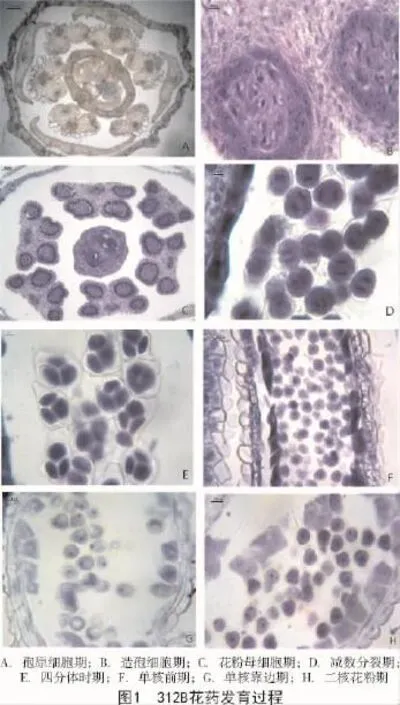
随着花粉囊进一步扩大,花粉母细胞向药室中央集中,此时在幼花蕾的横切面上,可见1个雌蕊和6个雄蕊,花药的横切面呈现理想规则的蝶形(图1-C);大孢子母细胞经过短暂的减数分裂期(图1-D),形成四分体(图1-E);随着胼胝质的消失,四分体相互分离,早期的小孢子花粉依然紧密连接在一起,细胞壁很薄,细胞核居于中央(图1-F),此时紧贴内壁规则排列的绒毡层细胞开始退化解体,为小孢子花粉的继续发育提供营养,促使单核中期花粉体积增大,细胞质中逐渐有大液泡出现;随即细胞核被迫移向细胞一侧,进入单核靠边期(图1-G),此时细胞内染色不均一;单核花粉粒因为一次常规的有丝分裂产生2个核,接着发生一次不均等的细胞质分裂,进入二核花粉粒时期(图1-H),绒毡层细胞进一步退化;随着花粉的进一步分化,生殖细胞再分裂,形成2个梭型的精核细胞,进入三核花粉粒时期,此时,绒毡层完全退化消失,相邻花粉囊之间的组织解体破裂,为成熟花粉的散出做准备。这与前人对油菜花粉发育的观察结果一致[12,15]。
2.3 油菜312A雄性败育细胞学特征
通过对312A和312B花粉发育过程的对比观察发现,312A不育系花粉败育类型有以下4种。
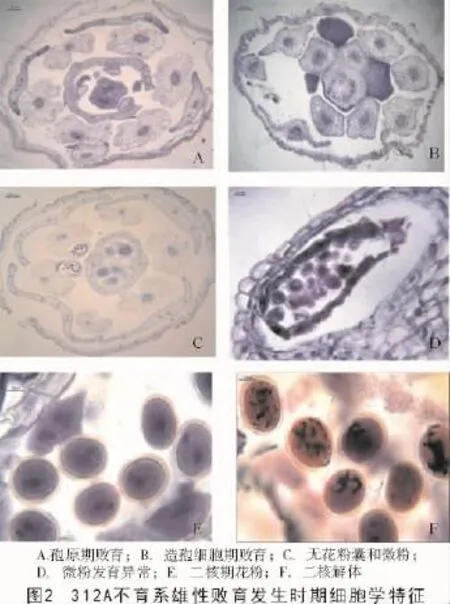
第1种,312A花药发育的初始阶段,花药周边有4团具有分裂能力的分生细胞快速分裂,使得花药变成类似蝶形,在花药横切面上出现具有4个棱角的花药雏体,类似蝶形花药的中央部分出现药室间隔,间隔由维管束和薄壁细胞共同组成,此时可以看到雌蕊位于中央,但没有子房腔的分化,染色均匀,四强雄蕊位于雌蕊周围。花药中没有孢原细胞的分化,也没有造孢细胞和花粉母细胞的进一步分化形成,整个花药的状态始终都是薄壁细胞。这一部分花药发育受阻于孢原细胞时期,属于无花粉囊型败育(图2-A)。
第2种,有一部分花药虽然能发育造孢细胞,但发育过程与312B花药发育明显不同。药室内壁中的细胞开始由原来的孢原细胞平周分裂形成初生壁细胞和初生造孢细胞,初生壁细胞经过平周分裂和重周分裂,产生呈同心排列的数层细胞,但花药出现畸形,没有发育成理想的蝶形,花药被严重拉伸,导致形态不对称,同时其中的维管组织也出现异常。此后,一部分花药的发育停留在造孢细胞时期,导致没有花粉囊的出现,这种败育类型属于无花粉囊型败育(图2-B)。
第3种,一部分花药会继续发育产生表皮层、中层和药室内壁,这3层细胞和紧贴内壁规则排列的绒毡层细胞一起构成花粉囊壁。同时,花粉母细胞也开始分化形成。但从花蕾的横切面来看,6个雄蕊的发育进程明显不同步,四强雄蕊靠近子房发育相对较快,体积相对较大,但花药依然没有发育成为规则的蝶形,已经发育好的药室也出现畸形,并且药室的发育不像正常会出现4个花粉囊,它最多出现一个花粉囊(图2-C),其余的应当出现花粉囊的细胞仍然保持薄壁状态。发育出的花粉囊里会出现少量的花粉母细胞,形成类似Polima CMS的微粉现象,但是这些花粉母细胞虽然会继续发育,但在后期其内部会出现异常(图2-D)而导致败育,并不能形成有活力的花粉粒。
第4种,有一部分花药内会发育出现单核花粉粒,花粉整体形态也能发育为规则的球形,单核中期时的花粉细胞核大,染色较深,位于中央。有的花粉也能经过有丝分裂和一次不均等的细胞质分裂,导致发育进入二核花粉粒时期(图2-E)。但随着花粉粒的进一步发育,2个细胞核的核膜消失,核开始解体直至消失(图2-F),形成无效的花粉粒。
3 讨论
本研究所用的材料312A,其测交转育的母本是26A,属于Polima CMS雄性不育系。312A的花药败育时期及特点与前人对Polima CMS研究所得结论不尽相同。本研究结果表明,312A的花药败育绝大多数出现在孢原细胞分化时期,属于无花粉囊型败育,与前人的研究结果一致[6,9-10,17]。所不同的是:312A油菜中出现了微粉现象,但是这些微粉在小孢子发育后期会败育。因此,这种现象与Polima CMS雄性不育系在低温下发生的微粉现象还不完全相同[9-10]。少部分油菜花粉败育出现在二核期。尽管LASER等[11]通过对CMS的研究,认为雄性不育可以发生在花药发育的每一个时期,但花药败育的高峰期集中在四分体和单核靠边期之间。二核期败育这种现象却是迄今为止首次在甘蓝型油菜中发现。在甘蓝型油菜的近缘种中,施展等[18]曾在大白菜细胞质雄性不育系6w-9605A中观察到了单核靠边期或者二核期败育这种不育现象。
本研究观察发现,312A在转育的过程中,雄性败育的时期和类型发生了变化,增加了新的败育类型。相似的情况前人也曾有报道,青海省农林科学院春油菜研究所从引进的双低春油菜品种“马努”与Polima CMS331A测交,并连续回交选育出来的105A,研究发现,花粉败育也发生在2个时期,即造孢细胞时期和单核晚期[13]。
对水稻光敏核不育的研究表明,雄性不育与绒毡层的程序化死亡有关[19]。利用近等基因系对Polima CMS的转录组基因表达分析结果表明,雄性不育系花粉败育与花粉发育过程中orf224/atp6相互作用引起的一系列能量匮乏有关[20]。312A的败育机制仍有待进一步研究。
[1]傅廷栋.油菜杂种优势研究利用的现状与思考[J].中国油料作物学报,2008,30(5):1-5.
[2]廖志强,况晨光,许丽芳,等.中国甘蓝型油菜细胞质雄性不育的主要类型及在育种实践中的应用[J].中国农学通报,2010,26(3):105-110.
[3]傅廷栋,杨光圣,杨小牛,等.甘蓝型油菜波里马细胞质雄性不育的发现、研究与利用[J].自然科学进展,1995,5(3):287-293.
[4]傅廷栋.杂交油菜的育种与利用[M].武汉:湖北科学技术出版社,1995:33-35.
[5]李殿荣.甘蓝型油菜三系选育初报[J].陕西农业科学,1980(1):26-29.
[6]余凤群,傅廷栋.甘蓝型油菜几个雄性不育系的细胞形态学研究[J].武汉植物学研究,1990(3):209-216.
[7]黄邦全,罗鹏.甘蓝型油菜雄性不育材料S90-8-7的获得及细胞学研究[J].湖北大学学报,2000,22(2):182-184.
[8]杨光圣,瞿波,王淑新,等.一个甘蓝型油菜DGCMS雄性不育系的花器形态及细胞学研究[J].中国油料作物学报,2000,22(3):16-21.
[9]聂明建,王国槐,朱卫平.甘蓝型油菜3种类型细胞质雄性不育系花药败育的细胞学研究[J].中国农业科学,2007,40(7):1543-1549.
[10]龙欢,姚家岭,涂金星.3种甘蓝型油菜雄性不育系花药发育的细胞学研究[J].华中农业大学学报,2005,24(6):570-575.
[11]LASER KD,LERSTENNR.Anatomyand cytologyofmicrosporogenesis in cytoplasmic male sterile angiosperms[J].The Botanical Review,1972,38(3):425-454.
[12]胡永敏,董军刚,孟倩,等.5种甘蓝型油菜细胞质雄性不育系的细胞学观察[J].西北农业学报,2012,21(7):95-99.
[13]张德双,徐家炳,曹鸣庆,等.大白菜转育新型甘蓝型油菜细胞质雄性不育系的研究[J].华北农学报,2002,17(1):60-63.
[14]危文亮,王汉中,刘贵华.甘蓝型油菜细胞质雄性不育系NCa花药发育的细胞学观察[J].中国农业科学,2005,38(6):1232-1237.
[15]田保明,王建平,文雁成,等.甘蓝型油菜胞质雄性不育系CMS22A的选育与遗传[J].河南农业科学,2005(2):22-25.
[16]田保明,宋文光,张书芬,等.甘蓝型双低油菜胞质雄性不育系384A不育性的表现与遗传[J].华北农学报,1998,13(4):80-85.
[17]杨晓云,曹寿椿.不结球白菜波里马胞质雄性不育系花药发育的细胞形态学研究[J].南京农业大学学报,1997,20(3):36-43.
[18]施展,万正杰,徐跃进,等.大白菜新型细胞质雄性不育系6w-9605A的育性鉴定和花药败育的细胞学观察[J].植物科学学报,2012,30(1):49-54.
[19]KU S,YOON H,SUH H S,et al.Male-sterility of thermosensitive genic male-sterile rice is associated with premature programmed cell death ofthe tapetum[J].Plata,2003,217:559-565.
[20]AN H,YANG Z,YI B,et al.Comparative transcript profiling of the fertile and sterile flower buds of pol CMS in B.napus[J].BMC Genomics,2014,15:258-267.
Study on Morphology and Cytology of Male Sterile Line 312A inBrassica napusL.
GE Puyu1,CUI Guimei2,WANGYaohui1,WANGJingxue1,DUChunfang3,SUNYi2
(1.College ofLife Science,Shanxi University,Taiyuan 030006,China;2.Research Center ofBiotechnology,Shanxi AcademyofAgricultural Sciences,Taiyuan 030031,China;3.Institute ofCotton,Shanxi AcademyofAgricultural Sciences,Yuncheng044000,China)
This study aims to use cytological means to reveal rapeseed(Brassica napus L.)flower organ morphology and male sterile line 312A anthers abortive characteristics,etc,to provide effective basis for 312A further use.Tested rapeseed varieties are from breeding hybrids out of stable male sterile line 312A and maintainer line 312B.The results show that 312A and 312B during bud development have more obvious differences:312B in the process of the whole anther development,the anther has been relatively full, large size,finally can release a large number ofmature pollen,312A in the process of the whole anther development,the anther has been dry,smaller volume,filaments short after mature,cannot release energetic bright yellowpollen.At the same time,the 312A and 312B of floral organ morphology difference reached significant level.By rapeseed 312A different development stages of bud slice observation,the results show that 312A of anthers abortive is divided into three kinds of situation,a total of two types of abortive.Part of anther development stagnation in spore cell period,lead to no pollen sac,belong to have no the abortive pollen sac type.Part of anther development of stagnation in spore period of cell differentiation,vascular tissue abnormalities,and did not develop into ideal butterfly-like shape,but appear deformity,belong to have no the abortive pollen sac type,some medicine chamber up to one anther, pollen sac will develop in a small amount ofpollen mother cell,the formation oftrace pollen grains ofthe invalid.Another part ofanther is because of a mitotic division of cytoplasm and an unequal,the lead to develop into a period of biuncleate pollen grains.With the further development of the pollen grain,the two nuclei of the nuclear membrane disappear,nuclear began to collapse,until disappear,form the pollen grain is invalid.This is first discoveryoftwonuclear abortion type in Brassia hapus L.
Brassica napus L.;cytoplasmic male sterilityline;cytology;pollen abortion
S565.4
A
1002-2481(2017)04-0510-05
10.3969/j.issn.1002-2481.2017.04.05
2016-12-08
山西省科技攻关项目(20140311010-4)
葛璞玉(1991-),女,山西运城人,硕士,主要从事油菜不育系细胞学研究工作。王景雪为通信作者。

