几株乳酸菌的抗氧化活性研究
余芳,吕嘉枥,张军蒙,田延楚
(陕西科技大学食品与生物工程学院,西安 710021)
几株乳酸菌的抗氧化活性研究
余芳,吕嘉枥*,张军蒙,田延楚
(陕西科技大学食品与生物工程学院,西安 710021)
选用来自传统发酵乳酸菌产品中分离的10株乳酸菌,研究了它们与抗氧化活性相关的清除DPPH自由基和O2-自由基的能力以及SOD酶、CAT酶和GSH-PX酶的产生情况。结果显示:10株乳酸菌对DPPH自由基和O2-自由基都有一定的清除能力,其中LB菌株对DPPH清除能力较强,清除率达到80.56%,BL菌株对O2-清除能力较强,清除率达到36.78%;10株乳酸菌均具有产生这3种酶的能力,LCP和LA产生较多的SOD酶和CAT酶,其中SOD酶活力达到91.29,90.56U/mL,CAT酶活力达到41.31,39.94U/mL,LC产生较多的GSH-PX酶,活力可达到65.45酶活力单位。
乳酸菌;自由基;抗氧化酶
氧化损伤是诱发多类疾病的一个重要原因,例如导致癌症、关节炎、心血管等疾病[1],因此,开发抗氧化剂,加强机体的抗氧化能力,对氧化损伤所引起的疾病有重要的预防和治疗意义。随着人们对抗氧化剂研究的深入,对人工合成抗氧化剂的安全性问题提出质疑[2]。天然抗氧化剂现已成为当今研究热点[3]。近年来,国内外一些研究结果显示:一些乳酸菌菌体及其代谢产物具有较强的抗氧化活性[4]。乳酸菌作为一种天然的抗氧化剂,具有安全、无毒副作用、稳定、增强机体免疫力等重要优势。有些乳酸菌不但能清除自由基,而且在发酵过程中还能分泌具有抗氧化活性的酶类,如超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等[5,6]。其中超氧化物歧化酶是可以清除超氧阴离子自由基的酶,过氧化氢酶是作用于过氧化氢和羟自由基的酶,谷胱甘肽过氧化物酶是清除过氧化氢和羟自由基的酶。
基于此,本研究对从传统发酵乳酸菌产品中分离的10株乳酸菌抗氧化活性进行分析,研究选用DPPH和O2-自由基的清除率作为评价乳酸菌清除自由基的指标,并且研究了它们是否产生抗氧化酶,包括SOD酶、CAT酶和GSH-PX酶,这为开发功能性乳酸菌产品提供依据。
1 材料和方法
1.1 菌种
从传统乳酸菌发酵食品中筛选的10株乳酸菌,分别为:保加利亚乳杆菌(Lactobacillus bulgaricus,简称LB)、嗜酸乳杆菌(Lactobacillus acidophilus,简称LA)、植物乳杆菌(Lactobacillus plantarum,简称LP)、乳双歧杆菌(Bifidobacterium animalis,简称BL,鼠李糖乳杆菌(Lactobacillus rhamnosus,简称LCR)、副干酪乳杆菌(Lactobacillus paracasei,简称LCP)、粪链球菌(Enterococcus faecalis,简称SF)、嗜热链球菌(Streptococcus thermophilus,简称ST)、干酪乳杆菌(Lactobacillus casei,简称LC)、罗伊氏乳杆菌(Lactobacillus reuteri,简称LR)、由陕西科技大学食品与生物工程学院微生物研究室提供。
1.2 仪器与设备
B203LEDR生物显微镜、AC-0629普通光学显微镜 重庆奥特光学仪器有限公司;DHP9080电热恒温培养箱 上海佳胜实验设备有限公司;LS-C50L型立式压力蒸汽灭菌锅 江阴滨江医疗设备厂;UV-2600紫外分光光度计 龙尼柯上海仪器有限公司;HHW21-600电热恒温水箱 天津市泰斯特仪器有限公司。
1.3 培养基
1.3.1 MRS培养基
蛋白胨10g,牛肉膏5g,柠檬酸二胺2g,牛肉膏10g,葡萄糖20g,Tween-80 1mL,乙酸钠5g,磷酸氢二钾2g,硫酸镁0.58g,硫酸锰0.25g,蒸馏水1000mL,pH值6.0,在121℃灭菌20min。
1.3.2 发酵培养基
荸荠300g,蒸馏水1000mL,煮沸后文火保持30min,过40目筛,再称取玉米粉10g,乳清粉10g,酵母粉10g,105℃高压蒸汽灭菌15min,冷却后以备用。
1.4 方法
1.4.1 菌种活化
将10株乳酸菌按体积分数为1%的比例接种到灭过菌的MRS液体培养基中,37℃条件下静置培养48h,按照相同步骤再重复活化1次,备用。
1.4.2 10株乳酸菌的生长曲线
将活化好的乳酸菌菌种按1%的接种量分别接种到发酵培养基中,37℃条件下静置培养,取0,8,16,24,32,40,48h的培养液测定其活菌数。分别以时间(t)为横坐标,活菌数的对数值(1gn)为纵坐标做图,得出乳酸菌活菌数的生长曲线。活菌数的测定方法为高层琼脂柱计数[7]。
1.4.3 10株乳酸菌发酵上清液的制备
将活化好的菌种接种到以灭过菌的发酵培养基中,37℃条件下静置培养48h,发酵液经4000r/min离心10min,收集上清液备用。
1.4.4 10株乳酸菌发酵上清液对DPPH清除率的研究方法
DPPH的自由基比较稳定,在519nm处有最大的吸收,其溶于甲醇,呈紫色,通过样品对DPPH自由基的作用可使溶液颜色发生变化,通过测定其吸光度的变化可以来表示样品对其的清除率。方法参考文献[8]略有改动,取2mL样品加入2mL的0.2mmol/mL DPPH,设置样品空白组与对照组,分别用等量甲醇代替DPPH与等量甲醇代替样品。均以甲醇为空白调零,黑暗中37℃反应20min,经4000r/min离心后于519nm处测定吸光率。清除率计算公式如下:
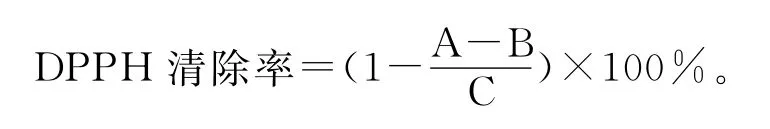
式中:A为样品组(含有样品溶液以及DPPH溶液);B为样品空白组(含有样品溶液不含DPPH溶液);C为对照组(不含有样品溶液含DPPH溶液)。
1.4.5 10株乳酸菌发酵上清液对O2-清除率的研究方法
O2-属于人体氧自由基的一种,对O2-的清除可以减轻人体细胞的氧化损伤,防止胰岛素抵抗。方法参照文献[9]略有改动,取1mL样品,加入4mL pH 8.2的Tris-HCl-EDTA缓冲液,将样品与缓冲液于25℃水浴25min,后加入现配的5mmol/L邻苯三酚溶液于25℃水浴10min,最后加0.5mL的8mol/L HCl终止反应,由于邻苯三酚自氧化速率过快,在420nm处有较稳定的吸光度值,所以终止反应后在420nm处测定其吸光度。清除率计算公式如下:
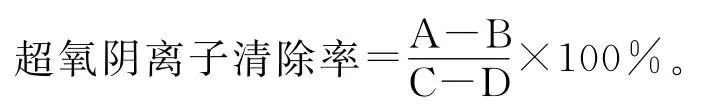
式中:A为样品组(含有样品溶液以及邻苯三酚溶液);B为样品空白组(含有样品溶液不含邻苯三酚溶液);C为对照组(不含有样品溶液含邻苯三酚溶液);D为空白组(不含有样品溶液以及邻苯三酚溶液)。
1.4.6 10株乳酸菌产超氧化物歧化酶(SOD酶)活性变化
超氧化物歧化酶(SOD)是生物体内能够清除超氧阴离子自由基的预防型抗氧化剂[10]。方法参照文献[11]略有改动,发酵液经4000r/min离心10min后,取样品加入到黄嘌呤氧化酶法反应体系中,室温放置10min,于波长550nm处测定其吸光度。SOD酶活力的计算公式如下:
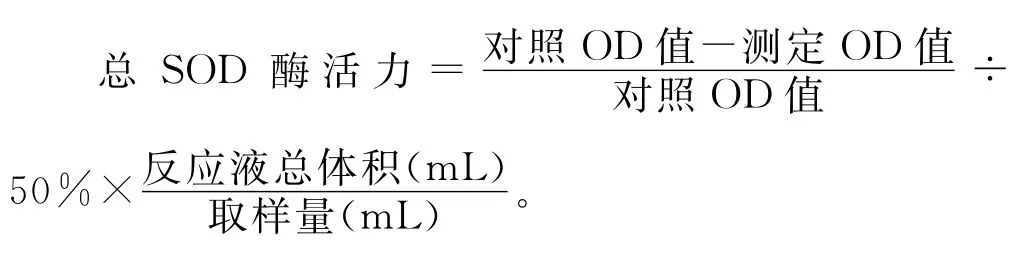
1.4.7 10株乳酸菌产过氧化氢酶(CAT酶)活性变化
过氧化氢酶(CAT酶)可催化H2O2生成水和氧,阻止H2O2与细胞有氧代谢中产生的超氧阴离子自由基进一步生成羟自由基,从而防止自由基对细胞的损伤。方法参照文献[12]略有改动,发酵液经4000r/min离心10min后,取样品加入到反应体系中,于波长405nm处测定其吸光度。CAT酶活力的计算公式如下:

1.4.8 10株乳酸菌产谷胱甘肽过氧化物酶(GSHPX酶)活性变化
谷胱甘肽过氧化物酶(GSH-PX酶)是机体内广泛存在的一种重要的催化过氧化氢分解的酶。方法参照文献[13]略有改动,取样品加入到酶促反应体系中,混匀,4000r/min离心10min,取上清液1mL加入到显色反应体系中,室温放置15min,于波长412nm处测定其吸光度。GSH-PX酶活力的计算公式如下:

式中:A为GSH标准液浓度。
2 结果与分析
2.1 10株乳酸菌的生长曲线
测10株乳酸菌在发酵培养基过程中的活菌数变化,每隔8h取样测定,结果见图1。

图1 10株乳酸菌的生长曲线
由图1可知,10株乳酸菌在发酵培养基中均能生长,BL,LB,LR,LCR,LP在0~8h为延滞期;8~40h为对数期;40h后进入稳定期;LA,LC,LCP在0~8h为延滞期;8~32h为对数期;32h后进入稳定期;ST,SF在0~8h为延滞期;8~24h为对数期;24h以后进入稳定期。10株乳酸菌发酵48h时,BL和LB的活菌数达到109cfu/mL,其余8株乳酸菌的活菌数均在1.3×108~9.9×108cfu/mL。
2.2 10株乳酸菌发酵上清液对DPPH自由基的清除率
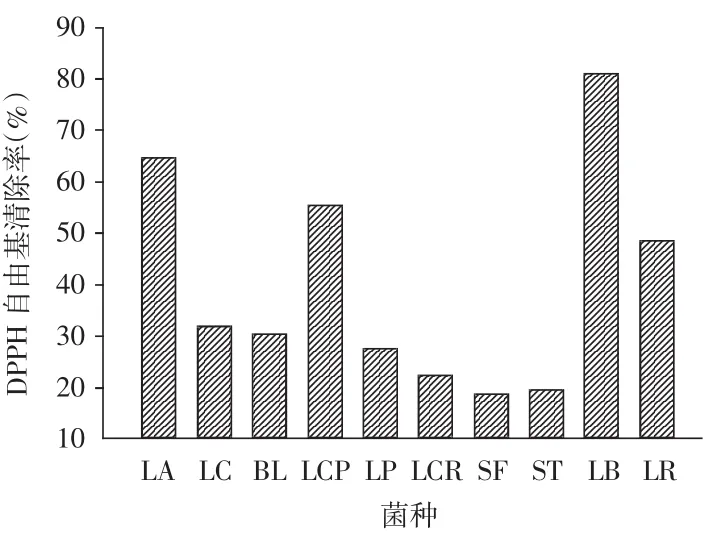
图2 乳酸菌发酵上清液对DPPH自由基的清除率
对DPPH自由基的清除可以评价乳酸菌样品清除这类稳定自由基的能力。由图2可知,这10株乳酸菌的发酵上清液对DPPH自由基都有一定的清除能力,其中LB的发酵上清液对DPPH自由基清除能力较强,清除率达到80.56%,其次是LA,LCP,LR发酵上清液,清除率在50%~70%之间,其余几株乳酸菌发酵上清液对DPPH自由基的清除率都在35%以下。
2.3 10株乳酸菌发酵上清液对O2-自由基的清除率

图3 乳酸菌发酵上清液对O2-自由基的清除率
对O2-自由基的清除可以减少体内的氧自由基。由图3可知,这10株乳酸菌的发酵上清液对O2-自由基都有一定的清除能力,BL,LC,LA菌株的发酵上清液的清除率在30%以上,BL发酵上清液的清除率最高为36.78%,LP,LB,SF,LCR 4种菌株的发酵上清液对O2-自由基清除能力在20%~30%之间,其余几株乳酸菌发酵上清液对O2-自由基清除能力在20%以下,菌株发酵上清液对O2-自由基的清除能力可能与菌株的代谢产物对O2-作用机制有关。对DPPH自由基的清除率与对O2-自由基的清除率之间并无对应关系,查阅文献得知可能与乳酸菌对这两种物质的作用原理不同有关。
2.4 10株乳酸菌产SOD酶活性变化

图4 10株乳酸菌产SOD酶变化
SOD酶是可以清除超氧阴离子自由基的酶,由图4可知,以不接菌为空白组,10株乳酸菌均产生SOD酶,其中LA产SOD酶量最多,活力可达到91.29U/mL,其次是LCP,LC,BL,活力依次是90.56,82.88,76.63U/mL;接着是LB,SF,LCR,LR,LP,ST,产生的SOD酶量相差不大,活力在60~75U/mL之间。
2.5 10株乳酸菌产CAT酶活性变化

图5 10株乳酸菌产CAT酶变化
CAT酶是作用于过氧化氢和羟自由基的酶,由图5可知,以不接种菌种的培养基为空白,10株乳酸菌发酵培养基时均产生CAT酶,其中LA产量最多,活力达到41.31U/mL;其次是LCP,LR,活力依次是37.91,38.59U/mL;接着是LC,BL,活力依次是21.31,24.62U/mL;LB,SF,LCR,LP,ST产CAT酶较少,而且活力相差不大,活力在10~20U/mL之间。
2.6 10株乳酸菌产GSH-PX酶活性变化

图6 10株乳酸菌产GSH-PX酶变化
GSH-PX酶是清除过氧化氢和羟自由基的酶,由图6可知,以不接菌种的培养基为空白,测得其GSHPX酶的活力为19.59酶活力单位,10株乳酸菌在发酵培养基48h时,测得添加LC的培养基产生较多的GSH-PX酶,其酶活力可达到65.45酶活力单位,其次是LCP,LA,LR,BL,酶活力依次是41.86,34.89,41.86,38.19酶活力单位,与空白相比,添加LC的培养基增加46酶活力单位。
3 结论
本研究选用来自传统发酵乳酸菌产品分离的10株乳酸菌,针对与抗氧化活性相关的对DPPH自由基的清除率和对O2-自由基的清除率以及SOD酶、CAT酶和GSH-PX酶的产生情况进行研究,加强发酵乳酸菌产品的抗氧化性。结果表明:10株乳酸菌在清除DPPH自由基和O2-自由基方面存在差异,但对DPPH自由基和O2-自由基都有一定的清除能力,其中LB对DPPH自由基清除能力较强,清除率达到80.56%;其次是LA,LCP,LR,对DPPH的清除率在45%~65%之间,BL菌株对O2-自由基清除能力较强,清除率达到36.78%;再次是LP,LB,SF,LCR 4种菌株,对O2-自由基清除能力在20%~30%之间;10株乳酸菌均具有产生这3种酶的能力,LCP和LA产生较多的SOD酶和CAT酶,其中SOD酶活力达到91.29,90.56U/mL,CAT酶活力达到41.31,39.94U/mL,LC产生较多的GSH-PX酶,活力可达到65.45酶活力单位,但10株乳酸菌产3种抗氧化酶方面无对应关系,是否存在其他抗氧化活性物质有待进一步研究。
[1]靳志强,王延祥,李平兰,等.植物乳杆菌耐酸耐胆盐的体外试验及其降胆固醇作用[J].中国食品学报,2009,9(5):24-28.
[2]徐清萍,钟桂芳,孟君.抗氧化剂抗氧化方法研究进展[J].食品工程,2007(2):23-25.
[3]彭新颜,于海洋,李杰,等.乳酸菌抗氧化作用研究进展[J].食品科学,2012,33(23):370-374.
[4]靳志强,王延祥.小米提取物对乳杆菌耐胆盐能力的影响[J].食品科学,2008,29(8):414-417.
[5]Kullisaar T,Zilmer M,Mikelsaar M,et al.Two antioxidative Lactobacilli strains as promising probiotics[J].Int J Food Microbiol,2002,72(3):215-224.
[6]Talwalker A,Kailasapathy K,Hourigan J,et al.An improved method for the determination of NADH oxidase in the presence of NADH peroxidase in lactic acid bacteria[J].J Microbio Methods,2003,52(3):333-339.
[7]马向前,周德庆.双歧杆菌和乳酸菌的一种简便快速计数法[J].微生物学报,1997,37(1):62-63.
[8]Lin M Y,Chang F Y.Antioxidative effect of intestinal bacteria Bifidobacterium longum ATCC15708and Lactobacillus acidophilusATCC4356[J].Digestive Diseases and Sciences,2000,45(8):1617-1622.
[9]吴祖芳,洪松虎,沈锡权,等.乳酸菌高抗氧化活性菌株的筛选及鉴定[J].中国食品学报,2010,10(1):74-78.
[10]蔡敬杰,樊志.超氧化物歧化酶的研究进展[J].天津化工,1997(2):2-4.
[11]徐东,赵建,黄汉昌,等.改良的黄嘌呤氧化酶法测定动植物组织中SOD比活力[J].食品科学,2011,32(6):237-241.
[12]刘砚韬,王振伟,张伶俐.过氧化氢酶活性测定的新方法[J].华西药学杂志,2013,28(4):403-405.
[13]顾品品,张灏,陈卫,等.几种体外评价乳酸菌无细胞提取物抗氧化活性方法的比较研究[J].食品工业科技,2015,36(23):84-88.
Research on Antioxidant Activity of Several Lactic Acid Bacteria Strains
YU Fang,LV Jia-li*,ZHANG Jun-meng,TIAN Yan-chu
(School of Food and Biological Engineering,Shaanxi University of Science and Technology,Xi'an 710021,China)
10strains of lactic acid bacteria isolated from traditional fermented lactic acid bacteriaproducts are studied on antioxidant activity such as the clearance ability of DPPH and O2-free radical,SOD enzyme,CAT enzyme and GSH-PX enzyme.The result shows that 10strains of lactic acid bacteria have the ability to remove DPPH and O2-free radical,LB has better ability to remove DPPH and the clearance rate is 80.56%,BL has better ability to remove O2-and the clearance rate is 36.78%;10strains of lactic acid bacteria have the ability to produce three enzymes,LCP and LA can produce more SOD enzyme and CAT enzyme.SOD enzyme activity reaches 91.29,90.56U/mL,CAT enzyme activity reaches 41.31,39.94U/mL,LC produces more GSH-PX enzyme and it can reach 65.45unit of enzyme activity.
lactic acid bacteria;free radical;antioxidant enzyme
TS261.13
A
10.3969/j.issn.1000-9973.2017.04.008
1000-9973(2017)04-0032-04
2016-10-17 *通讯作者
余芳(1988-),女,河南永城人,硕士,研究方向:食品微生物。

