益生菌联合四联疗法治疗老年人幽门螺杆菌感染的临床观察
伍银桥,李 军,李英男
(解放军总医院南楼临床部消化内科,北京 100853)
幽门螺杆菌(Helicobacterpylori,H.pylori)是一种定植于人类胃黏膜的革兰阴性微需氧菌,中国自然人群H.pylori平均感染率为54.76%[1]。H.pylori感染是慢性胃炎、消化性溃疡的主要致病因素,并与胃癌及胃黏膜相关淋巴样组织(mucosa associated lymphoid tissue,MALT)淋巴瘤等疾病密切相关[2],世界卫生组织将其列为Ⅰ类致癌因子,其治疗已日益引起人们关注。由于抗生素的广泛应用,H.pylori对抗生素的耐药率呈逐年上升趋势,导致患者依从性降低,H.pylori的根除率逐年下降,尤其在老年患者中更为突出。既往作为一线治疗方案的标准三联疗法根除率已低于或远低于80%[3],并且抗生素可引起胃肠道功能紊乱及菌群失调等不良反应,因此,根除H.pylori的方案也应随之相应调整。Maastricht Ⅳ 报告推荐的治疗方案主要有伴同方案、序贯方案和含铋剂四联方案[4];而最近微生态制剂的应用为H.pylori感染的治疗提供了新思路,有研究显示联合应用益生菌可使H.pylori根除率提高5%~10%[5]。酪酸梭菌肠球菌三联活菌片也是目前临床上常用的益生菌之一,但其作为根除H.pylori的辅助用药报道不多,其疗效和安全性并未得到完全证实,有必要进一步开展临床研究。为此,本研究采用酪酸梭菌肠球菌三联活菌片联合含铋剂四联疗法,以评估益生菌对根除老年人H.pylori感染的疗效及安全性,为临床选取更佳的根除治疗方案提供一定的参考。
1 对象与方法
1.1 研究对象
选取2014年1月至10月在解放军总医院南楼临床部消化内科门诊就诊,患有慢性活动性胃炎、功能性消化不良的老年H.pylori阳性患者,共120例。纳入标准:(1)年龄≥60岁;(2)经13C尿素呼气试验(13C urea breath test,13C-UBT)检查明确为阳性者;(3)入组本研究前2周内未接受过任何抗生素、质子泵抑制剂(proton pump inhibitor, PPI)、H2 受体拮抗剂或铋剂治疗;(4)血常规和肝肾功能检查均正常。排除标准: (1)恶性肿瘤患者;(2)合并重要脏器(心、肺、肝、肾)严重疾病;(3)对试验方案中的药物过敏;(4)依从性差。终止标准:(1)失访;(2)出现严重不良事件(如死亡、严重生命危险等);(3)病情恶化或出现并发症;(4)治疗期间出现其他疾病,伴随疾病的治疗会干扰本研究的临床观察;(5)违背研究方案者。所有纳入者对方案知情同意,且本研究经医院伦理委员会审核通过。入组患者按性别、年龄进行随机区组设计,分为治疗组和对照组。治疗组60例,其中男性58例,女性2例,年龄60~88(78.33±12.81)岁;对照组60例,其中男性57例,女性3例,年龄60~87(79.82±13.52)岁。
1.2 方法
对照组给予第四次Maastricht报告和《中华医学会第四次全国幽门螺杆菌感染处理共识报告》推荐的根治H.pylori含铋剂四联方案:胶体果胶铋胶囊(山西振东安特生物制药有限公司,规格:0.1g/粒)0.2g/次,2次/d+雷贝拉唑肠溶片(商品名:波利特,卫材药业有限公司,规格:10 mg/片)10 mg/次,2次/d +阿莫西林胶囊(哈药集团制药总厂,规格:0.25 g/粒)1 g/次,2次/d +克拉霉素片(商品名:克拉仙,上海雅培制药有限公司,规格:250 mg/片)500 mg/次,2次/d。疗程14 d。治疗组在对照组治疗的基础上给予酪酸梭菌肠球菌三联活菌片(商品名:适怡,日本东亚药品工业株式会社,规格:0.2 g/片)0.4 g/次,2次/d。疗程14 d。因阿莫西林的半衰期约为61.3 min,克拉霉素每12 h口服500 mg的半衰期为4.5~4.8 h,酪酸梭菌肠球菌三联活菌片服用时间与抗生素间隔>4 h。所有患者在治疗期间忌油腻、辛辣刺激性食物,忌大量饮酒和过度劳累。
1.3 疗效评价
于治疗前记录患者消化道症状,化验肝肾功能,治疗期间每周复诊,记录病情变化以及药物不良反应发生情况。按患者对药物的耐受程度不同分为4级:1级,没有不良反应;2级,轻度不适,对工作、生活无影响;3级,中度不适,对工作、生活无明显影响;4级,严重不适,严重影响工作、生活。所有患者均于治疗结束4周后复查13C-UBT,评估根除效果,结果阴性者判定为H.pylori根除成功。复查肝肾功能。1年后再次复查13C-UBT,观察H.pylori根除情况。H.pylori根除率按意向治疗(intention to treat,ITT)和方案(per-protocol,PP)分析表示。
1.4 统计学处理

2 结 果
2.1 两组患者H.pylori根除情况
治疗组有58例、对照组有59例患者按计划完成治疗。服药后,两组治疗方案均能有效改善患者上腹不适、返酸、烧心等症状。治疗组H.pylori成功根除50例,对照组根除43例,治疗组PP根除率、ITT根除率均显著高于对照组,但差异无统计学意义(PP:χ2=3.185,P=0.074;ITT: χ2=2.342,P=0.126;表1)。治疗组和对照组共有5例根除治疗失败,经胃镜取活检组织行H.pylori培养,结果4例培养阴性,仅1例培养阳性,根据药敏试验结果选用抗生素治疗后转为阴性。
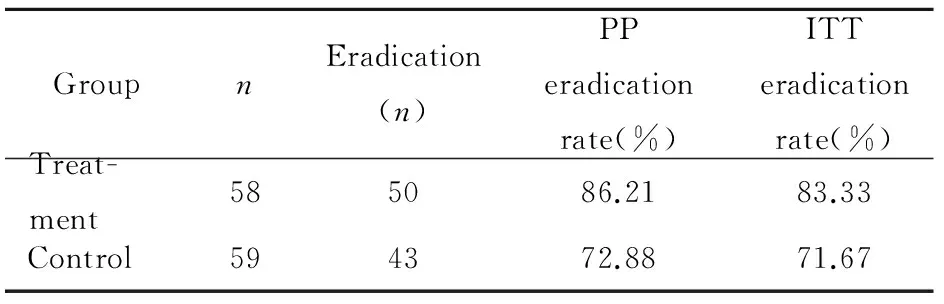
表1 两组H.pylori根除疗效比较
PP: pre-protocol; ITT: intention to treat
2.2 两组患者1年根除率比较
两组患者均成功随访1年,随访结束后对两组H.pylori根除率进行比较,结果显示:治疗组58例中有49例13C-UBT结果仍为阴性,对照组59例中有40例结果阴性,治疗组和对照组H.pylori根除率分别为84.48%和67.80%,治疗组显著高于对照组,且差异有统计学意义(χ2= 4.473,P=0.034)。
2.3 药物不良反应
主要不良反应有腹痛、恶心、食欲不振、便秘、腹泻、味觉异常等,治疗组和对照组不良反应发生率分别为10.34%(6例)和27.12%(16例),差异有统计学意义(χ2=5.39,P=0.02;表2)。
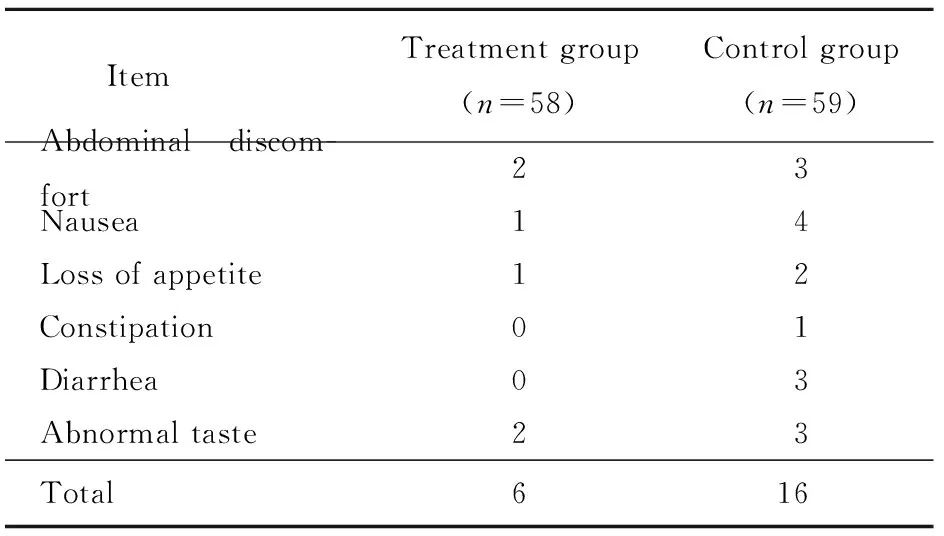
表2 两组患者不良反应发生情况比较
2.4 两组患者耐受程度比较
对照组中1例患者出现严重腹泻、腹痛,还有1例患者出现严重恶心、纳差,耐受程度为4级。药物的耐受程度治疗组显著优于对照组,差异有统计学意义(P=0.019;表3)。
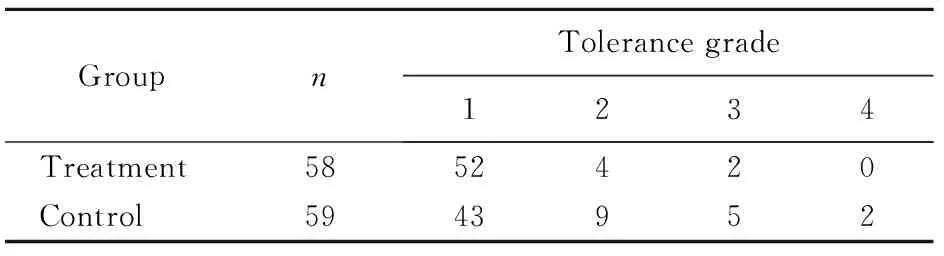
表3 两组患者药物耐受程度比较
3 讨 论
H.pylori是胃十二指肠疾病的重要致病菌。流行病学调查结果显示,全球半数以上的自然人群存在H.pylori感染,发展中国家的感染率一般高于发达国家[6]。我国为H.pylori感染高发国之一,感染率为55%[1]。质子泵抑制剂(proton pump inhibitors,PPI)加两种抗生素(阿莫西林、克拉霉素和硝基咪唑类药物等)的标准三联疗法从上世纪90年代开始用于根治幽门螺杆菌;然而,其疗效随幽门螺杆菌对抗生素的耐药性增加而逐渐下降,H.pylori根除失败率差异很大,约10%~45%。2012年,第四次Maastricht报告推荐的治疗方案主要有伴同方案、序贯方案和含铋剂四联方案[4],建议使用大剂量PPI(2次/d)和抗生素应用14 d根除H.pylori可这也导致药物副反应的发生率增加,如抗生素相关性腹泻、恶心呕吐等。抗生素的应用可破坏肠道正常微生态平衡,致使肠道对抗致病菌定植能力减弱,致病菌形成优势菌群定植于肠道大量繁殖。PPI的应用可减少胃酸分泌,提高胃内pH值,增加抗生素的药效,同时也可明显降低胃酸对过路菌的杀灭作用,使致病菌过度繁殖,进一步破坏肠道正常菌群。本研究结果表明,对照组药物不良反应发生率为27.12%,主要有腹痛、恶心、食欲不振、便秘、腹泻、味觉异常等,按耐受程度不同分级,大多患者为轻、中度不适,但有2例出现严重不适。
在传统三联或四联疗法基础上加用益生菌可显著提高H.pylori根除率,并减少治疗期间的不良反应。益生菌作为抗H.pylori治疗的一个选项,正引起大量的关注。既往研究表明,微生态制剂(主要包括乳酸菌、酵母菌和双歧杆菌)在体外和H.pylori感染动物模型中均具有抗H.pylori活性[7],联合应用益生菌制剂有助于提高H.pylori的根除率。Song等[8]对991例H.pylori感染患者的治疗研究表明,在三联7d疗法的基础上加用布拉氏酵母菌4 周能显著提高H.pylori根除率(ITT: 80.0%vs71.6%)。Emara等[9]应用三联疗法辅以乳杆菌治疗H.pylori感染患者,根除率提高8.6%。蒋永爱等[10]应用地衣芽孢杆菌联合PPI三联疗法根除H.pylori,根除率明显高于标准三联组(85.0%vs70.0%)。本研究显示,四联疗法联合应用酪酸梭菌肠球菌三联活菌片,明显提高了H.pylori根除率:PP根除率从72.88%提高至86.21%,ITT根除率从71.67%提高至83.33%。虽然治疗结束时差异无统计学意义,但随访1年后,治疗组H.pylori根除率仍显著高于对照组,且两组比较差异有统计学意义。
益生菌抑制H.pylori活性的机制尚不十分明确,可能是由于免疫及非免疫机制:(1)在胃黏膜上皮竞争位点[11];(2)产生抗H.pylori的物质,如乙酸、丙酸、丁酸[12];(3)调节免疫功能和分泌免疫球蛋白A,提高黏膜防御能力[13-15];(4)加强上皮细胞之间的紧密连接[15,16]。益生菌不仅具有抗H.pylori活性,还可改善肠道黏膜表面微生物菌群,减少致病菌毒素分泌,降低根除H.pylori治疗中的不良反应,如腹泻、恶心、呕吐和上腹部疼痛等[17,18]。酪酸梭菌肠球菌三联活菌片主要成分是酪酸梭菌、乳酸菌和糖化菌,其在人体肠道内增殖,能阻止有害菌的生长,并对双歧杆菌有助长作用,从而发挥使肠道菌群正常化的调整作用。本研究显示,联合应用酪酸梭菌肠球菌三联活菌片,不良反应发生率显著降低,且耐受程度也明显优于对照组。
老年人组织器官衰老、血管硬化,致使胃肠黏膜上皮腺体萎缩、血供减少、蠕动清除功能下降,肠道菌群老化,机体消化免疫功能下降。在选用经典三联或四联H.pylori治疗后,其肠道菌群失调和耐药菌株的优势生长(并呈多重耐药)较年轻人更为明显,从而导致老年人H.pylori根除率明显下降,不良反应发生率上升。益生菌可提高消化道内有益菌的数量和活性,并通过免疫及非免疫机制预防或减少H.pylori定植、减轻黏膜炎症,通过营养竞争、生物夺氧、产酸抑制等途径拮抗H.pylori的生长,提高H.pylori根除率;益生菌还可改善肠道黏膜表面微生物菌群,在肠黏膜表面形成具有保护作用的生物学屏障,抑制致病菌的生长,减少致病菌毒素的产生和吸收,改善肠功能,从而降低抗H.pylori药物引起的相关胃肠道副反应。针对老年H.pylori感染患者这一特殊群体,在根除H.pylori治疗过程中加用益生菌,不仅能够提高H.pylori根除率,而且还可以稳定胃肠道微生态环境[19],防止一些常见的抗生素相关性不良反应,临床疗效优势明显,值得在临床上推广应用。然而益生菌抗H.pylori的作用机制尚未完全明确,添加益生菌的时机以及应用多长时间等很多临床问题尚有待于进一步的研究解决。
【参考文献】
[1] 张万岱, 胡伏莲, 萧树东, 等. 中国自然人群幽门螺杆菌感染的流行病学调查[J]. 现代消化及介入诊疗, 2010, 15(5): 265-270.
Zhang WD, Hu FL, Xiao SD,etal. Prevalence ofHelicobacterpyloriinfection in China[J]. Mod Dig Intervention, 2010,15(5): 265-270.
[2] Ahn HJ, Lee DS.Helicobacterpyloriin gastric carcinogenesis[J]. World J Gastrointest Oncol, 2015, 7(12): 455-465. DOI: 10.4251/wjgo.v7.i12.455.
[3] 中华医学会消化病学分会幽门螺杆菌学组/全国幽门螺杆菌研究协作组. 第四次全国幽门螺杆菌感染处理共识报告[J].中华内科杂志, 2012, 51(10): 832-837.
The Collaboration Group ofHelicobacterpyloriResearch, Chinese Society of Gastroenterology. The 4th National Consensus onHelicobacterpyloriInfection Treatment[J]. Chin J Intern Med, 2012, 51(10): 832-837.
[4] Malfertheiner P, Megraud F, O’Morain CA,etal. European Helicobacter Study Group. Management ofHelicobacterpyloriinfection — the Maastricht IV/Florence Consensus Report[J]. Gut, 2012,61(5): 646-664. DOI: 10.1136/gutjnl-2012-302084.
[5] 胡可伟,张振玉,刘顺英,等.双歧杆菌三联活菌胶囊联合三联疗法根除幽门螺杆菌[J]. 临床荟萃, 2012, 27(7): 610-611.
Hu KW, Zhang ZY, Liu SY,etal. Bifidobacterium triple viable capsule combined with triple therapy forHelicobacterpylorieradication[J]. Clin Focus, 2012, 27(7): 610-611.
[6] Go MF. Review article: natural history and epidemiology ofHelicobacterpyloriinfection[J]. Aliment Pharmacol Ther, 2002, 16(Suppl 1): 3-15.
[7] Hsieh PS, Tsai YC, Chen YC,etal. Eradication ofHelicobacterpyloriinfection by the probiotic strainsLactobacillusjohnsoniiMH-68 andL.salivariusssp salicinius AP-32[J]. Helicobacter, 2012, 17(6): 466-477. DOI: 10.1111/j.1523-5378.2012.00992.x.
[8] Song MJ, Park DI, Park JH,etal. The effect of probiotics and mucoprotective agents on PPI-based triple therapy for eradication ofHelicobacterpylori[J]. Helicobacter, 2010, 15(3): 206-213. DOI: 10.1111/j.1523-5378.2010.00751.x.
[9] Emara MH, Mohamed SY, Abdel-Aziz HR. Lactobacillus reuteri in management ofHelicobacterpyloriinfection in dyspeptic patients: a double-blind placebo-controlled randomized clinical trial[J]. Therap Adv Gastroenterol, 2014, 7(1): 4-13. DOI: 10.1177/1756283X13503514.
[10] 蒋永爱, 欧希龙, 王建宁. 地衣芽孢杆菌联合PPI三联疗法根除幽门螺杆菌的临床疗效[J].世界华人消化杂志, 2013, 21(9): 840-844.
Jiang YA, Ou XL, Wang JN. Efficacy ofBacilluslicheniformiscombined with PPI triple therapy in eradication ofHelicobacterpylori[J]. World Chin J Digestol, 2013, 21(9): 840-844.
[11] Mukai T, Asasaka T, Sato E,etal. Inhibition of binding ofHelicobacterpylorito the glycolipid receptors by probiotic Lactobacillus reuteri[J]. FEMS Immunol Med Microbiol, 2002, 32(2): 105-110.
[12] Gotteland M, Brunser O, Cruchet S. Systematic review: are pro-biotics useful in controlling gastric colonization byHelicobacterpylori?[J]. Aliment Pharmacol Ther, 2006, 23(8): 1077-1086.
[13] Yang YJ, Sheu BS. Probiotics-containing yogurts suppressHelicobacterpyloriload and modify immune response and intestinal microbiota in theHelicobacterpylori-infected children[J]. Helicobacter, 2012, 17(4): 297-304. DOI: 10.1111/j.1523-5378.2012.00941.x.
[14] Kwon HK, Kim GC, Kim Y,etal. Amelioration of experimental autoimmune encephalomyelitis by probiotic mixture is mediated by a shift in T helper cell immune response[J]. Clin Immunol, 2013, 146(3): 217-227. DOI: 10.1016/j.clim.2013.01.001.
[15] Sultana R, McBain AJ, O’Neill CA. Strain-dependent augmentation of tight-junction barrier function in human primary epidermal keratinocytes by Lactobacillus and Bifidobacterium lysates[J]. Appl Environ Microbiol, 2013, 79(16): 4887-4894. DOI: 10.1128/AEM.00982-13.
[16] Yeung CY, Chiang Chiau JS, Chan WT,etal.Invitroprevention of Salmonella lipopolysaccharide-induced damages in epithelial barrier function by various Lactobacillus strains[J]. Gastroenterol Res Pract, 2013, 2013: 973209. DOI: 10.1155/2013/973209.
[17] Ahmad K, Fatemeh F, Mehri N,etal. Probiotics for the treatment of pediatricHelicobacterpyloriinfection: a randomized double blind clinical trial[J]. Iran J Pediatr, 2013, 23(1): 79-84.
[18] Bekar O, Yilmaz Y, Gulten M. Kefir improves the efficacy and tolerability of triple therapy in eradicatingHelicobacterpylori[J]. J Med Food, 2011, 14(4): 344-347. DOI: 10.1089/jmf.2010.0099.
[19] Oh B, Kim BS, Kim JW,etal. The effect of probiotics on gut microbiota during theHelicobacterpylorieradication: randomized controlled trial[J]. Helicobacter, 2016, 21(3): 165-174. DOI: 10.1111/hel.12270.

