KCN基因对小鼠脂代谢的影响及其机制初探
刘敬怡 卢 晶 杨金奎*
(1.首都医科大学附属北京同仁医院内分泌科,北京 100730; 2.糖尿病防治研究北京市重点实验室,北京 100730)
·内分泌与代谢病专题 ·
KCN基因对小鼠脂代谢的影响及其机制初探
刘敬怡1,2卢 晶1,2杨金奎1,2*
(1.首都医科大学附属北京同仁医院内分泌科,北京 100730; 2.糖尿病防治研究北京市重点实验室,北京 100730)
目的 研究钾离子电压门控通道(potassium voltage-gated channel,KCN)基因对小鼠脂代谢的影响及其相关信号通路,为治疗糖尿病的脂肪异常提供新的治疗靶点。方法 采用KCN基因敲除的小鼠模型及对照C57BL/6野生小鼠动物模型,检测三酰甘油、胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇等脂代谢相关指标。HE染色观察小鼠肝脏组织脂肪变。Western blotting法测定小鼠肝脏组织腺苷酸激活蛋白激酶[adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK]通路相关蛋白的表达。结果KCN基因敲除小鼠较野生型对照小鼠血清中三酰甘油、总胆固醇和低密度脂蛋白胆固醇浓度均明显增高,差异有统计学意义(P<0.05)高密度脂蛋白明显降低,肝脏HE染色显示基因敲除小鼠肝脏内脂滴的数目和体积均与野生型有明显差异,Western blotting结果显示KCN基因敲除小鼠肝脏组织中磷酸化蛋白激酶B(phosphate-protein kinase B,Phos-AKT)、磷酸化乙酰辅酶A羧化酶(phosphate-acetyl CoA carboxylase,Phos-ACC)、phos-AMPK浓度均较正常对照组小鼠表达量降低,phos-ACCα水平较正常对照组小鼠明显增高差异有统计学意义(P<0.05)。结论KCN基因对小鼠血脂代谢有保护作用,其作用机制与AMPK的脂肪酸氧化有关。
钾离子电压门控通道(potassium voltage-gated channel,KCN);脂代谢;AMPK通络
钾离子电压门控通道(potassium voltage-gated channel,KCN),是电压依赖性钾通道(voltage-dependent potassium channel, Kv) 家族中的一员[1]。在人的心脏、脑和胰腺组织中有表达[2]。本课题组[3]前期研究表明,KCN通道基因在维持胰岛β细胞的形态及功能方面具有重要作用,在C57BL/6小鼠上将KCN基因敲除后,小鼠会出现血糖增高、胰岛素抵抗等糖代谢紊乱现象。
蛋白激酶B(protein kinase B,AKT/PKB)-腺苷酸激活蛋白激酶(adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)-乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)信号通路为人和动物体内控制脂肪酸氧化的重要途径[4]。本课题组[3]前期已经构建KCN基因敲除小鼠动物模型。本研究观察到KCN基因敲除糖尿病小鼠在14月龄时出现血糖和脂肪代谢异常,进一步探讨其机制发现,KCN基因敲除小鼠体内AMPK及其上游的AKT/PKB被抑制并促进其下游的ACCa磷酸化使其活性增高,脂肪酸氧化受到抑制,最终导致血脂代谢异常。本研究将有助于了解KCN基因在糖尿病发生、发展过程中的作用及其相关机制,KCN基因有望成为糖尿病血脂病变药物作用的新靶点。
1 材料与方法
1.1 实验动物
14月龄雄性SPF级C57BL/6野生型小鼠及KCN+/-、KCN-/-小鼠(C57BL/6 background),实验动物许可证号:11400700146921,所有动物均符合实验动物伦理法案。所有的小鼠均置于SPF环境中饲养,室温22 ℃~23 ℃,每天光照12 h,动物可自由摄食摄水。
1.2 主要试剂
血清三酰甘油(triglyceride, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(highdensity lipoprotein-cholesterol, HDL-C)及低密度脂蛋白胆固醇(lowdensity lipoprotein-cholesterol, LDL-C) 试剂盒(中生北控科技股份有限公司),抗APMK抗体(美国Santa Cruz公司)、抗Phos-AMPK抗体(美国Santa Cruz公司)、抗ACCa抗体(美国Santa Cruz公司)、抗Phos-ACCa抗体(美国Santa Cruz公司)、抗AKT抗体(美国Santa Cruz公司)、抗Phos-AKT抗体(美国Santa Cruz公司)、β-actin(美国Cell Signaling公司),酶标仪(美国Bio-Rad公司)。
1.3 实验方法
1) 动物分组:14个月龄雄性C57BL/6小鼠(A组)、同月龄KCN+/-小鼠(B组)及同月龄KCN-/-小鼠(C组),每组10只,普通饲料适应性喂养1周后称量体质量并进行腹腔糖耐量试验。
2)小鼠腹腔葡萄糖耐量实验:将3组小鼠过夜禁食14 h(但不禁水),采用1%(质量分数)戊巴比妥钠,45 mg/kg用量麻醉小鼠,尾静脉取空腹血糖(0 min)后腹腔注射葡萄糖2 g/kg [20%(质量分数)葡萄糖注射液],在注射葡萄糖后15、30、60及120 min时尾静脉取血测血糖,血糖测定用强生公司One-Touch 血糖仪及配套试纸。
3)标本采集:腹腔葡萄糖耐量实验5~7 d后处死动物。处死前禁食过夜12 h,内眦取血,4 ℃ 4 000 r/min离心10 min,取上清后分装-80 ℃保存,待测血清中三酰甘油、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇。麻醉后测量其体质量,体长(鼻尖至肛门外沿的距离)。计算Lee’s指数,Lee’s指数=体质量(g)1/3/体长(cm)×1 000。断颈处死后,取睾周脂肪、肝脏、骨骼肌及胰腺组织,迅速称质量。并留取组织置入10%(体积分数)中性甲醛溶液保存,用于制备石蜡切片。
4)血脂测定:采用Bio-Rad酶标仪测定浓度血浆三酰甘油、胆固醇、高密度脂蛋白胆固醇及低密度脂蛋白胆固醇浓度。
5)肝脏组织HE染色:将肝脏组织常规石蜡包埋,5 μm厚度切片,烤片,72 ℃,100 min。石蜡切片脱蜡至水,自来水冲洗5 min,洗去乙醇,苏木精侵染3 min,自来水冲洗1 min,盐酸分化液2 s,自来水冲返蓝5 min。伊红侵染30 s,自来水冲30 s,80%(体积分数)乙醇30 s,95%(体积分数)乙醇、100%(体积分数)乙醇各3 min。二甲苯透明1~2 h,中性树胶封片后显微镜下拍照。
6)Western blotting法提取小鼠肝脏组织总蛋白:BCA蛋白分析试剂盒测定蛋白浓度。取80 μg总蛋白进行10%(质量分数)SDS-PAGE电泳,湿转(200 mA,120 min)至硝酸纤维膜上。用TBST(TBS+0.1%Tween-20)配制的5%(质量分数)脱脂奶粉室温封闭1.5 h,用封闭液将一抗按照一定比例稀释(抗APMK抗体 1∶200、抗Phos-AMPK抗体 1∶200、抗ACCa抗体1∶200、抗Phos-ACC抗体1∶200、抗AKT抗体 1∶1 000、抗Phos-AKT抗体1∶1 000),将膜与一抗4 ℃摇床孵育过夜,次日TBST洗膜3次,每次5 min,再与辣根过氧化物酶(horseradish peroxidase, HRP)标记的二抗(1∶2 000)室温孵育1 h。同时以β-actin作为内参,抗体稀释比例为1∶1 000。TBST洗涤,滴加增强化学发光(enhanced chemiluminescence, ECL)发光液后用Chemi-Doc Touch凝胶成像系统显影成像,并用 Image J软件对图像进行灰度分析。分别计算出AMPK、phos-AMPK、phos-ACC、ACC和phos-AKT、AKT与内参β-actin的吸光度积分值之比作为AMPK、phos-AMPK、ACC、phos-ACC、AKT和phos-AKT的相对含量值。
解决上述2个问题的办法:①在焚烧炉超负荷运行时,如增加垃圾处理量、增加炉膛热负荷,可适当回喷浓缩液,起到降低焚烧炉出口烟温的作用。②协同处理沼气回喷、污泥入炉。
1.4 统计学方法
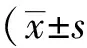
2 结果
2.1KCN基因敲除小鼠与C57BL/6野生型小鼠的一般特征比较
小鼠体质量和身长及一般情况的观察C组小鼠体质量较A组有显著增长,差异有统计学意义(P<0.05),B组较A组有增长趋势。B、C 2组的体长及Lee’s指数较A组有增高的趋势(图1)。
2.2KCN基因敲除小鼠腹腔葡萄糖耐量实验(introperitoneal glucose tolerance test, IPGTT)异常
腹腔注射葡萄糖后15 min B、C 2组的血糖浓度明显高于A组(F=52.89,P<0.05;F=2 173.89,P<0.01)、30 min B、C 2组的血糖水平明显高于A组(F=128.2,P<0.05;F=221.1,P<0.05,)、60 min及120 minB、C 2组的血糖水平较A组有增高的趋势。(P<0.05,图2)。
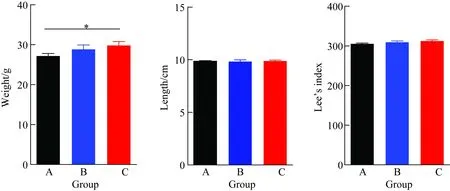
图1 小鼠体质量、体长及Lee’s指数的比较
A:C57BL/6 group; B:KCN+/-group; C:KCN-/-group;*P<0.05vsgroup A;n=6;KCN: potassium voltage-gated channel.

图2 小鼠腹腔糖耐量的比较
A:C57BL/6 group; B:KCN+/-group; C:KCN-/-group; At 15 minutes,the blood glucose level in group B was significantly higher than that in group A (*P<0.05),n=6; The blood glucose level in group B was significantly higher than that in group A (**P<0.01). At 30 minutes:the blood glucose level in group B was significantly higher than that in group A (*P<0.05). The blood glucose level in group B was significantly higher than that in group A.IPGTT:introperitoneal glucose tolerance test;KCN:potassium voltage-gated channel.
B、C 2组的TG和LDL-C较A组明显增高(P<0.05),而TC较A组有升高趋势,但差异无统计学意义(P>0.05, 图3)。B、C组的HDL-C较A组明显降低。
2.4 HE染色结果
KCN基因敲除小鼠肝脏有明显的脂肪堆积,对照组A组小鼠肝脏色暗红、质地柔软, B组、C组肝脏颜色灰黄,体积变大,表面有白色颗粒状物。B、C两组肝脏有明显的肝脏脂肪变性,气球样变增多,有较多坏死灶,肝小叶内明显的炎性细胞浸润(图4)。
2.5 Western blotting检测结果
AKT-AMPK-ACCa脂代谢通路激活,KCN基因敲除小鼠B、C两组肝脏组织中phos-AKT,phos-ACCα,phos-AMPK水平均较正常对照组A组小鼠表达量降低(P<0.05,图5),ACCα水平较A组明显增高KCN基因敲除小鼠的AMPK通路受到抑制(P<0.05,图5)。
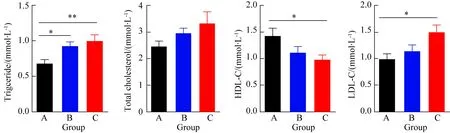
图3 小鼠血脂比较
A:C57BL/6 group; B:KCN+/-group; C:KCN-/-group;KCN:potassium voltage-gated channel; TG: triglyceride; TC: total cholesterol; LDL-C: low density lipoprotein cholesterol; HDL-C: high density lipoprotein cholesterol;*P<0.05,**P<0.01vsgroup A,n=10.
图4 小鼠肝脏组织
3 讨论
随着社会经济的发展及人们生活方式的改变,糖尿病已经成为威胁我国人民健康的主要疾病,糖尿病主要表现为胰岛素分泌缺陷或胰岛素作用障碍[5]。糖尿病病人大多伴有肥胖和血脂异常,其主要原因是病人体内脂肪组织大量蓄积。而脂肪细胞中脂肪酸的大量堆积可以导致胰岛素抵抗,从而引发糖尿病[6]。
非酒精性脂肪肝、高三酰甘油血症、血脂增高等脂代谢紊乱症状在代谢综合征、肥胖及2型糖尿病病人中普遍存在,细胞中脂肪酸的大量堆积可以导致胰岛素抵抗,进而引发糖耐量异常[7]。而机体中糖代谢与脂代谢有密不可分的关系,一定条件下可以相互转化[8]。AMPK是一个能量传感器,参与调节包括胰岛B细胞、肝脏、骨骼肌和脂肪在内的多种外周组织的糖脂代谢过程[9]。AMPK调节脂代谢的信号通路是由AMPK、ACCa以及AKT组成[10]。活化后可通过减少葡萄糖利用、增加脂肪酸氧化而产生能量,同时抑制葡萄糖异生及脂肪酸合成而减少能量消耗以维持细胞能量代谢平衡[11-13]。
AMPK是细胞和机体能量代谢的主要调节器[14], 其活性主要受细胞中AMP/ATP比例的调节,控制能量的分解与合成代谢通路。ACC受AMPK负调控,是脂肪酸代谢的限速酶。ACC在体内主要有ACCa 和ACCD两种形式,由不同基因编码,ACCa(265 000)主要在脂肪生成活跃的肝脏、脂肪组织和乳腺组织中表达,在脂类代谢过程中具有重要作用[15]。
已有结果表明在人类、小鼠、大鼠的胰岛细胞中,KCN基因对于调节胰岛素分泌扮演了重要的角色[16],但目前对于KCN基因是否影响糖尿病合并脂代谢紊乱及相关机制尚未有定论。本研究表明,KCN基因敲除糖尿病小鼠存在TG、TC和LDL增高,HDL降低等脂代谢紊乱症状。进一步研究其机制发现,KCN基因敲除糖尿病小鼠的AMPK及其上游的AKT被抑制,并且其下游的ACCa磷酸化增强,脂肪酸氧化受到抑制。因此,本研究将有助于明确KCN通道基因在糖尿病发生、发展中的作用及其机制,并可能为糖尿病合并脂代谢异常的治疗提供新策略和新的药物靶点。
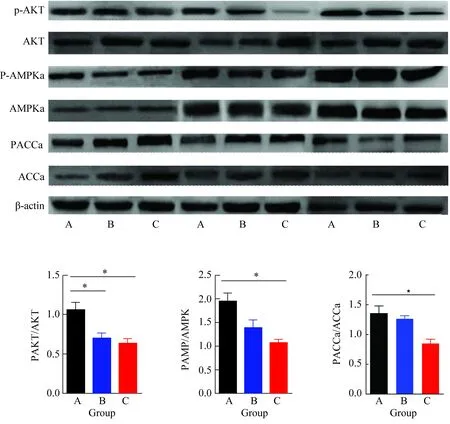
图5 AKT、AMPK、ACC及其磷酸化水平
A:C57BL/6 group; B:KCN+/-group; C:KCN-/-group. The levels of phos-AKT and phos-AMPK in group B and C were significantly lower than thosein control group and phos-ACCα significantly increased,*P<0.05,**P<0.01vsgroup A;KCN:human ether-a-go-go related gene; AKT:protein kinase B; AMPK:adenosine 5′-monophosphate (AMP)-activated protein kinase; ACC:acetyl CoA carboxylase.
本研究的后续工作将在细胞水平验证AMPK对脂代谢的影响以及验证AKT-AMPK-SREBP-1脂肪酸合成途径是否与脂肪酸氧化途径共同影响了KCN基因敲除糖尿病小鼠的脂代谢。下一步,将分别采用KCN基因激动剂和抑制剂进行体内和体外实验,检测细胞和动物水平的三酰甘油等脂代谢相关指标,并从RNA水平和蛋白水平分别检测AMPK相关通路蛋白标志物的表达情况,进一步明确KCN通道基因在糖尿病合并脂代谢紊乱发生、发展过程中的作用及机制。
[1] Liman E R, Tytgat J, Hess P. Subunit stoichiometry of a mammalian K+channel determined by construction of multimeric cDNAs[J]. Neuron,1992, 9(5): 861-871.
[2] Hardy A B, Fox J E, Giglou P R, etal. Characterization of Erg K+ channels in α-and β-cells of mouse and human islets[J]. Biol Chem, 2009, 284(144): 30441-30452.
[3] Qiu H Y, Yuan S S, Yang F Y, et al. HERG protein plays a role in moxifloxacin-induced hypoglycemia [J]. J Diabetes Res, 2016,16(6): 298-304.
[4] Kudo N,Gillespie J G,Kung L, et al.C haracterization of 50AMP-activated protein kinase activity in the heart and its role in inhibiting acetyl-CoA carboxylase during reperfusion following ischemia [J].Biochim Biophys Acta, 1996, 1301(1-2): 67-75.
[5] Ye J M, Dzamko N, Cleasby M E, et al. Direct demonstration of lipid sequestration as a mechanism by which rosiglitazone prevents fatty-acid-induced insulin resistance in the rat: comparison with metformin [J]. Diabetologia, 2004, 47(7):1306-1313.
[6] Fryer L G, Carling D. AMP-activated protein kinase and the metabolic syndrome [J]. Biochem Soc Trans, 2005, 33(2):362-366.
[7] Gonzalez A A, Kumar R, Mulligan, et al. Metabolic adaptations to fasting and chronic caloric restriction in heart, muscle, and liver do not include changes in AMPK activity [J]. Am J Physiol Endocrinol Metab,2004, 287(5): 1032-1037.
[8] Weickert M O, Pfeiffer A F. Signalling mechanisms linking hepatic glucose and lipid metabolism [J]. Diabetologia, 2006, 49 (8): 1732-1741.
[9] Hardie D G. The AMP-activated protein kinase pathway new players upstream and downstream [J]. J Cell Sci, 2004,117 (23):5479-5487.
[10]Jampvska A, Hatzinikolas G. AMPK and ACC phosphorylation: Effect of leptin, muscle fibre type and obesity [J].Mol Cell Endocrinol, 2008, 284(1-2): 1-10.
[11]解雪芬,朱毅. AMPK与代谢综合征[J]. 基础医学与临床,2006,26 (1): 27-34.
[12]王楚媛,孔令芳,侯永生,等.脂联素与2型糖尿病进程的相关性[J]. 中国医科大学学报,2014,(5) :429-431,436.
[13]马娜敏,于世林,耿亚辉,等.北京温泉社区中老年2型糖尿病人群伴发代谢综合征的患病率及分布特征[J]. 首都医科大学学报, 2014,35 (1) :56-59.
[14]Viollet B, Foretz M, Guigas B, et al. Activation of AMP-activated protein kinase in the liver: a new strategy for the management of metabolic hepatic disorders [J]. J Physiol, 2006, 574 (1): 41-53.
[15]Bourbeau,Bartberger. Recent advances in the development of acetyl-CoA carboxylase (ACC) inhibitors for the treatment of metabolic disease [J]. J Med Chem, 2015, 58(2): 525-536.
[16]Muhlbauera E, Bazwinsky I, Wolgasta S, et al. Circadian changes of ether-a-go-go-related-gene (Erg) potassium channel transcripts in the rat pancreas and β-cell[J]. Cell Mol Life Sci, 2007, 64(6): 768-780.
编辑 慕 萌
Effect ofKCNpotassium channel gene on lipid metabolism in mice
Liu Jingyi1,2, Lu Jing1,2, Yang Jinkui1,2*
(1.DepartmentofEndocrinology,BeijingTongrenHospital,CapitalMedicalUniversity,Beijing100730,China; 2.BeijingKeyLaboratoryofDiabetesResearchandCare,Beijing100730,China)
Objective To study the effect of potassium channel gene (KCN) on lipid metabolism in mice and its related signal pathway and to provide a new therapeutic target for dyslipidemia in diabetes . Methods Our group constructedKCNchannel knock-out mouse model. In this study,KCNchannel knock-out mice and control C57BL/6 mice will be examined. We will detect total cholesterol, triglyceride, high-density lipoprotein and low-density lipoprotein in their serum, the protein level of adenosine 5′-monophosphate (AMP)-activated protein kinase (AMPK) pathway from rat’s tissue was detected by western blot and the level of hepatic steatosis will be observed by HE staining.Results The serum levels of total cholesterol, triglyceride and low-density lipoprotein inKCNgene knock-out mouse were all significantly higher than those in controls, and high-density lipoprotein is lower than control (P<0.05). The results of Western blotting showed that phosphate-protein kinase B (Phos-AKT) and phos-AMPK levels in liver tissue ofKCNgene knockout mice were lower than those in normal control group, and phosphate-acetyl CoA carboxylase (phos-ACCα) level was significantly higher (P<0.05). ConclusionKCNchannel influences lipid metabolism in mice by classical fatty acid oxidation AMPK pathway.
potassium voltage-gated channel; lipid metabolism; adenosine 5′-monophosphate (AMP)-activated protein kinase pathway
国家自然科学基金(81400824,81370946, 81300726),北京市自然科学基金(7131005). This study was supported by National Natural Science Foundation of China (81400824,81370946, 81300726),Natural Science Foundation of Beijing (7131005).
时间:2017-04-13 20∶08
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.2008.060.html
10.3969/j.issn.1006-7795.2017.02.004]
R589.2
2017-01-20)
*Corresponding author, E-mail:jinkui.yang@gmail.com

