8年生转基因库安托杨外源基因转移及对土壤微生物数量影响的检测
朱文旭,丁昌俊,张伟溪,张冰玉,黄秦军,褚延广,苏晓华
(林木遗传育种国家重点实验室,国家林业局林木培育重点实验室,中国林业科学研究院林业研究所,北京 100091)
8年生转基因库安托杨外源基因转移及对土壤微生物数量影响的检测
朱文旭,丁昌俊,张伟溪,张冰玉,黄秦军,褚延广,苏晓华*
(林木遗传育种国家重点实验室,国家林业局林木培育重点实验室,中国林业科学研究院林业研究所,北京 100091)
[目的]评价转基因库安托杨可能引起的生态风险。[方法]利用PCR扩增研究外源基因水平转移情况,利用稀释平板法研究土壤中细菌、真菌和放线菌数量。[结果]电泳结果显示:林下杂草混合样品和土壤微生物DNA样品中均未出现目的基因片段。转基因株系和非转基因株系的非根际土壤中可培养的细菌、真菌和放线菌数量在杨树的不同生长期出现一定的变化,但是这种变化没有明显的规律。[结论]8年生转基因库安托杨未出现外源基因水平转移,也未对土壤微生物的数量产生显著影响。
转多基因杨树;基因水平转移;土壤微生物;生态安全性
国际农业生物技术服务组织(ISAAA)发布的最新统计数据,截止到2014年转基因植物商业化种植已经进行了19年(1996年—2014年),转基因植物的推广面积持续增加[1]。在林木方面,通过转基因手段已获得了耐盐[2]、抗虫[3-4]、抗除草剂[5]、降低木质素含量[6]、增加生长量[7]等转基因树木。伴随着转基因植物的快速发展,关于转基因植物安全性方面的争论一直存在。因此,转基因植物在实际推广之前需要进行安全性评估。目前,转基因植物生态安全性评估[8]主要集中在转基因植物外源基因逃逸[9-10]以及对生态系统的影响方面。土壤微生物是土壤生态系统的一个重要组成部分,参与土壤生态系统中物质循环和能量流动,对土壤中C、N、P和S等养分元素的循环和有机质的分解起重要作用[11]。转基因植物的外源基因通过水平转移,将遗传物质传递给非子代的其他细胞的方式整合到土壤微生物的基因组中,从而可能使土壤微生物的遗传特性与功能发生一定变化。外源基因的表达所引起的植物生理代谢的改变,以及外源基因表达的产物进入土壤生态系统后可能会对根际微生物群落产生潜在影响[12]。因此,在研究中经常通过测定土壤微生物种类和数量作为转基因植物安全性监控的指标。
国内外关于转基因植物安全性的研究多集中在大豆、玉米、棉花等1年生农作物上[1],关于转基因林木对土壤微生物多样性的研究报道多以苗期或幼树为主[1, 13-15],对成龄期树木的研究很少[16]。林木多是在成龄期取材利用,所以,对转基因林木的安全性监测需要长期进行。在苗期调查时未发现转多基因库安托杨对土壤微生物的数量造成影响[17]。本研究以8年生转多基因的库安托杨为研究对象,研究了外源基因是否发生转移及对土壤微生物数量的影响,为转基因杨树安全性评估提供参考。
1 试验林概况
试验林位于北京市房山区韩村河东营苗圃,2006年春季造林,每个转基因株系按正方形种植,行10株、列10株(密度2 m×2 m),造林总面积为0.66 hm2。试验地的地势、地貌、气温、降雨、植被、栽培管理等自然条件和人为管理均一致,整个试验阶段林地不进行任何肥水及喷施农药管理。实验材料为转5个基因的库安托杨(P.×euramericana‘Guariento’) 5个株系,5个外源基因包括:枯草杆菌果聚糖蔗糖酶基因(SacB)、透明颤菌血红蛋白基因(Vgb)、双价抗蛀干害虫基因(BtCry3A+OC-Ⅰ)及调节基因(JERF36),5个株系编号为D5-9、D5-19、D5-20、D5-21和D5-24,非转基因无性系编号为(D5-0)。各株系经PCR、Southern杂交和BtCryAELISA等分子检测,同时含有上述5个基因[18]。
2 研究方法
2.1 取样方法

2.2 DNA 的提取
将同一无性系林地下方的植物样品混合研磨,提取多种植物DNA的混合样品。植物样品DNA的提取采用DNeasy Plant Mini Kit (Qiagen, Germany)法。参照UltraClean®DNA Isolation kit(土壤微生物DNA提取试剂盒)使用说明书,使用试剂盒提取7月份的非根际土壤中微生物的总DNA。
2.3 PCR反应条件及程序
使用外源基因的特异引物对土壤微生物DNA和植物DNA进行PCR扩增。PCR 反应体系如下:10×Taq buffer 5 μL,dNTP Mixture (2.5 mol·L-1) 1 μL ;Primer F (10 μmol·L-1) 1 μL ,Primer R (10 μmol·L-1) 1 μL ,rTaq (2.5 U·μL-1) 0.5 μL ,模板DNA 2 μL ,加ddH2O补足至50 μL 。PCR所用引物序列与反应条件见表1、2。

表1 外源基因引物及产物大小
2.4 土壤微生物数量测试方法
细菌培养使用牛肉膏蛋白胨培养基,真菌培养使用马丁(Martin)孟加拉红-链霉素培养基,放线菌培养使用改良淀粉铵盐培养基。首先用灭菌的250 mL三角瓶称取10 g土壤样品,加入90 mL无菌水,再加入少量灭菌的小玻璃珠以方便将土壤摇开,

表2 PCR 反应程序
室温下在摇床上(平动用150 r·min-1,晃动用200 r·min-1)振荡30 min,然后使用无菌水对菌液进行浓度稀释,每个处理选择2种浓度的菌液进行培养。细菌选取10-3、10-4浓度的土壤悬浊液,放线菌选取10-2、10-3浓度的土壤悬浊液,真菌选取10-1、10-2浓度的土壤悬浊液,吸取50 μL菌液,均匀的涂在选择性培养基上,每个浓度涂抹5个培养皿,放线菌培养基置于28 ℃的培养箱内培养,细菌和真菌培养基置于35 ℃的培养箱内培养。同时称取一定量的待测土样,用牛皮纸袋装好,放于烘箱中,105 ℃烘烤,恒质量后称量其质量,计算土壤含水量,从而计算出每克干土中土壤微生物的数量。
2.5 数据统计分析
采用Excel和SPSS软件对试验数据进行方差分析和多重比较
3 结果与分析
3.1 外源基因水平转移的情况分析
利用外源基因Vgb、SacB、BtCry3A+OC-I和JERF36的特异性引物分别对试验林内的根际土壤微生物总DNA和林下杂草混合样品总DNA进行PCR检测。CK-为无底物模板DNA只有水的对照,CK+为对应基因的质粒阳性对照,M为DNA Marker(200、400、700、1 000、1 500、2 000 bp)。由图1、2可知,未见目的片段。

图1 微生物DNA的PCR扩增
Fig.1 PCR amplification in genomic DNA of soil microbial
(Vgb、SacB、BtCry3A+OC-I和JERF36代表不同引物,图上数字代表PCR 产物的大小,下同。)
(Vgb、SacB、BtCry3A+OC-I and JERF36 represent different primers, chart numbers represent the size pcr product,the same below。)

图2 对植物DNA的PCR 扩增Fig.2 PCR amplification in genomic DNA of plant
3.2 不同株系中土壤微生物的数量变化
对8年生转基因杨树(D5-9,D5-19,D5-20,D5-21和D5-24)及非转基因杨树(D5-0)的非根际土中细菌、真菌和放线菌的数量进行统计分析。表3表明:在7月份(杨树生长旺盛阶段)细菌数量急剧增加,显著高于春季开始生长阶段和秋季停止生长阶段,转基因杨树与非转基因杨树土壤中细菌的数量差异不显著。比较同一无性系的转基因杨树在不同月份土壤中细菌的数量发现:除4月份差异显著外,其它月份的差异不显著。真菌数量的变化趋势也是先增加后下降,D5-0、D5-21和D5-24非根际土壤中真菌数量的最大值出现在8月份,D5-9 D5-19 D5-20非根际土壤中真菌数量的最大值出现在9月份,随后明显下降。转基因无性系与非转基因无性系的差异不显著。放线菌数量也有同样的变化趋势,在杨树生长最快的7月份,除D5-24外,其余都达到最大值。
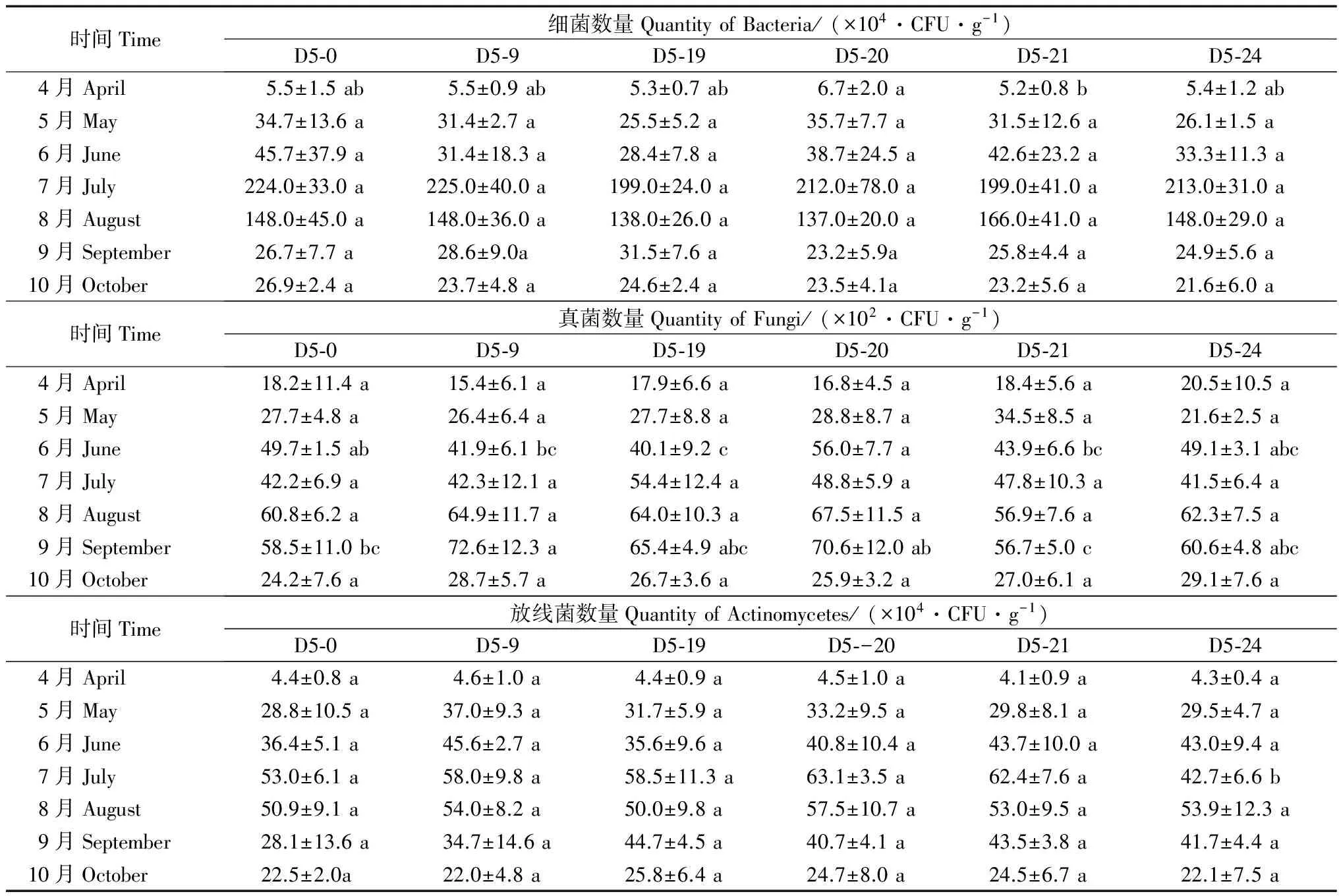
表3 8年生林地不同无性系土壤微生物数量
注:数据是平均值±标准差(n=3);同一行不同小写字母表示差异显著(P<0.05)。
Note: Values are means ± standard deviation (n=3). The values followed by diferent lowereases mean significant diference (P<0.05) between treatments.
4 讨论
转基因植物在大面积种植以后,其对环境的影响一直备受关注。转基因林木产生大量的根茬和残枝落叶,外源基因片段会随之进入土壤生态系统,这时目的基因片段有可能会发生基因的水平转移,进入土壤微生物体内并整合到其基因组上,进而改变土壤微生物群落结构及其多样性,而且植物残体和根际分泌物与土壤中的微生物相互作用,也有可能影响微生物的种类、数量以及生命活动。利用外源基因引物分别对试验林内植物总DNA和根际土壤微生物总DNA进行PCR检测,未见目的片段。稀释平板培养法的结果显示:转基因杨树与非转基因杨树的非根际土壤中可培养的细菌、真菌和放线菌数量在不同生长期会出现一定的变化,但是这种变化没有达到显著水平而且变化规律也不明显。微生物的数量都是在杨树生长最旺盛的(7月和8月)达到最大值。
李霞等[15]研究1年生转Bt基因欧洲黑杨发现,转基因和对照林地间及根际土壤中微生物数量在不同月份的差异不显著。胡建军等[16]研究7年生转Bt基因的欧洲黑杨,转基因欧洲黑杨与非转基因欧洲黑杨间根系土壤中细菌、放线菌和霉菌数量的差异不显著,转基因欧洲黑杨与邻近杨树林地的土壤细菌、放线菌和霉菌数量的差异也不显著。张雁等[19]研究转Bt基因南林895杨发现,转Bt基因杨树根际三大类土壤微生物的数量与对照的差异不显著。另一些研究表明,转基因植物对土壤微生物多样性组成的影响显著。王洪兴等[20]在研究转Bt基因的水稻发现,转基因水稻根际细菌数量显著低于非转基因水稻,转基因水稻根际真菌数量却显著高于非转基因水稻,根际放线菌数量没有明显变化规律。王倩倩等[21]研究转CpTI基因苹果发现,种植30 d时,转基因根际土壤中细菌和真菌数量高于非转基因对照;60 d时,根际土壤中真菌数量显著高于对照,而细菌数量显著低于对照。
5 结论
通过对8年生转多基因库安托杨5个株系和非转基因株系进行研究,未发现外源基因转移,转基因杨树的土壤微生物数量主要受季节变化影响。森林中土壤微生物的组成和结构复杂,关于林木转基因安全需要进行系统、全面和长期的研究。
[1] Clive James. 2014年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2015, 35(1):1-14.
[2] 杨春霞, 李火根, 程 强, 等. 南林895杨抗旱耐盐基因DREB1C的转化[J]. 林业科学, 2009, 45(2):17-21.
[3] Zhang B, Chen M, Zhang X,etal. Expression ofBt-Cry3A in transgenicPopulusalba×P.glandulosaand its effects on target and non-target pests and the arthropod community[J]. Transgenic research, 2011, 20(3): 523-532.
[4] Génissel A, Leplé J C, Millet N,etal. High tolerance againstChrysomelatremulaeof transgenic poplar plants expressing a syntheticcry3Aagene formBacillusthuringiensisssp. tenebrionis[J]. Mol Breed, 2003, 11(2): 103-110.
[5] Confalonieri M, Belenghi B, Balestrazzi A,etal. Transformation of elite white poplar (PopulusalbaL. ) cv. ‘Villafranca’and evaluation of herbicide resistance[J]. Plant Cell Rep, 2000, 19(10): 978-982.
[6] Eriksson M E, Israelsson M, Olsson O,etal. 2000. Increased gibberellin biosynthesis in transgenic trees promotes growth,biomass production and xylem fiber length[J]. Nat Biotechnol, 18(7): 784-788.
[7] Shani Z, Dekel M, Tsabary G,etal. Growth enhancement of transgenic poplar plants by overexpression ofArabidopsisthalianaendo-1,4-β-glucanase(cel1)[J]. Mol Breed, 2004, 14(3): 321-330.
[8] Wolfenbarger L L, Phifer P R. The ecological risks and benefits of genetically engineered plants[J]. Science, 2000, 290(5499): 2088-2093.
[9] Lu B R, Snow A A. Gene flow from genetically modified rice and its environmental consequences[J]. BioScience, 2005, 55(8): 669-678.
[10] Londo J P, Bautista N S, Sagers C L,etal. Glyphosate drift promotes changes in fitness and transgene gene flow in canola (Brassicanapus) and hybrids[J]. Annals of botany, 2010, 106(6): 957-965.
[11] Preston-Mafham J, Boddy L, Randerson P F. Analysis of microbial community functional diversity using sole-carbon-source utilisation profiles-a critique[J]. FEMS Microbiology Ecology, 2002, 42(1): 1-14.
[12] 关正君, 鲁顺保, 魏 伟. 转基因植物对土壤微生物群落的影响及风险评价[J]. 科学, 2015, 67(3): 47-51.
[13] 魏 冰, 李 云, 杜宁霞, 等. 毛白杨杂种外源基因稳定性及其对土壤微生物的影响[J]. 核农学报, 2009, 23(6): 1054-1059.
[14] 侯英杰, 苏晓华, 焦如珍, 等. 转基因银腺杂种杨对土壤微生物的影响[J]. 林业科学, 2009, 45(5):148-152.
[15] 李 霞, 薛泉宏, 樊军锋, 等. 一年生转Bt基因欧洲黑杨对土壤微生物的影响[J]. 西北林学院学报, 2011, 26(4): 123-127.
[16] 胡建军, 张蕴哲, 卢孟柱, 等. 欧洲黑杨转基因稳定性及对土壤微生物的影响[J]. 林业科学, 2004, 40(5): 105-109.
[17] 侯英杰. 转基因杨树生态安全性评价初步研究[D]. 北京:中国林业科学研究院, 2008.
[18] Wang J G, Su X H, JI L L,etal. Multiple TransgenesPopulus×euramericana‘Guariento’ plants obtained by biolistic bombardment[J]. Chinese Science Bulletin, 2007, 52 (2) : 224- 230.
[19] 张 雁, 郭同斌, 潘惠新, 等. 转Bt基因南林 895 杨抗虫性及对土壤微生物影响分析[J]. 林业科学研究, 2012, 25(3): 346-350.
[20] 王洪兴, 陈 欣, 唐建军, 等. 转Bt基因水稻秸秆降解对土壤微生物可培养类群的影响[J]. 生态学报, 2004, 24(1): 89-94.
[21] 王倩倩. 转基因苹果对微生物群落数量及植株花粉育性影响研究[D]. 保定:河北农业大学, 2013.
(责任编辑:詹春梅)
DOI:10.13275/j.cnki.lykxyj.2017.02.024
毛竹扩张对常绿阔叶林土壤性质的影响及相关分析
赵雨虹1,2,范少辉2*,罗嘉东3
(1.国家林业局林产工业规划设计院,北京 100010; 2.国际竹藤中心,国家林业局竹藤科学与技术重点实验室,北京 100102;3.中国林业科学研究院亚热带林业实验中心,江西 分宜 336600)
收稿日期: 2015-01-29
基金项目: “十二·五”竹藤资源高效培育技术研究与示范资助(2012BAD23B04)
作者简介: 赵雨虹(1983—),女,天津市人,工程师,博士,主要从事森林生态学研究.E-mail: rainbow.86@163.com
* 通讯作者:范少辉(1962—),男,福建永泰人,研究员,博士生导师,主要从事竹林培育研究.E-mail: fansh@icbr.ac.cn

关键词:毛竹扩张;土壤碳含量;土壤物理性质;土壤水分特征

Keywords:Phyllostachysedulisexpansion;soil organic carbon content;soil physical properties;soil water properties
常绿阔叶林是我国湿润亚热带地区特有的森林生态系统,蕴藏丰富的资源和生物多样性。毛竹(Phyllostachysheterocycla(Carr.)Mitford)作为一种高大散生乔木状克隆植物,依靠强大的地下茎(竹鞭)向常绿阔叶林蔓延以实现种群克隆扩张,导致常绿阔叶林演替形成竹阔混交林,甚至在人为干扰下形成毛竹纯林[1]。毛竹扩张能够引起一系列生态变化,如森林景观被破坏[2]、生物多样性锐减[3]、林地土壤退化[4]及森林碳库改变[5]等。常绿阔叶林在毛竹扩张的胁迫下,结构简化、组成成分减少、物流能流受阻、平衡状态破坏、更新能力减弱,以及生态系统服务功能的持续下降导致水土流失加剧,自然灾害频发、生物多样性减少、生态与环境质量下降[6]。近年来,常绿阔叶林受邻近毛竹林扩张的问题逐渐引起生态学家的广泛关注,但基于土壤有机碳含量和土壤性质对毛竹扩张给常绿阔叶林带来的影响尚未见报道。为此,本研究在江西省大岗山森林生态定位站,基于空间代替时间理论,选择常绿阔叶林、2∶8竹阔混交林,8∶2竹阔混交林和毛竹纯林4种林分类型为研究对象,对4种植被林下土壤有机碳和土壤物理性质、持水能力变化特征进分析,并运用相关分析方法探讨其相互关系,以揭示毛竹扩张对常绿阔叶林土壤性质的影响。旨在为我国亚热带森林植被演替方面研究提供理论支持,丰富我国南方竹林主要分布区域已有竹林扩张研究成果,为大岗山地区森林科学经营提供参考。
1 材料与方法
1.1 研究区概况

1.2 研究样地设置
试验地设置在大岗山森林生态站海拔300 m区域。2014年6月,在尽量保持立地条件和经营措施一致的前提下,选取常绿阔叶林、2∶8竹阔混交林、8∶2竹阔混交林和毛竹纯林4种林分类型,每种林分各设置3个20 m×20 m标准样地,共12个样地。常绿阔叶林优势种主要为丝栗栲(CastanopsisfargesiiFr.),林下植物主要为黄牛奶树(Symplocoslaurina(Retz.)Wall.)、苦槠栲(Castanopsissclerophylla(Lindl.)Schott.)、绒毛润楠(MachilusvelutinaChamp. ex Benth.)、油茶(CamelliaoleiferaAbel.)、铁芒萁(Dicranopterisdichotoma(Thunb.)Bernh.)、淡竹叶(LophatherumgracileBrongn.)和草珊瑚(Sarcandraglabra(Thunb.)Nakai)等;竹阔混交林由毛竹和丝栗栲组成,林下植被主要有刨花楠(MachiluspauhoiKanehira)、山乌桕(Sapiumdiscolor(Champ. ex Benth.)Muell.Arg.)、油茶、绒毛润楠、杜茎山(Maesajaponica(Thunb.)Moritzi.)、淡竹叶、铁芒箕和寒莓(RubusbuergeriMiq.)等;毛竹纯林下植被简单,主要有淡竹叶、油茶、毛冬青(IlexpubescensHook. et Arn.)和狗脊(Woodwardiajaponica(L.f.)Sm.)等[9]。4种林分类型样地基本情况详见表1。
1.3 样品采集与分析方法
1.3.1 样品采集 在每个标准样地内按照海拔高

表1 样地概况
注:表中每种林分数据均为实际调查样地的加权平均值。
Note: The data of each stand is a weighted average of the actual survey plots in the table.

1.3.2 室内分析 土样密度、土壤持水量采用环刀法测定;土壤孔隙度和贮水量采用计算法;土壤有机碳采用K2Cr2O7外加热法测定[10-12]。
1.4 数据处理
采用Excel图表和SPSS13.0软件进行数据处理。
2 结果与分析
2.1 土壤有机碳含量变化特征
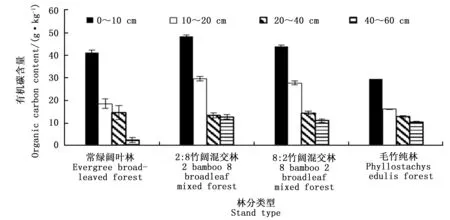
图1 毛竹扩张对林地土壤有机碳含量的影响Fig.1 The effect on soil organic carbon content about P. edulis expansion
2.2 土壤密度与孔隙度变化特征

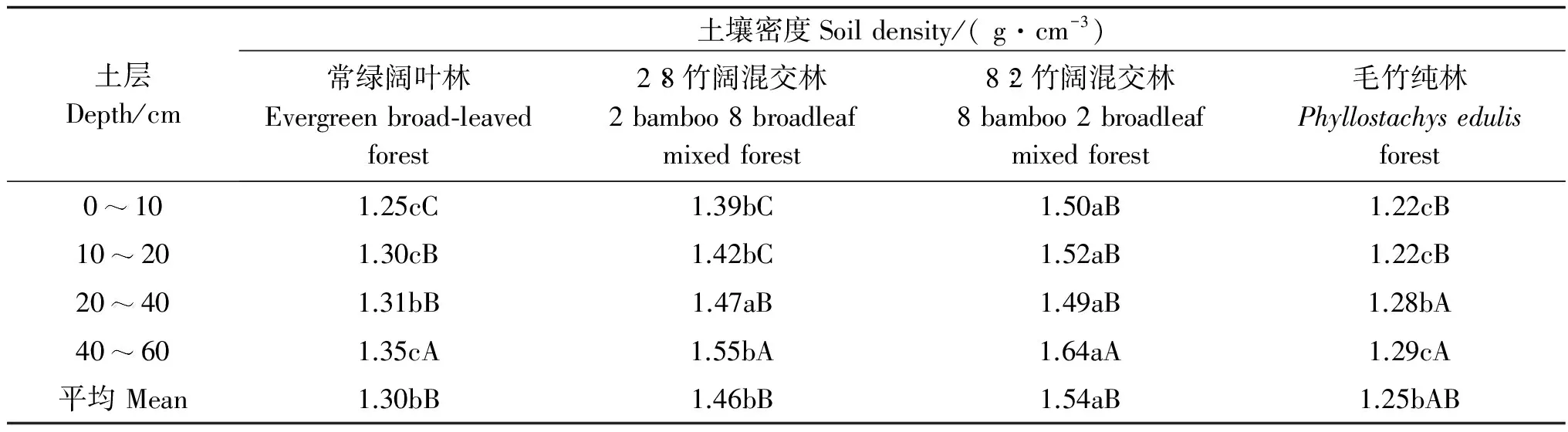
表2 4种林分类型土壤密度
注:同行不同小写字母表示不同林分间差异显著(p<0.05),同列不同大写字母表示同一林分不同土层间差异显著(p<0.05) (LSD)。
Note: Different lower case letters in same line indicate significant difference in different stand (P<0.05). Different capital letters in the same column indicate significant difference in different soil layers in the same stand (P<0.05) (LSD).
2.3 土壤水分变化特征


表3 4种林分土壤物理性质特征
注:同林分不同小写字母表示不同土层间差异显著(p<0.05),同列不同大写字母表示不同林分间差异显著(p<0.05) (LSD),下同。
Note: Different lower case letters in same stand indicate significant difference in different soil layers (P<0.05). Different capital letters in the same column indicate significant difference in different stand (P<0.05) (LSD). The same below.

2.4 土壤有机碳含量与土壤其他特征的相关分析
表5表明:土壤有机碳含量与土壤总孔隙度呈显著正相关,与土壤密度、非毛管持水量和现有贮水量呈显著或极显著负相关,与其它相关变量相关性不显著。土壤物理性质和水分各指标间也存在不同程度的相关关系,土壤密度与总孔隙度、毛管孔隙度、饱和持水量、毛管持水量呈极显著负相关,与非毛管持水量成显著正相关;而土壤总孔隙度与毛管孔隙度、饱和持水量、毛管持水量呈极显著正相关,与非毛管持水量呈显著负相关;毛管孔隙度与饱和持水量、毛管持水量呈极显著正相关;饱和持水量与毛管持水量呈极显著正相关,与非毛管持水量呈显著负相关。

表4 4种林分土壤水分变化特征
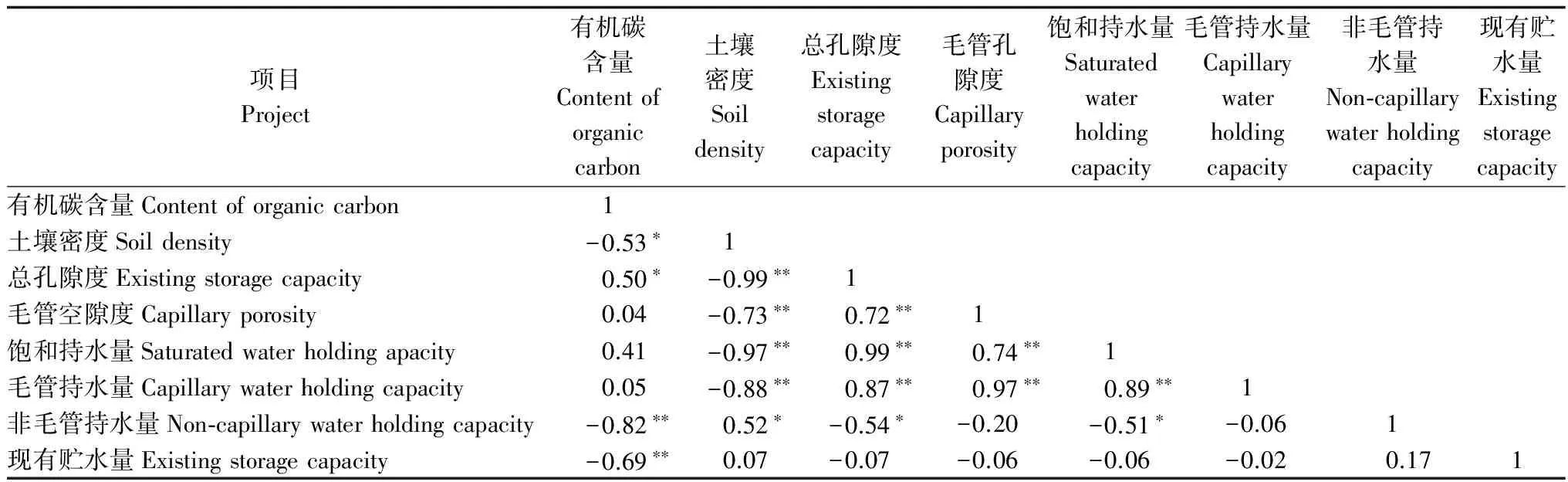
表5 土壤有机碳与各土壤性质间的相关系数
注:表中*表示P<0.05,**表示P<0.01。
Note: * indicateP<0.05,** indicateP<0.01。
3 讨论

大岗山生态站研究区域均为林龄较高的次生常绿阔叶林,凋落物层较厚,土壤肥沃,有机碳含量较高,常绿阔叶林表层土壤孔隙度和持水量均较高,为扩张后竹笋萌发提供了充足的养分、水分来源。宋庆妮等[13]的研究结果表明,毛竹扩张对土壤氮素的矿化是毛竹成功扩张的另一个原因,在常绿阔叶林逐渐演替成毛竹纯林的过程中,土壤氮素氨化作用增强,产生的大量铵态氮,进一步满足了毛竹生长发育对土壤氮素的需求,而随着林地毛竹比例增加,土壤硝化作用和总矿化作用下降,不能满足常绿阔叶林对大量土壤硝态氮和无机氮的需求,影响了常绿阔叶林的生长。因此,土壤碳氮含量以及土壤密度、孔隙度和水分特征可能是控制毛竹林扩张,维持常绿阔叶林作为顶级群落稳定性的重要生态策略,但是,空间代替时间的方法不能完整还原常绿阔叶林向毛竹纯林演替过程,其机理也更为复杂,需进一步研究。
4 结论
原先阔叶树的林分土壤密度高于毛竹纯林,土壤孔隙度、持水量较低,进而影响土壤水肥的运输和通气性能,降低植物对养分的利用;毛竹在扩张过程中为了吸收营养物质,依靠强大的地下竹鞭不断扩张到常绿阔叶林生态系统,导致林内部分木本植物竞争失败而死亡,增加了竹阔混交林土壤有机碳来源,促进竹阔混交林土壤有机碳含量的增加;但由于毛竹无性繁殖的特点,对土壤有机碳消耗巨大,当常绿阔叶林完全演替到毛竹纯林后,原来常绿阔叶林林下植被大部分已消失殆尽,再加上择伐、挖笋等人类活动的影响,地上、地下碳源大量减少,从而导致土壤有机碳归还降低,有机碳含量逐渐下降。
参考文献:
[1] 《江西森林》编委会. 江西森林[M]. 南昌: 江西科学技术出版社, 1986: 220-230.
[2] Yuji I, Atsushi T. Range expansion and its mechanisms in a naturalized bamboo species,Phyllostachyspubescens, in Japan [J]. Journal of Sustainable Forestry, 1998, 6:127-141.
[3] 杨淑贞, 杜晴洲, 陈建新, 等. 天目山毛竹林蔓延对鸟类多样性的影响研究[J]. 浙江林业科技, 2008, 28(4): 43-46.
[4] 吴家森, 姜培坤, 王祖良. 天目山国家级自然保护区毛竹扩张对林地土壤肥力的影响[J]. 江西农业大学学报, 2008, 30(4): 689-692.
[5] 杨清培, 王 兵, 郭起荣, 等. 大岗山毛竹扩张对常绿阔叶林生态系统碳储特征的影响[J]. 江西农业大学学报, 2011, 33(3): 529-536.
[6] 宋永昌, 陈小勇. 中国东部常绿阔叶林生态系统退化机制与生态恢复[M]. 北京: 科学出版社, 2007.
[7] 王 兵, 李少宁, 李利学, 等. 大岗山森林生态系统优化管理模式研究[J]. 江西农业大学学报, 2005, 27(5): 683-688.
[8] 张昌顺,范少辉,谢高地. 闽北毛竹林枯落物层持水功能研究[J]. 林业科学研究,2010, 23(2): 259-265.
[9] 赵雨虹. 毛竹扩张对常绿阔叶林主要生态功能的影响[D]. 北京:中国林业科学研究院,2015.
[10] 国家林业局.森林土壤分析方法[M]. 北京: 中国标准出版社, 1999: 1-108.
[11] 王 丹, 戴 伟, 王 兵, 等. 杉木人工林不同发育阶段土壤性质变化的研究[J]. 北京林业大学学报, 2010, 32(3): 59-63.
[12] 鲍士旦. 土壤农化分析方法[M]. 北京: 中国农业出版社, 2008: 1-200.
[13] 宋庆妮, 杨清培, 刘 骏, 等. 毛竹扩张对常绿阔叶林土壤氮素矿化及有效性的影响[J]. 应用生态学报, 2013, 24(2): 338-344.
[14] 刘蔚漪, 范少辉, 苏文会, 等. 竹林不同界面水文效应研究[J]. 浙江农林大学学报,2011,28(3):486-493.
[15] 王 丹,王 兵, 戴 伟, 等. 杉木人工林土壤系统有机碳相关变量的通径分析[J].土壤通报,2011,42(4):822-827.
(责任编辑:徐玉秀)
Exogenous Gene Transformation of 8-Year-Old Multi-gene TransgenicPopulus×euramericana‘Guariento’ and Its Influence on Soil Microbial Quantity
ZHUWen-xu,DINGChang-jun,ZHANGWei-xi,ZHANGBing-yu,HUANGQin-jun,CHUYan-guang,SUXiao-hua
(State Key Laboratory of Forest Genetics and Tree Breeding, Key Laboratory of Tree Breeding and Cultivation, State Forestry Administration, Research Institute of Forestry, Chinese Academy of Forestry, Beijing 100091, China)
[Objective]To evaluate the possibility of the ecological risk caused by multi-gene transgenicPopulus×euramericana‘Guariento’.[Method]The target genes were amplified by PCR, and the amounts of three species of rhizosphere soil microbe, including bacteria, actinomycetes and fungi, were counted.[Result]No target PCR product was observed in all samples analyzed. The amounts of bacteria, fungi and actinomycetes in non-rhizosphere soil between transgenic poplar and non-transgenic poplar did have some changes in different growing period, but no obvious regularity was found in these changes themselves.[Conclusion]The result suggested that no horizontal transfer of transgene occurred, and the gene transformation did not significantly affect the soil microbial quantity.
multi-gene transgenic poplar; gene transfer; soil microorganism; ecological safety
The Influence ofPhyllostachysedulisExpanding into Evergreen Broadleaf Forest on Soil Property and Its Related Analysis
ZHAOYu-hong1,2,FANShao-hui2,LUOJia-dong3
(1.Forest Product Industry Programming and Design Institution, Beijing 100010, China; 2.International Center for Bamboo and Rattan, SFA Key Laboratory of Bamboo and Rattan Science and Technology, Beijing 100102, China; 3.Experiment Center of Subtropical Forestry, Chinese Academy of Forestry, Fenyi 336600, Jiangxi, China)
2016-06-12 基金项目: 国家“863”国家高技术研究发展计划项目(2013AA102703);林业公益性行业科研专项经费重大项目(201004004) 作者简介: 朱文旭(1986-),男,辽宁省辽阳人,在读博士.研究方向:林木遗传育种.E-mail:zhuwenxu.315@163.com * 通讯作者:研究员,首席专家.研究方向:林木遗传育种.E-mail:suxh@caf.ac.cn
10.13275/j.cnki.lykxyj.2017.02.023
S718.46
A 文章编号:1001-1498(2017)02-0349-05
14 文献标识码:A
1001-1498(2017)02-0354-06

