IgA肾病牛津分型与临床指标的相关性及危险因素分析
李卅立,范秋灵,赵洁,刘楠,王曦,姜奕,王力宁
(1.中国医科大学附属第一医院肾内科,沈阳110001;2.沈阳医学院附属第二医院肾内科,沈阳110002)
·论著·
IgA肾病牛津分型与临床指标的相关性及危险因素分析
李卅立1,2,范秋灵1,赵洁1,刘楠1,王曦1,姜奕1,王力宁1
(1.中国医科大学附属第一医院肾内科,沈阳110001;2.沈阳医学院附属第二医院肾内科,沈阳110002)
目的研究IgA肾病牛津分型的4种主要病变:系膜细胞增生(M0/1)、内皮细胞增生(E0/1)、节段性硬化或粘连(S0/1)、肾小管萎缩或肾间质纤维化(T0/1/2)与临床指标之间的相关性及危险因素。方法收集2006年2月17日至2011年10月11日在中国医科大学附属第一医院肾内科经肾活检确诊的514例18岁以上IgA肾病患者的临床及病理资料。除外过敏性紫癜、强直性脊柱炎、银屑病等继发性IgA肾病。采用χ2检验、Spearman秩相关、二分类及多因素logistic回归分析进行统计学分析。结果514例IgA肾病患者中,男女比例1.06∶1,平均年龄(35.70±11.99)岁,平均病程(18.31±30.42)个月。单纯血尿组牛津分型以M0E0S0T0为主。慢性肾脏病肾功能分期、24 h尿蛋白定量、尿微量白蛋白、尿转铁蛋白、尿IgG与M病变呈正相关;血清白蛋白、C3、血小板与M病变呈负相关。24 h尿蛋白定量和血小板升高是影响系膜细胞增生程度的独立危险因素。尿蛋白≥3.5 g的患者M1的比例(67.5%)显著高于非肾病范围蛋白尿的患者。年龄、收缩压、尿红细胞计数、24 h尿蛋白定量、尿微量白蛋白、尿转铁蛋白、尿IgG与E病变呈正相关;病程、血清白蛋白与E病变呈负相关。年龄、病程长是E病变加重的独立危险因素。60岁以上患者E1的比例(73.3%)显著高于60岁以下患者。CKD分期、收缩压、24 h尿蛋白定量与S病变呈正相关。年龄、CKD肾功能分期、收缩压、舒张压、C4、甘油三酯、低密度脂蛋白、C反应蛋白、血清纤维蛋白原、血尿酸、血胱抑素C、24 h尿蛋白定量、尿β2微球蛋白、尿微量白蛋白、尿转铁蛋白、尿IgG与T病变程度呈正相关,血红蛋白、血清白蛋白、血IgG与T病变呈负相关。前驱感染史、舒张压≥90 mmHg、低白蛋白血症、高低密度脂蛋白血症、贫血、高C反应蛋白血症是T病变加重的影响因素。结论24 h尿蛋白定量和血小板升高,高龄,病程长,存在低白蛋白血症、贫血、高脂血症、前驱感染、舒张压升高、高C反应蛋白血症是IgA肾病患者牛津分型病变严重的危险因素,对存在上述因素的患者应及时行肾活检,明确病理分级,给予个体化治疗,以改善预后。
IgA肾病;牛津分型;临床指标;危险因素;相关分析
IgA肾病是我国最常见的原发性肾小球肾炎,在肾活检资料中约占原发性肾小球疾病的20%~58.2%,是我国导致终末期肾脏病的首位病因。2009年的牛津分型[1⁃2]是针对原有的WHO组织学分类方法、Hass分类法、Lee分级法的不足而产生的,虽然牛津分型弥补了既往病理分类方法的不足,但是在对疾病的诊断上是否优于之前的分型,是否能独立预测中国IgA肾病患者的预后,是否与临床指标之间存在相关性,还需要进一步验证[3⁃6]。本研究试图探寻IgA肾病牛津分型中4种主要的病理改变:系膜细胞增生(M0/1)、内皮细胞增生(E0/1)、节段性硬化或粘连(S0/1)、肾小管萎缩或肾间质纤维化(T0/1/2)分别与年龄、性别、病程、尿红细胞计数、CKD分期、血清胱抑素C、尿蛋白定量、血压、血脂、血尿酸、血红蛋白、血小板、血清纤维蛋白原以及血免疫指标之间的相关性,旨在为临床上制定个体化治疗方案和判断预后提供依据。
1 材料与方法
1.1 临床资料
收集2006年2月17日至2011年10月11日在中国医科大学附属第一医院肾内科经光镜与免疫病理学检查确诊为原发性IgA肾病的514例患者的临床及病理资料。除外过敏性紫癜、糖尿病、肝硬化、系统性红斑狼疮、乙型肝炎病毒感染、肿瘤、强直性脊柱炎、银屑病等导致的继发性IgA肾病。采用MDRD公式计算估计肾小球滤过率(estimated glomerular filtration rate,eGFR)进行肾功能分期。
1.1.1 临床指标:包括性别、年龄、病程、肉眼血尿病史、高血压病史、前驱感染史、24 h尿蛋白定量、尿红细胞、血免疫球蛋白和补体水平、血IgA/C3比值、血胱抑素C、肾功能分期、收缩压、舒张压、血清白蛋白、血清总胆固醇、血清甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、血尿酸、血红蛋白、血小板、纤维蛋白原、C反应蛋白、尿α1微球蛋白、尿β2微球蛋白、尿微量白蛋白、尿转铁蛋白、尿IgG。
1.1.2 肾活检:经皮肾穿刺取得肾组织,石蜡包埋切片厚度2~3 μm,常规HE、PAS、PASM和Masson染色;冰冻切片厚度4~5 μm,直接免疫荧光法检查IgG、IgA、IgM、补体C3、C1q、C4和纤维蛋白原;间接免疫荧光检查HBsAg和HBcAg。
1.1.3 临床病理诊断和分型标准:病理诊断按照2009年的IgA肾病牛津分型。(1)系膜细胞增生(M0/ 1):50%肾小球系膜区超过3个系膜细胞即为M1;(2)内皮细胞增生(E0/1)无或有;(3)节段性硬化或粘连(S0/1)无或有;(4)肾小管萎缩或肾间质纤维化(T0/1/2)。≤25%为T0,>25%~50%为T1,>50%为T2[1⁃2]。临床分型分为单纯血尿、血尿伴蛋白尿、伴高血压、大量蛋白尿(≥3.5 g/24 h)、恶性高血压、肾功能不全(eGFR<60 mL/min)。
1.2 统计学分析
单因素分析应用Spearman秩相关分析、χ2检验,多因素分析应用二分类和多分类logistic回归分析。数据采用SPSS 17.0统计软件处理,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
514例IgA肾病患者男女比例1.06∶1。平均年龄(35.70±11.99)岁,平均病程(18.31±30.42)个月。占同期总肾活检病例的32.9%,占原发性肾小球疾病的47.7%。
2.2 临床类型分布
单纯血尿21例(4.1%);血尿伴蛋白尿210例(40.9%);伴高血压145例(28.2%);大量蛋白尿123例(23.9%);合并肾功能不全98例(19.1%);恶性高血压4例(0.1%)。
2.3 病理类型分布
牛津分型中,系膜细胞增生:M0 213例(42.4%),M1 301例(58.6%);内皮细胞增生:E0 378例(73.5%),E1 136例(26.5%);节段性硬化或粘连:S0 303例(58.9%),S1 211例(41.1%);肾小管萎缩或肾间质纤维化:T0 284例(55.2%),T1 152例(29.6%),T2 78例(15.2%)。
2.4 牛津分型在各种临床分型中的分布
单纯血尿患者牛津分型多为M0E0S0T0,T评分均为T0;大量蛋白尿分型中评分多为M1E0S1T1,T组评分T0、T1、T2比例较为相近;合并肾功能不全者除内皮细胞病变外,病理分型较其他临床类型更为严重,多为M1E0S1T2。见表1。

表1 各种临床分型IgA肾病患者牛津分型情况[n(%)]Tab.1Characteristics of Oxford classification in patients with IgA nephropathy[n(%)]
2.5 牛津分型系膜细胞增生病变(M)与临床指标的关系
CKD肾功能分期、24 h尿蛋白定量、尿微量白蛋白、尿转铁蛋白和尿IgG水平与M病变呈正相关;血清白蛋白、C3、血小板与其呈负相关。见表2。
多因素分析结果表明24 h尿蛋白定量和血小板增高可能是引起M病变的危险因素,见表3。
将24 h尿蛋白定量分为3个层次:24 h尿蛋白定量<1.0 g的患者M1和M2病变的比例大致相同,24 h尿蛋白定量1.0 g~<3.5 g和≥3.5 g的患者以M1病变为主,分别占60.4%和67.5%。见表4。

表2 系膜细胞增生病变(M)与临床指标的单因素分析Tab.2Single factor analysis between mesangial hypercellularity(M)and clinical indicators

表3 系膜细胞增生病变(M)与临床指标的多因素分析Tab.3Multiple⁃factors analysis between mesangial hypercellularity(M)and clinical indicators
2.6 牛津分型内皮细胞增生病变(E)与临床指标的关系
年龄、收缩压、尿红细胞计数、24 h蛋白定量、尿微量白蛋白、尿转铁蛋白和尿IgG水平与E病变呈正相关;病程、血清白蛋白与其呈负相关,见表5。
多因素分析结果显示,年龄大、病程长可能是引起E病变的危险因素,见表6。
将年龄分为3个层次:18~35岁和>35~60岁以E0病变为主,分别占77.7%和71.7%,而>60~70岁的患者以E1病变为主,占73.3%。

表4 系膜细胞增生病变的分层分析[n(%)]Tab.4The stratification analysis of mesangial hypercellularity[n(%)]
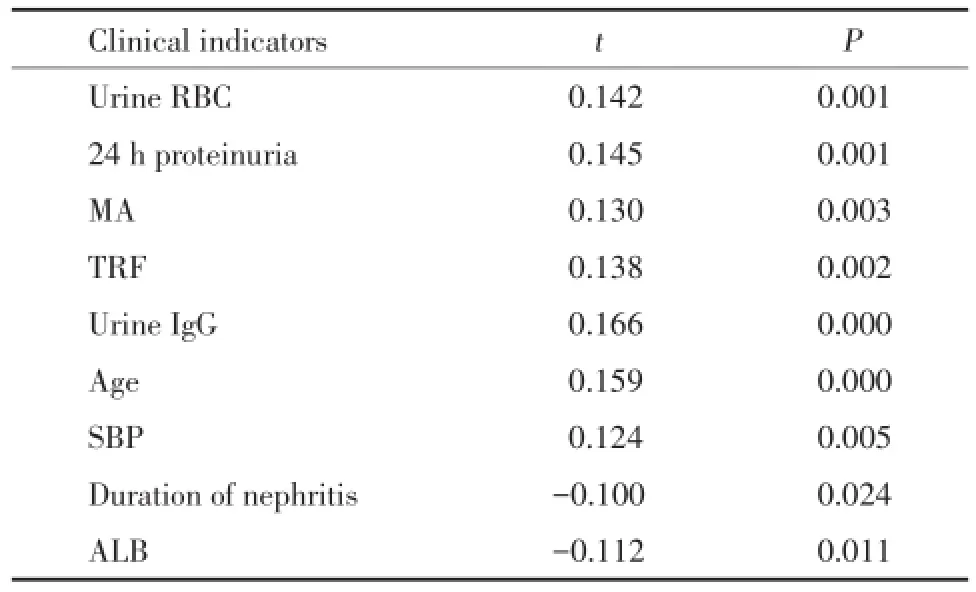
表5 内皮细胞增生病变(E)与临床指标的单因素分析Tab.5Single factor analysis between endocapillary prolifera⁃tion(E)and clinical indicators
2.7 牛津分型节段性硬化或粘连(S)与临床指标的关系
CKD肾功能分期、收缩压、24 h尿蛋白定量与S病变呈正相关,见表8。多因素分析未得出与其相关的危险因素。
2.8 牛津分型肾小管萎缩或间质纤维化(T)与临床指标的关系
年龄、CKD肾功能分期、收缩压、舒张压、C4、甘油三酯、低密度脂蛋白、总胆固醇、C反应蛋白、血清纤维蛋白原、血尿酸、血胱抑素⁃C、24 h尿蛋白定量、尿β2微球蛋白、尿微量白蛋白、尿转铁蛋白、尿IgG与T病变(T0/T1、T2)呈正相关,血红蛋白、血清白蛋白、血IgG与其呈负相关。性别、反复肉眼血尿病史、HDL⁃C、IgA、IgM、IgA/C3、尿α1⁃MG与牛津分型中4种主要病变无相关关系。见表9。

表6 内皮细胞增生病变(E)与临床指标的多因素分析Tab.6Multiple⁃factors analysis of the correlation between endocapillary proliferation(E)and clinical indicators

表7 内皮细胞增生病变(E)的分层分析[n(%)]Tab.7The stratification analysis of endocapillary proliferation(E)[n(%)]

表8 节段性硬化或粘连(S)与临床指标的单因素分析Tab.8Single factor analysis between segmental sclerosis or adhesion(S)and clinical indicators
多因素分析显示,将T组按T0和T1(T1+T2)分组后,得出增龄、CKD肾功能分期可能是引起T病变的危险因素,血红蛋白可能是保护因素(表10)。将T组按T0、T1、T2分组,得出前驱感染史、舒张压≥90 mmHg、低白蛋白血症、高低密度脂蛋白血症、贫血、高C反应蛋白水平是其加重的影响因素(表11)。
3 讨论
IgA肾病是我国尿毒症患者的主要原发病,只能依靠病理学检查确诊,迫切需要可准确全面评估肾脏病理情况的病理分型。牛津分型虽然在一定程度上弥补了之前分型的共同缺点,但也有局限性,其有效性还需要在不同人群进一步验证。

表9 肾小管萎缩或间质纤维化与临床指标的单因素分析Tab.9Single factor analysis between tubular atrophy/interstitial fibrosis and clinical indicators
目前文献[3⁃5]报道支持肾小管萎缩或间质纤维化可独立预测IgA肾病患者的预后,但对于内皮细胞增生、系膜细胞增生和节段性硬化或粘连是否可预测IgA肾病患者的预后意见并不统一。
牛津分型与临床指标关系的研究[7⁃11]显示:单纯血尿和尿蛋白定量为系膜细胞增生的危险因素:高龄、高血压和降低的eGFR为节段性硬化或粘连的危险因素;升高的尿蛋白、高血压、高尿酸血症、高血和尿胱抑素C以及降低的eGFR是肾小管萎缩或间质纤维化的危险因素[22⁃25],而血红蛋白是其保护因素。高尿酸血症、高血压合并高尿素血症时可加重节段性硬化或粘连和肾小管萎缩或间质纤维化的病变程度[1,9,22⁃25]。血清IgA/C3比值越高,肾小球硬化、肾间质炎性细胞浸润、肾间质纤维化、肾小管萎缩越重[12]。此外,未透析患者的血清C反应蛋白增高程度越大,肌酐清除率越低[13⁃14],年龄(≥60岁)、蛋白尿、eGFR降低、扁桃体切除史可独立预测肾功能丧失,评估eGFR的下降速度[20⁃21]。纤维蛋白原在肾小球沉积参与了IgA肾病的临床病理过程,具有一定的致病作用,相比无纤维蛋白原沉积组,有纤维蛋白原沉积组的血浆纤维蛋白原升高[15]。
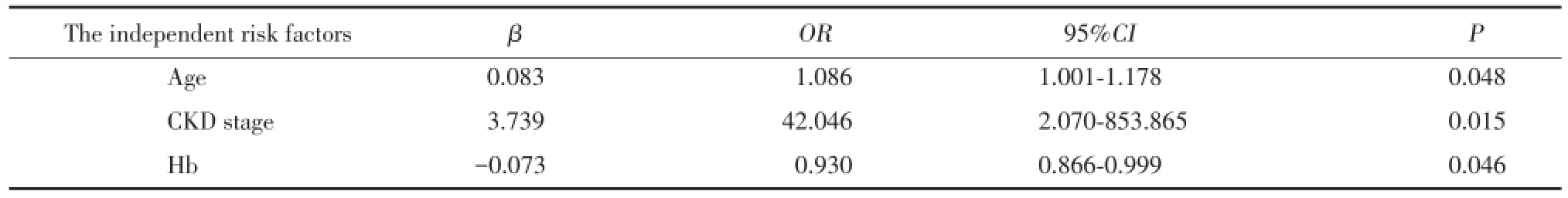
表10 肾小管萎缩或间质纤维化(T)的危险因素分析Tab.10The independent risk factors analysis of tubular atrophy/interstitial fibrosis(T)

表11 肾小管萎缩或间质纤维化(T)的影响性因素Tab.11The influence factors of tubular atrophy/interstitial fibrosis(T)
既往本课题组Lee分级的相关危险因素研究[17⁃19]提示24 h尿蛋白定量增高及年龄大,CKD肾功能分期、贫血、高甘油三酯血症、低蛋白血症、高低密度脂蛋白血症重,有前驱感染史、舒张压≥90 mmHg,均可加重肾脏病理损害。不同的是血小板与Lee分级的严重程度无相关性,但本研究提示血小板增高是系膜细胞增生的独立危险因素,入选患者已除外血液系统疾病,且无脾切除病史,考虑血小板增高为原发性血小板增高,血小板功能异常、炎性细胞浸润、肾小球毛细血管微血栓都可加重系膜细胞增殖、损伤,应用抗血小板聚集药物可减少尿蛋白;Lee分级重的独立危险因素中不包括血清C反应蛋白,但本研究提示高C反应蛋白可影响肾小管或间质纤维化病变程度。
在该研究过程中,根据查阅的既往本课题组的研究及相关文献结果,逐步纳入共30项临床指标,根据统计方法的应用条件,样本含量至少为自变量的5~10倍,为避免由于样本含量不足及部分病例中少量自变量数值缺失影响统计结果,故将样本量逐步扩大至目前例数。本研究病例中,临床表现以血尿伴蛋白尿型为主,其次是伴高血压型、大量蛋白尿型、合并肾功能不全型、单纯血尿型、恶性高血压型。一部分患者因无明显症状,于体检中发现异常才就诊,还有部分患者已知尿检异常,但因对本病了解甚少且不够重视,拖延诊治时间,肾活检时病理损伤较重已为不可逆性病变。建议定期行尿检,以便尽早发现肾脏疾病,如怀疑本病者应积极行肾活检确诊,尽早进行正规治疗。
[1]WORKING GROUP OF THE INTERNATIONAL IgA NEPHROPA⁃THY NETWORK AND THE RENAL PATHOLOGY SOCIETY,CATTRAN DC,COPPO R,et al.The Oxford classification of IgA ne⁃phropathy:rationale,clinicopathological correlations,and classifica⁃tion[J].Kidney Int,2009,76(5):534-545.DOI:10.1038/ ki.2009.243.
[2]WORKING GROUP OF THE INTERNATIONAL IgA NEPHROPA⁃THY NETWORK AND THE RENAL PATHOLOGY SOCIETY,ROBERTS ISD,COOK HT,et al.The Oxford classification of IgA nephropathy:pathology definitions,correlations,and reproducibility[J].Kidney Int,2009,76(5):546-556.DOI:10.1038/ki.2009.168.
[3]ZENG CH,LE W,NI Z,et al.A multicenter application and evalua⁃tion of the oxford classification of IgA nephropathy in adult Chinese patients[J].Am J Kidney Dis,2012,60(5):812-820.DOI:10.1053/j.ajkd.2012.06.011.
[4]LEE H,YI SH,SEO MS,et al.Validation of the Oxford classifica⁃tion of IgA nephropathy:a single⁃center study in Korean adults[J]. Korean J Intern Med,2012,27(3):293-300.DOI:10.3904/ kjim.2012.27.3.293.
[5]师素芳,张宏.对于IgA肾病牛津病理分型验证现状的分析[J].中华肾脏病杂志,2012,28(3):167-169.
[6]COPPO R,TROYANOV S,BELLUR S,et al.Validation of the Ox⁃ford classification of IgA nephropathy in cohorts with different pre⁃sentations and treatments[J].Kidney Int,2014,86(4):828-836. DOI:10.1038/ki.2014.63.
[7]陶水兴,赵久阳,尹永红.IgA肾病的临床与病理联系[J].大连医科大学学报,2006,28(5):400-401.DOI:10.3969/j.issn.1671⁃7295.2006.05.017.
[8]伍巧源,李洁,黄莉,等.IgA肾病不同年龄组临床与病理特点分析[J].实用医学杂志,2010,26(18):3374-3376.
[9]李申恒,史伟,夏运风,等.尿酸升高IgA肾病临床病理特征变化的比较分析[J].南方医科大学学报,2010,30(1):133-136.
[10]向莉,周华,李旻,等.胱抑素C评估IgA肾病患者肾纤维化程度及早期肾损害的价值[J].江苏医药,2012,38(16):1899-1901.
[11]何婷,毛海萍,李志斌,等.贫血加重IgA肾病患者的临床和病理改变[J].中华肾脏病杂志,2012,28(6):460-463.DOI:10.3760/cma.j.issn.1001⁃7097.2012.06.008.
[12]ZHANG J,WANG C,TANG Y,et al.Serum immunoglobulin A/C3 ratio predicts progression of immunoglobulin A nephropathy[J]. Nephrology(Carlton),2013,18(2):125-131.DOI:10.1111/ nep.12010.
[13]孙艳霞,康天,王新良.超敏C⁃反应蛋白在小儿原发性肾病综合征中的临床意义[J].河北医药,2010,32(21):3060-3061.
[14]洪丽萍,周晓玲,陈孟华.慢性肾脏病非透析患者微炎症状态分析[J].宁夏医科大学学报,2010,32(3):348-351.
[15]汤颖,马小琨,张俊,等.血清IgA、C3及IgA/C3与IgA肾病诊断及病理分级的关系[J].中华全科医学,2010,8(1):17-19.
[16]王惠英,严海燕,韩艳平,等.IgA肾病患者肾小球内纤维蛋白原沉积的意义[J].中国热带医学,2008,8(11):1960-1962.DOI:10.3969/j.issn.1009⁃9727.2008.11.045.
[17]赵洁,范秋灵,刘楠,等.IgA肾病Lee分级的危险因素分析[J].中国医科大学学报,2010,39(7):570-571,578.
[18]赵洁,范秋灵,刘楠,等.IgA肾病3种病理分级的比较及与临床指标的相关性分析[J].中国实用内科杂志,2010,30(10):910-912.
[19]MORIYAMA T,NAKAYAMA K,IWASAKI C,et al.Severity of ne⁃phrotic IgA nephropathy according to the Oxford classification[J]. Int Urol Nephrol,2012,44(4):1177-1184.DOI:10.1007/s11255⁃011⁃0109⁃5.
[20]陶军,靳亚非,王礼春,等.年龄对血管弹性和内皮细胞功能的影响[J].中华心血管病杂志,2003,31(4):250-253.DOI:10.3760/j:issn:0253⁃3758.2003.04.004.
[21]OSHIMA Y,MORIYAMA T,ITABASHI M,et al.Characteristics of IgA nephropathy in advanced⁃age patients[J].Int Urol Nephrol,2015,47(1):137-145.DOI:10.1007/s11255⁃014⁃0872⁃1.
[22]RAFALSKA A,FRANCZUK J,FRANCZUK P,et al.Stratifying risk for progression in IgA nephropathy:how to predict the future[J].Pol Arch Med Wewn,2014,124(7⁃8):365-372.
[23]SEDAGHAT S,HOORN EJ,VAN ROOIJ FJ,et al.Serum uric ac⁃id and chronic kidney disease:the role of hypertension[J].PLoS ONE,2013,8(11):e76827.DOI:10.1371/journal.pone.0076827.
[24]刘擘,徐安平,曾玉纯,等.血尿酸水平与IgA肾病患者临床及病理的关系[J].广东医学,2015,36(13):2068-2070.
[25]ZHOU J,CHEN Y,LIU Y,et al.Plasma uric acid level indicates tubular interstitial leisions at early stage of IgA nephropathy[J]. BMC Nephrol,2014,15:11.DOI:10.1186/1471⁃2369⁃15⁃11.
(编辑王又冬)
Risk Factors and Correlation Analysis between the Oxford Classification and Clinical Indicators of IgA Nephropathy
LI Sali1,2,FAN Qiuling1,ZHAO Jie1,LIU Nan1,WANG Xi1,JIANG Yi1,WANG Lining1
(1.Department of Nephrology,The First Hospital,China Medical University,Shenyang 110001,China;2.Department of Nephrology,The Second Affiliated Hospital of Shenyang Medical College,Shenyang 110002,China)
ObjectiveTo analyze the risk factors and correlation between clinical indicators and the four main pathological lesions of IgA ne⁃phropathyintheOxfordclassification:mesangialhypercellularity(M0/1),endocapillaryproliferation(E0/1),segmentalsclerosisoradhesion(S0/1),and tubular atrophy/interstitial fibrosis(T0/1/2).MethodsClinical and pathological data were collected from 514 patients with biopsy⁃proven IgA nephropathy admitted in our hospital from February 17,2006 to October 11,2011.These patients were all above 18 years old.Cases with sec⁃ondary causes of mesangial IgA deposition were excluded,such as Henoch⁃chonlein purpura,ankylosing spondylitis and psoriasis et al.The inde⁃pendent risk factors affecting the pathological classification were analyzed by Spearman rank correlation analysis and two⁃category and multi⁃classi⁃fication logistic regression using SPSS 17.0 statistical software.ResultsIn 514 IgAN patients,the ratio of males to females was 1.06∶1.The aver⁃age age was 35.70±11.99 years,and the average disease duration was 18.31±30.42 months.M0E0S0T0 was the major pathologic classification of isolated hematuria.Chronic kidney disease(CKD)stage,24 hours proteinuria,albuminuria,urine transferrin and IgG levels were positively corre⁃lated with M lesion;serum albumin,C3 and PLT showed a negative correlation with M lesion.Twenty four hours proteinuria and blood platelet count were the independent risk factors for M lesion.As shown by stratified analysis,the proportion of M1 in cases with 24 hours proteinuria≥3.5 g/ d is much higher than that in cases with non⁃nephrotic range proteinuria.Age,systolic blood pressure,uRBC,24 hours proteinuria,albuminuria urine transferrin and IgG levels were positively correlated with E lesion,Duration,serum albumin showed a negative correlation with E lesion.Age and duration of nephritis were independent risk factors for E lesion.73.3%of patients that above 60 years old showed endothelial proliferation. CKD stage,24 hours proteinuria were positively correlated with S lesion.Age,CKD stage,systolic blood pressure,diastolic blood pressure,C4,TC,LDL⁃C,CRP,Fib,UA,Cys⁃C and 24 hours proteinuria,urine β2⁃microglobulin,albumin,transferrin and IgG levels were positively associated with T lesion;hemoglobin,serum albumin,serum IgG showed a negative correlation with T lesion.Infection history,high CRP levels,DBP more than 90 mmHg,hypoalbuminemia,high low density lipoproteinemia,and anemia were independent risk factors for T lesion.ConclusionTwenty four hours proteinuria,blood platelet count,age,duration of nephritis,hypoalbuminemia,anemia,hyperlipidemia,DBP≥90 mmHg and high CRP lev⁃els were risk factors for the Oxford classification of IgA nephropathy.Renal biopsy should be carried out in time to make clear the pathological clas⁃sification and individual treatment,so as to improve the prognosis.
IgA nephropathy;Oxford classification;clinical indicators;risk factor;correlation
R692.6
A
0258-4646(2017)01-0001-06
10.12007/j.issn.0258⁃4646.2017.01.001
国家自然科学基金(81270808);辽宁省高等学校重大科技平台免疫皮肤病学重点实验室自主创新课题(201303);沈阳市科技计划(F16⁃205⁃1⁃40)
李卅立(1985-),女,医师,硕士研究生.
范秋灵,E-mail:cmufql@163.com
2016-04-20
网络出版时间:

