38例结节病诊断方法分析并文献复习
黄靓雯 周敏 周剑平 陈巍 项轶 孙蕴伟
38例结节病诊断方法分析并文献复习
黄靓雯1周敏1周剑平1陈巍1项轶1孙蕴伟2
目的 探讨结节病不同诊断方法的临床价值,以提高诊断水平。方法 回顾性分析瑞金医院呼吸内科2011年5月-2016年6月确诊的38例结节病病人资料,并进行文献复习。结果 临床症状无特异性,影像学对诊断有一定辅助。38例病人中病理或细胞学证实结节病者27例(71%),病理未明确但临床治疗后回顾性诊断11例,2/11例患者经眼科会诊后发现眼底典型结节病表现。EBUS-TBNA阳性结果3例,EBUS-TBNA联合纤支镜其他标本获取手段(BALF+EBB+TBB)阳性结果4例, EBUS-TBNA联合EUS-FNA阳性结果3例。结论 结节病的诊断需要综合分析患者的临床资料,而EBUS-TBNA联合EUS-FNA的临床应用前景较有优势,但目前尚无足够的临床数据能对此做出有力的证明。
结节病;PET/CT;EBUS-TBNA;EUS-FNA
结节病是一种可累及多器官的肉芽肿性疾病。但从结节病1877年被发现以来,其病因一直未明,同时由于结节病患者发病症状因人而异,通过临床表现诊断结节病相对困难[1]。结节病在亚洲人群中发病率较低[2-3],瑞金医院呼吸内科2011.5-2016.6共确诊结节病38例,其中病理确诊27例,病理未明确但临床治疗后回顾性诊断11例。现回顾性分析结节病各诊断方法的临床价值并文献复习。
资料与方法
一、一般资料
2011年5月至2016年6月至我院出院诊断为结节病患者共38例,其中男性14例,年龄78-22岁,中位年龄40岁;女24例,年龄70-30岁,中位年龄50岁。
二、临床表现
38例中无明显症状7例,胸片或胸部CT发现肺内异常;咳嗽14例;发热7例;胸闷、胸痛14例;体重明显下降5例;视物模糊2例;查体皮肤红斑2例,皮肤结节2例;浅表淋巴结肿大6例,所有患者肺部听诊及心脏体检均未及异常。
三、影像学检查
所有病人都曾在当地或我院行影像学检查。14/38例曾在外院行胸片检查,其中3例未见肺内结节或纵隔肿物等结节病典型胸片特点,I期4例,Ⅱ期5例,Ⅲ期2例。 入我院行胸部CT检查后,提示纵隔淋巴结肿大8例,纵隔淋巴结肿大伴肺内结节24例,仅可见肺内结节1例。另有1例胸部CT提示肺部炎症改变,考虑间质性肺炎,1例发现肺内结节伴钙化。腹部CT发现腹腔多发淋巴结肿大2例。4例曾在外院或我院行HRCT,1例未行常规胸片或胸部CT直接行HRCT显示纵隔及双肺门淋巴结增大及肺内小结节,2例显示与常规胸部CT特征同,余1例除CT见肿大纵隔淋巴结外另见肺内多发小结节。15例经PET/CT发现淋巴结高代谢灶,其中4例于病理或细胞学活检阴性后进一步行PET/CT发现肺外多发高代谢淋巴结。
四、病理或细胞学诊断情况
38例病人经内科有创操作及外科手术均取得病理或细胞活检,其中病理或细胞学证实结节病者27例(71%),病理未明确但临床治疗后回顾性诊断11例。35/38例患者经纤维支气管镜不同取材方法(见表1)。所有患者支气管腔均通畅,其中7例患者支气管表面可见小结节样改变,6例患者有支气管管腔狭窄表现。
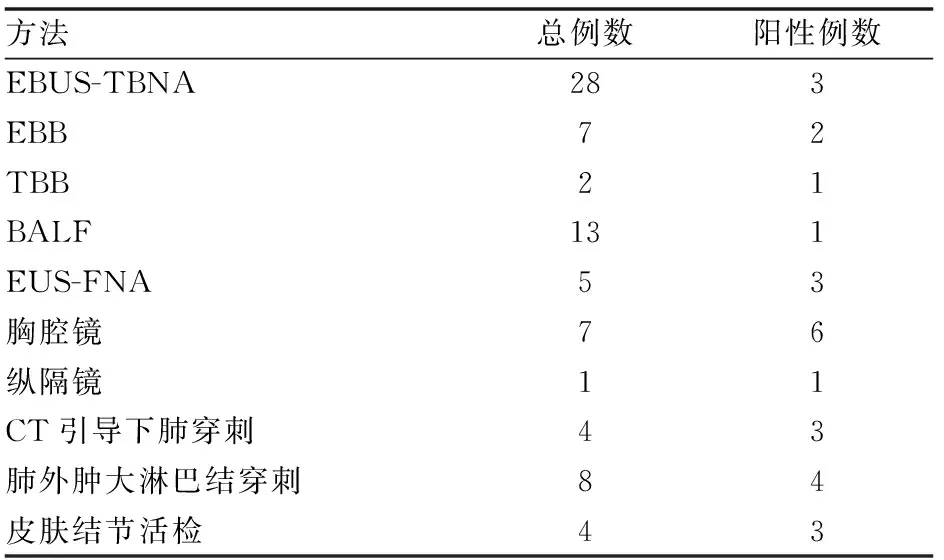
表1 38例结节病患者的病理或细胞学诊断情况
讨 论
一、临床表现
结节病的临床表现缺乏特异性,主要有乏力、关节痛、体重下降、发热、咳嗽等,且其很大程度上受性别、人种、年龄影响,这也是结节病与其他疾病鉴别诊断的难点。同时,具有Lofgren’s综合征(双侧肺门淋巴结肿大、急性关节痛、葡萄膜炎、结节性红斑)或Heerfordt’s 综合征(慢性发热、腮腺肿胀、葡萄膜炎、贝尔氏麻痹)的患者极少,我国仅有报道1例Heerfordt’s 综合征患者[4]。但经过长期的临床调研,一些临床表现可间接支持结节病的诊断,如20-39岁及65-69岁的女性、症状隐匿、多系统受累;而有吸烟史及金属及微生物抗原暴露史、反复感染、肺部听诊异常、单器官受累、恶性肿瘤个人史、IBD或有免疫缺陷患者结节病发生概率低[5]。本组38例患者临床资料分析后其临床症状各异且不典型,而累及肺外病变共13例,其中仅有2例有视物模糊症状,经眼科会诊后发现眼底典型结节病表现;4例有皮肤受累,其中3例活检后病理明确。
二、病理诊断及特征
活检组织学示非凝固性坏死上皮样细胞肉芽肿可明确诊断结节病。目前病理活检诊断结节病越来越倾向小创伤,同时纵隔镜对于前后纵隔及主动脉旁肺窗的淋巴结组织采样较困难,这也一定程度上限制了纵隔镜的应用[6]。支气管内病灶活检(EBB)也是传统获取结节病病理学常用方法,但文献报道其诊断阳性率仅有50%左右[7]。我们经纤支镜观察的35例患者中有气管内黏膜病变者仅7/35例,例数较少,取黏膜活检后仅有2例有典型结节病病理结果。
最近几年,经气管镜超声引导针吸活检术(EBUS-TBNA)在纵隔淋巴结肿大的病人中的应用逐渐提升,众多临床数据均表明这一技术具有很高的灵敏度(>84%)及特异度(绝大多数100%)[8-11]。本组38例最终诊断为结节病的患者中,最终得到阳性病理结果的共27例,其中作为目前主要诊断纵隔淋巴结肿大的EBUS-TBNA方法,仅发现11%(3/28)阳性结果明显低于研究报道的数据,其可能原因:① 本组患者穿刺点主要为7组隆突下淋巴结和气管,但其超声显示纵隔多发淋巴结肿大,因此穿刺时选取淋巴结数目不足。② 使用的穿刺针较细,难以获得典型的上皮样肉芽肿组织标本。③ 非凝固性坏死上皮样细胞肉芽肿病理结果不典型,或者患者淋巴结未受累。
超声胃镜引导下细针穿刺(EUS-FNA)对于纵隔肿物组织活检具有很高的临床意义。EBUS-TBNA对于第5、6、8、9组胸部淋巴结组穿刺成功率低,需要借助EUS-FNA,同时EUS相比EBUS来说病人更易耐受。在Michael B. Wallace等人的试验数据中,甚至得到EUS-FNA敏感性高于EBUS-TBNA的结果,但总体而言,对于两者皆可的淋巴结活检,EBUS-TBNA的检出率高于EUS-FNA[12],而联合应用EUS-FNA与EBUS-TBNA较单用任一技术诊断的敏感性可提高[6],但对于主支气管和段支气管之前的淋巴结EBUS-TBNA检出率更高;而对于纵隔下部的淋巴结更适宜使用EUS-FNA[13]。本组28例行EBUS-TBNA患者中,联合EUS-FNA多发现3例结节病患者,此3例多项检查均表明结节病迹象而EBUS-TBNA结果为阴性后再行EUS-FNA结果阳性。通过更多病人的临床数据收集EUS-FNA对于纵隔肿物活检的临床意义可能得以更好地体现。支气管镜置入食管进行超声引导下经食管针吸活检技术(EUS-B-FNA)的诞生使EUS-FNA与EBUS-TBNA都能更好地应用于临床。Bin Hwangbo实验组通过150个病人的临床数据证明EUS-B-FNA可以将活检率从EBUS-TBNA的78.6%增至84.8%[14];Felix J.F.等人[15]发现同时用支气管镜代替胃镜行EUS-FNA(EUS-B-FNA),其与EBUS-TBNA联合应用活检纵隔肿大淋巴结的敏感性及阴性预测值均可达95%以上,如此患者可以省去同时购买两套设备检查的费用,其安全性及有效性也有保证。但是由于支气管镜与胃镜的结构不同,其应用也有局限之处。支气管镜的长度不能到达检查左肾上腺和左肝的区域,同时EUS原本能检查到的第3组淋巴结组及主动脉肺窗的淋巴结组在此方法下也不能检查。
有时结节病肉芽肿结节会形成玻璃样变或周围组织会出现纤维化,甚至中心部位的组织也会有凝固性坏死[16],使非典型结节病病理与结核、肺炎等难以区分。在收集本组结节病患者资料的过程中,也发现有一部分患者的病理结果仅显示肉芽肿性改变或是炎性细胞浸润,其中3例有少量异型细胞予以免疫组化排除恶性可能。考虑到患者既往无结核分枝杆菌等病源接触,结合临床表现、检验结果及影像学特点,一般排除特殊病原体感染所引起的肉芽肿性病变[17]。
三、细胞学诊断及特征

四、影像学诊断要点
影像学的作用主要是为了辅助病理和细胞学诊断,如果组织和细胞分析均不能明确诊断结节病,就需要更清晰的影像学证据。90%结节病患者均有肺内病变征象[16],但鲜有患者具有双侧肺门对称性淋巴结肿大的结节病胸部典型CT表现,同时结节病的肉芽肿结节往往分布在淋巴管的小间隙中,因此若患者常规胸片或CT未发现异常,HRCT可能可以发现微小结节或在淋巴管旁支气管血管处见相对薄弱的肺泡薄壁组织[22],本组5例行HRCT患者均发现纵隔及双肺门淋巴结增大及肺内微小结节。另18F-FDG PET/CT对于摄取活跃的病灶的敏感度可达97%以上,需与转移淋巴结、其他炎性肿大淋巴结区分。肺部淋巴结受累需与恶性肿瘤和肺炎鉴别,除常用的血清学相关指标和炎性浸润灶、毛刺征等典型影像学特点鉴别外,恶性肿瘤的肺内肿大淋巴结多沿右支气管分布,且第10-14组淋巴结多不受累;而肺炎累及的淋巴结的SUV值由外周向中央部淋巴引流区呈外高内低分布与结节病相反[23]。若结节病患者病变累及全身,鉴别诊断时尤其要考虑淋巴瘤,其PET/CT特征主要区别在于:①与活动期结节病受累淋巴结相比,淋巴瘤的淋巴结SUV值较低(一般不高于10);②淋巴瘤受累淋巴结多融合,结节病淋巴结多孤立,且不沿淋巴引流分布,肺叶受累少见[24]。若仍难以鉴别可通过骨穿明确,此外PET/CT可以显示隐匿的高代谢病灶或明确定位。本组患者中有1例患者EBUS结果阴性,PET/CT示全身多处淋巴结高代谢灶,HRCT发现CT示纵隔肿大淋巴结外的肺内多发小结节,综合考虑为结节病,激素治疗后病情明显好转。另有5例PET/CT发现颈部或锁骨上淋巴结高代谢灶,予以淋巴结活检4例示阳性结果,而未行PET/CT者3例肿大锁骨上淋巴结穿刺结果为阴性。临床有条件行PET/CT者建议先行检查后取活检,阳性率更高。
综上所述,结节病诊断需要综合临床表现、影像学、病理活检,并排除其他可造成类似影像学特点的疾病等一系列复杂的诊断流程。同时,仅累及皮肤、肝脏、黏膜的肉芽肿性病变不能作为结节病的充分证据[16]。结节病非特异性的临床表现和同时累及多器官的特点,使得在结节病诊断时均不能做出迅速的判断。所幸越来越多先进的技术的诞生使确诊所需病理结果获取途径大大增加,一定程度上降低了结节病诊断的困难度,但最终确诊率仍有待提高。EBUS-TBNA联合EUS-FNA对于结节病活检范围的扩大和临床检出率的提高均有较大的帮助,尽管其临床应用价值初步体现,但目前仍缺乏足够强有力的数据。
[1] Nagai S, Izumi T. Pulmonary sarcoidosis: population differences and pathophysiology[J]. South Med J, 1995, 88(10):1001-1010.
[2] Iwai, K, et al, Racial difference in cardiac sarcoidosis incidence observed at autopsy[J]. Sarcoidosis, 1994. 11(1): 26-31.
[3] James D G. Sarcoidosis and Other Granulomatous Disorders[J]. Postgr Med J, 1988, 64(755):729.
[4] 李勇, 胡怡芳, 杨巧玲. Heerfordt综合征1例[J]. 宁夏医学杂志, 1999,(3).
[5] Culver, D.A, Diagnosing sarcoidosis[J]. Curr Opin Pulm Med, 2015. 21(5):499-509.
[6] Ruifeng Z, Kejing Y, Liuhong S, et al. Combined endobronchial and endoscopic ultrasound-guided fine needle aspiration for mediastinal lymph node staging of lung cancer: a meta-analysis[J]. Eur J Cancer, 2013, 49(8):1860-1867.
[7] Dziedzic DA, Peryt A, Orlowski T. The role of EBUS-TBNA and standard bronchoscopic modalities in the diagnosis of sarcoidosis[J]. Clin Respir J, 2017,11(1):58-63.
[8] Groth S S, Andrade R S. Endobronchial Ultrasound-Guided Transbronchial Needle Aspiration for MediastinalLymph Node Staging in Non-Small Cell Lung Cancer[J]. Sem Thor Card Surg, 2008,20(4): 274-278.
[9] Wong M, Yasufuku K, Nakajima T, et al. Endobronchial ultrasound: New insight for the diagnosis of sarcoidosis[J]. Eur Resp J, 2007, 29(6):1182-1186.
[10] Garwood S, Judson M A, Silvestri G, et al. Endobronchial Ultrasound for the Diagnosis of PulmonarySarcoidosis[J]. Chest, 2007, 132(4): 1298-1304.
[11] Tremblay A, Stather D R, Maceachern P, et al. A randomized controlled trial of standard vs endobronchial ultrasonography-guided transbronchial needle aspiration in patients with suspected sarcoidosis[J]. Chest, 2009, 136(2):340-346.
[12] Wallace MB, Pascual JM, Raimondo M, et al. Minimally invasive endoscopic staging of suspected lung cancer[J]. Jam J Am Med Assoc, 2008, 299(5):540-546.
[13] Vilmann P, Krasnik M, Larsen S S, et al. Transesophageal Endoscopic Ultrasound-Guided Fine-Needle Aspiration(EUS-FNA) and Endobronchial Ultrasound-Guided Transbronchial Needle Aspiration (EBUS-TBNA) Biopsy: aCombined Approach in the Evaluation of Mediastinal Lesions[J]. Endoscopy, 2005, 37(9): 833-839.
[14] Hwangbo B, Lee GKLee H S, Lim K Y, et al. Transbronchial and transesophageal fine-needle aspiration using an ultrasound bronchoscope in mediastinal staging of potentially operable lung cancer[J]. Chest, 2010, 138(4):795-802.
[15] Herth F J F, Krasnik M, Kahn N, et al. Combined endoscopic-endobronchial ultrasound-guided fine[J]. Chest, 2010, 138(4):790-794.
[16] Costabel U, Hunninghake GW. ATS/ERS/WASOG statement on sarcoidosis. Sarcoidosis Statement Committee. American Thoracic Society. European Respiratory Society. World Association for Sarcoidosis and Other Granulomatous Disorders[J]. Eur Respir J, 1999, 14(4): 735-737.
[17] 赵军,林心情,胡婷,等.结节病与肺结核的临床病理分析[J].临床肺科杂志, 2016,21(1):7-10.
[18] Costabel U. Sensitivity and specificity of BAL findings in sarcoidosis[J]. Sarcoidosis, 1992, 9(Suppl 1):211-214.
[19] Clinical guidelines and indications for bronchoalveolar lavage (BAL): Report of the European Society of Pneumology Task Group on BAL[J]. Eur Respir J, 1990, 3(8): 937-976.
[21] Danila, E, et al, Diagnostic role of BAL fluid CD4/CD8 ratio in different radiographic and clinical forms of pulmonary sarcoidosis[J]. Clin Respir J, 2009. 3(4): 214-221.
[22] Rossi, G, A. Cavazza, and T.V. Colby, Pathology of Sarcoidosis[J]. Clin Rev Allergy Immunol, 2015. 49(1): 36-44.
[23] Jolepalem, P, K.Z. McLean, and C.Y. Wong, Atypical Presentation of Sarcoidosis on 18F-FDG PET/CT[J]. J Nucl Med Technol, 2014. 42(2): 114-115.
[24] 关志伟,姚树林,王瑞民,等.22例结节病18F-FDG PET /CT影像学特征分析[J].中华核医学杂志,2011,31(5):334-338.
37 cases of sarcoidosis report on diagnosis method and literature review
HUANGJing-wen,ZHOUMin,ZHOUJian-ping,CHENWei,XIANGYi,SUNYun-wei
ShanghaiJiaotongUniversitySchoolofMedicine,Shanghai200025,China
Objective To study the clinical value of various diagnosis Methods in order to improve diagnosing sarcoidosis. Methods A retrospective analysis was conducted on 38 sarcoidosis patients in Respiratory Department of Ruijin Hospital from May 2011 to June 2016 and their relevant literature was reviewed. Results There was no special symptoms of sarcoidosis. Chest image screening was helpful at some degree. All 38 patients got successfully pathological biopsied samples, with a confirmed result in 27 cases (71%). Among 11 patients of negative pathological results, 2 cases were confirmed after ophthalmic consultation. In the above 27 patients, 3 positive results were obtained by EBUS-TBNA, 4 positive results obtained by EBUS-TBNA combined with bronchoscopy (BALT+EBB+TBB), and 3 positive results obtained by EBUS-TBNA combined with EUS-FNA. Conclusion All the patients' clinical data should be analyzed to diagnose sarcoidosis. By combining EBUS-TBNA with EUS-FNA, more diagnosis can be made. However, a significant demonstration needs more clinical statistics.
sarcoidosis; PET/CT; EBUS-TBNA; EUS-FNA
10.3969/j.issn.1009-6663.2017.05.020
200025 上海,上海交通大学医学院附属瑞金医院 1.呼吸内科 2. 消化科
,周敏,E-mail:doctor_zhou_99@163.com
2016-08-15]

