体外人工感染的刺激隐核虫幼虫的电镜观察
沈 晨, 周旻曦, 周素明, 王国良
(宁波大学 应用海洋生物技术教育部重点实验室, 宁波 315211)
体外人工感染的刺激隐核虫幼虫的电镜观察
沈 晨, 周旻曦, 周素明, 王国良
(宁波大学 应用海洋生物技术教育部重点实验室, 宁波 315211)
通过透射和扫描电镜等研究刺激隐核虫幼虫阶段发育特征。从患病的大黄鱼上采集各个时期的包囊,体外感染传代培养收集幼虫,制成电镜样品,研究幼虫的超微结构。对不同时间段的脱包后幼虫的电镜和光镜观察发现,脱包后0~4 h的幼虫虫体,细胞结构比较完整,周身遍布体纤毛,于培养液中快速游动;8~16 h时,幼虫体纤毛逐渐减少,游动缓慢,细胞胞质稀薄,幼虫长径缩短;20~24 h时,体纤毛稀少,幼虫不运动沉底,细胞形状由泪滴形变为不规则并开始凋亡,虫体明显萎缩,长径仅10 μm左右。在不同时段的幼虫形态结构变化特征与感染活性丧失过程相关联,反映能量衰减可能是影响刺激隐核虫幼虫感染能力的主要原因。
刺激隐核虫;感染力;人工感染;超微结构
刺激隐核虫(Cryptocaryonirritans)又名海水小瓜虫,隶属于前口纲(Class Prostomatea),前管目(Order Proreodonisa),隐核虫科(Family Cryptocaryonidae)的隐核虫属(Genuscryptocaryon)[1]。最早被日本学者Sikama[2]研究报道。刺激隐核虫常寄生于海水硬骨鱼类体表的上皮组织中,导致白点病的发生[3]。一旦海产经济鱼类发病,就会对当地渔业经济造成重大损失[4]。
在刺激隐核虫超微结构研究方面,1981年Cheung[5]采用扫描电镜研究了刺激隐核虫的包囊以及滋养体,其中详实地描述了滋养体口器的观察,而未对幼虫阶段进行研究。徐润林等[6]和Xu等[7]分别研究了刺激隐核虫幼虫的口器和包囊壁结构的超微结构。Colorni和Diamont[8]对刺激隐核虫不同发育期虫体超微结构进行研究。Matthews[9]首次使用透射电镜对刺激隐核虫幼虫阶段进行描述。黄玮等[10]对人工感染的刺激隐核虫的皮层和口器进行详细地描述。上述文献虽对刺激隐核虫各阶段结构特点进行了研究,但未探讨幼虫24 h内失去感染力的原因。本实验参考但学明[11]以卵形鲳鲹(Trochintuovatus)为宿主建立的刺激隐核虫传代系统,稍加改进后选择养殖大黄鱼(Pseudosciaenacrocea)作为宿主。通过人工感染和传代的方法收集幼虫,对其进行较为系统地超微结构观察,以探索刺激隐核虫幼虫感染力丧失的原因,为驱杀该虫的时机和防治白点病提供科学依据。
1 材料和方法
1.1 虫体来源
大黄鱼样本分批采自宁波市象山养殖海区和福建省宁德养殖海区,并按照但学明[11]的方法选取患病大黄鱼。剪下鳃片,放入含过滤海水的培养皿中,用载玻片刮下滋养体,用吸管将长径大于400 μm的滋养体转移至9 cm培养皿中,加入25‰的灭菌海水,25℃黑暗中培育。
1.2 虫体的感染及不同时期幼虫的收集
待刺激隐核虫幼虫从包囊中孵出后,收集幼虫。以每尾鱼用大约20 000个幼虫,感染体重250 g左右的大黄鱼2 h,之后放入海水网箱中养殖。每天检查鱼体和鳃表面,待白点充分显现后,将鱼放到特制的收虫漏斗中暂养过夜。最后取下收虫漏斗下的收虫杯,即可从中收获大量的包囊。在包囊脱包后放出幼虫高峰期(即收集包囊后第3天的晚上),更换培养液,然后将收集的活跃幼虫同步分成若干份,分别在0、4、8、12、16、20和24 h用0.2%福尔马林杀死幼虫,于4000 r/min离心5 min 收集虫体。
1.3 透射电镜样品制备
用3 %戊二醛(0.1 mol/L磷酸缓冲液)固定幼虫1 h以上(4℃)。将样品用磷酸缓冲液洗涤2次,每次15 min。之后酒精逐级脱水,然后树脂包埋(幼虫包埋之前,需进行离心浓缩),超薄切片,再用柠檬酸铅和乙酸双氧铀染色。透射电镜下观察、拍照及记录。
1.4 扫描电镜样品制备
用3 %戊二醛(0.1 mol/L 磷酸缓冲液)固定幼虫1 h(4℃)。之后用酒精逐级脱水(每次脱水均需进行离心浓缩),临界点干燥,喷金。扫描电镜下观察、拍照及记录。
1.5 幼虫形态大小测量
分别取各时段幼虫10条,测量长径和短径,统计数值取平均值。
2 结果与分析
2.1 刺激隐核虫幼虫脱包后形态变化过程的显微及亚显微结构观察
幼虫在光镜下呈卵圆形或泪滴状,长径约50 μm,短径约20 μm,全身布满纤毛。脱包后0~4 h的幼虫虫体,在光镜下清晰可见随着周身纤毛的摆动,虫体于培养液中快速游动,此时幼虫感染力最强;脱包后8~16 h时,幼虫虫体纤毛逐渐减少,游动缓慢,感染力开始减弱;脱包后20~24 h,只有少部分虫体仍在运动,大部分幼虫沉于培养板底部,并可见周身纤毛大量减少,感染力丧失。
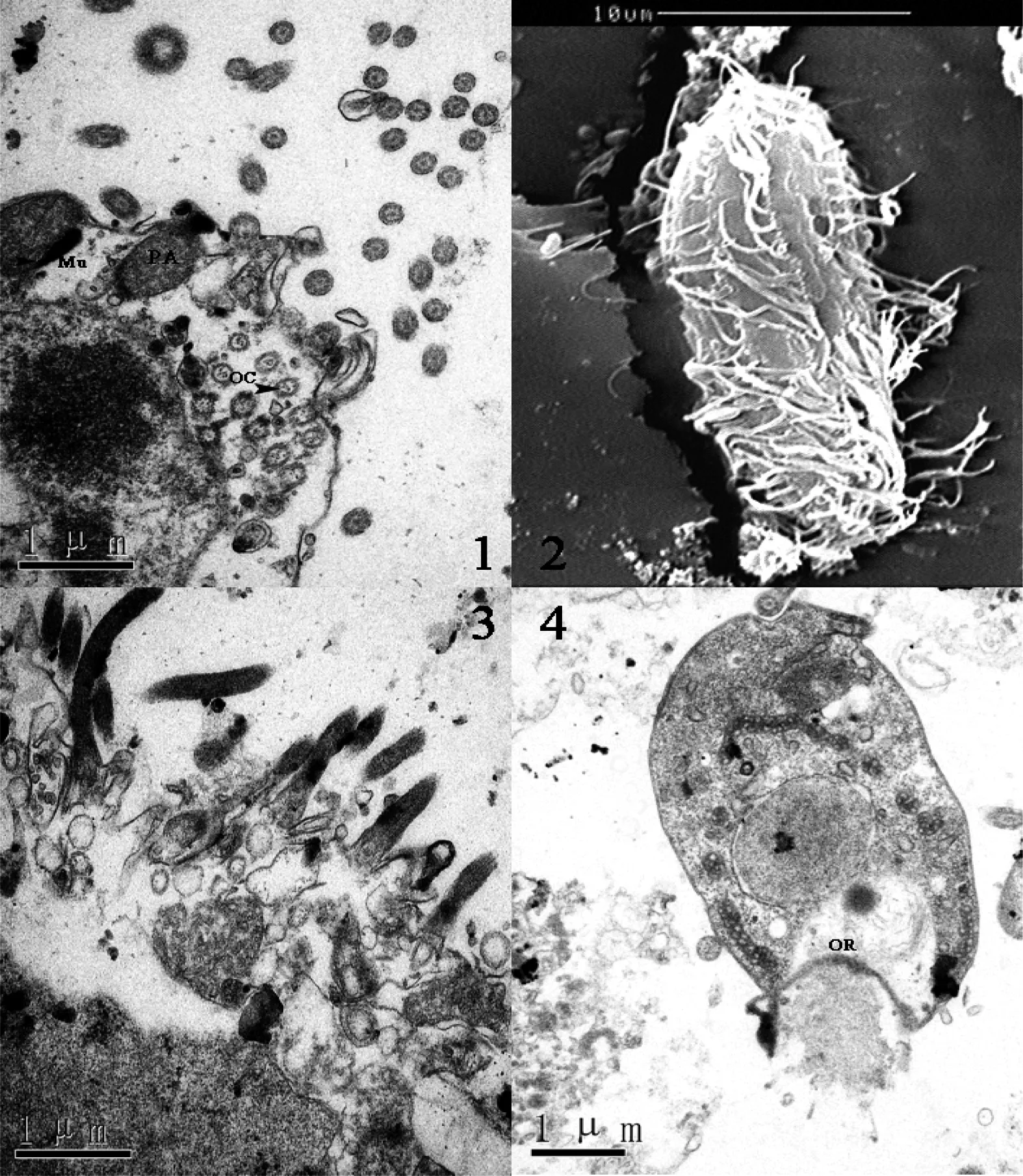
图1 刺激隐核虫幼虫脱包0~4 h亚显微观察
1:幼虫口器及纤毛的透射电镜(刚脱包),示口纤毛(OC)、黏液囊(Mu)、质膜小泡(PA);2:整个幼虫扫描电镜(刚脱包),示体纤毛;3:示双动基口纤毛(4 h);4:示幼虫横切面(4 h),口肋(OR)
幼虫全身密被单动基体纤毛(图1-2),分为纵向平行排列的体纤毛和环向排列的口纤毛(图1-2、3)。胞口(oralrib)从幼虫的前部顶端延伸至后腹部,整个口肋位于前端偏腹侧,呈缝隙状(图1-4) 。幼虫有3 层外膜,由内向外分别是内泡膜(inner alveolar membrane)、外泡膜(outer alveolarmembrane) 和外限制膜(outer limiting membrane)。内泡膜在质膜小泡的内侧,质膜小泡凸出于质膜表面且内部充满电子致密物质(图1-1),两排质膜小泡之间的细胞膜凹下呈犁沟状,纵行的纤毛即从此犁沟内长出来(图1-1)。外泡膜衬于外限制膜之下,外限制膜覆盖整个虫体、口囊、纤毛和细胞表面内陷部分。
幼虫脱包后0~4 h:从扫描电镜可以看出幼虫虫体全身遍布体纤毛(图1-2)并且较为浓密,而且这一时期幼虫的细胞结构比较完整,细胞中含有较多颗粒状胞质比如高尔基体、伸缩泡、线粒体和共生细菌,幼虫胞质中还含少量的脂肪颗粒 (图1-1)。
幼虫脱包后8~16 h:纤毛不断脱落导致体纤毛数量明显减少(图2-5、7)。此时幼虫长径约为20~30 μm。透射电镜图显示其细胞胞质变的稀薄(图2-5),电子致密物质减少,但口器清晰可见,口纤毛依然茂密(图2-6、7)。
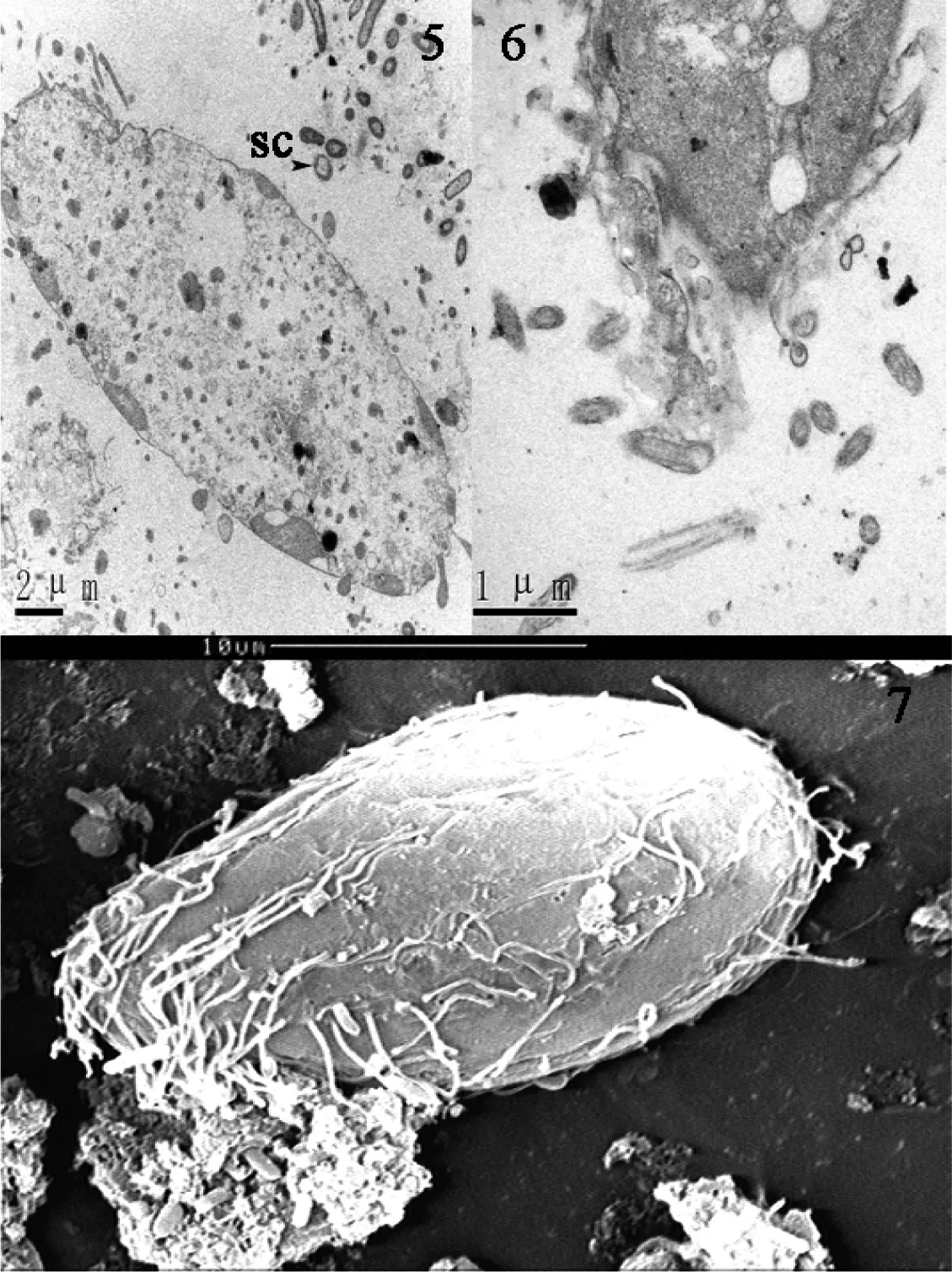
图2 刺激隐核虫幼虫脱包8~16 h亚显微观察
5:幼虫胞质稀薄(16 h),单动基体纤毛(SC);6:口器横切面(8 h);7:幼虫扫描电镜(12 h),示体纤毛已逐渐脱落
幼虫脱包后20~24 h:幼虫细胞发生显著变化。体纤毛和口纤毛几乎完全脱落,露出一列一列的毛基体。细胞大小也发生了变化,严重紧缩,平均长径仅10 μm左右,体型变得更为修长。细胞膜变松弛,细胞形状由泪滴形变得不规则,细胞器几乎完全凋亡,形成许多凋亡小体(图3-8、9、10、11)。
3 讨论
若想系统地研究刺激隐核虫,能够适时获得足量的寄生虫材料是非常必要的,但要想从自然界稳定地获得样本却非常困难,发病的时间和地点,及其采样的客观条件都直接制约着获取样本的数量。曾经有学者试图在实验室里用其他海水鱼类作为宿主培育寄生虫,但由于某些海水鱼类饲养的复杂性而存在着某些缺陷,导致最终的寄生虫产量较低。本研究建立的以大黄鱼为宿主的传代系统有诸多优点:首先,材料收集方法简单,幼虫可以杀死后离心收集;其次,寄生虫孵化率高,循环周期短,因此总产量很高,为研究工作提供了保障;再次,大黄鱼是最易感染刺激隐核虫的养殖鱼类[12],故紧密结合生产实际,研究结果可及时应用于养殖生产。
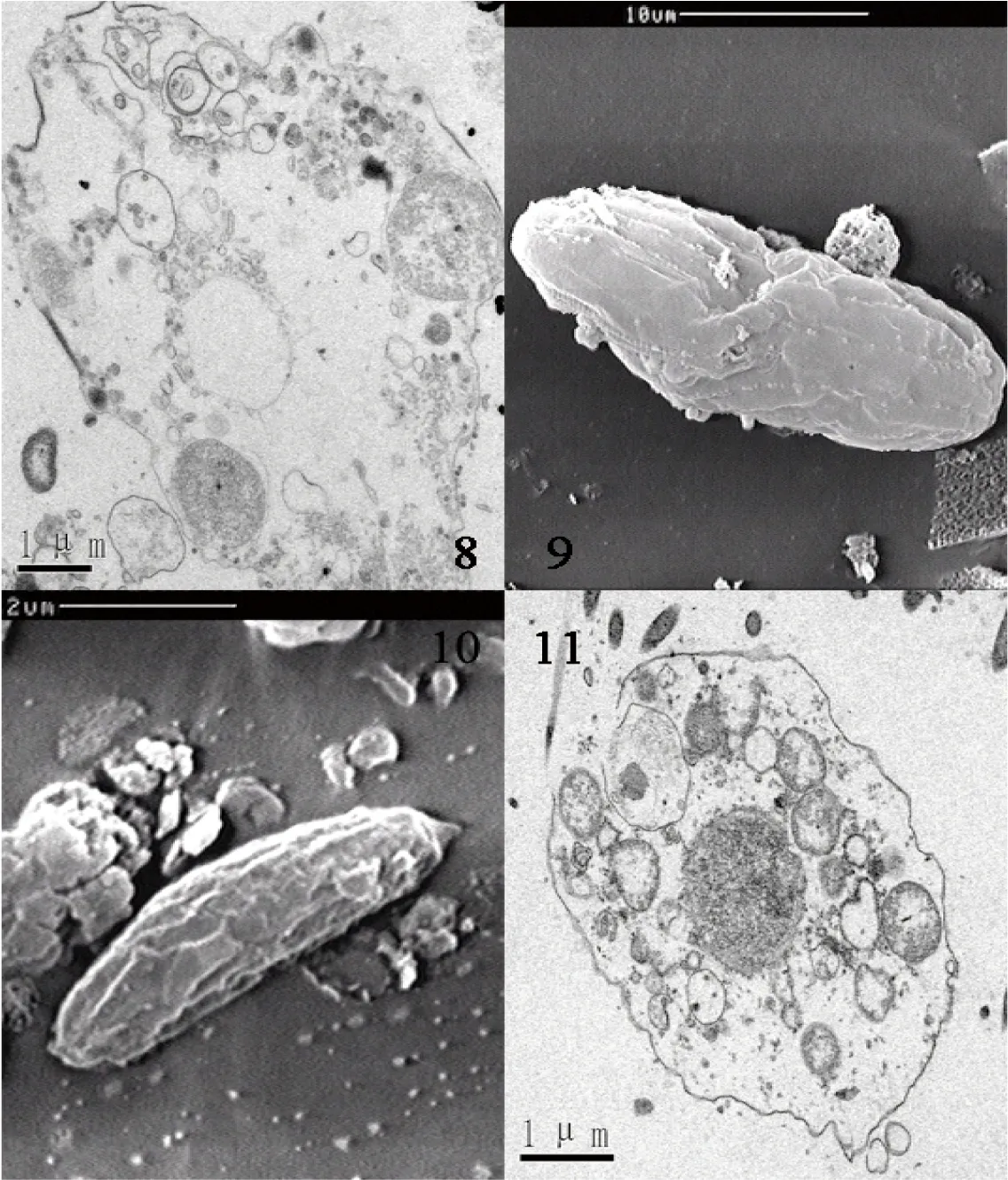
图3 刺激隐核虫幼虫脱包20~24 h亚显微观察
8:凋亡的刺激隐核虫幼虫(24 h);9:体被纤毛完全脱落的幼虫(20 h);10:幼虫体积萎缩(24 h);11:凋亡中的刺激隐核虫幼虫(20 h)
刺激隐核虫的幼虫期是其整个生活史中唯一具有感染能力的时期,其虫体透明,游动速度快,且脱离包囊后2 h的幼虫感染力最强,3~20 h 感染力逐渐减弱到丧失感染力,幼虫30 h内不感染宿主就会死亡[13]。在本实验中,分别将存活了0、4、8、12、16、20和24 h的幼虫固定后,利用显微及亚显微技术观察各时段发育形态的变化特征,探索其形态结构变化与感染力消失之间的关系,为防治刺激隐核虫病的有效时间和方法提供了实验依据。
观察脱包0~4 h时期的幼虫时发现,其全身布满纤毛,游动速度快,有利于它在水体中寻找宿主和成功感染。有报道认为脱包6~8 h后,幼虫的感染能力大大减弱[14-16],作者观察脱包8~16 h时期的幼虫时发现在扫描电子显微镜下其体纤毛大部分脱落,光镜下幼虫行动迟缓,这些现象表明刺激隐核虫幼虫感染能力的下降。Burgess[14]和Dan[17]认为刺激隐核虫幼虫在脱包18 h后完全丧失感染力,本实验在观察脱包20~24 h时期的幼虫时,发现刺激隐核虫幼虫纤毛几乎完全脱落,细胞发生显著变化,形体急剧萎缩,呈现凋亡。Nigrelli和Ruggier[18]研究发现幼虫从包囊溢出之后并不进食而是在水中快速游动,寻找感染宿主才能维系生命活动。徐润林等[6]研究刺激隐核虫幼虫超微结构时也发现此时仅有无法摄食的口器原基,无明显口器结构。由此推测,刺激隐核虫幼虫3~20 h 感染力逐渐减弱到丧失感染力,与幼虫摆动纤毛寻找宿主过程中能量的不断消耗有关,最终幼虫能量枯竭而失去感染活性。本研究在不同时段的幼虫形态结构变化特征与感染活性丧失过程相关联,反映能量衰减可能是影响刺激隐核虫幼虫感染能力的主要原因。
[1]成 奇,潘连德.刺激隐核z虫生物学和刺激隐核虫病临床诊治的研究进展[J].中国渔业质量与标准,2014, 4(5):16-23.
[2]SIKAMA Y. Preliminary report on the white spot disease in marine fish[J].Suisan-Gakukai-Ho, 1937(7):149-160.
[3]黄 玮,马 跃,李安兴.人工感染的刺激隐核虫各期虫体的超微结构[J].水产学报, 2005, 29(5):635-642.
[4]刘振勇,林小金,谢友佺,等.大黄鱼刺激隐核虫病继发细菌感染致死原因的研究[J].福建水产, 2012,34(1):11-15.
[5]CHEUNG P J, NIGRELLI R F, RUGGIERI G D. Scanning electron microscopy onCryptocaryonirritansBrown, 1951, a parasitic ciliate in marine fishes[J]. Aquaculture, 1981(2):70-72.
[6]徐润林,白庆笙,李贵生,等.刺激隐核虫(Cryptocaryonirritans)感染幼虫的超微结构研究[J].中山大学论丛, 1995 (1):142-145.
[7]XU R L, JIANG J B, CHEN B S. Light microscopy observation on life cycle of theCryptocaryonirritans[J]. Marine Siences, 1992(3):87-90.
[8]COLORNI A, DIAMONT A. Ultrastructural features ofCryptocaryonirritans, a ciliate parasite of marine fish[J]. European Journal of Parasitology, 1993, 29(4):425-434.
[9]MATTHEWS B F, MATTHEWS R A, BURGESS P J.CryptocaryonirritansBrown, 1951(Ichthyophiriidae):the ultrastructure of the somatic cortex throughout the life cycle[J]. Fish Disease, 1993, 16(4):339-349.
[10]DIGGLE B K. Some information on the morphology ofCryptocaryonirritansfrom South-East Queensland Australia . Eur[J]. European Journal of Protistology, 1997, 33(2):200-210.
[11]但学明.刺激隐核虫 (Cryptocaryonirritans) 的传代,保存及刺激隐核虫病的防治研究[D].广州:暨南大学, 2006.
[12]王忠华,张辰仓,王印庚,等.网箱养殖大黄鱼刺激隐核虫病及治疗[J].河北渔业, 2013(2):29-34.
[13]COLORNI A. Aspects of the biology ofCryptocaryonirritans, and hyposalinity as a control measure in cultured gilt-head sea breamSparusaurata[J]. Dis Aquat Organ, 1985, 1(1):19-22.
[14]BURGESS P J.CryptocaryonirritansBrown, 1951 (Ciliophora): transmission and immune response in the mulletChelonlabrosus(Risso, 1826)[D]. Plymouth: University of Plymouth, 1992.
[15]YOSHINAGA T, DICKERSON H W. Laboratory propagation ofCryptocaryonirritanson a saltwater-adapted Poecilia hybrid, the black many[J]. Aquat Anim Health, 1994, 6(3): 197-201.
[16]DIGGLES B K, LESTER R J. Influence of temperature and host species on the development ofCryptocaryonirritans[J]. Parasitol, 1996, 82(1):45-51.
[17]DAN X M, LI A X, LIN X T, et al. A standardized method to propagateCryptocaryonirritanson a susceptible host pompanoTrachinotusovatus[J]. Aquaculture, 2006, 258(1-4):127-133.
[18]NIGRELLI R F, RUGGIERI G D. Enzooties in the New York aquarium caused byCryptocaryonirritansbrown, 1951(ThyophthiriusmarinusSikama, 1961), histophagous ciliate in the skin, eyes and gills of marine flsh[J]. Zoologica, 1966(51):97-102.
Electron microscopic observation of artificial infection of theront ofCryptocaryonirritansin vitro
SHEN Chen, ZHOU Min-xi, ZHOU Su-ming, WANG Guo-liang
(Key Laboratory of Applied Marine Biotechnology, Ministry of Education, Ningbo University, Ningbo 315211, China)
Cryptocaryonirritanstheront stage development characteristics were examined by observation of scanning electron microscopy (SEM) and transmission electron microscopy (TEM). Tomont in each period collected from the diseasedPseudosciaenacrocea, and the strains were maintained in experimentally infectingPseudosciaenacroceafrom which the sample used for ultrastructural observation was collected. The result of observing different stages of theront off the tomont by electron microscope and light microscope showed: theront off the tomont after 0-4 h, ciliary body of the worm body was more dense and the cell structure was complete, swimming quickly in culture fluid; theront off the tomont after 8-16 h,Cryptocaryonirritanslarvae significantly reduced the long diameter and the number of its body cilia, with thin cytoplasm, swimming slowly; theront off the tomont after 20-24 h, the larvae body cilia was few. And the larvae were nonmoving, sinking to the bottom. Meanwhile, the cell shapes of teardrop changed into the irregular and begain apoptosis, the cell size in a serious recession significantly, with long diameter of only 10 μm around. In this study, the morphological and structural characterization changes of the larvae in different periods are associated with the process of the loss of infectivity, reflecting the main reason that the influences on infectivity ofCryptocaryonirritansis energy attenuation.
Cryptocaryonirritans; contagious; artificial infection; ultrastructure
2016-05-30;
2016-06-21
教育部长江学者与创新团队资助项目(IRTO734号);国家公益性行业(农业)科研专项资助项目(200903029号);浙江省海水养殖重点科技创新团队项目(2010R50025-08号)
沈 晨,硕士研究生,水生动物病害方向,E-mail:1506012768@qq.com
王国良,教授,主要从事水生动物病害研究,E-mail:wangguoliang@nbu.edu.cn
S941.51
B
2095-1736(2017)02-0104-04
doi∶10.3969/j.issn.2095-1736.2017.02.104

