微藻生物采收技术的现状和展望
樊 华, 韩 佩, 王菁晗, 李 昆, 黎 俊, 周文广
(1. 南昌大学 资源环境与化工学院 鄱阳湖环境与资源利用教育部重点实验室, 南昌 330031;2. 清华大学 环境学院 环境模拟与污染控制国家重点联合实验室国家环境保护环境微生物利用与安全控制重点实验室,北京 100084)
微藻生物采收技术的现状和展望
樊 华1, 韩 佩1, 王菁晗2, 李 昆1, 黎 俊1, 周文广1
(1. 南昌大学 资源环境与化工学院 鄱阳湖环境与资源利用教育部重点实验室, 南昌 330031;2. 清华大学 环境学院 环境模拟与污染控制国家重点联合实验室国家环境保护环境微生物利用与安全控制重点实验室,北京 100084)
微藻是一类重要的光合微生物,在能量转化和碳循环中举足轻重。目前,微藻生物技术主要应用在固碳控污、生物质能源、食品、医药、饲料及其他高附加值产品制备等方面。但仍有很多技术瓶颈亟待解决,其中,微藻采收的高能耗是阻碍微藻产业化发展的主要原因之一。由于微藻在培养液中浓度低、粒径小,传统的沉降、过滤、离心等采收方法都存在效率低或成本高的限制。利用絮凝性藻类、细菌、真菌或者从微生物中提取的生物絮凝剂收获微藻的生物采收技术由于具有安全、无二次污染、采收率高、 设备投入和运行能耗与其他方法相比显著降低等优点,目前被认为是最具前景的采收技术之一。系统地评价了不同微藻采收技术的优缺点,并重点阐述了微藻生物采收技术的研究进展及前景。
微藻;絮凝性微生物;生物絮凝;采收
微藻是地球上分布最广、种类最多的一类形态微小、结构简单的单细胞或多细胞光合自养微生物,在能量转化和碳循环中举足轻重。微藻具有光合作用效率高、环境适应能力强、生长速率快、生长周期短、占地面积小、生物质产率高和环境效益显著(高效吸收废水中的N、P等营养元素)等特点[1-3]。这些独特优势使微藻生物质在制备液体燃料,生产医药、食品和动物饲料,污水深度处理以及CO2固定等方面的应用前景广阔。
尽管有诸多优势,微藻的产业化应用至今仍面临许多挑战,微藻采收技术的低效或高能耗是阻碍其商业化的主要原因之一。微藻个体微小,直径只有3~30 μm;大部分藻细胞表面带负电荷,在培养液中会形成均匀分散的悬浮体系;且微藻自养培养时生物质浓度低,一般只有0.4~1.0 g/L,这些特点使其采收成本高昂。研究表明,大规模培养过程中微藻的采收成本约占微藻生产总成本的20%~30%,有的甚至高达50%[4-5]。因此,寻求一种高效率、低成本的采收方法是目前微藻产业化亟须解决的关键问题。
利用生物絮凝采收微藻的相关研究已开展多年,该种方法由于具有安全、对环境无二次污染和采收效率高等特点,且设备投入和运行能耗与其他方法相比明显降低,目前被认为是最具应用潜力的微藻采收技术之一,近年来已引起全球研究者们的广泛关注[6]。本文系统地比较了现有多种不同微藻采收技术的优缺点,并重点讨论了微藻生物采收技术的研究现状和未来发展趋势,以期为大规模微藻培养过程中微藻采收方法的选取提供理论参考和实践依据。
1 传统微藻采收技术
近年来,包括自然沉降、絮凝、浮选、过滤、离心以及上述方法的组合等各类微藻采收技术已被广泛研究[7]。
自然沉降法利用重力作用使微藻沉降,该方法适用于硅藻(Diatomsp.)等细胞密度较大的微藻[8],但其效率低、耗时长,一般需要与絮凝法结合使用。
以上提到的絮凝法是指传统絮凝方法,主要包括物理絮凝和化学絮凝。化学絮凝目前在微藻采收中应用较多,多使用金属盐或高分子聚合物为絮凝剂,常用的多价金属絮凝剂为FeCl3和Al2(SO4)3,已成功采收衣藻(Chlamydomonassp.)、布朗葡萄藻(Botryococcusbraunii)、栅藻(Scenedesmussp.)和小球藻(Chlorellasp.)[9-10]等;除此之外,聚合铝盐、铁盐等聚合金属盐类也是使用较为广泛的絮凝剂。使用金属盐絮凝剂的主要问题是金属离子造成的化学污染会较大程度限制微藻的应用[11]。高分子聚合物絮凝剂主要分为人工高分子絮凝剂和天然高分子絮凝剂两类:人工高分子絮凝剂多用聚丙烯酰胺,但絮凝效率低下;天然高分子絮凝剂多用壳聚糖,常用于食药级藻体的采收,因其成本较高且只有在酸性条件下絮凝效果才显著,故应用上受到限制[12-13]。除了添加化学絮凝剂,化学絮凝还可通过调节微藻培养液pH值使钙、镁等离子沉淀,诱导絮凝现象的产生[14]。物理絮凝中,电絮凝的使用范围较广,该种方法对绿藻(Chlorophyta)、蓝绿藻(Cyanobacteria)和硅藻(Diatomsp.)的絮凝率可达95%[15]。但电絮凝对设备和操作的技术要求较高,同时电解的金属离子易残留在培养液及微藻细胞内,不利于培养液的循环利用和微藻的提炼加工等[16-17]。此外,物理絮凝还包括利用磁场、静电吸附以及超声采收微藻等[18]。总的来说,化学絮凝采收效率高、操作简单、工艺成熟,但絮凝剂的使用不仅会增加生产成本,而且絮凝剂的残留会增加下游处理难度;相对于化学絮凝法,物理絮凝法无二次污染,但其受操作环境局限较大,能耗较高。
浮选法在微藻采收方面也应用较多,主要有泡载法和气浮法,两者原理类似,都是利用气泡作为载体实现固液分离,区别在于气浮法的气泡更加微小,浮选可以看作是分离效果优于沉降法的反向沉降[19-20]。Yan等[21]利用浮选法采收微藻,采收率可达98%以上。在浮选之前对微藻进行预处理,使其富集浓缩,可克服微藻采收过程中因微藻细胞小、培养浓度低等造成的不易沉降等问题[12]。浮选法主要用于先进的一体化光生物反应器中,可达到同步培养和采收微藻的目的[19]。浮选法的工作原理决定了其仅适用于单细胞藻类的采收;此外由于需要复杂的工艺和较高的能耗来产生大量的微小气泡,浮选法的投资和运行成本可能超过离心法,技术和经济的可行性成为限制浮选法发展的主要因素[22]。
过滤法是常用的微藻分离方法之一,细胞大小是影响微藻过滤效率的关键因素,对于部分大型海藻或丝状藻,如螺旋藻(Spirulinasp.)和空星藻(Coelastrumsp.),简单过滤就能有效采收藻体[23]。通过加压操作,可进一步提高过滤法的采收效率[24]。过滤法的成本相对其它方法较低,但该法只适用于个体较大的微藻,且易污染堵塞滤料[25-26]。
离心法是目前较为可靠有效的微藻采收方法之一,绝大多数微藻都可以通过离心达到分离、采收的目的[27]。离心法采收效率高,在适宜条件下对微藻的采收率可达95%[28]。离心法的主要缺点是能耗大,当微藻的采收率达到95%时,处理能耗高达20 kW·h/m3;此外系统折旧和维护的费用也很大程度上增加了离心法的成本[29-30]。极高的能耗和投资运行成本使离心法目前只能应用于高附加值产品的生产[31]。
表1罗列了传统微藻采收技术的优缺点。
2 生物絮凝采收法
近年来,添加絮凝性藻类、细菌、真菌或从微生物中提取的絮凝性物质的生物絮凝采收法被视为一种很有前景的低成本微藻采收方法[25,27]。微藻的生物絮凝是利用生物体本身或其代谢产生的黏性物质,对微藻进行采收的过程。由于不需要添加额外的化学物质,微藻生物絮凝采收技术被认为是一种经济可行、绿色清洁、可持续发展,且最有希望实现规模化应用的采收技术。
微藻的生物絮凝采收主要包括:微藻自絮凝法、细菌介导的生物絮凝法以及丝状真菌介导的生物絮凝法。

表1 不同微藻采收技术的比较
2.1 微藻自絮凝法
微藻自絮凝现象由来已久,1988年Sukenik等[34]在户外开放培养和实验室封闭培养中均发现了藻细胞自絮凝现象。研究表明,自絮凝现象是由微藻分泌的糖苷或多糖等絮凝活性物质与藻细胞相互作用造成的[26,35]。目前发现的自絮凝藻株有斜生栅藻(Scenedesmusobliquus)、小球藻(Chlorellasp.)、刚毛绿球藻(Cladophoraaegagrophila)、骨条藻属(Skeletonemasp.)、布朗葡萄藻(Botryococcusbraunii)、镰形纤维藻(Ankistrodesmusfalcatus)和扁藻(TetraselmisChui)等[27,36-37]。这些自絮凝藻株既可用于微藻生物质的自收获,也可用于与其他种类的微藻混合培养并诱导生物絮凝 ,如骨条藻属(Skeletonemasp.)可以通过共培养的方式收获高脂海洋微绿球藻(Nannochloropsisoceanica)[39-40]。
微藻自絮凝法由于不需要添加化学絮凝剂,安全性高;通常情况下将自絮凝藻株与目标藻种混合培养即可达到采收目的,与其他采收方法相比操作简单;同时,微藻自絮凝法的成本和能耗低[41],相比于直接离心法,自絮凝后再离心可降低90%的能耗[36]。尽管具备上述诸多优点,微藻自絮凝法在实际应用时依然存在一些不足:如自絮凝过程所需时间过长;收获的微藻生物质含水量高,需进一步浓缩[27];自絮凝藻株的筛选条件严苛;自絮凝藻株具有藻株特异性,对微藻的采收效果会“因藻而异”,普适性不高;此外,该法的可靠性也还有待进一步研究。
2.2 细菌介导的生物絮凝法
除了絮凝性藻类以外,国内外学者发现一些细菌也有絮凝特性,这是由于细菌分泌的特定胞外聚合物(EPS)具有絮凝效果引起的。目前已知絮凝性细菌有洋葱伯克氏菌(Burkholderiacepacia)、类芽孢杆菌(Paenibacillussp.)、黄杆菌属(Flavobacterium)、泉发菌属(Terrimonas)、鞘氨醇杆菌属(Sphingobacterium)、根瘤菌属(Rhizobium)、生丝单胞菌属(Hyphomonas)[6,25,42-43]。利用絮凝性细菌采收微藻的方法称为细菌介导的生物絮凝法,该法的作用机理主要为:细菌分泌的EPS降低了藻细胞表面静电斥力,从而与微藻细胞紧密地黏结在一起形成絮凝体[23],在这个过程中,细菌分泌的EPS起到了絮凝剂的作用。Oh等[6]利用类芽孢杆菌AM49(Paenibacillussp. AM49)分泌的絮凝物质来絮凝小球藻(Chlorellavulgaris),絮凝效率高达83%。絮凝性细菌本身也可直接用于微藻的絮凝采收[44-45],如Lee等[45]将具有絮凝性状的细菌与颗石藻(Pleurochrysiscarterae)共培养,微藻采收效率超过90%,且剩余的培养液无需额外处理即可循环利用。由于本地细菌对当地环境的耐受性更好,实际操作时,通常采用本地活性污泥中分离的细菌菌株与微藻联合培养,故对土壤和活性污泥中未知细菌的研究更为广泛[45-46]。
细菌介导的生物絮凝法成本低,絮凝效果也较为理想,但利用絮凝性细菌采收微藻的主要问题是细菌引起的微生物污染可能会导致生物安全问题,从而影响微藻的利用价值。
2.3 丝状真菌介导的生物絮凝法
自然界中绝大部分真菌的营养体都是丝状的,菌丝可将微藻细胞包裹其中而有助于微藻采收,作为其中的一个典型代表,地衣是自然环境中常见的微藻和真菌的共生体。《中国国家地理杂志》把地衣比喻为一个“组装家庭”:真菌把微藻包裹在真菌体内靠近上皮层的部位,并为微藻提供水分和矿物质,微藻则把糖类回馈给真菌,形成优势互补的共生系统。然而,这种共生关系的具体机理尚不完全清楚,还需进一步的研究,图1是地衣的结构示意图。
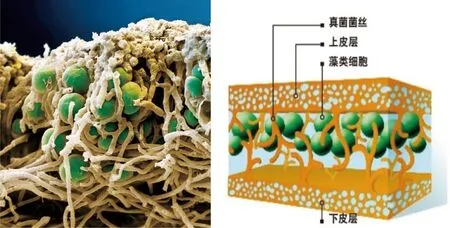
图1 地衣的结构
(http://www.dili360.com/nh/article/p5350c3d9c97b298.htm)
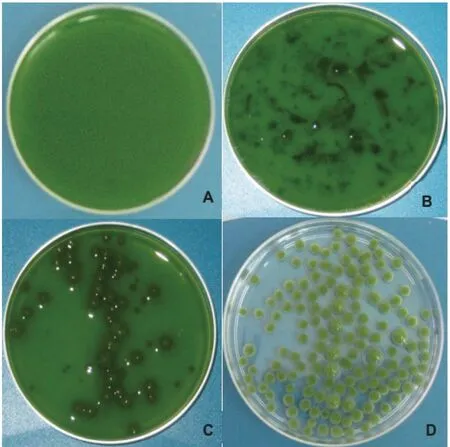
图2 菌-藻颗粒形成的过程图[23]
A:待收获的微藻;B:添加能成球的真菌孢子;C:部分微藻细胞以菌-藻球体的形式聚集;D:所有微藻细胞以菌-藻球体的形式聚集,可通过简单过滤法收获
受到地衣中微藻与真菌共生关系的启发,Zhou等[22-23]研发了一种新型丝状真菌介导的微藻絮凝采收技术,通过真菌和微藻共生成球易沉降的特性来实现微藻采收的目的,如图2所示。在此技术基础上,本实验室研究了以成球真菌为生物质载体来实现小球藻的固定化和采收,发现在不同pH值下,真菌菌丝球对微藻的吸附效果有明显差异。结果表明:在pH=4的条件下,2.5 h内菌丝球对小球藻的吸附效率达到96%以上(图3)。
利用絮凝性丝状真菌与微藻共生成球采收微藻的方法在近年来受到越来越广泛的关注,有报道称利用拟盘多毛孢菌(Pestalotiopsisversicolor)可采收布朗葡萄藻(Botryococcusbraunii)[9];Zhang等[47]将黑曲霉孢子与小球藻共培养3 d,不仅成功采收小球藻(Chlorellasp.),还显著提高了藻细胞内总脂肪酸含量。然而并非所有丝状真菌都能获得很好的收获效果,有的真菌甚至不能与微藻产生絮凝现象[47],目前研究较为广泛的丝状真菌有曲霉属(Aspergillussp.)、气球菌属(Aerococcussp.)、白缘皱孔菌属(Leucogyrophanasp.)、和小克银汉霉属(Cunninghamellasp.)等[47-49]。
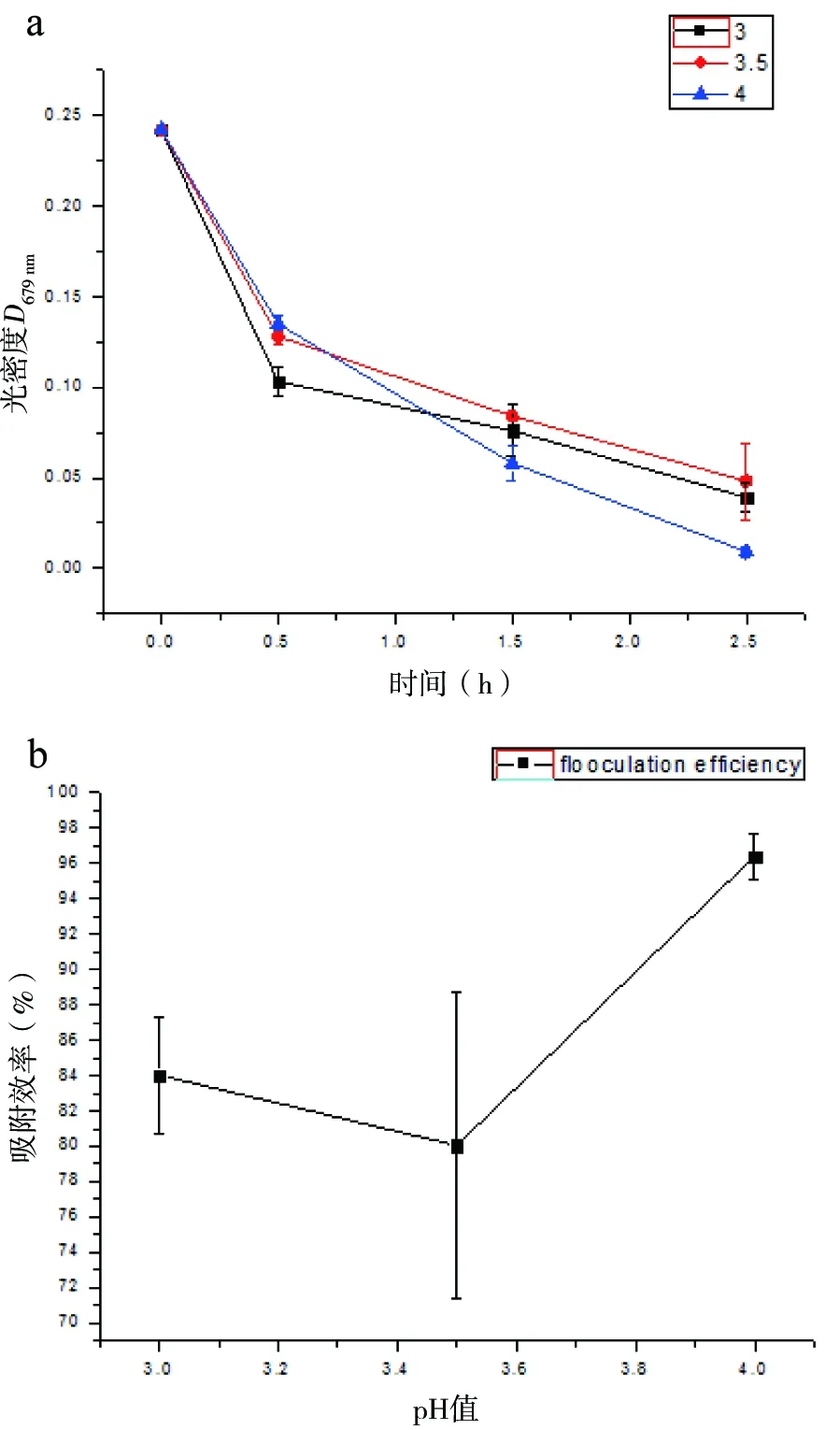
图3 不同pH值下的真菌菌丝球对微藻的吸附效果
A:不同pH值条件下的微藻光密度值随时间的变化;B:2.5 h时,不同pH值下的真菌菌丝球对微藻的吸附效率
丝状真菌介导的生物絮凝法可通过多种方式实现,除了将絮凝性真菌与微藻共培养,还可将絮凝性真菌的混合培养液,或胞外抽取液以及分离纯化后的胞外提取物作为絮凝剂来采收微藻(后者的添加方式需要单独的培养系统,且后续分离和加工等环节成本较高)[14]。
丝状真菌介导的生物絮凝有多重优点,包括无需添加化学絮凝剂,操作简单;丝状真菌在与微藻培养过程中由于其菌丝缠绕易形成菌丝球,有利于传质传氧,还可以进一步吸附微藻等。但在实际应用中,该方法尚存在很多问题:1)丝状真菌的絮凝时间长;2)与微藻自絮凝和细菌介导的生物絮凝相比,培养条件相对严苛;3)与细菌介导的生物絮凝法的问题相似,很多丝状真菌是人类病原菌,一些丝状真菌还可能在培养过程中产生毒素,给微藻的后续加工处理带来巨大风险等。目前已开展了利用食用菌采收微藻的相关研究,如平菇和小球藻可形成稳定性良好的混合菌丝球[50],且收获的生物质可直接用于食品、医药等产品的生产,该法的主要缺陷是食用菌生长速度过慢,使其应用受到限制。
表2列举了不同微藻生物絮凝采收法的比较。
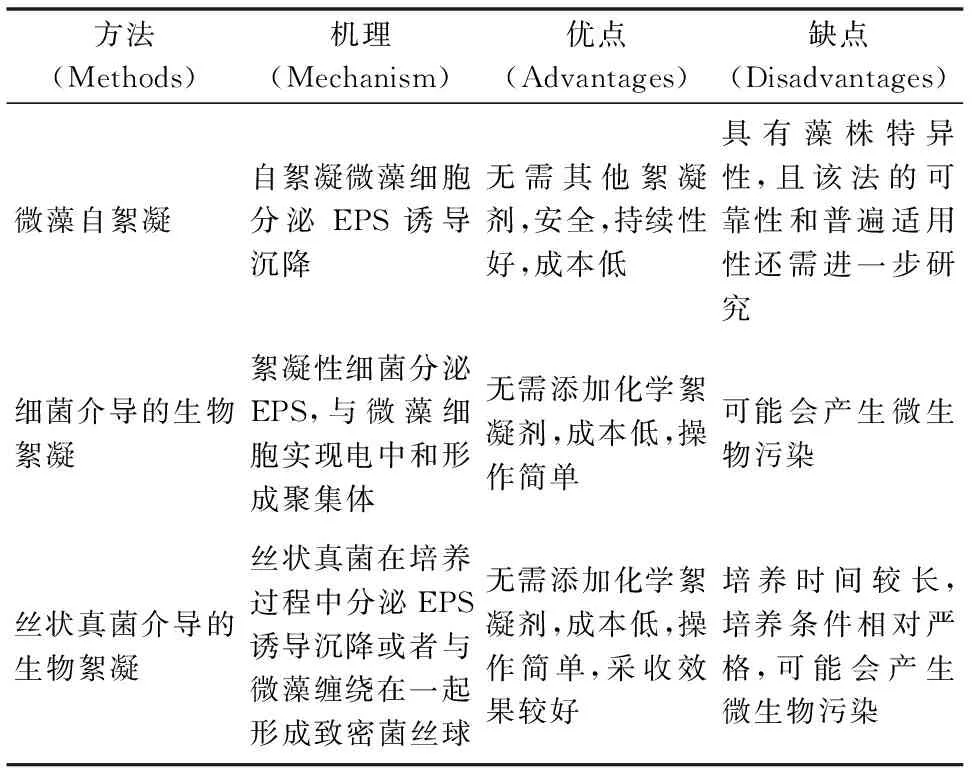
表2 不同微藻生物絮凝方法的比较
2.4 其他生物絮凝法
除了微生物絮凝剂,一些植物提取物也可作为采收微藻的絮凝剂[51],但上述利用植物絮凝剂采收微藻的方法在经济和技术上的要求相对较高,本文不做详细讨论。
3 微藻生物絮凝采收的影响因素
微藻生物絮凝采收效率与许多因素有关,主要取决于絮凝性微生物的种类,目标藻种和培养条件的不同也会导致絮凝效率的差异。在确定絮凝性微生物的种类后,目标藻种培养条件的依存性是不容忽视的。
3.1 目标藻种的类型
目前研究最广泛的微藻主要有小球藻(Chlorellasp.)、栅藻(Scenedesmussp.)等淡水藻及海洋微绿球藻属(Nannochloropsissp.)、新绿藻属(Neochlorissp.)、颗石藻属(Pleurochrysissp.)和海链藻属(Thalassiosirasp.)等海水藻[22,25,27,36,38,43,45,52]。这些微藻种类不同,所需的培养条件也不同,部分藻种只能在自养条件下培养[53],其他的则可在混养/异养条件下培养[22-23,47]。即使采用相同的絮凝微生物,微藻生物絮凝效率也会随目标藻种的变化而变化[26-27,42]。
3.2 培养条件
3.2.1 絮凝性微生物投加比例
絮凝微生物投加比例也是影响微藻采收效率的一个重要参数,絮凝性微生物投加过少时,微藻采收效率低下;投加量过多时,成球颗粒数量多、尺寸小,不利于生物质的采收及利用。研究表明,在微藻生物絮凝中,所需的絮凝性微生物的数量与目标藻种的尺寸有关。小型藻细胞的比表面积较大,所需生物絮凝剂的量较多[54]。
Zhou等[22]研究发现利用真菌作为絮凝性微生物采收微藻时,真菌孢子投加量为1.1×104个/mL时与微藻共生成球的效果最好。值得注意的是,在菌-藻共培养过程中,菌株会与微藻竞争营养物质,不利于微藻生物量的累积,且过多的絮凝性微生物会给后续处理增加难度[55]。因而,选择适宜的絮凝性微生物投加比例对于微藻的采收至关重要。
3.2.2 培养基类型
培养基的类型及老化程度会影响微藻生物絮凝的效率[56]。此外,研究表明培养基中的碳源种类对微藻采收效率也有重要影响:采用自絮凝藻株作为生物絮凝剂,一般只需要无机碳源;而以细菌和真菌为絮凝性微生物的生物絮凝则还需要有机碳源[57]。为降低微藻的培养成本,已开展利用废水作为微藻培养基的相关研究,然而大量非目标微生物的引入会降低絮凝效果,加剧污染情况,从而严重降低目标产品的质量[55]。
3.2.3 培养时间
对于微藻的自絮凝和细菌介导的生物絮凝,絮凝效率是由微藻或细菌分泌的EPS量决定的[56]。研究表明,在微藻的自絮凝中,EPS含量的峰值通常出现在微藻生长的最后阶段,由此可推测,EPS的分泌量可能与培养基中微藻细胞的密度正相关[56]。
对于真菌介导的生物絮凝,真菌与微藻共生成球的效率是由真菌的表面特性决定的,成球时间一般在2 d左右。
3.2.4 其他
除上述因素之外,还有许多培养条件会对微藻的生物絮凝效果产生影响。1)pH值:pH值与微藻及絮凝性微生物的表面电荷有关系。微藻的自絮凝宜在中性条件下进行[26];细菌介导的生物絮凝效果在碱性条件下更优[6];真菌形成菌-藻颗粒则通常需要酸性环境[22]。2)温度和光照:温度和光照是微藻生长和繁殖的基本要素,直接决定了微藻生物量,温度对自絮凝微藻的 EPS分泌具有重要影响[58],高温刺激 EPS 的形成,低温则对EPS 的形成产生抑制;除了温度,充足的光照也是微藻EPS形成的有利因素[59]。3)目标微藻所处生长阶段:目标微藻所处生长阶段是另一个影响絮凝效率的参数[25],通常将絮凝性微生物与对数生长末期的微藻混合培养可获得较好的絮凝效果[60]。4)搅动速率:搅动速率直接影响混合强度,混合强度的不同会引起剪切应力的不同,进而影响菌-藻颗粒成形效果,一般在无搅拌时,菌-藻不会形成颗粒球体;另外,搅动速率对成球颗粒的尺寸也有影响[22]。5)重金属和碳酸盐:重金属、碳酸盐也可能对菌-藻颗粒成形有重要影响,目前此方面的报道较少,有待进一步研究[22]。
4 结论与展望
微藻采收阶段成本占微藻培养总成本比例较高,严重制约了微藻的产业化发展。目前微藻的采收方法主要包括自然沉淀、化学及物理絮凝沉淀、气浮、过滤、离心等,这些传统方法在技术及经济性上存在不足,难以满足实际大规模生产的需求。微藻的生物采收法是一种以微藻自絮凝法、细菌介导的生物絮凝法、丝状真菌介导的生物絮凝法为主体的技术方法,相比于传统方法,具有以下优势:1)无需添加化学药剂,对环境无二次污染; 2)易于操作且能显著降低能耗。影响微藻生物絮凝效率的因素非常复杂,包括絮凝微生物和目标藻种的种类以及培养条件等,为进一步提高微藻生物絮凝的效率,需要深入研究这些影响因素间的相互关系。
尽管微藻生物采收优势突出,但在实际应用中尚存在一些不足:微藻的自絮凝法可靠性低;细菌或丝状真菌介导的生物絮凝容易造成微生物污染;真菌与微藻的共生机制还有待进一步研究等。为解决上述问题,微藻生物采收技术需在以下方面寻求突破:1)针对微藻的不同应用选择适宜的絮凝性微生物,降低微生物污染对微藻应用的影响;2)优化共培养条件,减少微藻收获所需时间;3)对真菌与微藻的共生机制进行深入研究,为微藻采收提供新思路。此外,利用基因工程提取出絮凝性菌株的有效基因,并在微藻细胞中表达,也是一个有前景的研究方向。
[1]GEORGIANNA D R, MAYFIELD S P. Exploiting diversity and synthetic biology for the production of algal biofuels[J]. Nature, 2012, 488(7411):329-335.
[2]MIAO X L, WU Q Y. Exploitation of biomass renewable energy sources of microalgae[J]. Renewable Energy, 2003, 3(109):13-16.
[3]SPOLAORE P, JOANNIS-CASSAN C, DURAN E, et al. Commercial applications of microalgae[J]. Journal of Bioscience and Bioengineering, 2006, 101(2):87-96.
[4]MATA T M, MARTINS A A, CAETANO N S. Microalgae for biodiesel production and other applications: a review[J]. Renewable and Sustainable Energy Reviews, 2010, 14(1):217-232.
[5]BARROS A I, GONCALVES A L, SIMES M, et al. Harvesting techniques applied to microalgae: A review[J]. Renewable and Sustainable Energy Reviews, 2015, 41:1489-1500.
[6]OH H M, LEE S J, PARK M H, et al. Harvesting ofChlorellavulgarisusing a bioflocculant fromPaenibacillussp. AM49[J]. Biotechnology Letters, 2001, 23(15):1229-1234.
[7]UDUMAN N, QI Y, DANQUAH M K, et al. Dewatering of microalgal cultures: a major bottleneck to algae-based fuels[J]. Journal of Renewable and Sustainable Energy, 2010, 2(1):012701.
[8]HENDERSON R, PARSONS S A, JEFFERSON B. The impact of algal properties and pre-oxidation on solid-liquid separation of algae[J]. Water Research, 2008, 42(8-9):1827-1845.
[9]LEE S J, KIM S B, KIM J E, et al. Effects of harvesting method and growth stage on the flocculation of the green algaBotryococcusbraunii[J]. Letters in Applied Microbiology, 1998, 27(1):14-18.
[10]KONG Q, LI L, MARTINEZ B, et al. Culture of microalgaeChlamydomonasreinhardtiiin wastewater for biomass feedstock production[J]. Applied Biochemistry and Biotechnology, 2010, 160(1):9-18.
[11]LI Y, HORSMAN M, WU N, et al. Biofuels from microalgae[J]. Biotechnology Progress, 2008, 24(4):815-820.
[12]马志欣,尚春琼,胡小丽,等.微藻絮凝采收的研究进展[J].基因组学与应用生物学,2016, 35(4):942-948.
[13]翟 玥,杨 哲,安 阳,等. 壳聚糖凝聚去除景观水中微囊藻的研究[J]. 净水技术, 2009, 28(6):58-60.
[14]胡沅胜,刘 斌,郝晓地,等.微藻处理污水中的絮凝分离/采收研究现状与展望[J].环境科学学报, 2015, 35(1):12-29.
[15]POELMAN E, DEPAUW N, JEURISSEN B. Potential of electrolytic flocculation for recovery of micro-algae[J] . Resources Conservation And Recycling, 1997, 19(1):1-10.
[16]VANDAMME D, PONTES S C, GOIRIS K, et al. Evaluation of electro-coagulation-flocculation for harvesting marine and freshwater microalgae[J]. Biotechnology and Bioengineering, 2011, 108(10):2320-2329.
[17]UDUMAN N, BOURNIQUEL V, DANQUAH M K, et al. A parametric study of electrocoagulation as a recovery process of marine microalgae for biodiesel production[J]. Chemical Engineering Journal, 2011, 174(1):249-257.
[18]HU Y R, GUO C, XU L, et al. A magnetic separator for efficient microalgae harvesting[J]. Bioresource Technology, 2014, 158:388-391.
[19]HANOTU J, BANDULASENA H C, ZIMMERMAN W B. Microflotation performance for algal separation[J]. Biotechnology and Bioengineering, 2012, 109(7):1663-1673.
[20]EDZWALD J K. Algae, bubbles, coagulants, and dissolved air flotation[J]. Water Science and Technology, 1993, 27(10):67-81.
[21]YAN Y D, JAMESON G J. Application of the Jameson cell technology for algae and phosphorus removal from maturation ponds[J]. International Journal of Mineral Processing, 2004, 73(1):23-28.
[22]ZHOU W, MIN M, HU B, et al. Filamentous fungi assisted bio-flocculation: a novel alternative technique for harvesting heterotrophic and autotrophic microalgal cells[J]. Separation and Purification Technology, 2013, 107(4):158-165.
[23]ZHOU W, CHENG Y, LI Y, et al. Novel fungal pelletization-assisted technology for algae harvesting and wastewater treatment[J]. Applied Biochemistry and Biotechnology, 2012, 167(2):214-228.
[24]MOHN F H. Experiences and strategies in the recovery of biomass from mass cultures of microalgae[J]. Algae Biomass, 1980:471-547.
[25]WAN C, ZHAO X, GUO S, et al. Bioflocculant production fromSolibacillussilvestrisW01 and its application in cost-effective harvest of marine microalgaNannochloropsisoceanicaby flocculation[J]. Bioresource Technology, 2013, 135:207-212.
[26]GUO S, ZHAO X, WAN C, et al. Characterization of flocculating agent from the self-flocculating microalgaScenedesmusobliquusAS-6-1 for efficient biomass harvest[J]. Bioresource Technology, 2013, 145:285-289.
[27]SALIM S, BOSMA R, VERMU M H, et al. Harvesting of microalgae by bio-flocculation[J]. Journal of Applied Phycology, 2011, 23(5):849-855.
[28]HEASMAN M, DIEMAR J, O'CONNOR W, et al. Development of extended shelf-life microalgae concentrate diets harvested by centrifugation for bivalve molluscs - a summary[J]. Aquaculture Research, 2000, 31(8-9):637-659.
[29]DASSEY A J, THEEGALA C S. Harvesting economics and strategies using centrifugation for cost effective separation of microalgae cells for biodiesel applications[J]. Bioresource Technology, 2013, 128:241-245.
[30]RICHMOND A, HU Q. Handbook of microalgal culture: applied phycology and biotechnology[M]. US: John Wiley & Sons, 2013:1-719.
[31]MOLINA GRIMA E, BELARBI E H, ACI N FERN NDEZ F G, et al. Recovery of microalgal biomass and metabolites: process options and economics[J]. Biotechnology Advances, 2003, 20(7 8):491-515.
[32]MILLEDGE J J, HEAVEN S. A review of the harvesting of microalgae for biofuel production[J]. Reviews In Environmental Science and Biotechnology, 2013, 12(2):165-178.
[33]CHENG Y, JUANG Y, LIAO G, et al. Harvesting ofScenedesmusobliquusFSP-3 using dispersed ozone flotation[J]. Bioresource Technology, 2011, 102(1):82-87.
[34]SUKENIK A, BILANOVIC D, SHELEF G. Flocculation of microalgae in brackish and sea waters[J]. Biomass, 1988, 15(3):187-199.
[35]ALAM M A, WAN C, GUO S, et al. Characterization of the flocculating agent from the spontaneously flocculating microalgaChlorellavulgarisJSC-7[J]. Journal of Bioscience and Bioengineering, 2014, 118(1):29-33.
[36]SALIM S, VERMU M H, WIJFFELS R H. Ratio between autoflocculating and target microalgae affects the energy-efficient harvesting by bio-flocculation[J]. Bioresource Technology, 2012, 118:49-55.
[37]SALIM S, SHI Z, VERMUЁ M H, et al. Effect of growth phase on harvesting characteristics, autoflocculation and lipid content of Ettlia texensis for microalgal biodiesel production[J]. Bioresource Technology, 2013, 138:214-221.
[38]TAYLOR R L, RAND J D, CALDWELL G S. Treatment with algae extracts promotes flocculation, and enhances growth and neutral lipid content inNannochloropsisoculata-a candidate for biofuel production[J]. Marine Biotechnology, 2012, 14(6):774-781.
[39]SCHENK P M, THOMAS-HALL S R, STEPHENS E, et al. Second generation biofuels: high-efficiency microalgae for biodiesel production[J]. Bioenergy Research, 2008, 1(1):20-43.
[40]ELDRIDGE R J, HILL D R A, GLADMAN B R. A comparative study of the coagulation behaviour of marine microalgae[J]. Journal of Applied Phycology, 2012, 24(6):1667-1679.
[41]万 春,张晓月,赵心清,等.利用絮凝进行微藻采收的研究进展[J].生物工程学报, 2015, 31(2):161-171.
[42]MANHEIM D, NELSON Y. Settling and bioflocculation of two species of algae used in wastewater treatment and algae biomass production[J]. Environmental Progress & Sustainable Energy, 2013, 32(4):946-954.
[43]KIM D G, LA H J, AHN C Y, et al. Harvest ofScenedesmussp. with bioflocculant and reuse of culture medium for subsequent high-density cultures[J]. Bioresource Technology, 2011, 102(3):3163-3168.
[44]WANG H, LAUGHINGHOUSE H D, ANDERSON M A, et al. Novel bacterial isolate from Permian groundwater, capable of aggregating potential biofuel-producing microalgaNannochloropsisoceanicaIMET1[J]. Applied and Environmental Microbiology, 2012, 78(5):1445-1453.
[45]LEE A K, LEWIS D M, ASHMAN P J. Microbial flocculation, a potentially low-cost harvesting technique for marine microalgae for the production of biodiesel[J]. Journal of Applied Phycology, 2009, 21(5):559-567.
[46]VAN DEN HENDE S, VERVAEREN H, DESMET S, et al. Bioflocculation of microalgae and bacteria combined with flue gas to improve sewage treatment[J]. New Biotechnology, 2011, 29(1):23-31.
[47]ZHANG J, HU B. A novel method to harvest microalgae via co-culture of filamentous fungi to form cell pellets[J]. Bioresource Technology, 2012, 114:529-535.
[48]XIE S, SUN S, DAI S Y, et al. Efficient coagulation of microalgae in cultures with filamentous fungi[J]. Algal Research, 2013, 2(1):28-33.
[49]AL-HOTHALY K A, ADETUTU E M, TAHA M, et al. Bio-harvesting and pyrolysis of the microalgaeBotryococcusbraunii[J]. Bioresource Technology, 2015, 191:117-123.
[50]巫小丹,阮榕生,王 辉,等.菌藻共生系统处理废水研究现状及发展前景[J].环境工程, 2014, 32(3):34-37.
[51]HANSEL P A, GUY RIEFLER R, STUART B J. Efficient flocculation of microalgae for biomass production using cationic starch[J]. Algal Research, 2014, 5:133-139.
[52]GROSSART H P, CZUB G, SIMON M. Algae bacteria interactions and their effects on aggregation and organic matter flux in the sea[J]. Environmental Microbiology, 2006, 8(6):1074-1084.
[53]MACKAY S, GOMES E, HOLLIGER C, et al. Harvesting ofChlorellasorokinianaby co-culture with the filamentous fungus Isaria fumosorosea: a potential sustainable feedstock for hydrothermal gasification[J]. Bioresource Technology, 2015, 185:353-361.
[54]HENDERSON R K, BAKER A, PARSONS S A, et al. Characterisation of algogenic organic matter extracted from cyanobacteria, green algae and diatoms[J]. Water Research, 2008, 42(13):3435-3445.
[55]RAMOS TERCERO E A, SFORZA E, MORANDINI M, et al. Cultivation ofchlorellaprotothecoideswith urban wastewater in continuous photobioreactor: Biomass productivity and nutrient removal[J]. Applied Biochemistry and Biotechnology, 2014, 172(3):1470-1485.
[56]LAVOIE A, DE LA NO E J. Harvesting ofScenedesmusobliquusin wastewaters: auto or bioflocculation? [J]. Biotechnology and Bioengineering, 1987, 30(7):852-859.
[57]ZHOU W, RUAN R, WANG J. Bio-flocculation of microalgae: Status and prospects[J]. Current Biotechnology, 2015, 4(4):448-456.
[58]LUPI F M, FERNANDES H, SACORREIA I, et al. Temperature profiles of cellular growth and exopolysaccharide synthesis byBotryococus-brauniikutzuc-58[J]. Journal of Applied Phycology, 1991, 3(1):35-42.
[59]REBOLLOSO FUENTES M M, GARCIA SANCHEZ J L, FERNNDEZ SEVILLA J M, et al. Outdoor continuous culture ofPorphyridiumcruentumin a tubular photobioreactor: quantitative analysis of the daily cyclic variation of culture parameters[J]. Progress in Industrial Microbiology, 1999, 35:271-288.
[60]GROSSART H P, CZUB G, SIMON M. Algae-bacteria interactions and their effects on aggregation and organic matter flux in the sea[J]. Environmental Microbiology, 2006, 8(6):1074-1084.
Status and prospects of microalgae harvesting with biological flocculation
FAN Hua1, HAN Pei1, WANG Jing-han2, LI Kun1, LI Jun1, ZHOU Wen-guang1
(1. Key Laboratory of Poyang Lake Environment and Resources Utilization, Ministry of Education School of Resources,Environmental & Chemical Engineering, Nanchang University, Nanchang 330031; 2. Environmental Simulation and Pollution Control State Key Joint Laboratory, State Environmental Protection Key Laboratory of Microorganism Application and Risk Control (SMARC), School of Environment, Tsinghua University, Beijing 100084, China)
Microalgae are important photosynthetic microorganisms playing important roles in energy conversion and carbon cycle. At present, algae biotechnology is mainly used in carbon fixation and pollution control, production of bio-energy, food, medicine, feed, and other value-added by-products, etc. However, there are still many technical bottlenecks need to be addressed such as energy-intensive microalgae harvesting, which is one of the main obstacles that hinders microalgae industry. Traditional harvesting methods such as sedimentation, filtration, and centrifugation are either of low efficiency or high cost for microalgae harvesting due to low concentration in medium and the relatively small size of microalgal cells. Biological flocculation method, mediated through flocculating algae, fungi, bacteria and/or microbial flocculants extracted from microorganisms, is considered as one of the most promising techniques for algae harvesting due to advantages of high safety, high recovery efficiency, low fundamental investment, low operating energy consumption, and no secondary pollution to the environment, etc. This paper critically reviewed different microalgae harvesting methods with particular focus on the current status and prospects of biological flocculation.
microalgae; flocculating microorganisms; biological flocculation; harvesting
2016-12-10;
2017-02-20
国家自然基金(No.51668044);江西省重点研发计划(20161BBH80029);江西省教育厅科学技术研究重点项目(150029);第59批中国博士后科学基金(No. 2016M591188)
樊华,副教授,研究方向为污染防治
周文广,博士,教授,研究方向为生物技术与微藻产业联盟,E-mail: wgzhou@ncu.edu.cn
Q949.2
A
2095-1736(2017)02-0026-07
doi∶10.3969/j.issn.2095-1736.2017.02.026

