盐处理对甜菜生长和渗透调节物质积累的影响
伍国强,冯瑞军,李善家,王春梅,焦琦,刘海龙(.兰州理工大学生命科学与工程学院,甘肃 兰州 730050;.中国农业科学院兰州畜牧与兽药研究所,甘肃 兰州 730050)
盐处理对甜菜生长和渗透调节物质积累的影响
伍国强1*,冯瑞军1,李善家1,王春梅2,焦琦1,刘海龙1
(1.兰州理工大学生命科学与工程学院,甘肃 兰州 730050;2.中国农业科学院兰州畜牧与兽药研究所,甘肃 兰州 730050)
采用室内盆栽法,探究了不同浓度NaCl (0、50、100和150 mmol/L)对60 d龄甜菜植株生长及渗透调节物质积累的影响。结果表明, 添加50、100和150 mmol/L NaCl明显促进甜菜植株生长,维持良好水分状况。与对照(0 mmol/L)相比,不同浓度NaCl均显著增加甜菜叶片、叶柄和贮藏根的鲜重和干重(P<0.05)。高盐(150 mmol/L)条件下,甜菜叶片和叶柄Na+浓度较对照分别增加4.4和4.9倍(P<0.05),贮藏根和侧根Na+相对分配比例分别降低44%和53%(P<0.05);叶片和侧根K+浓度分别降低39%和55%(P<0.05),叶柄和贮藏根K+相对分配比例分别增加35%和80%(P<0.05)。盐处理下贮藏根蔗糖含量降低44%~50%(P<0.05),果糖含量减少31%~36%(P<0.05),而葡萄糖含量维持在稳定水平。另外,高盐使贮藏根的脯氨酸浓度较对照增加93%(P<0.05)。由此可见,甜菜通过叶片和叶柄积累大量Na+、根部维持K+的稳态平衡以及提高脯氨酸含量,以适应盐渍生境。
甜菜; 耐盐性; 脯氨酸; 可溶性糖
盐胁迫是限制植物生长和产量的主要环境因子,全球超过20%的耕地遭受盐分的威胁[1]。尤其在频繁灌溉地区,劣质水源的利用导致土壤次生盐渍化,进一步加重土壤盐分对植物的伤害[1-3]。我国是世界上土壤盐碱化最为严重的国家之一,盐碱化和盐渍土地面积约为3460万hm2,其中耕地约为760万hm2,主要分布在北方干旱、半干旱地区和东部滨海地区[4-5]。土壤盐渍化使大多数农作物幼苗形态难以建立,即使幼苗成活,其产量也严重下降,在高盐地区甚至导致绝产,对农业生产造成严重危害[6-7]。此外,土壤盐渍化致使大面积的土地资源难以开发利用,威胁着畜牧业生产及生态环境建设[8]。因此,通过培育耐盐性强的植物,以利用和改良盐碱地,对提高土地利用效率和生产力以及生态环境建设具有重要作用[9-10]。在对大多数植物、特别是嗜钠植物(natrophilic plants)的耐盐机制深入了解的前提下,通过生物技术手段和人工措施才能更有效地改良和利用盐碱化土地[11]。因此,研究嗜钠作物的耐盐适应生理机制具有重要的现实意义。
甜菜(Betavulgaris)为黎科(Chenopodiaceae)甜菜属(Beta)二年生草本植物,是一种重要的糖料作物[12],其糖产量约占世界总糖产量的35%,在我国北方干旱、半干旱地区广泛种植[12-13]。甜菜属于典型的嗜钠作物,具有耐盐碱、抗旱、耐贫瘠及适应性广等特点,是开发利用盐碱地的先锋作物,尤其在粮食作物低产的轻盐碱、半干旱地区种植具有较好的经济效益[14]。然而,甜菜种子萌发和幼苗生长期对盐分较为敏感[15],特别是高盐条件下其幼苗形态难以建成[16]。另外,其他非生物胁迫(如水分亏缺、高温、寒冷等)使甜菜叶片的光合速率下降,根生长受到抑制,糖积累减少,从而影响甜菜的产量和品质[17]。甜菜还是一种最具潜力的能源作物,相比于甜高粱(Sorghumbicolor)和甘蔗(Saccharumsinensis),其在开发燃料乙醇方面具有广阔的应用前景[12]。Wu等[18-19]利用农学和生理学指标通过隶属函数法对甘肃省广泛栽培的3个优良甜菜品种的耐盐性和抗旱性分别进行综合评价,筛选出具有较强耐盐性和抗旱性的品种“甘糖7号”。Wu等[20]进一步研究发现,添加5~50 mmol/L NaCl可使幼苗期甜菜通过增加地上部叶Na+的积累量,维持幼苗水分状况、促进生长,并显著缓解由渗透胁迫引起的不利影响;即使在介质中不添加NaCl,渗透胁迫后甜菜叶中Na+的积累量始终维持在稳定水平。尽管目前对甜菜幼苗期耐盐机制的研究已有大量报道[16,18,20],然而,有关壮苗期甜菜植株、特别是其不同组织(叶片、叶柄、贮藏根和侧根)对盐分响应特性的研究报道较少。鉴于此,本研究以60 d龄甜菜植株为材料,分析不同浓度NaCl处理对其生长及不同组织Na+、K+、可溶性糖和脯氨酸等渗透调节物质积累的影响,探究壮苗期甜菜对盐分的响应机理,为今后盐渍化地区甜菜的科学合理化种植提供理论参考。
1 材料与方法
1.1 试验材料及其培养
供试甜菜(B.vulgaris)品种为“甘糖7号”,属多粒型品种,耐盐、抗旱性较强[18-19],种子由武威三农种业科技有限公司提供。试验于2015年7-12月在兰州理工大学生命科学与工程学院植物培养室内进行,培养室昼夜温度为(28±2) ℃/(23±2) ℃,光照16 h/d,光强为500~600 μmol/(m2·s),空气相对湿度为60%~70%。2015年7月2日,挑选籽粒饱满、均匀一致的种子,播种在装有灭菌蛭石的培养盒(5 cm×5 cm×5 cm,12孔/培养盒)中,每孔播1~2粒种子,浇灌蒸馏水进行萌发。生长4 d,待2片子叶露出蛭石表面后,浇灌等量的1/2 Hoagland营养液进行培养,三叶期间苗,每孔留2株幼苗。营养液配方为:2 mmol/L KNO3,0.5 mmol/L NH4H2PO4,0.25 mmol/L MgSO4·7H2O,0.1 mmol/L Ca(NO3)2·4H2O,0.5 mmol/L Fe-citrate,92 μmol/L H3BO3,18 μmol/L MnCl2·4H2O,1.6 μmol/L ZnSO4·7H2O,0.6 μmol/L CuSO4·5H2O,0.7 μmol/L (NH4)6Mo7O24·4H2O。培养15 d后,挑选高度、叶片数量一致的健壮幼苗移栽到装有蛭石的塑料盆(11 cm×10 cm)中,继续浇灌1/2 Hoagland营养液进行培养,每盆1株。
1.2 试验处理
2015年9月3日,待甜菜幼苗生长60 d后,挑选长势均匀、一致的植株,分别用含0(对照)、50、100和150 mmol/L NaCl的1/2 Hoagland营养液处理,每个处理设3次重复。每3 d更换一次处理液,以保持恒定的NaCl浓度。处理30 d后取样,分别测定相关指标。
1.3 测定指标
干重、鲜重和组织含水量:参考Wu等[18]的方法略有修正,将植物材料用蒸馏水冲洗表面灰尘和残留盐后,吸干其表面水分,将其分成叶片、叶柄、贮藏根和侧根等四部分,称取鲜重;随后将样品装在信封中,杀青后,置于80 ℃烘干至恒重,称取干重。参考Yue等[21]的方法计算组织含水量:组织含水量(g/g)=(鲜重-干重)/干重。
Na+、K+浓度和Na+/K+:参考Yue等[21]的方法略有修正,将恒重的干样品置于研钵中,研磨至粉末状后,转入试管中,加10 mL 100 mmol/L冰乙酸,用塑料薄膜密封试管,置于96 ℃沸水中水浴2 h。待冷却后,过滤,上清液稀释适当倍数后,在火焰光度计(2655-00,Cole-Parmer Instrument Co.,USA)上测定Na+、K+浓度。以每g样品干重所含的毫摩尔数表示离子浓度(mmol/g)。Na+/K+及Na+、K+相对分配比例计算参考Wang等[22]的方法。
蔗糖、果糖、葡萄糖和脯氨酸浓度:参考Liu等[13]的方法略有修正,叶片、叶柄、贮藏根和侧根的可溶性糖用80%乙醇提取,上清液分别在480、630和480 nm处测定样品吸光度,分别用蔗糖、葡萄糖和D-果糖做标准曲线,计算3种可溶性糖含量。脯氨酸浓度采用茚三酮比色法[23]测定。以每g样品干重所含的毫克数表示可溶性糖含量(mg/g),脯氨酸浓度则用每g样品干重所含的微摩尔数(μmol/g)表示。
1.4 数据处理
用SPSS 19.0软件(SPSS Inc., USA)进行统计分析,采用单因素方差分析不同处理间各项指标的差异,采用Duncan检验进行显著性差异分析(P<0.05),用Excel制图。
2 结果与分析
2.1 盐处理对甜菜鲜重、干重和组织含水量的影响
由图1可知, 50、100和150 mmol/L NaCl明显促进甜菜植株的生长(图1)。与对照(0 mmol/L)相比,不同浓度NaCl均显著增加甜菜叶片、叶柄和贮藏根的鲜重和干重(P<0.05)(图2)。在150 mmol/L NaCl下,甜菜叶片、叶柄和贮藏根鲜重较对照分别增加94%、109%和58%(P<0.05),干重分别增加75%、89%和91%(P<0.05) (图2)。与对照相比,盐处理并没有改变甜菜植株组织含水量(图2)。可见,50~150 mmol/L NaCl促进甜菜植株的生长,增加其生物量,维持组织内水分状况。

图1 不同浓度NaCl对甜菜形态的影响Fig.1 Effects of different concentrations of NaCl on morphology of sugar beet
2.2 盐处理对甜菜Na+、K+浓度及其相对分配比例的影响
随着NaCl浓度的递增,甜菜叶片、叶柄、贮藏根和侧根中Na+浓度呈显著性增加趋势(P<0.05)(图3)。150 mmol/L NaCl下,叶片、叶柄、贮藏根和侧根的Na+浓度较对照分别增加4.4、4.9、0.7和1.2倍(P<0.05)(图3)。相比之下,叶片和侧根中K+浓度均呈下降趋势,尤其侧根中下降的幅度最大(图3)。在100和150 mmol/L NaCl下,叶片中K+浓度较对照分别下降35%和39%(P<0.05),侧根中分别下降59%和55%(P<0.05),而叶柄和贮藏根没有显著性变化(P>0.05)(图3)。在50、100和150 mmol/L NaCl下,甜菜叶片、叶柄和侧根的Na+/K+均显著高于对照(P<0.05)(图3)。100和150 mmol/L NaCl也使贮藏根Na+/K+分别增加64%和81%(P<0.05)(图3)。
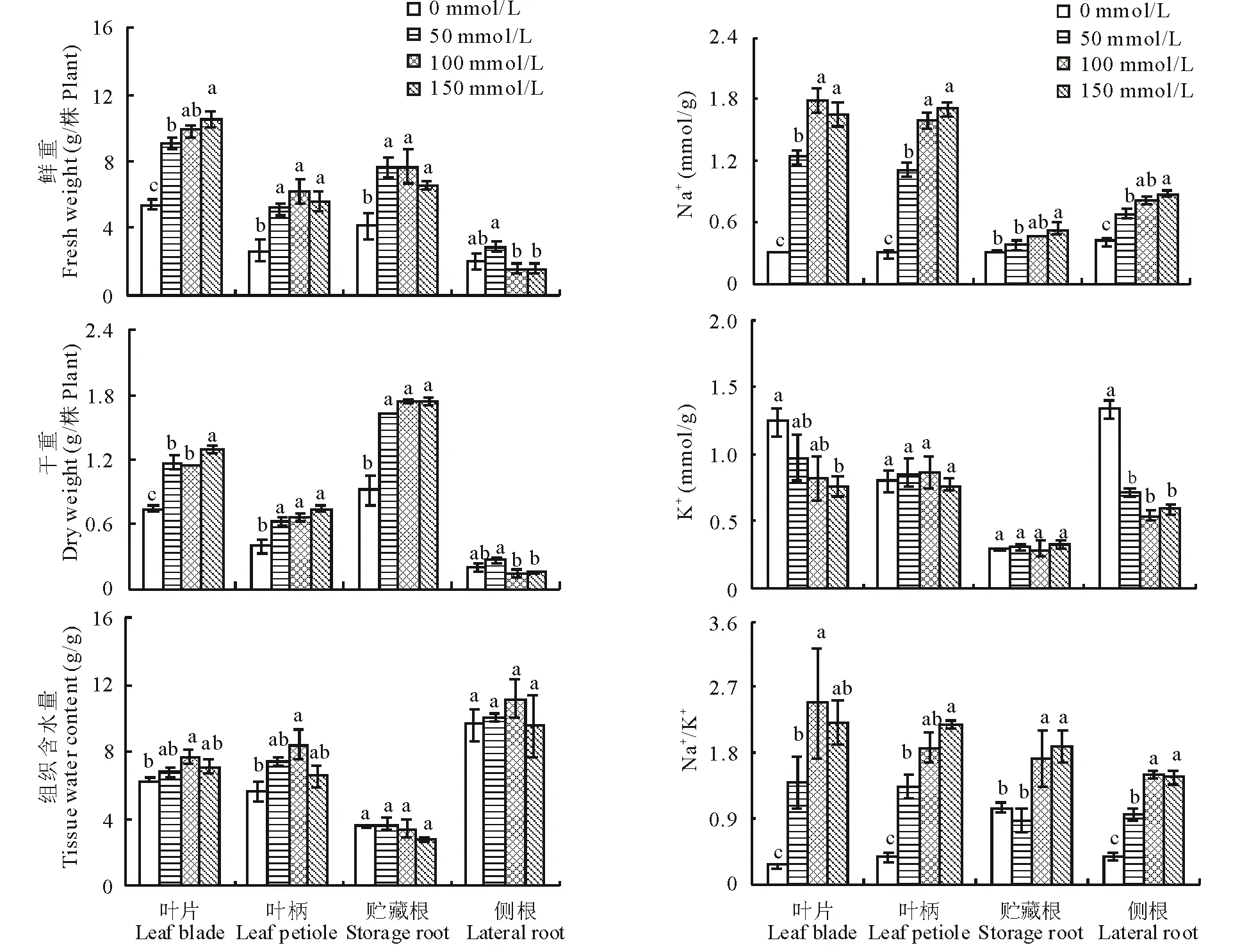
图2 不同浓度NaCl对甜菜鲜重、干重和组织含水量的影响Fig.2 Effects of different concentrations of NaCl on fresh weight, dry weight and tissue water content of sugar beet

图2 不同浓度NaCl对甜菜鲜重、干重和组织含水量的影响Fig.2 Effects of different concentrations of NaCl on fresh weight, dry weight and tissue water content of sugar beet
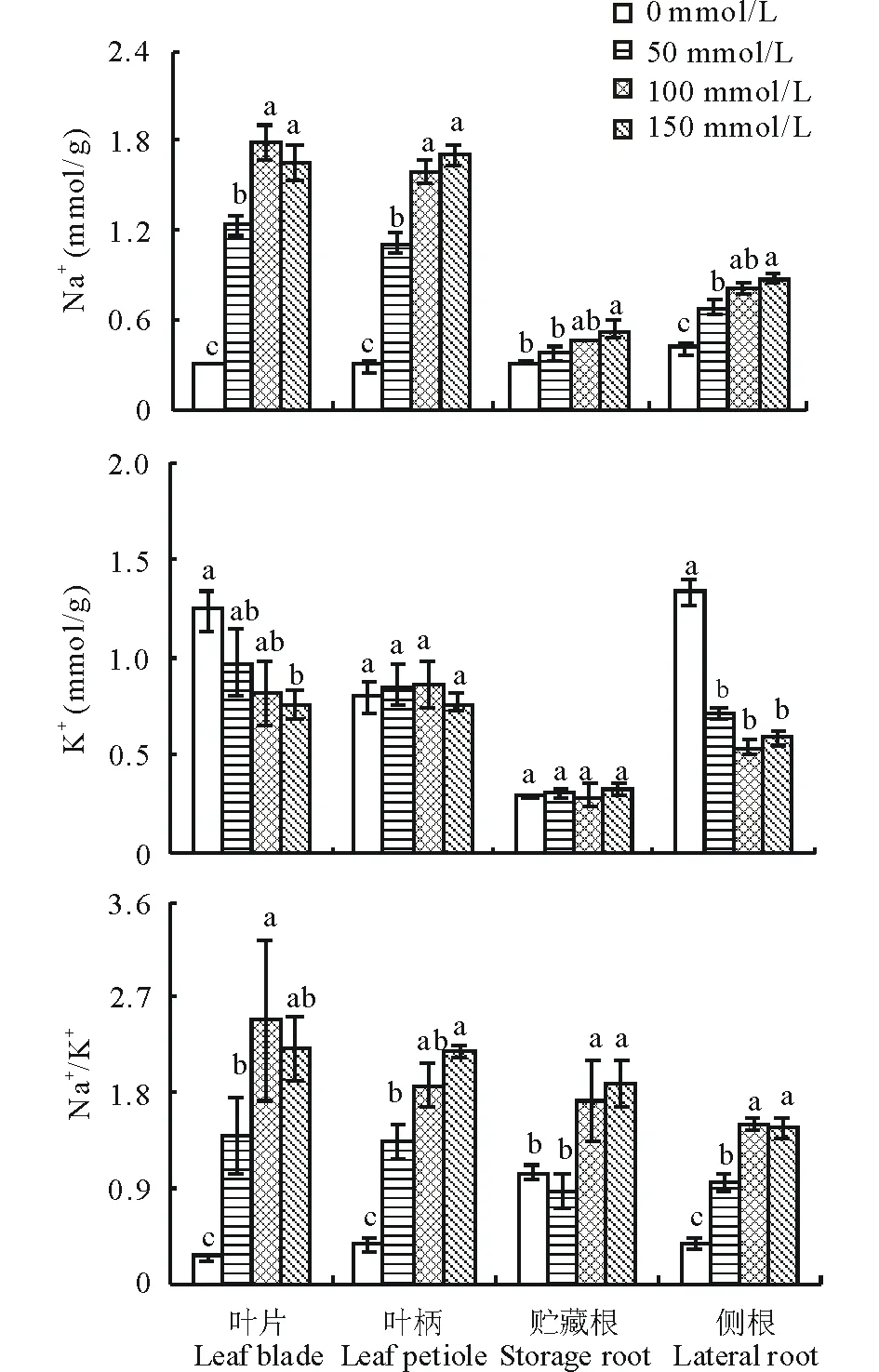
图3 不同浓度NaCl对甜菜Na+、K+浓度和Na+/K+的影响Fig.3 Effects of different concentrations of NaCl on Na+, K+ concentrations and Na+/K+ of sugar beet
图柱上不同小写字母表示不同浓度NaCl处理下差异显著(P<0.05),下同。Different small letters indicate significant differences among different concentrations of NaCl atP<0.05, the same below.
在NaCl处理下,叶片和叶柄中Na+相对分配比例较对照增加40%~60%(P<0.05),而贮藏根和侧根中降低40%~60%(P<0.05) (表1)。尽管盐处理使整株K+含量较对照显著性下降,但叶柄和贮藏根的K+相对分配比例增加32%~55%(P<0.05);叶片中K+比例没有显著性变化(P>0.05),而侧根中下降30%~54% (P<0.05) (表2)。由此可见,盐处理下,一方面甜菜植株能将吸收的大量Na+转运至叶片和叶柄,从而减少贮藏根和侧根中Na+的比例;另一方面其能维持叶片、叶柄和贮藏根中K+稳定水平,从而适应盐渍生境。
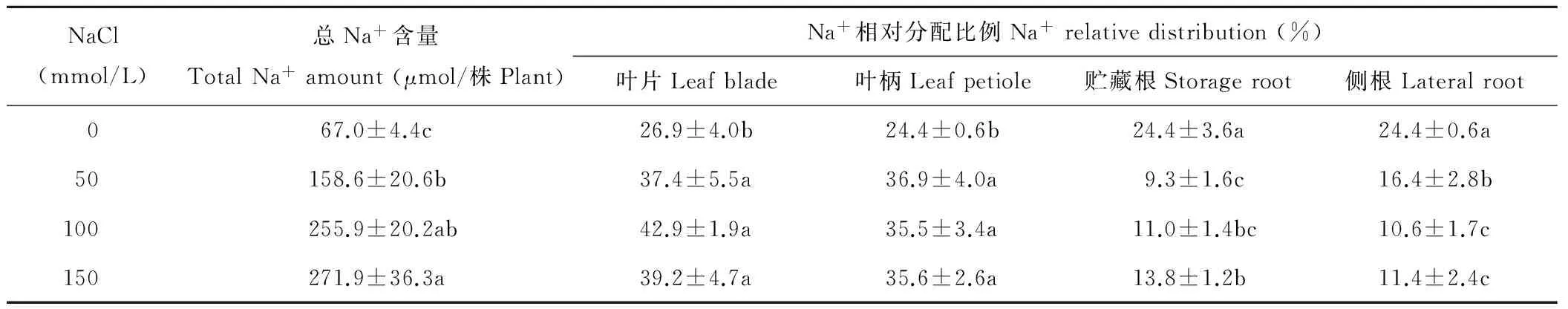
表1 不同浓度NaCl对甜菜 Na+相对分配比例的影响Table 1 Effects of different concentrations of NaCl on Na+ relative distribution of sugar beet
注:同列不同小写字母表示不同浓度NaCl处理下差异显著(P<0.05),下同。
Note: Different small letters within the same column indicate significant differences among different concentrations of NaCl atP<0.05, the same below.

表2 不同浓度NaCl对甜菜K+相对分配比例的影响Table 2 Effects of different concentrations of NaCl on K+ relative distribution of sugar beet
2.3 盐处理对甜菜可溶性糖和脯氨酸积累的影响
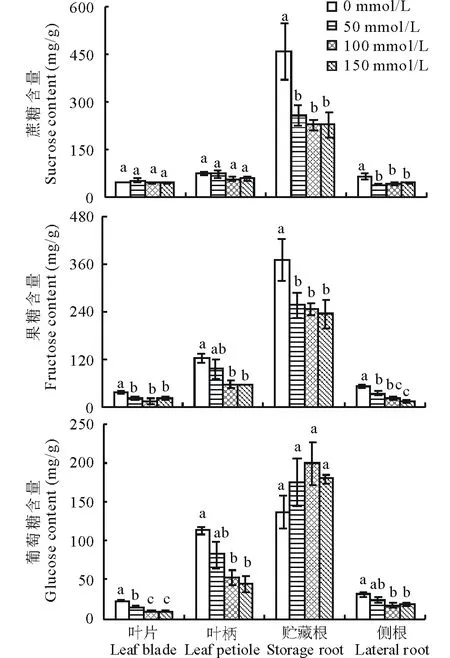
图4 不同浓度NaCl对甜菜蔗糖、果糖和葡萄糖含量的影响Fig.4 Effects of different concentrations of NaCl on sucrose, fructose, and glucose contents of sugar beet
在正常条件(0 mmol/L NaCl)下,蔗糖、果糖和葡萄糖主要积累在甜菜贮藏根中,占植株总糖量的63%,且蔗糖含量明显高于果糖和葡萄糖(图4)。与对照相比,50、100和150 mmol/L NaCl处理使甜菜贮藏根蔗糖含量分别降低44%、49%和50%(P<0.05),果糖含量分别降低31%、33%和36%(P<0.05) (图4)。此外,盐处理下叶片、叶柄和侧根中蔗糖、果糖和葡萄糖含量较对照均有所下降(除叶片中蔗糖维持稳定的水平)。在150 mmol/L NaCl下,叶片中果糖和葡萄糖含量较对照分别下降43%和63%(P<0.05),叶柄中果糖和葡萄糖含量分别下降54%和60%(P<0.05),侧根中蔗糖、果糖和葡萄糖含量分别下降34%、72%和44%(P<0.05) (图4)。由此可见,盐处理抑制甜菜贮藏根中可溶性糖的积累,尤其对蔗糖含量的影响最大。
由图5可以看出,50和100 mmol/L NaCl对甜菜植株不同组织中脯氨酸的积累没有显著性影响(P>0.05)。在150 mmol/L NaCl下,脯氨酸浓度在贮藏根中较对照增加93%(P<0.05);然而,在叶片、叶柄和侧根中维持在稳定水平(图5)。
3 讨论
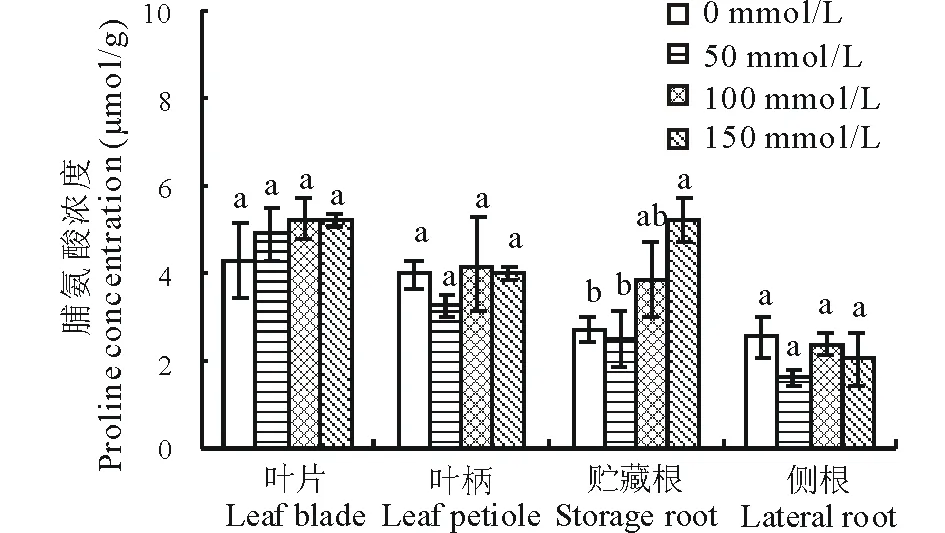
图5 不同浓度NaCl处理对甜菜脯氨酸浓度的影响Fig.5 Effects of different concentrations of NaCl on proline concentration of sugar beet
甜菜是仅次于甘蔗的第二大糖料作物,主要分布在北温带。我国甜菜种植面积约26万hm2,主要分布在新疆、内蒙古、黑龙江和甘肃等地区[24]。这些地区由于频繁性季节交替作用,其环境变化常引发土壤干旱和盐碱化,使甜菜种子萌发和幼苗生长受到严重威胁。Wakeel等[25]研究发现,4 mmol/L NaCl处理显著增加甜菜地上部鲜重。Wu等[20]研究表明,低浓度NaCl(5~50 mmol/L)能促进3周龄甜菜幼苗的生长,高浓度NaCl(100和150 mmol/L)对其生长没有显著性影响。耿贵等[26]研究表明,40 mmol/L NaCl可增加甜菜干物质重量;随着NaCl浓度的增加(80~380 mmol/L),甜菜幼苗叶面积逐渐变小,生物量降低。本研究结果表明,添加50~150 mmol/L NaCl均促进壮苗期甜菜植株的生长,表现为叶面积大、叶片浓绿(图1),其叶片、叶柄和贮藏根的鲜重和干重增加70%~90% (图2)。类似的结果在盐生植物,如细叶滨藜(Atriplexgmelini)[27]、沙芥(Pugioniumcornutum)[28]和盐地碱蓬(Suaedasalsa)[29]以及旱生植物霸王(Zygophyllumxanthoxylum)[21]中均有报道。盐处理下,这些植物一方面通过增加叶片的肉质化程度、提高组织含水量,另一方面促进植物新叶的生长、提高植株的生物量,将叶片中的Na+稀释到毒害水平以下,以适应盐渍环境[21-22,27-28]。可见,适量浓度NaCl对甜菜正常生长和发育是必需的,其壮苗期植株比幼苗期具有更强的耐盐性。
Subbarao等[30]认为Na+是一种功能性营养元素,有别于必需营养元素,具有K+的一些生理功能,如:渗透调节作用、调控气孔运动及酶活性等。Wu等[20]研究发现,50 mmol/L NaCl能有效缓解渗透胁迫对甜菜幼苗的伤害,他们认为大量的脯氨酸和Na+积累是甜菜适应干旱的有效措施。Yue等[21]研究表明,NaCl能提高霸王的抗旱能力,增强光合作用效率。本研究结果表明,盐处理使甜菜植株地上部叶片和叶柄Na+浓度较对照增加4~5倍(图3),占植株总Na+的60%~70%,而根中Na+相对分配比例降低40%~60%(表1)。已有研究表明,盐渍环境下,霸王、沙芥和盐地碱蓬能将大量Na+转运到肉质化的叶片、并将其区域化至液泡中,一方面降低细胞渗透势、增强细胞吸水能力,另一方面使细胞质内的Na+保持在非毒害水平[21,28-29,31]。因此,尽管植物在盐处理下能积累大量Na+,但这些Na+并不一定对植物造成伤害。Wu等[32]将霸王液泡膜Na+/H+逆向转运蛋白ZxNHX和H+-PPaseZxVP1-1基因同时转入甜菜,发现转基因甜菜的耐盐性显著增强,生长量明显增加。可见,甜菜属于积盐型作物,其吸收的绝大部分Na+积累在地上部,而贮藏根中的Na+保持在正常生长时的含量水平。此外,K+是植物体内必需的一种大量矿质营养元素[2,18,25]。盐胁迫下,Na+会竞争植物根系对K+的吸收,致使植物体内K+严重亏缺[1,3,33]。本研究结果表明,盐处理下甜菜植株叶片和侧根中K+浓度均显著性下降,其中侧根中下降的幅度最大,为50%~60%,叶柄中没有显著性变化(图3)。进一步分析发现,盐处理下甜菜叶柄和贮藏根中K+相对分配比例显著性增加(P<0.05) (表2)。斯琴等[34]研究发现,K+参与糖运输和代谢,促进光合产物从叶片向贮藏根运输。由此可见,叶柄作为甜菜叶片与根之间水分和养分运输的通道,盐处理下其装载的K+可能是维持甜菜叶光合作用的关键因子。
可溶性糖和脯氨酸是植物体内重要的渗透调节物质,具有降低植物细胞渗透势[35-36]、稳定亚细胞和清除抗氧化系统的作用[37]。贮藏根的糖含量是决定甜菜品质的重要因素之一[13]。逆境胁迫下糖含量的变化可为甜菜育种和改良品质提供可靠的理论依据。本研究结果表明,在50~150 mmol/L NaCl下,甜菜贮藏根中的蔗糖和果糖含量较对照显著性降低,而葡萄糖含量维持在稳定的水平(图4)。Liu等[13]研究发现,甜菜贮藏根蔗糖含量随NaCl浓度增加而呈下降趋势;但在过量表达拟南芥(Arabidopsisthaliana)液泡膜Na+/H+逆向转运蛋白AtNHX3基因的甜菜中其含量并没有下降。Wu等[32]的研究进一步表明,过量表达ZxNHX和ZxVP1-1基因使甜菜贮藏根的果糖、蔗糖和葡萄糖含量显著性增加。最近研究发现,H+-PPase定位于韧皮部筛管-伴胞(sieve element-companion cell, SE-CC)复合体质膜上,其在质膜两侧形成的质子驱动力为韧皮部蔗糖装载具有重要作用[38-39]。由此可见,盐分可能通过降低甜菜质膜两侧的H+驱动力,抑制甜菜韧皮部糖的装载,降低贮藏根糖的积累。此外,添加150 mmol/L NaCl使贮藏根中的脯氨酸浓度较对照显著性增加(图5)。类似的结果在海滨雀稗(Paspalumvaginatum)[11]、马铃薯(Solanumlycopersicum)[40]、甜高粱[41]、扁蓿豆(Melilotoidesruthenica)[42]和橄榄(Oleaeuropaea)[43]等植物中均有报道。Farkhondeh等[44]研究表明,盐胁迫下甜菜耐盐性品种“Dorotea”的脯氨酸含量高于盐敏感品种“SBSI004”。Wu等[18]研究发现,100和200 mmol/L NaCl使甜菜幼苗的脯氨酸浓度显著性增加,且在耐盐品种“甘糖7号”中增加的幅度大于耐盐性弱的品种“ST21916”。由此可见,脯氨酸作为一种渗透调节物质,在甜菜适应盐渍生境中起重要作用。
4 结论
添加50~150 mmol/L NaCl能显著促进壮苗期甜菜植株生长,增加生物量,维持良好水分状况。盐处理下,一方面甜菜能将吸收的大量Na+转运至叶片和叶柄,减少贮藏根和侧根中Na+的比例;另一方面其能维持叶片、叶柄和贮藏根中K+的稳定水平。盐处理也使甜菜贮藏根中的蔗糖和果糖含量减少,而使葡萄糖保持在恒定水平。另外,高盐也显著增加贮藏根脯氨酸浓度。这些结果表明,甜菜通过地上部积累大量Na+、根部维持K+的稳态平衡以及提高脯氨酸含量,以适应盐渍生境。
References:
[1] Gupta B, Huang B. Mechanism of salinity tolerance in plants: physiological, biochemical, and molecular characterization. International Journal of Genomics, 2014, 32: 1-18.
[2] Zhang J L, Shi H Z. Physiological and molecular mechanisms of plant salt tolerance. Photosynthesis Research, 2013, 115(1): 1-22.
[3] Kronzucker H J, Britto D T. Sodium transport in plants: a critical review. New Phytologist, 2011, 189(1): 54-81.
[4] Zhu J K. Plant salt tolerance. Trends in Plant Science, 2001, 6(2): 66-71.
[5] Liu F Q, Liu J L, Zhu R F,etal. Physiological responses and tolerance of four oat varieties to salt stress. Acta Prataculturae Sinica, 2015, 24(1): 183-189. 刘凤歧, 刘杰淋, 朱瑞芬, 等. 4种燕麦对NaCl胁迫的生理响应及耐盐性评价. 草业学报, 2015, 24(1): 183-189.
[6] Lu Y M, Su C Q, Li H F. Effects of different salts stress on seed germination and seedling growth ofTrifoliumrepens. Acta Prataculturae Sinica, 2013, 22(4): 123-129. 卢艳敏, 苏长青, 李会芬. 不同盐胁迫对白三叶种子萌发及幼苗生长的影响. 草业学报, 2013, 22(4): 123-129.
[7] Feng R J, Wu G Q. Progress on physiological and molecular research in sugar beet under salt stress. Sugar Crops of China, 2015, 37(6): 60-65. 冯瑞军, 伍国强. 甜菜耐盐性生理及其分子水平研究进展. 中国糖料, 2015, 37(6): 60-65.
[8] Galvan-ampudia C S, Testerink C. Salt stress signals shape the plant root. Current Opinion in Plant Biology, 2011, 14(3): 296-302.
[9] Wang L Y, Pan J, Xiao H,etal. Effect of soluble salt on planting salt-tolerant plants of coastal saline soil. Acta Agriculturae Boreal-Sinica, 2014, 29(5): 226-231.
[10] Lu Y, Lei J Q, Zeng F J,etal. Effect of salt treatment on the growth and ecophysiological characteristics ofHaloxylonammodendron. Acta Prataculturae Sinica, 2014, 23(3): 152-159. 卢艳, 雷加强, 曾凡江, 等. NaCl处理对梭梭生长及生理生态特征的影响. 草业学报, 2014, 23(3): 152-159.
[11] Jia X P, Deng Y M, Sun X B,etal. Impacts of salt stress on the growth and physiological characteristics ofPaspalumvaginatum. Acta Prataculturae Sinica, 2014, 24(12): 204-212. 贾新平, 邓衍明, 孙晓波, 等. 盐胁迫对海滨雀稗生长和生理特性的影响. 草业学报, 2014, 24(12): 204-212.
[12] Li C Y, Wang Y F, Huang R,etal. Research progress in stress resistance of sugar beet. Sugar Crops of China, 2010, (1): 56-58. 李承业, 王燕飞, 黄润, 等. 我国甜菜抗逆性研究进展. 中国糖料, 2010, (1): 56-58.
[13] Liu H L, Wang Q Q, Yu M M,etal. Transgenic salt-tolerant sugar beet (BetavulgarisL.) constitutively expressing anArabidopsisthalianavacuolar Na+/H+antiporter gene,AtNHX3, accumulates more soluble sugar but less salt in storage roots. Plant Cell and Environment, 2008, 31(9): 1325-1334.
[14] Pan Q, Zhang R. Cultivates of sugar beet for drought-resistance. China Beet and Sugar, 2011, (1): 38-43. 潘琦, 张睿. 谈甜菜抗旱栽培. 中国甜菜糖业, 2011, (1): 38-43.
[15] Khayamim S, Afshari R T, Sadeghian S Y,etal. Seed germination, plant establishment, and yield of sugar beet genotypes under salinity stress. Journal of Agricultural Science and Technology, 2014, 16(4): 779-790.
[16] Mostafavi K. Effect of salt stress on germination and early seedling growth stage of sugar beet cultivars. American Eurasian Journal of Sustainable Agriculture, 2012, 6(2): 120-125.
[17] Ober E S, Rajabi A. Abiotic stress in sugar beet. Sugar Tech, 2010, 12(3/4): 294-298.
[18] Wu G Q, Liang N, Feng R J,etal. Evaluation of salt tolerance in sugar beet (BetavulgarisL.) cultivars seedlings using proline, soluble sugars and cation accumulation criteria. Acta Physiologiae Plantarum, 2013, 35(9): 2665-2674.
[19] Wu G Q, Wang C M, Su Y Y,etal. Assessment of drought tolerance in seedlings of sugar beet (BetavulgarisL.) cultivars using inorganic and organic solutes accumulation criteria. Soil Science and Plant Nutrition, 2014, 60(4): 565-576.
[20] Wu G Q, Feng R J, Liang N,etal. Sodium chloride stimulates growth and alleviates sorbitol-induced osmotic stress in sugar beet seedlings. Plant Growth Regulation, 2015, 75(1): 307-316.
[21] Yue L J, Li S X, Ma Q,etal. NaCl stimulates growth and alleviates water stress in the xerophyteZygophyllumxanthoxylum. Journal of Arid Environments, 2012, 87: 153-160.
[22] Wang S M, Zhang J L, Flowers T J. Low-affinity Na+uptake in the halophyteSuaedamaritima. Plant Physiology, 2007, 145(2): 559-571.
[23] Bates L S, Waldren R P, Teare I D. Rapid determination of free proline for water stress studies. Plant and Soil, 1973, 39(1): 505-515.
[24] Liu H J, Wang Y F, Li C F,etal. Research progress of drought and salt tolerance of sugar beet in China. Sugar Crops of China, 2010, (4): 52-58. 刘华君, 王燕飞, 李翠芳, 等. 我国甜菜抗旱与耐盐性研究进展. 中国糖料, 2010, (4): 52-58.
[25] Wakeel A, Faroop M, Qadir M,etal. Potassium substitution by sodium in plants. Critical Reviews in Plant Sciences, 2011, 30(4): 401-413.
[26] Geng G, Zhou J Z, Sun L Y,etal. The affection of sugar beet growth and nutrient absorptivity in different salt content. China Beet and Sugar, 2000, (1): 12-14. 耿贵, 周建朝, 孙立英, 等. 不同盐度对甜菜生长和养分吸收的影响. 中国甜菜糖业, 2000, (1): 12-14.
[27] Matoh T, Watanabe J, Takahashi E. Effects of sodium and potassium salts on the growth of a halophyteAtriplexgmelini. Soil Science and Plant Nutrition, 1986, 32(3): 451-459.
[28] Yue L J, Yun K, Li H W,etal. Adaptive responses of eremophytePugioniumcornutumto different concentrations of NaCl. Acta Prataculturae Sinica, 2016, 25(1): 144-152. 岳利军, 袁坤, 李海伟, 等. 荒漠植物沙芥苗期对不同浓度NaCl的适应机制. 草业学报, 2016, 25(1): 144-152.
[29] Wang B, Lttge U, Ratajczak R. Effects of salt treatment and osmotic stress on V-ATPase and V-PPase in leaves of the halophyteSuaedasalsa. Journal of Experimental Botany, 2001, 52: 2355-2365.
[30] Subbarao G V, Ito O, Berry W L,etal. Sodium-A functional plant nutrient. Critical Reviews in Plant Sciences, 2003, 22(5): 391-416.
[31] Bassil E, Blumwald E. The ins and outs of intracellular ion homeostasis: NHX-type cation/H+transporters. Current Opinion in Plant Biology, 2014, 22: 1-6.
[32] Wu G Q, Feng R J, Wang S M,etal. Co-expression of xerophyteZygophyllumxanthoxylumZxNHXandZxVP1-1 confers enhanced salinity tolerance in chimeric sugar beet (BetavulgarisL.). Frontiers in Plant Science, 2015, 6: 1-11.
[33] Mahajan S, Tuteja N. Cold, salinity and drought stresses: an overview. Archives of Biochemistry and Biophysics, 2005, 444(2): 139-158.
[34] Si Q, Wei L, Tian Z H,etal. The effects of sodium bisulfite and potassium bicarbonate on the photosynthesis, yield and sugar content of sugar beet (BetavulgarisL.). Acta Agriculturae Boreal-Sinica, 2010, 25(3): 212-216. 斯琴, 魏磊, 田自华, 等. 亚硫氰酸钠和碳酸氢钾对甜菜光合作用、块根产量及含糖率的影响. 华北农学报, 2010, 25(3): 212-216.
[35] Heyer B. Influence of exogenous application of proline and glycinebetaine on growth of salt-stressed tomato plants. Plant Science, 2003, 165(4): 693-699.
[36] Zhang J L, Li H R, Guo S Y,etal. Research advances in higher plant adaptation to salt stress. Acta Prataculturae Sinica, 2015, 24(12): 220-236. 张金林, 李惠茹, 郭姝媛, 等. 高等植物适应盐逆境研究进展. 草业学报, 2015, 24(12): 220-236.
[37] Ashraf M, Foolad M A. Improving plant abiotic-stress resistance by exogenous application of osmoprotectants glycine betaine and praline. Environmental and Experimental Botany, 2007, 59: 206-216.
[38] Paez-Valencia J, Patron-Soberano A, Rodriguez-Leviz A,etal. Plasma membrane localization of the type I H+-PPase AVP1 in sieve element-companion cell complexes fromArabidopsisthaliana. Plant Science, 2011, 181(1): 23-30.
[39] Regmi K C, Zhang S J, Gaxiola R A. Apoplasmic loading in the rice phloem supported by the presence of sucrose synthase and plasma membrane-localized proton pyrophosphatase. Annals of Botany, 2016, 117(2): 257-268.
[40] Juan M, Rivero R M, Romero L,etal. Evaluation of some nutritional and biochemical indicators in selecting salt-resistant tomato cultivars. Environmental and Experimental Botany, 2005, 54(3): 193-201.
[41] Bavei V, Shiran B, Arzani A. Evaluation of salinity tolerance in sorghum (SorghumbicolorL.) using ion accumulation, proline and peroxidase criteria. Plant Growth Regulation, 2011, 64: 275-283.
[42] Yao J, Liu X B, Cui X,etal. Effects of NaCl stress on substances linked to osmotic adjustment and on photosynthetic physiology ofMelilotoidesruthenicain the seedling stage. Acta Prataculturae Sinica, 2015, 24(5): 91-97. 姚佳, 刘信宝, 崔鑫, 等. 不同NaCl胁迫对苗期扁蓿豆渗透调节物质及光合生理的影响. 草业学报, 2015, 24(5): 91-97.
[43] Ahmed C B, Rouina C B, Sensoy S,etal. Exogenous proline effects on photosynthetic performance and antioxidant defense system of young olive tree. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4216-4222.
[44] Farkhondeh R, Nabizadeh E, Jalilnezhad N. Effect of salinity stress on proline content, membrane stability and water relations in two sugar beet cultivars. International Journal of AgriScience, 2012, 2(5): 385-392.
Effects of salt treatments on growth and osmoregulatory substance accumulation in sugar beet (Betavulgaris)
WU Guo-Qiang1*, FENG Rui-Jun1, LI Shan-Jia1, WANG Chun-Mei2, JIAO Qi1, LIU Hai-Long1
1.SchoolofLifeScienceandEngineering,LanzhouUniversityofTechnology,Lanzhou730050,China; 2.LanzhouInstituteofHusbandryandPharmaceuticalScience,CAAS,Lanzhou730050,China
In this study, the effects of NaCl at different concentrations (0, 50, 100 and 150 mmol/L) on the growth and osmoregulatory substance accumulation in 60-day-old sugar beet (Betavulgaris) plants were investigated in pot experiments. The addition of 50, 100, and 150 mmol/L NaCl promoted the growth of sugar beet plants and maintained water conditions well. Compared with the control (0 mmol/L), various concentrations of NaCl significantly increased the fresh weights and dry weights of the leaf blade, leaf petiole, and storage root ofB.vulgarisplants (P<0.05). Compared with the control, the high-salt treatment (150 mmol/L) resulted in marked increases in Na+concentrations in the leaf blade and leaf petiole (4.4- and 4.9-fold, respectively;P<0.05), and decreased the relative distribution of Na+in storage roots and lateral roots (by 44% and 53%, respectively;P<0.05). The high-salt treatment also reduced the K+concentrations in the leaf blade and lateral root by 39% and 55%, respectively (P<0.05), and increased the relative distribution of K+in the leaf petiole and storage root by 35% and 80%, respectively (P<0.05). The salt treatments reduced sucrose contents by 44%-50% (P<0.05) and fructose contents in the storage root by 31%-36% (P<0.05), whereas glucose contents were unaffected. The high-salt treatment increased the proline concentration in the storage root by 93%, compared with the control (P<0.05). These results suggested that sugar beet plants can adapt to saline conditions by accumulating the large quantities of Na+in the leaf blade and leaf petiole, by maintaining K+homeostasis, and by enhancing the accumulation of proline in storage roots.
sugar beet (Betavulgaris); salt tolerance; proline; soluble sugars
10.11686/cyxb2016192
http://cyxb.lzu.edu.cn
2016-05-09;改回日期:2016-06-28
国家自然科学基金项目(31260294和31460101),兰州市人才创新创业专项(2014-2-6)和兰州理工大学“红柳杰出人才”培养计划项目(J201404)资助。
伍国强(1976-),男,甘肃通渭人,副教授,博士。*通信作者Corresponding author. E-mail: wugq08@126.com
伍国强, 冯瑞军, 李善家, 王春梅, 焦琦, 刘海龙. 盐处理对甜菜生长和渗透调节物质积累的影响. 草业学报, 2017, 26(4): 169-177.
WU Guo-Qiang, FENG Rui-Jun, LI Shan-Jia, WANG Chun-Mei, JIAO Qi, LIU Hai-Long. Effects of salt treatments on growth and osmoregulatory substance accumulation in sugar beet (Betavulgaris). Acta Prataculturae Sinica, 2017, 26(4): 169-177.

