水土保持植物类芦对土壤酸胁迫的形态生理响应
陈雪娇,韩航,侯晓龙,2,3*,刘爱琴,2,蔡丽平,2,周垂帆,2,马祥庆,2(.福建农林大学林学院,福建 福州350002;2.福建农林大学资源与环境学院,福建 福州350002;3.海峡两岸红壤区水土保持协同创新中心,福建 福州350002)
水土保持植物类芦对土壤酸胁迫的形态生理响应
陈雪娇1,韩航1,侯晓龙1,2,3*,刘爱琴1,2,蔡丽平1,2,周垂帆1,2,马祥庆1,2
(1.福建农林大学林学院,福建 福州350002;2.福建农林大学资源与环境学院,福建 福州350002;3.海峡两岸红壤区水土保持协同创新中心,福建 福州350002)
土壤酸度低是限制一些金属矿山废弃地植被恢复的主要因素之一,类芦可在酸度极低的稀土矿废弃地正常生长,其中可能存在对酸胁迫特殊的形态生理响应机制。因此,采用室内土培盆栽模拟胁迫试验,设计不同强度酸胁迫处理(pH: 3.5,4.5,5.0和5.6),测定不同酸胁迫条件下,类芦地上部分和根系生长、生物量、抗氧化酶活性及MDA含量等指标,探讨类芦对土壤酸胁迫的适应策略。结果表明,类芦对土壤酸胁迫有一定的耐性,pH 3.5处理仍能较正常生长;随土壤pH的逐渐增大,类芦地上部分和根系各生长指标整体表现为先增大后减小的变化趋势,弱酸胁迫对类芦根系生长有一定促进作用,pH 4.5处理均达最大值,为类芦最适宜生长的土壤酸度;酸胁迫条件下,类芦可通过加快根直径的生长,增大根系的生物量分配,以适应酸胁迫条件,但酸胁迫对类芦体内抗氧化酶活性具有一定抑制作用。
类芦;酸胁迫;生长指标;形态生理响应
长汀县是我国南方典型的离子型矿区之一,是福建省稀土资源储量最多和稀土产业发展最早的县。长汀稀土矿开采工艺主要是采用加入草酸或硫酸铵等强酸溶浸液,将吸附在黏土矿物表面的稀土离子交换解析出来,因此导致开采废弃地土壤酸化严重,长期的开采形成了大量土壤pH值低的废弃地,生态环境恶化严重,植被恢复难度大[1-2]。土壤pH是限制植物生长的关键因素之一[3],长汀稀土矿废弃地土壤酸度较低,在这样的酸性土壤中,植物根系生长发育受阻,吸收水分和矿质营养元素能力降低,受到土壤中铝毒、锰毒等毒害作用,难以存活[4-5]。前期研究发现,类芦(Neyraudiareynaudiana)可在长汀稀土矿废弃地正常生长,且保持较高生物量,其中可能蕴藏着对土壤酸胁迫特殊的适应策略。类芦是多年生具木质根状茎草本植物,生于河边、山坡或砾石草地,海拔300~1500 m,广泛分布于亚洲东南部,适应性较强,是我国南方地区水土流失治理的优良草种[6]。有研究发现,在干旱胁迫下,类芦通过调整叶片形态、MDA含量和叶绿素含量等途径提高水分利用率,维持生存[7]。同时在土壤铅浓度达800 mg/kg的重金属污染土壤中,类芦仍可存活,对土壤重金属胁迫也有一定耐性[8]。目前国内外学者对类芦的研究,主要集中在水土流失治理、根系固土等方面[9-11],类芦对土壤酸胁迫下的适应策略尚不清楚。
鉴于此,以类芦为试验材料,根据长汀离子型稀土矿废弃地土壤pH[4],设计不同土壤酸度胁迫水平,测定酸胁迫条件下,类芦叶片数、株高、叶长、分蘖数根长、根体积、根表面积等生长指标,生物量、体内抗氧化酶系统活性及MDA含量,分析酸胁迫条件下类芦各形态指标的变化规律及其之间的相关性,探讨类芦对土壤酸胁迫的适应策略,以期为离子型稀土矿山废弃地及酸性矿废地土壤植被恢复提供科学依据。
1 材料与方法
1.1 试验材料
2015年5月至10月,于福建农林大学林学院温室内进行试验,类芦种子购于深圳鑫淼森种子公司。
1.2 方法
1.2.1 试验设计 选取饱满类芦种子,预处理后,蒸馏水浸泡24 h后,将种子播入干净河沙盆中,待种子发芽后,每隔7 d浇灌100 mL 的Hoagland营养液, 30 d后选取株高12 cm、长势基本一致的,根系完整的类芦苗用于酸胁迫试验。土培基质为3∶1干净河沙和黄心土[12],干重15 kg,每盆1株类芦苗,缓苗2周后开始酸胁迫试验。设3个土壤酸度胁迫:pH 5.0、pH 4.5、pH 3.5,并设置pH 5.6(南方自然土壤平均酸度)为对照处理,每个处理5个重复。试验期间每15 d每盆浇100 mL 的Hoagland营养液。
根据土壤酸碱性缓冲曲线调节培养基pH[13]。土壤酸碱性缓冲曲线:取基质土样 4份,过2 mm筛,各10 g,放入A、B、C、D 4个50 mL烧杯中,分别加25 mL去离子水,调节pH至3.5、4.5、5.0 和5.6,记录HCl 溶液和Ca(OH)2溶液的体积,7 d 后测定实际pH 值,以此pH 值和消耗的溶液体积绘制缓冲曲线,计算调节pH 所需HCl 或Ca(OH)2的量。
在酸胁迫的30、60、90、120、150 d测定类芦地上部分各生长指标;胁迫120 d,测定不同酸胁迫类芦叶片的抗氧化酶活性和MDA含量;胁迫150 d后收获类芦,测定不同酸胁迫类芦根系各形态指标。
1.2.2 测定项目和方法 形态指标和生物量:株高、叶片长度、叶片宽度用卷尺测量,株高从分蘖节到拉直后最长叶尖距离量取,叶片长度以叶身计算(不含叶鞘),叶片宽度以叶身中部最宽处计算;根系长度、根表面积、根体积和根平均直径用数字化扫描仪(STD 1600 Epson, USA)进行图像扫描,用WinRhizo (Version 4.0 B)根系分析系统软件(Regent Insrtruments Inc, Canada)分析;将收获的类芦植株在105 ℃杀青30 min,75 ℃烘干至恒重,用电子天平称量其地上部分和根系生物量。
抗氧化酶活性和MDA含量:取0.2 g类芦叶片,加入5 mL预冷的pH 7.0的磷酸缓冲液,研磨成匀浆,于4 ℃下10000 r/min冷冻离心20 min,取上清液放4 ℃冰箱冷藏待测。参考王学奎[14]方法,超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定、过氧化氢酶(CAT)活性采用紫外吸收法测定,过氧化物酶(POD)活性采用愈创木酚法测定,丙二醛(MDA)含量采用硫代巴比妥酸法测定。
1.3 数据处理
所有数据均为5次重复,采用Microsoft Excel以及SPSS 19.0软件进行数据处理,Origin Pro 9.0作图,试验结果均以平均值±标准差来表示,不同小写英文字母表示不同处理间差异达到显著水平(P<0.05)。
2 结果与分析
2.1 酸胁迫对类芦地上形态指标的影响
由图1可知,在不同酸胁迫处理时间,类芦株高、叶长、叶片数和分蘖数均表现为:pH 4.5处理>pH 5.0处理>pH 3.5处理>pH 5.6处理,在pH 4.5处理时达最大值;酸胁迫条件下,类芦地上部分各生长指标均大于对照(pH 5.6)处理,且随胁迫时间的增加表现越明显;说明酸胁迫对类芦地上部分生长具有一定促进作用,土壤pH 4.5为类芦生长最适宜酸度。
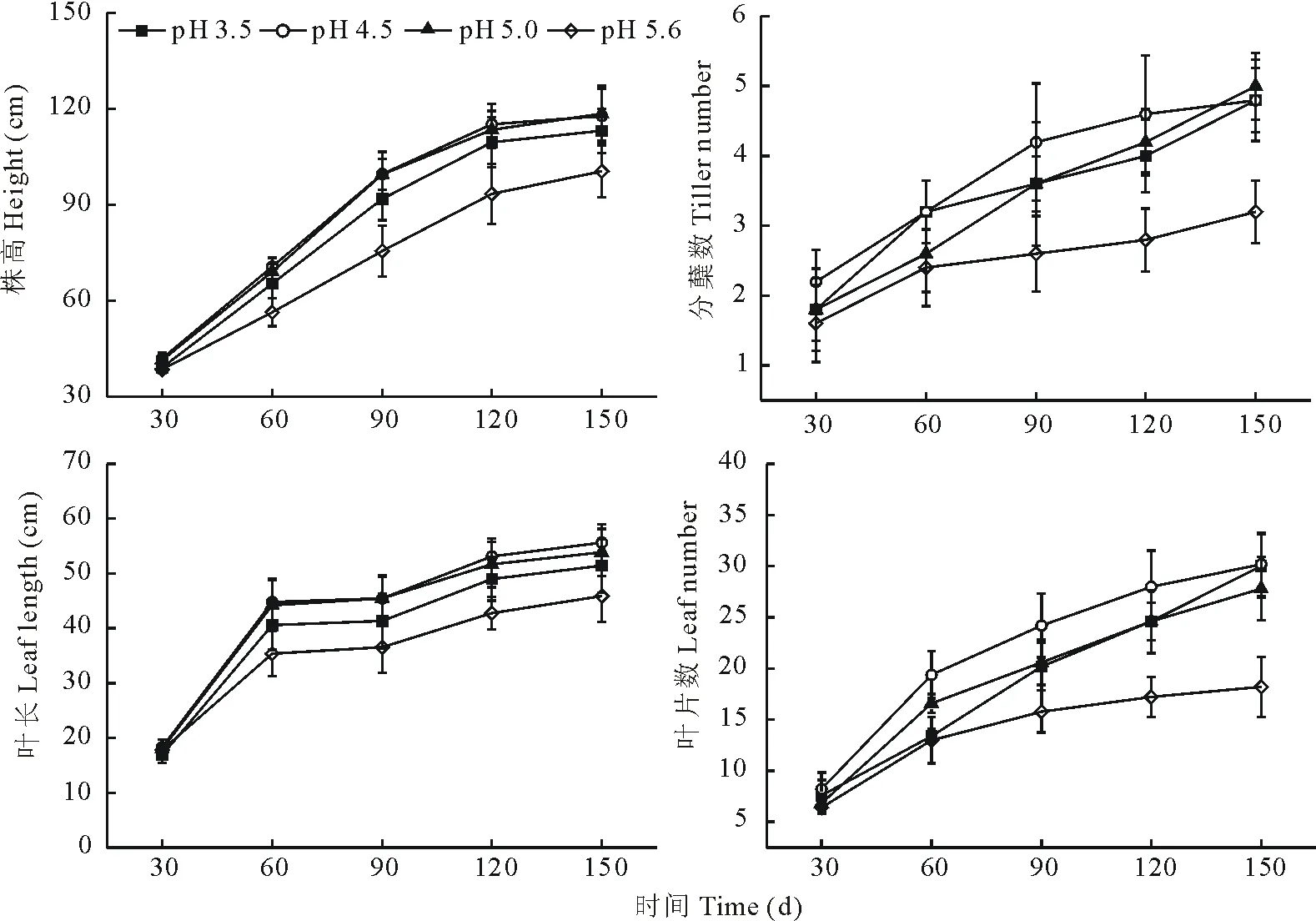
图1 不同酸胁迫下类芦地上部分生长情况Fig.1 The growth of aboveground parts of N. reynaudiana under acid stress
2.2 酸胁迫对类芦根系形态的影响
由图2可知,随土壤pH值增大,类芦根长、根表面积、根体积、根平均直径均表现出了先显著增大后显著减小的变化规律(P<0.05),在pH 4.5处理达最大值,且不同酸胁迫处理均显著大于pH 5.6对照处理(P<0.05);根长表现为先显著增大后显著减小的变化规律(P<0.05),除pH 3.5处理与对照无显著差异外,其他处理均显著大于pH 5.6对照处理(P<0.05);说明酸胁迫对类芦根系生长有一定促进作用。
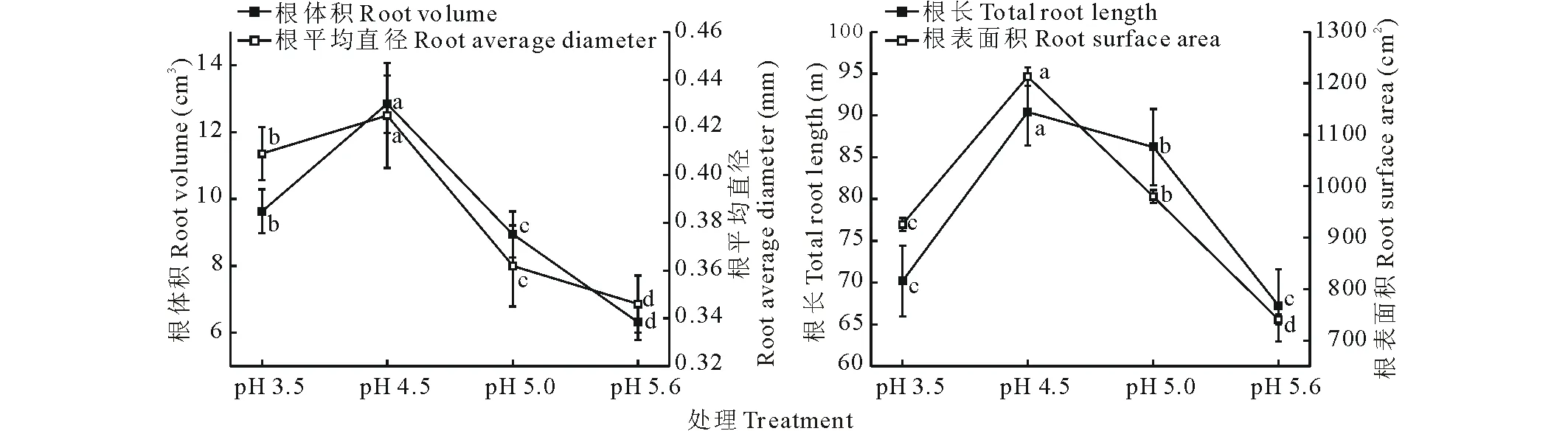
图2 不同酸胁迫下类芦的根系生长情况Fig.2 Root morphology of N. reynaudiana under acid stress 不同小写字母表示各处理间差异显著(P<0.05),下同。Different lowercase letters indicate significant differences (P<0.05) among different treatments, the same below.
2.3 酸胁迫对类芦生物量及其分配的影响
由图3可知,随土壤pH的逐渐增大,类芦地上部分、根系及全株生物量均表现为先显著增大后显著减小的变化规律(P<0.05),在pH 4.5处理达最大值,显著大于其他处理,且不同酸胁迫处理均显著大于pH 5.6对照处理(P<0.05);根冠比表现为先显著增大,在pH 5.0处理达最大值,然后又显著减小(P<0.05),pH 3.5处理显著小于对照,pH 4.5处理与对照无显著差异(P<0.05),说明酸胁迫条件下,类芦根系生物量分配增大。
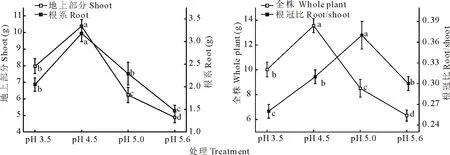
图3 不同酸胁迫下类芦生物量Fig.3 The biomass of N. reynaudiana under acid stress
2.4 不同酸胁迫对类芦抗氧化酶活性和丙二醛含量的影响
由图4可知,随土壤pH的逐渐增大,类芦叶片的POD、SOD、CAT活性均表现为先增大后减小的趋势,pH 3.5和pH 4.5处理的SOD、CAT活性均显著小于对照(P<0.05);pH 5.0处理的SOD和CAT活性与对照无显著差异,仅POD活性显著大于对照(P<0.05);MDA含量先表现为显著减小的趋势(P<0.05),在pH 5.0处理和对照无显著差异(P<0.05),随后显著增加;说明酸胁迫对类芦抗氧化酶活性具有一定抑制作用。
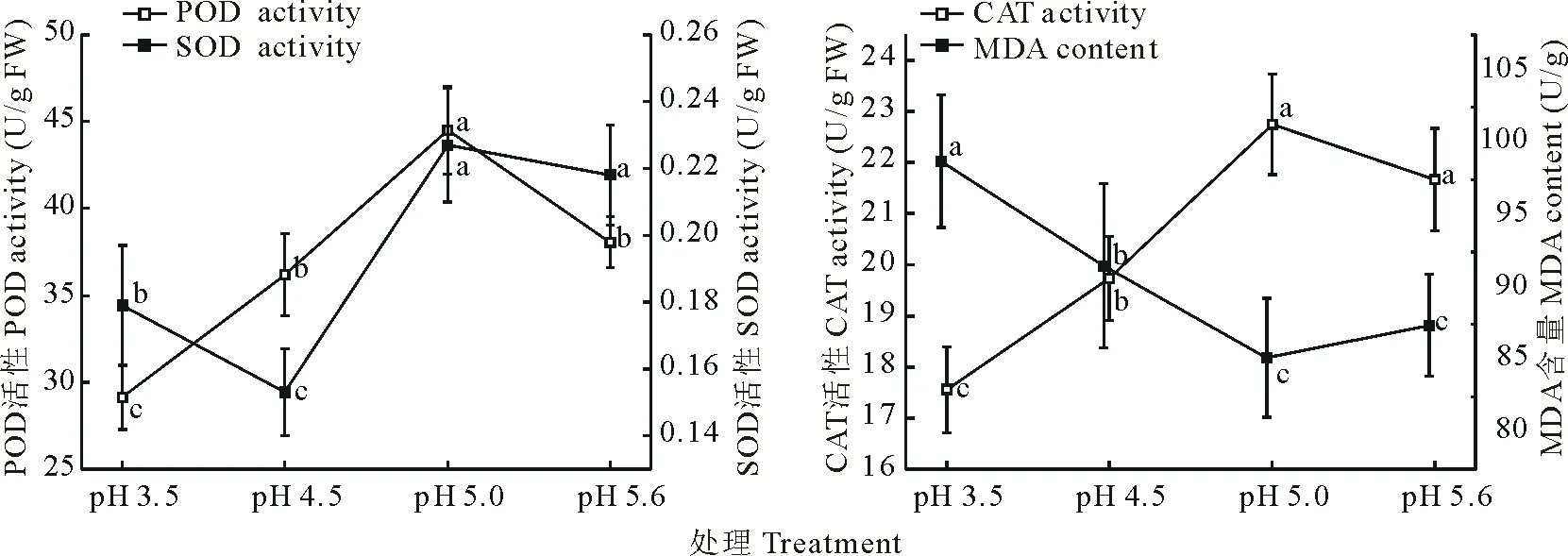
图4 不同酸胁迫处理对类芦抗氧化酶及丙二醛的影响Fig.4 Effects of acid stress on the antioxidant enzymes and MDA of N. reynaudiana
2.5 土壤酸胁迫下部分形态指标和生理指标相关性分析
通过Spearman相关性分析(表1)可知:酸胁迫条件下,类芦株高、叶长、叶片数、根长、根表面积和根体积之间表现为显著或极显著正相关;类芦SOD和CAT活性均与各生长指标负相关,特别是和根直径和根体积显著或极显著负相关;POD活性和叶片数、分蘖数、根体积、根直径负相关,其中,与根直径极显著负相关;MDA含量与各生长指标呈正相关关系,与根体积和直径呈极显著正相关关系,与叶片数呈显著正相关关系,而与POD、SOD和CAT均呈显著负相关关系。
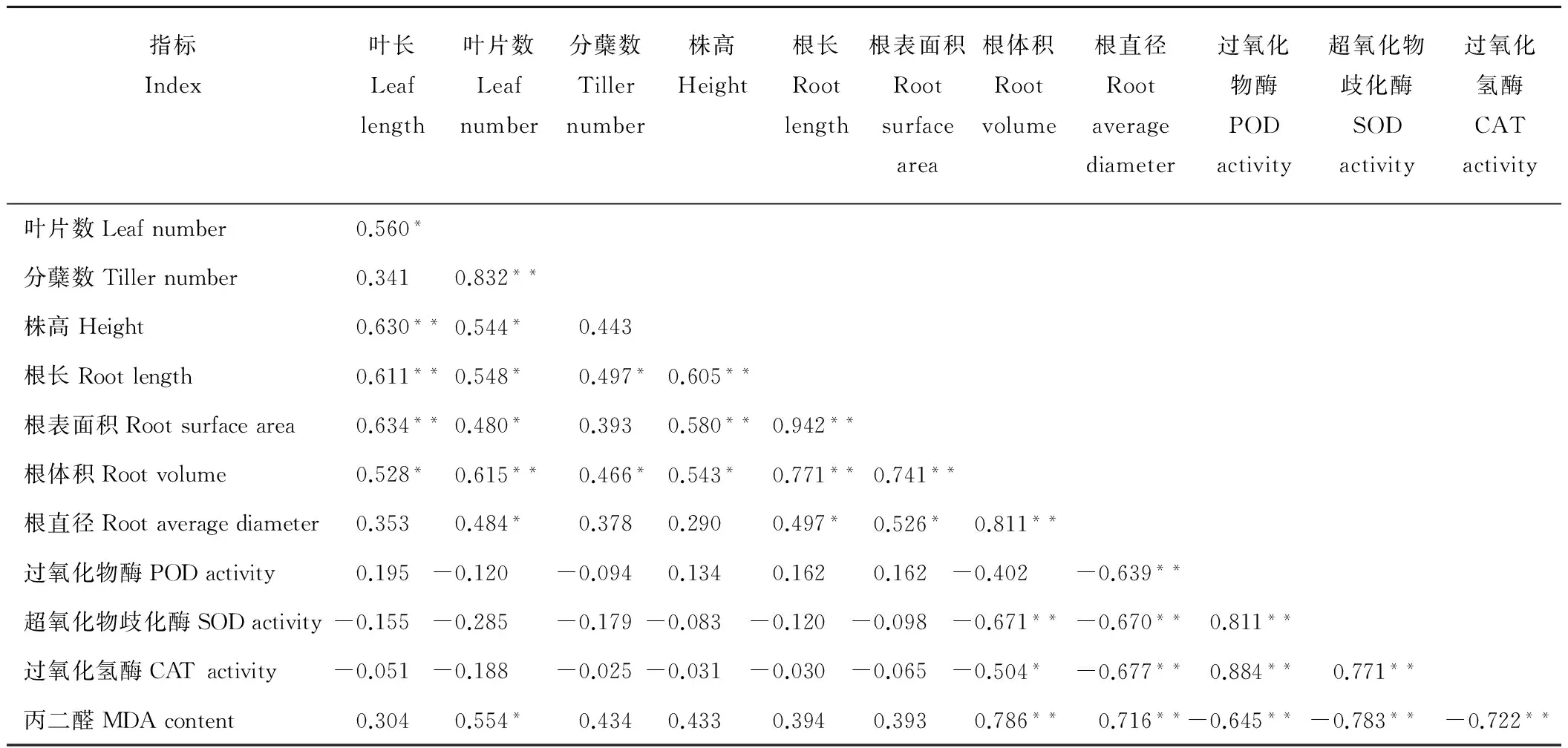
表1 类芦形态指标与生理指标的相关分析Table 1 Correlation analysis between morphological and physiological indexes of N. reynaudiana
注:* 和* *分别表示在0.05和0.01水平上显著相关。
Note:“*”和“* *”indicate significant correlation at the level of 0.05 and 0.01, respectively.
3 讨论
植物生长对土壤的酸碱度有一定要求,不同植物生长适宜的土壤酸碱度各有差异[15]。金银花(Lonicerajaponica)适宜种植在pH 8.2左右的土壤中[16],柳枝稷(Panicumvirgatum)在土壤pH值高于5.0地区生长最佳[17]。土壤环境过酸会影响植物正常的营养代谢、光合作用和呼吸作用,甚至导致植物萎黄枯死[18-19]。本研究发现,类芦对土壤酸胁迫具有较强耐性,在pH 3.5土壤仍能较正常生长,且在土壤pH 4.5各生长指标均达到最大值,为其最适宜生长的酸度,这与长汀稀土矿废弃地土壤酸度实际情况表现出一致性[1],但随土壤酸度继续降低,生长逐渐受到抑制,MDA含量持续增加,这与前人研究基本一致[20]。
逆境条件下,植物能通过株高、叶片数、根系等形态指标的变化、改变器官大小比例、调整生物量分配布局来维持生存[21-22]。干旱环境下,类芦会增加根长和根冠比等途径,来汲取更多水分养分维持植物体正常代谢需要[23]。类芦在弱酸土壤(pH 5.0、pH 4.5)条件下,长势好于对照(pH 5.6)。在强酸(pH 3.5)胁迫条件下,根体积和根平均直径保持相对稳定,根冠比下降,地下部分生物量比重增加,表现出对酸胁迫的较强耐性。且在不同酸胁迫条件下,株高、叶长、根长和根表面积互为显著正相关,根体积和根直径互为极显著正相关,说明类芦可通过地上和地下部分同步有效地改变形态构建和生物量分配等途径适应了酸逆境。超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)组成了植物抗氧化酶系统,是植物适应逆境的重要酶类和指标,逆境胁迫会影响植物体内抗氧化酶活性及其化学性质等,产生大量丙二醛(MDA),阻碍损害植物正常生长[24-25]。本研究发现,类芦在弱酸胁迫条件下,POD和CAT活性增强,但随酸胁迫的增强(pH 3.5),类芦POD和CAT酶活性降低, MDA含量迅速增加,类芦抗氧化酶系统活性受到明显抑制,但SOD活性有所增加,这可能是类芦适应强酸胁迫的原因之一。
通过以上分析可发现,类芦在pH 4.5时各项指标,整体长势最好,较适宜应用于长汀废弃矿酸性土壤区植被恢复,且类芦本身生物量较大,耐热强,还有一定富集转运重金属的能力[8],在福建重金属污染和酸性土壤的复杂土壤环境中有较大的利用潜力,值得进一步深入研究。本研究是室内模拟实验,与矿区环境仍有一定差异,类芦适应酸胁迫的机制还需进行野外大田实验进一步验证以及细胞分子层次等的深入研究,方能最终揭示其对酸胁迫的耐性机制。
4 结论
类芦对土壤酸胁迫具有较强的耐性,pH 3.5条件下仍可较正常生长;酸胁迫对类芦地上部分和根系生长均有一定促进作用,在pH 4.5处理达到最大值,为类芦的最适宜生长的土壤酸度;酸胁迫对类芦体内抗氧化酶活性具有一定抑制作用;酸胁迫条件下,类芦可通过加快根直径的生长,增大根系的生物量分配,以适应酸胁迫环境;因此,可以得出,类芦主要是通过形态响应,特别是根系形态指标的改变适应酸胁迫。
References:
[1] Li W. Research on Landscape and Ecology Restoration of Wasted Ionic Rare Earth Deposit in South China[D]. Fuzhou: Fujian Agriculture and Forestry University, 2014. 李伟. 离子型稀土废弃地景观生态恢复研究[D]. 福州: 福建农林大学, 2014.
[2] Qiu R L, Qiu H, Lei M,etal. Advance in research on remediation of multi-metal contaminated soil in mine and surrounding area. Journal of Agricultural Environmental Science, 2009, 28(6): 1085-1091. 仇荣亮, 仇浩, 雷梅, 等. 矿山及周边地区多金属污染土壤修复研究进展. 农业环境科学学报, 2009, 28(6): 1085-1091.
[3] Ai X M, Yang P, Li Y,etal. Variation of physiological indexes ofMelaleucabracteataseedlings under acid, alkali and salt stress. Journal of West China Forestry Science, 2014, 43(1): 29-33. 艾星梅, 杨鹏, 李煜, 等. 酸、碱、盐胁迫下千层金幼苗的生理指标变化研究. 西部林业科学, 2014, 43(1): 29-33.
[4] Wang Y S, Wu P F, Hou X L,etal. Effect of different revegetation model on soil properties in abandon mine area of rare earth. Ecology and Environmental Sciences, 2015, 24(11): 1831-1836. 王友生, 吴鹏飞, 侯晓龙, 等. 稀土矿废弃地不同植被恢复模式对土壤肥力的影响. 生态环境学报, 2015, 24(11): 1831-1836.
[5] Ma J F, Ryan P R. Understanding how plants cope with acid soils. Functional Plant Biology, 2010, 37(4): 3-6.
[6] Sun F Z, Hu R, Zhang Y D,etal. The evaluation mechanism and application of burmareed on the growth. Soil and Water Conservation in China, 2004, 7(8): 18-20. 孙发政, 胡荣, 张艺东, 等. 类芦在岩壁上生长的机理及其应用评价. 中国水土保持, 2004, 7(8): 18-20.
[7] Cai L P, Wu P F, Hou X L,etal. Effect of drought stress on the photosynthetic characteristics of the pioneer plantNeyraudiareynaudianaon soil and water conservation. Journal of Soil and Water Conservation, 2011, 25(6): 237-241. 蔡丽平, 吴鹏飞, 侯晓龙, 等. 干旱胁迫对水土保持先锋植物类芦光合特性的影响. 水土保持学报, 2011, 25(6): 237-241.
[8] Dai W J, Ning P, Liu X H,etal. Tolerance and accumulation ofNeyraudiareynaudianafor Pb. Journal of Environmental Engineering, 2008, 2(7): 1004-1008. 戴文娇, 宁平, 刘晓海, 等. 类芦对铅的耐性及富集能力探讨. 环境工程学报, 2008, 2(7): 1004-1008.
[9] Yuan Z Y, Guo Y B, Li Q,etal. Effects of organic-inorganic fertilizer application on pioneer plantNeyraudiareynaudianaon ecological restoration. Journal of Soil and Water Conservation, 2014, (5): 302-308. 袁中友, 郭彦彪, 李强, 等. 有机无机肥配施对生态重建先锋植物类芦生长的影响. 水土保持学报, 2014, (5): 302-308.
[10] Deng H, Ye Z H, Wong M H. Accumulation of lead, zinc, copper and cadmium by 12 wetland plant species thriving in metal-contaminated sites in China. Environmental Pollution, 2004, 132(1): 29-40.
[11] Deng H, Ye Z H, Wong M H. Lead, zinc and iron (Fe2+) tolerances in wetland plants and relation to root anatomy and spatial pattern of ROL. Environmental and Experimental Botany, 2009, 65(2): 353-362.
[12] Liu Y, Zeng B S, Qiu Z F,etal. Effect of different substrates on transplanting survival rate ofParaserianthesfalcatariatube culture seedlings. Journal of Central South University of Forestry and Technology, 2013, 33(11): 29-33. 刘英, 曾炳山, 裘珍飞, 等. 基质对南洋楹组培苗移植成活的影响. 中南林业科技大学学报, 2013, 33(11): 29-33.
[13] Jiang J, Xu R K, Zhao A Z. Detemination of pH buffer capacity of acid red soils by acid-base titration. Chinese Journal of Soil Science, 2006, 37(6): 1247-1248. 姜军, 徐仁扣, 赵安珍. 用酸碱滴定法测定酸性红壤的pH缓冲容量. 土壤通报, 2006, 37(6): 1247-1248.
[14] Wang X K. Principle and Technology of Plant Physiology and Biochemistry Experiment[M]. Beijing: Higher Education Press, 2006. 王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006.
[15] Tong G H, Liu T J, Huang W,etal. Effect of simulated acid rain and its acidified soil on lipid peroxidation of wheat seedlings. Acta Ecologica Sinica, 2005, 25(6): 1509-1516. 童贯和, 刘天骄, 黄伟. 模拟酸雨及其酸化土壤对小麦幼苗膜脂过氧化水平的影响. 生态学报, 2005, 25(6): 1509-1516.
[16] Wu Y Y, Xing D K, Zhu Y L,etal. Effect of pH on growth characters and chlorophyll fluorescence of three vine plants. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(2): 338-343. 吴沿友, 邢德科, 朱咏莉, 等. 营养液pH对3种藤本植物生长和叶绿素荧光的影响. 西北植物学报, 2009, 29(2): 338-343.
[17] Xu K J, Shi L L, Wang Y,etal. Effect of the pH value on switchgrass seedling growth and development in hydroponics. Acta Ecologica Sinica, 2015, 23(35): 7691-7698. 徐开杰, 史丽丽, 王勇, 等. 水培条件下pH值柳枝稷幼苗生长发育的影响. 生态学报, 2015, 23(35): 7691-7698.
[18] Navascués J, Pérez-Rontomé C, Sánchez D H,etal. Oxidative stress is a consequence, not a cause, of aluminum toxicity in the forage legumeLotuscorniculatus. New Phytologist, 2012, 193(3): 625-636.
[19] Vardar F,smailolu I,nan D,etal. Determination of stress responses induced by aluminum in maize (Zeamays). Acta Biologica Hungarica, 2011, 62(2): 156-170.
[20] Tang K, Zhu W W, Zhou W X,etal. Research progress on effcets of soil pH on plant growth and development. Crop Research, 2013, 27(2): 207-212. 唐琨, 朱伟文, 周文新, 等. 土壤pH对植物生长发育影响的研究进展. 作物研究, 2013, 27(2): 207-212.
[21] Li F L, Bao W K, Wu N. Morphological and physiological responses of current sophora davidii seedlings to drought stress. Acta Ecologica Sinica, 2009, 29(10): 5407-5416. 李芳兰, 包维楷, 吴宁. 白刺花幼苗对不同强度干旱胁迫的形态与生理响应. 生态学报, 2009, 29(10): 5407-5416.
[22] Liu C H, Luo L Q, Guo T,etal. Preliminary research on Cd-tolerance ofPanicumvirgatumandPanicummaximum. Acta Prataculturae Sinica, 2015, 24(11): 100-108. 刘长浩, 娄来清, 郭涛, 等. 柳枝稷和坚尼草的耐镉性初步研究. 草业学报, 2015, 24(11): 100-108.
[23] Cai L P. The Mechanism of Eco-physiological Respond to Enviromental Stress for Pioneer PlantNeyraudiareynaudianain Collapsing Hill Area[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012. 蔡丽平. 崩岗侵蚀区先锋植物类芦对环境胁迫的生理生态学响应机制[D]. 福州: 福建农林大学, 2012.
[24] Zhao Y D, Pan Y Z, Liu B Y,etal.PileacadiereiGagnep.et Guills growth and accumulation under single and combined pollution of Cd and Pb. Journal of Agricultural Environmental Science, 2012, 31(1): 48-53. 赵杨迪, 潘远智, 刘碧英, 等. Cd、Pb单一及复合污染对花叶冷水花生长的影响及其累积性研究. 农业环境科学学报, 2012, 31(1): 48-53.
[25] Li Z Z, Wu J, Tang Y,etal. Effect of Pb, Zn and their interactions on the chlorophyll content and antioxidant enzyme systems ofHouttuyniacordatathumb. Acta Ecologica Sinica, 2007, 27(12): 5441-5445. 李铮铮, 伍钧, 唐亚, 等. 铅、锌及其交互作用对鱼腥草(Houttuyniacordata)叶绿素含量及抗氧化酶系统的影响. 生态学报, 2007, 27(12): 5441-5445.
The morphological and physiological responses of the soil and water conservation plantNeyraudiareynaudianato acid stress
CHEN Xue-Jiao1, HAN Hang1, HOU Xiao-Long1,2,3*, LIU Ai-Qin1,2, CAI Li-Ping1,2, ZHOU Chui-Fan1,2, MA Xiang-Qing1,2
1.CollegeofForestry,FujianAgricultureandForestryUniversity,Fuzhou350002,China; 2.CollegeofResourcesandEnvironmentalSciences,FujianAgricultureandForestryUniversity,Fuzhou350002,China; 3.Cross-StraitCollaborativeInnovationCenterofSoilandWaterConservation,Fuzhou350002,China
Soil acidification is one of the main limitation factors affecting vegetation restoration in mining wastelands.Neyraudiareynaudianacan grow normally in the wasteland of rare earth mines with extremely serious soil acidification, indicating that it has specific morphological and physiological mechanisms. In order to reveal these mechanisms, a one-pot acid stress experiment was designed with four different pH levels (3.5, 4.5, 5.0 and 5.6) and the growth indices, biomass, antioxidant enzymes and MDA content ofN.reynaudianawere measured. The results showed thatN.reynaudianagrows normally in soil with pH 3.5, suggesting a strong resistance to acid stress. With the increase of soil pH, growth indices such as plant height, leaf length, number of leaves, tiller number, root length, root volume, root surface area and root diameter at first increased and then decreased, demonstrating that the low acid stress had a promotion effect onN.reynaudianagrowth. In addition, all the growth indices forN.reynaudianareached their peak under the pH 4.5 treatment, suggesting that this is the most suitable soil pH level for the species.N.reynaudianaadapts to acid stress by accelerating the root diameter growth rate and increasing the biomass allocation of the root. Our research also indicated that the antioxidant enzymes ofN.reynaudianawere inhibited under acid stress.
Neyraudiareynaudiana; acid stress; growth index; morphophysiological response mechanism
10.11686/cyxb2016170
http://cyxb.lzu.edu.cn
2016-04-21;改回日期:2016-06-06
国家科技支撑计划项目(2014BAD15B02),国家自然科学基金(41401364),国家林业局林业公益性行业科研项目(201304303)和福建省自然科学基金(2013J01073)资助。
陈雪娇(1989-),女,福建福州人,硕士。E-mail:960382981@qq.com*通信作者Corresponding author. E-mail:xl.hou@fafu.edu.cn
陈雪娇, 韩航, 侯晓龙, 刘爱琴, 蔡丽平, 周垂帆, 马祥庆. 水土保持植物类芦对土壤酸胁迫的形态生理响应. 草业学报, 2017, 26(4): 143-149.
CHEN Xue-Jiao, HAN Hang, HOU Xiao-Long, LIU Ai-Qin, CAI Li-Ping, ZHOU Chui-Fan, MA Xiang-Qing. The morphological and physiological responses of the soil and water conservation plantNeyraudiareynaudianato acid stress. Acta Prataculturae Sinica, 2017, 26(4): 143-149.

