甜高粱青贮有氧暴露的稳定性及微生物变化的研究
周斐然,张苏江,王明,肖丹,郭雪峰(塔里木畜牧科技兵团重点实验室,塔里木大学动物科学学院,新疆 阿拉尔843300)
甜高粱青贮有氧暴露的稳定性及微生物变化的研究
周斐然,张苏江*,王明,肖丹,郭雪峰
(塔里木畜牧科技兵团重点实验室,塔里木大学动物科学学院,新疆 阿拉尔843300)
为了更好地开发利用甜高粱青贮饲料,本研究以高糖甜高粱青贮(HSS)、低糖甜高粱青贮(LSS)和玉米青贮(MZS)为材料,研究了在有氧暴露0、5、10、15、20和25 d时干物质、水溶性碳水化合物(WSC)、pH、温度和微生物数量的变化。结果表明,在有氧暴露前期(0~5 d),与LSS和MZS比较,HSS具有较低的pH值,较高的乳酸菌含量和较高的温度;在有氧暴露的后期(15~25 d),HSS酵母菌、霉菌和好氧菌数量均显著大于LSS和MZS (P<0.05),LSS的温度和pH值显著低于HSS和MZS(P<0.05);在整个有氧过程中,WSC含量在HSS中最高,干物质含量在LSS中最高(P<0.05)。可见,在有氧暴露环境下,LSS有氧稳定性最好,酵母菌、霉菌和好氧细菌数量增加最少;HSS有氧稳定性最差,酵母菌、霉菌和好氧细菌数量增加最多;MZS有氧稳定性和好氧性微生物数量居中。本研究结果提示,HSS在有氧暴露环境下更容易发生二次发酵,因此,有必要在青贮中使用添加剂,以保证HSS在使用过程的营养品质。
甜高粱;青贮;有氧稳定性;微生物
甜高粱(Sorghumbicolor/sweet sorghum)属C4作物,是粒用高粱的一个变种,起源于非洲。由于其光合效率高、生物产量高、含糖量高,具有抗旱、耐贫瘠、耐盐碱等特性,甜高粱作为能源、饲料和糖源作物已受到世界各国的普遍重视,被认为是最具开发潜力的能源植物之一[1-2]。作为饲料作物,制作青贮是目前甜高粱应用的主要形式。研究表明,青贮甜高粱粗纤维、蛋白质含量与青贮玉米(Zeamays)相当或优于青贮玉米[3],干物质降解率、中性洗涤纤维消化率高于玉米青贮,pH值、乳酸含量与玉米青贮相近[4-5]。
目前,青贮饲料是奶牛、肉牛养殖过程必不可少的重要饲料,而且在其他草食动物,如羊和鹿养殖中也有广泛应用。青贮的质量对家畜的生产和生长都有直接影响,因此,青贮的品质倍受关注。丰富的水溶性碳水化合物(water soluble carbohydrate WSC)和适宜的水分含量是制作优质青贮饲料的基础。然而,在开窖、取料、配制全混合日粮以及饲喂过程中,青贮饲料因接触空气容易发生二次发酵的问题[6]。青贮二次发酵使腐败菌大量繁殖,造成青贮饲料营养物质损失,产生难闻的气味,进而影响到家畜的采食量和生产性能[7]。
研究表明,青贮饲料的有氧稳定性不仅可以受到有机酸[8]和微生物[9]添加剂的影响,而且可以受到饲料原料组成[10-11]的影响。然而,作为一种在干旱、半干旱地区极具开发潜力的青贮饲料作物[2,12],甜高粱青贮饲料有氧稳定性方面的研究尚少见报道,为此,本研究选择了含糖量存在差异的两种甜高粱和普通玉米加工而成的甜高粱青贮和玉米青贮为材料,通过跟踪分析有氧环境条件下3种青贮饲料中微生物数量的动态变化、温度及pH变化,进而评价甜高粱青贮的有氧稳定性,为甜高粱青贮饲料的科学利用提供依据。
1 材料与方法
1.1 青贮饲料制作
高糖甜高粱(high sugar sweet sorghum, HS)品种为丽欧,糖锤度为22.1%,低糖甜高粱(low sugar sweet sorghum, LS)品种为X096,糖锤度为9.4%,玉米(maize, MZ)品种为包玉2号,糖锤度为9.2%。两个品种甜高粱与玉米于2015年4月28日播种,每个播种小区面积约为100 m2(20 m×5 m),每个品种重复播种3个小区。播种行距为60 cm,株距20 cm,人工播种,按常规方法进行田间管理,腊熟期甜高粱和玉米2015年10月10日收割,分别制作高糖甜高粱青贮(high sugar sweet sorghum silage, HSS)、低糖甜高粱青贮(low sugar sweet sorghum silage, LSS)和玉米青贮(maize silage, MZS),青贮原料的化学成分见表1。
HS: High sugar sweet sorghum; LS: Low sugar sweet sorghum; MZ: Maize; DM: Dry matter; CP: Crude protein; WSC: Water soluble carbohydrate; NDF: Neutral detergent fibre; ADF: Acid detergent fibre; ADL: Acid detergent lignin. 下同The same below.
用普通粉草机将收割的玉米及甜高粱粉碎至2~3 cm,人工填装于青贮塑料罐中。在填装青贮原料的过程中,用粗细适宜的短木棒不断用力捣压,最大限度确保每罐青贮原料被压实压紧。之后,在罐口上附密封垫,拧紧盖口,标记后于室温(15~25 ℃)避光保存,每种青贮制作10罐青贮。
1.2 有氧稳定性分析
青贮饲料在2016年4月1日开罐,以一个发酵罐为重复单位,每种青贮取3个重复。松动开窖后青贮使之与空气能充分接触。把多路温度记录仪(NZ93-6,南京能兆科技有限公司)探头放置于青贮饲料的中心位置,之后覆盖2层纱布,放置于室温下。在开罐有氧暴露后0,5,10,15,20,25 d时,从每个青贮罐中分别取样,测定青贮饲料各时间点pH值、干物质、微生物数量。有氧稳定性定义为青贮饲料接触空气后核心物料温度比外界温度高出2 ℃时所需要的小时(h)数[13]。
1.3 温度、干物质、WSC及pH值测定
pH值的测定:取出15 g青贮饲料样品,浸于135 mL蒸馏水中搅拌1 min,并用2层滤纸进行过滤处理。滤液经离心后用电子酸度计(PHSJ-5,上海仪电科学仪器股份有限公司)测定pH值。干物质采用烘干法测定。WSC采用硫酸-蒽酮比色法测定[14]。温度由多路温度记录仪测定。
大学生自身专业学习能力、日常兴趣爱好、思想价值观念也是影响就业观形成的主要因素。在面临就业问题的时候,大学生通常会根据自己的能力、爱好、物质追求等来确立自身的就业方向。
1.4 微生物菌落测定
从每种青贮饲料中各取5 g样品,剪碎放入45 mL的无菌蒸馏水中封口,置于37 ℃恒温摇床中慢速摇40 min后,即成10-1稀释液。用装有无菌枪头的移液枪吸取100 μL的10-1稀释液移入装有900 μL无菌水的离心管中混合均匀,即成10-2稀释液。按此方法连续稀释,制成10-3、10-4、10-5、10-6、10-7稀释菌液[15]。取选择性培养基,用记号笔在培养皿的底部划分10-3、10-4、10-5、10-6、10-7五种扇形稀释梯度,分别吸取不同稀释梯度的菌液10 μL滴在相应的扇形区域内,用涂抹棒均匀涂抹,每个稀释梯度做3个重复。
按Ashbell等[16]的方法,乳酸菌、好氧细菌和酵母菌分别采用Rogosa琼脂培养基、营养琼脂培养基和孟加拉红培养基,霉菌采用葡萄糖麦芽浸膏培养基。乳酸菌用CO2培养箱(BC-J80S,上海博讯实业有限公司)、好氧细菌和酵母菌用生化培养箱(SPX-150B,北京光明医疗仪器有限公司)、霉菌放在霉菌培养箱(MJX-160,宁波江南仪器厂),37 ℃培养48 h,用菌落计数器(YLN-30A,北京中兴伟业仪器有限公司)统计菌落形成单位(colony forming unit, CFU)。
1.5 数据处理
使用Excel 2007对pH、微生物数量、温度和DM数据进行数据整理,微生物数据进行以10为底的对数转换。采用统计软件SPSS 19.0进行方差分析,采用Duncan法进行多重比较,显著性检验水平为0.05。
2 结果与分析
2.1 有氧暴露过程pH、DM、WSC和温度的变化
HSS、LSS和MZS饲料有氧暴露过程pH、DM、WSC和温度的变化情况见表2。在0到第15天期间,3种青贮DM含量由高到低依次为LSS,MZS,HSS(P<0.05)。在20和25 d时, DM在HSS和MZS达到同一水平(P>0.05),但依然显著低于LSS(P<0.05)。在25 d的有氧暴露过程中,HSS增加了21.7%,MZS增加了10.1%,LSS增加了8.6%。
从pH值看,在0 d时,HSS显著低于LSS和MZS(P<0.05),在第10天时,3种青贮pH达到同一水平(P>0.05),而在第25天时,MZS的pH最大,LSS最低,HSS居中,三者之间差异达到显著水平(P<0.05)。3种青贮pH值都随着有氧暴露时间的延长而上升。
从温度变化来看,3种青贮饲料在0 d时温度基本一致,但在有氧环境下,在5、10和15 d期间青贮饲料温度持续升高,HSS和MZS温度显著大于LSS(P<0.05);从0到第5天,HSS温度增加了3 ℃,MZS温度增加了1.9 ℃,LSS温度增加了1.4 ℃。在15和20 d时,各组青贮温度均有所下降,在25 d时,各青贮温度依然高于室温。
2.2 有氧暴露过程微生物的数量变化
3种青贮饲料在有氧暴露过程中微生物数量的变化见表3。有氧暴露第0天时,HSS中乳酸菌数量最多,显著大于LSS(P<0.05),MZS居中。在5至25 d期间,3种青贮的乳酸菌数量持续减少,在25 d时,乳酸菌数量在3种青贮中差异不显著(P>0.05)。酵母菌和霉菌的数量变化相似,在有氧暴露的0 d时,3种青贮饲料之间酵母菌、霉菌数量无显著差异(P>0.05),但在10至25 d期间,酵母菌和霉菌数量持续增加,HSS的酵母菌和霉菌数量显著大于LSS(P<0.05),MZS居中。有氧暴露后,3种青贮中的好氧细菌数量均逐渐增加,在整个有氧暴露期间,好氧细菌数量在HSS中显著高于LSS(P<0.05),而MZS的好氧菌数量基本处于二者之间。
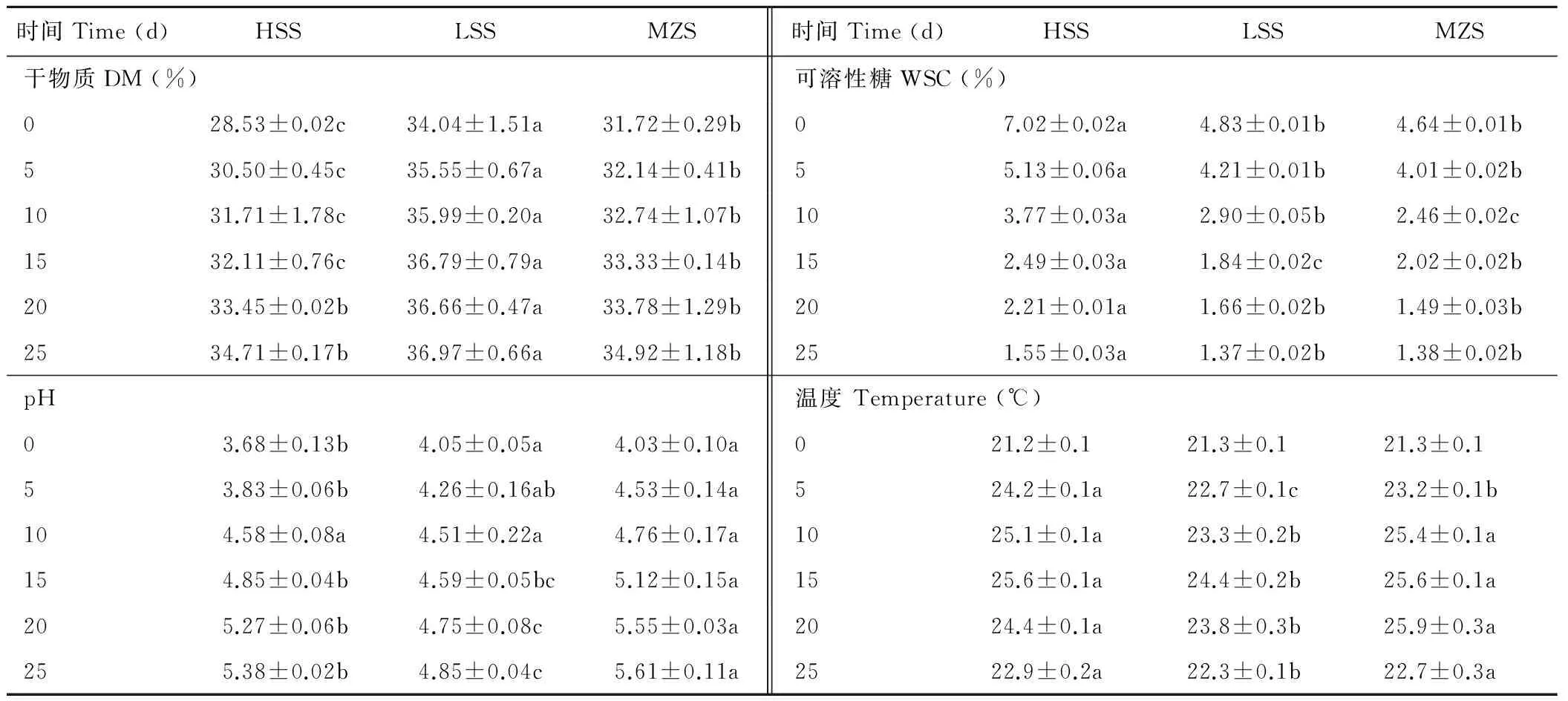
表2 青贮有氧暴露过程DM、pH、WSC和温度的变化Table 2 The change of DM, pH, WSC and temperature during aerobic exposure of the silages
注:HSS:高糖甜高粱青贮;LSS:低糖甜高粱青贮;MZS:玉米青贮。表中同一指标同行比较,标注不同小写字母表示差异显著(P<0.05)。下同。
Note: HSS:High sugar sweet sorghum silage;LSS:Low sugar sweet sorghum silage;MZS:Maize silage.The values within rows under the same items are significantly different (P<0.05). The same below.
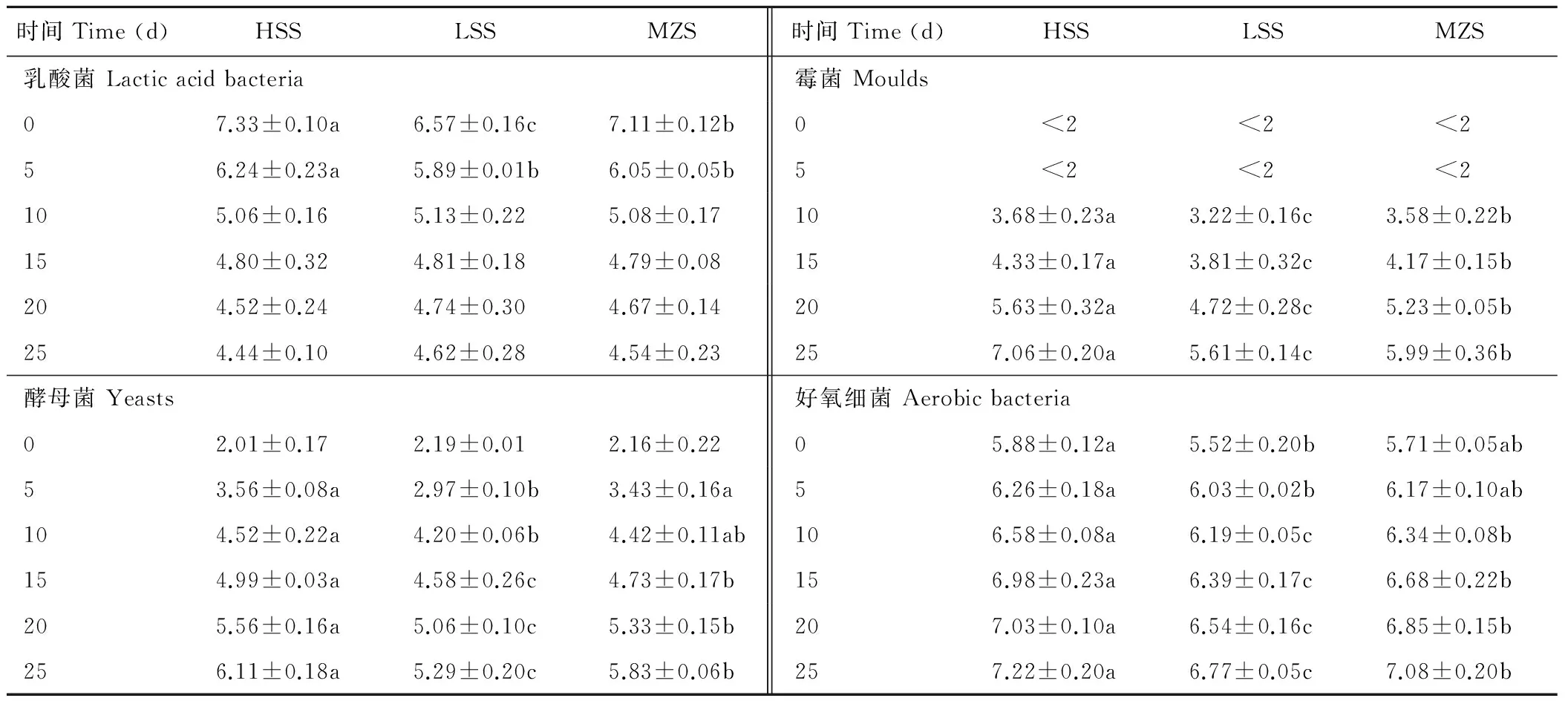
表3 青贮有氧暴露过程微生物数量的变化Table 3 The change of microbial populations in the silages during aerobic exposure log cfu/g FM
注: log cfu/g FM为每g青贮中菌落的对数值。
Note: log cfu/g FM means logarithm of bacterial colonies in 1 g silage.
3 讨论
3.1 有氧条件下青贮pH、DM、WSC和温度的变化
青贮DM与青贮原料本身的含水量有直接的关系。LS含水量最低,因此在LSS中DM也最大;HS持绿期较长,HS甜高粱表面富含的蜡质也阻止了水分的散失,在收割时含水量较多,导致HSS中DM较低;而MZ的水分在秋季很容易散失,导致含水量下降,使MZS的DM含量也较大。
青贮饲料pH值是评判青贮质量的关键性指标,是青贮乳酸发酵的结果。一般来讲pH值越低,酸度越大,青贮越容易保存[17-18]。在有氧环境条件下,青贮饲料pH值会随接触空气时间的延长而增加,这主要是好气性微生物快速增殖所引起的[18]。在有氧暴露的前5 d,HSS的pH值显著低于LSS和MZS,这是由HSS初始pH较低(pH=3.68)所引起的。在25 d时,LSS的pH值最低,MZS最高,HSS居中,这可能与三者可发酵糖的含量有关。
原料中丰富的WSC是保证青贮成功的关键因素之一,WSC是一类易发酵的物质,可以为青贮乳酸菌的增殖提供营养物质,产生有机酸而使pH下降。在0 d时,HSS、MZS和LSS中的WSC是青贮发酵后残余的WSC。HSS中较高的WSC说明了HS在青贮发酵达到稳定阶段后残余的WSC较多,这与青贮原料HS中富含WSC(18.40%)有关。而在有氧条件下,HSS中丰富的WSC可以为好氧微生物的大量增殖提供养分,导致WSC的快速下降,同样,LSS和MZS中残留的WSC也可以为好氧菌的生长提供养分而下降。
产热是青贮饲料在有氧环境条件下最显著的变化之一,它是大量微生物活动的结果,也是青贮养分损失的过程。一般人们用有氧稳定性来判断青贮饲料在有氧条件下变质的速度。有氧稳定性低,说明青贮遇氧变质速度越快[19]。在本研究中,环境温度为21 ℃,因此,按有氧稳定性的定义,有氧稳定性LSS最高,HSS最低,而MZS居中。这种差异反映了青贮饲料中易发酵物质的多少,容易发酵物质越多,在有氧条件下,由于好气性微生物快速增殖而使变质速度加快。因此,HSS较多的WSC可能是导致其有氧稳定性差的主要原因,此外,HSS较高含水量也加速了其变质过程;相反,LSS较低WSC含量是导致其在有氧条件下温度上升较慢的主要原因,而MZS虽然WSC含量也比较低,但MZS所含的丰富淀粉也属于易发酵物质,可以为好氧菌的生长提供养分,导致其在有氧条件下温度上升也较快。
3.2 有氧条件下青贮微生物的变化
青贮过程是一个复杂的微生物发酵过程,其中乳酸菌被认为是决定青贮发酵能否成功的关键微生物[20],青贮过程添加乳酸菌制剂往往也可以明显提高青贮的品质[21]。研究表明[3],HS和MZ比LS更容易青贮,与LSS相比,HSS残留了更多的WSC,MZS则残留了较多的淀粉。残留在HSS中较多的WSC和MZS中的淀粉均属易发酵糖类,在有氧的环境条件下,很容易被微生物利用而发生二次有氧发酵,导致HSS和MZS在有氧环境下酵母菌、霉菌和好氧细菌的快速增殖,而乳酸菌受到抑制而数量下降,更容易引起青贮饲料腐烂变质。LSS中较少的WSC和较低的含水量,可能是导致酵母、霉菌和好氧菌增殖较慢的重要原因。酵母菌和霉菌等好气性微生物通过氧化青贮有机酸而引起青贮饲料的有氧变质[22],是导致青贮二次发酵过程营养损失的主要因素。有研究估计,在青贮发酵过程中的有氧变质损失可高达10%~15%[23]。由此,在有氧暴露环境下,酵母菌和霉菌等好气性微生物所引起的HSS和MZS营养损失也是不可忽视的。
青贮乳酸菌的发酵类型,可以影响有氧条件下青贮的微生物数量和有氧稳定性。有研究表明,异型发酵乳酸菌产乳酸的能力虽然不如同型发酵乳酸菌,但它能够增加青贮中乙酸、丙酸的比例,而乙酸和丙酸具有抑制酵母菌和霉菌生长的特性[24-26]。由此推测,在有氧条件下,LSS中酵母菌和霉菌数量较少,很可能由于LSS是以异型乳酸菌发酵为主,产生了较多的乙酸和丙酸,后者抑制了酵母菌和霉菌等好气性微生物的增殖。但具体作用机制尚需进一步研究。
此外,不同的青贮原料附着的微生物种类和数量存在很大差异,这些微生物在青贮酸性环境条件下生长增殖受到了抑制,一旦环境发生变化,受抑制的微生物就会重新生长增殖。因此,HSS、MZS和LSS在有氧环境条件下不同微生物的数量变化也可能与其原料附着的微生物数量有关。
4 结论
有氧暴露条件下,LSS有氧稳定性最好,酵母菌、霉菌和好氧细菌数量增加最少;HSS有氧稳定性最差,酵母菌、霉菌和好氧细菌数量增加最多;MZS有氧稳定性和好氧性微生物数量居中。本研究结果提示,HSS在有氧暴露环境下更容易发生二次发酵,因此,有必要在青贮过程中使用添加剂,以保证HSS在使用过程中的营养品质。
References:
[1] Corredor D Y, Salazar J M, Hohn K L,etal. Evaluation and characterization of forage sorghum as feedstock for fermentable sugar production. Applied Biochemistry & Biotechnology, 2009, 158(1): 164-179.
[2] Xiao D, Zhang S J, Chen L Q,etal. Prospect analysis on the development of sweet sorghum as forage resources in Southern Xinjiang. Grass-Feeding Livestock, 2014, (6): 22-27. 肖丹, 张苏江, 陈立强, 等. 甜高粱饲料在南疆粗饲料资源开发中的前景分析. 草食家畜, 2014, (6): 22-27.
[3] Zhang S J, Chaudhry A S, Ramdani D,etal. Chemical composition andinvitrofermentation characteristics of high sugar forage sorghum as an alternative to forage maize for silage making in Tarim Basin, China. Journal of Integrative Agriculture, 2016, 15(1): 175-182.
[4] Marco O N D, Ressia M A, Arias S,etal. Digestibility of forage silages from grain, sweet and bmr sorghum types: Comparison ofinvivo,insituandinvitrodata. Animal Feed Science & Technology, 2009, 153(3): 161-168.
[5] Amer S, Seguin P, Mustafa A F. Short communication: Effects of feeding sweet sorghum silage on milk production of lactating dairy cows. Journal of Dairy Science, 2012, 95(2): 859-863.
[6] Guo X S, Zhou H, Yu Z. Effects of different additives on the aerobic stability of silage. China Dairy Cattle, 2006, (9): 18-21. 郭旭生, 周禾, 玉柱. 不同添加剂对青贮饲料有氧稳定性的影响. 中国奶牛, 2006, (9): 18-21.
[7] Zhou D B. Research, development and actuality for corn stover silage. Amino Acids and Biotic Resources, 2004, 26(2): 32-34. 周德宝. 青贮饲料的研究、发展及现状. 氨基酸和生物资源, 2004, 26(2): 32-34.
[8] Ma X G, Liu J J, Zheng Z H,etal. Effects of acetic and lactic acid in corn stover silage on aerobic stability and methane yield rate. Journal of China Agricultural University, 2015, 20(1): 44-52. 马旭光, 刘晶晶, 郑泽慧, 等. 乙酸和乳酸对玉米秸秆青贮料有氧稳定性和甲烷产率的影响. 中国农业大学学报, 2015, 20(1): 44-52.
[9] Guan W T, Ashbell G, Hen Y,etal. Effects of microbial inoculants applied to sorghum at ensiling on silage characteristics and aerobic stability. Scientia Agricultura Sinica, 2002, 35(11): 1401-1405. 管武太, Ashbell G, Hen Y, 等. 微生物添加剂对青贮高粱发酵品质和稳定性的影响. 中国农业科学, 2002, 35(11): 1401-1405.
[10] Wang Y, Yuan X J, Guo G,etal. Fermentation and aerobic stability of mixed ration forages in Tibet. Acta Prataculturae Sinica, 2014, 23(6): 95-102. 王勇, 原现军, 郭刚, 等. 西藏不同饲草全混合日粮发酵品质和有氧稳定性的研究. 草业学报, 2014, 23(6): 95-102.
[11] Xu Q F, Yu Z, Li Z Q,etal. A study on aerobic stability of alfalfa and corn silage. Acta Agrestia Sinica, 2007, 15(6): 519-524. 许庆方, 玉柱, 李志强, 等. 苜蓿、玉米青贮饲料有氧稳定性研究. 草地学报, 2007, 15(6): 519-524.
[12] Zhang S J, Osman A, Xue X Z,etal. Quality analysis on different sweet sorghum silages in Southern Xinjiang compared with a corn silage. Acta Prataculturae Sinica, 2014, 23(3): 232-240. 张苏江, 艾买尔江·吾斯曼, 薛兴中, 等. 南疆玉米和不同糖分甜高粱的青贮品质分析. 草业学报, 2014, 23(3): 232-240.
[13] Hu W, Schmidt R J, Mcdonell E E,etal. The effect ofLactobacillusbuchneri40788 orLactobacillusplantarumMTD-1 on the fermentation and aerobic stability of corn silages ensiled at two dry matter contents. Journal of Dairy Science, 2009, 92(8): 3907-3914.
[14] Yu R H, Zhao L H, Mo F,etal. Determination of water soluble carbohydrate in corn straw silage. Feed Industry, 2003, 24(9): 38-39. 余汝华, 赵丽华, 莫放, 等. 玉米秸秆青贮饲料中水溶性碳水化合物测定方法研究. 饲料工业, 2003, 24(9): 38-39.
[15] Zhang G N, Zhang Q. Study on microbial culture method in silage. Feed Industry, 2010, 31(7): 19-22. 张高娜, 张骞. 青贮饲料中微生物培养方法的研究. 饲料工业, 2010, 31(7): 19-22.
[16] Ashbell G, Pahlow G, Barbara D,etal. Dynamics of orange peel fermentation during ensilage. Journal of Applied Microbiology, 1987, 63(4): 275-279.
[17] Yang Y G, Zhang Y L, Du X,etal. Study on the major microorganism changes during the silage processing of two kinds of corn silage. Chinese Journal of Animal & Veterinary Sciences, 2012, 43(3): 397-403. 杨云贵, 张越利, 杜欣, 等. 2种玉米青贮饲料青贮过程中主要微生物的变化规律研究. 畜牧兽医学报, 2012, 43(3): 397-403.
[18] Wang B P, Dong X Y, Dong K H,etal. Effects of organic acid on the aerobic stability of whole-crop corn silage. Acta Agrestia Sinica, 2013, 21(5): 991-997. 王保平, 董晓燕, 董宽虎, 等. 有机酸对全株玉米青贮有氧稳定性的影响. 草地学报, 2013, 21(5): 991-997.
[19] Qin L G. Study on aerobic stability of corn silage with different additives. China Dairy, 2010, (8): 40-42. 秦立刚. 不同添加剂对青贮玉米的有氧稳定性研究. 中国乳业, 2010, (8): 40-42.
[20] Stokes M R. Effects of an enzyme mixture, an inoculant, and their interaction on silage fermentation and dairy production. Journal of Dairy Science, 1992, 75(3): 764-773.
[21] Guo H M, Zhu W, Zhang Y,etal. Effect of additives on the quality of asparagus officinalis stem leaf silage. Acta Prataculturae Sinica, 2016, 25(5): 134-140. 郭海明, 朱雯, 张勇, 等. 青贮添加剂对芦笋茎叶青贮品质的影响. 草业学报, 2016, 25(5): 134-140.
[22] Spoelstra S F, Driehuis F, Elferink S J. Anaerobic lactic acid degradation during ensilage of whole crop maize inoculated with. Journal of Applied Microbiology, 1999, 87(4): 583-593.
[23] Ashbell G, Lisker N. Aerobic deterioration in maize silage stored in a bunker silo under farm conditions in a subtropical climate. Journal of the Science of Food & Agriculture, 1987, 45(4): 307-315.
[24] Kung L, Taylor C C, Lynch M P,etal. The effect of treating alfalfa withLactobacillusbuchneri, 40788 on silage fermentation, aerobic stability, and nutritive value for lactating dairy cows. Journal of Dairy Science, 2002, 85(7): 1793-1800.
[25] Weinberg Z G, Ashbell G, Hen Y,etal. The effect of applying lactic acid bacteria at ensiling on the aerobic stability of silages. Journal of Applied Microbiology, 2008, 75(6): 512-518.
[26] Taylor C C, Kung L. The effect ofLactobacillusbuchneri, 40788 on the fermentation and aerobic stability of sigh moisture corn in laboratory silos. Journal of Dairy Science, 2002, 85(6): 1526-1532.
Aerobic stability and microbial populations in sweet sorghum silages during aerobic exposure
ZHOU Fei-Ran, ZHANG Su-Jiang*, WANG Ming, XIAO Dan, GUO Xue-Feng
KeyLaboratoryofTarimAnimalHusbandryScience&Technology,CollegeofAnimalScience,TarimUniversity,Alar843300,China
In order to promote the exploitation and utilization of sweet sorghum silage, three kinds of silages (high sugar sweet sorghum silage, HSS; low sugar sweet silage, LSS; maize silage, MZS) were used to analyze the changes in dry matter (DM), water soluble carbohydrates (WSC), pH, temperature and microbial populations during aerobic exposure over 0, 5, 10, 15, 20 and 25 days. The results showed that HSS had a lower pH and higher LAB (lactic acid bacteria) population and higher temperature compared with LSS and MZS (P<0.05) in the early stage of aerobic exposure (0-5 d). The numbers of yeast, mould and aerobic bacteria in HSS were higher than that in LSS and MZS (P<0.05), while temperature and pH were lower in LSS than those in HSS and MZS (P<0.05) in the latter stages of aerobic exposure (15-25 d). HSS had the highest WSC and LSS had the lowest dry matter content (P<0.05) over all exposure periods. Overall, LSS had the greatest aerobic stability with less yeast, mould and aerobic bacteria which were highest in HSS which had the lowest aerobic stability; bacteria numbers and aerobic stability were intermediate in in MZS. The results of this study suggest that it is necessary to use additives when making HSS to assure quality because it is more prone to secondary fermentation under aerobic exposure.
sweet sorghum; silage; aerobic stability; microbe
10.11686/cyxb2016304
http://cyxb.lzu.edu.cn
2016-08-17;改回日期:2016-11-14
国家自然科学基金项目(31160472)资助。
周斐然(1991-),男,新疆喀什人,在读硕士。E-mail: 710298044@qq.com*通信作者Corresponding author. E-mail: zsjdky@126.com
周斐然, 张苏江, 王明, 肖丹, 郭雪峰. 甜高粱青贮有氧暴露的稳定性及微生物变化的研究. 草业学报, 2017, 26(4): 106-112.
ZHOU Fei-Ran, ZHANG Su-Jiang, WANG Ming, XIAO Dan, GUO Xue-Feng. Aerobic stability and microbial populations in sweet sorghum silages during aerobic exposure. Acta Prataculturae Sinica, 2017, 26(4): 106-112.

