蘖穗氮肥追施比例对水稻灌浆成熟期 Rubisco 和 GS同工型基因表达量的影响
朱方旭,郭雪冬,同拉嘎,张玉磊,潘冬,李明月,李丹,张忠臣,金正勋
(东北农业大学农学院,黑龙江哈尔滨 150030)
蘖穗氮肥追施比例对水稻灌浆成熟期 Rubisco 和 GS同工型基因表达量的影响
朱方旭,郭雪冬,同拉嘎,张玉磊,潘冬,李明月,李丹,张忠臣,金正勋*
(东北农业大学农学院,黑龙江哈尔滨 150030)
【目的】氮素营养影响着水稻灌浆过程中核酮糖-1, 5-二磷酸羧化酶/加氧酶 (Rubisco) 和谷氨酰胺合成酶(GS) 基因转录表达量,研究其变化动态及其与不同形态氮含量的关系,旨在为阐明氮素营养对光合效率和籽粒蛋白质积累的影响分子调控机理提供理论依据。【方法】选用寒地粳稻穗数型高产品种和穗重型超级稻品种进行盆栽试验。施肥比例为 N∶P2O5∶K2O = 1∶0.5∶1,氮肥 50% 作为基肥,其余作分蘖肥和穗肥追施,分蘖肥和穗肥比例为 10%∶40%、20%∶30%、30%∶20%、40%∶10%。分析了水稻灌浆过程中 Rubisco 和 GS 基因转录表达量及不同形态氮的积累动态。【结果】增加穗肥氮素施用量可显著提高水稻灌浆过程中叶片和籽粒的全氮、铵态氮、硝态氮含量;增加穗肥比例不同程度的上调了 Rubisco 大亚基和小亚基基因的 mRNA 表达量,其中 OsRBCSL、OsRBCS2 和 OsRBCS4 表达上调显著,OsRBCS3 和 OsRBCS5 表达上调较小;穗肥比例增加延长了 Rubisco 各亚基基因高表达持续时间,增加了水稻灌浆中期和后期叶片中 OsGS1;1 和 OsGS2 基因的转录表达量以及籽粒 OsGS1;1 基因的转录表达量和整个灌浆过程中 OsGS1;3 基因的转录表达量。Rubisco 五个亚基基因的转录表达量与叶片 NO3--N 和全氮含量间以及叶片和籽粒中 GS 基因的转录表达量与 NH4
粳稻;氮素;灌浆成熟期;Rubisco;GS;基因表达
氮肥施用方法不仅对水稻的生长发育及产量和品质影响很大,而且也影响肥料的利用率和农田水土污染。围绕着氮肥施用方法与水稻生长发育及产量和品质性状的关系国内外学者已做了大量的研究。但由于水稻不同类型新品种的选育和推广、栽培条件和方法及农业生产环境的变化、经济水平的发展、研究手段和水平的提高等原因,不断地出现新的问题,并要求解决新问题和阐明相关机理,以致该领域仍然是至今国内外学者要研究解决的热点问题。水稻产量和品质的形成主要是淀粉和蛋白质合成与积累的过程[1],十分复杂的碳氮代谢参与这些过程。核酮糖-1, 5-二磷酸羧化酶/加氧酶 (Rubisco) 和谷氨酰胺合成酶 (GS) 都是碳氮代谢过程中的关键酶,该酶含量和活性大小对水稻产量和品质的形成影响很大。已有研究结果表明,硝酸盐[2]、铵[3]、谷氨 酰 胺 和 谷 氨 酸[4]等 能 够 作 为 调 节 基 因 表 达 的 氮 信号。在高等植物中氮素含量与 Rubisco 之间存在着很强的线性关系[5]。水稻的 Rubisco 是由一个大亚基和5 个小亚基组成的 8 聚体,其中 OsRBCS1 在水稻叶片中不表达[6-7]。GS 则是无机氮转化为有机氮的第一步,对无机氮素的同化起到关键性的作用。基因转录表达是基因表达调控的重要环节之一,转录表达量与酶活性和基因性状表现都有密切的线性关系。国内外至今不同施氮方法对水稻灌浆过程中 Rubisco和 GS 基因转录表达量的影响方面研究报道很少。因此,针对水稻生长发育特点和生产上采用的氮肥施用方法,本试验选用寒地粳稻高产品种研究不同蘖穗肥比例对籽粒灌浆过程中 Rubisco 和 GS 同工型基因转录表达量变化及不同形态氮含量的影响,旨在为阐明氮素营养对叶片光合效率和籽粒蛋白质积累影响的分子调控机理提供理论依据。
1 材料与方法
1.1 试验设计
本试验选用寒地粳稻穗数型高产品种松粳 6 号和穗重型超级稻品种松粳 9 号,于 2014 年和 2015年在东北农业大学农学院进行盆栽试验。盆的规格为长 × 宽 × 高为 60 cm × 40 cm × 40 cm。盆栽用土过筛混拌均匀后等量装盆,插秧前 3 天灌水浸泡,施入的基肥与上层 20 cm 土壤混拌均匀。4 月 5 日在育秧盘上等距离单粒点播催芽籽,大棚旱育秧管理,5月 10 日选择叶龄相同、长势相近的秧苗插秧,每盆插 8 穴,每穴 2 株。施肥量为 N 135 kg/hm2,N∶P2O5∶K2O 比例为 1∶0.5∶1,施用肥料为分析纯尿素、磷酸二铵、硫酸钾,按盆的表面积折算成每盆的 N,P2O5,K2O 的施用量。磷肥 100% 基施;钾肥的 50% 基施,50% 在孕穗期追施;氮肥的 50% 基施,其余 50% 用于分蘖肥和穗肥按照以下比例分配进行追施:10%∶40%、20%∶30%、30%∶20%、40%∶10%,共 4 个处理,每个处理 8 盆,共 32 盆。分蘖肥在秧苗第 5 片叶完全展开后施入,穗肥在倒 2叶展开约三分之一时施入。其它管理同大田。
1.2 取样方法
以穗部抽出叶鞘 3 cm 为准挂牌标记抽穗日期,分别在抽穗后 5、10、15、20、25、30 d 取穗和剑叶。剑叶取中间部分 5 cm 长;籽粒在灌浆程度基本一致的穗中部取样,籽粒去颖壳。样品一部分用105℃ 杀青 10 min,65℃ 烘干;另一部分液氮冷冻处理,-80℃ 保存,备用。
1.3 基因转录水平检测
根据 Jain 等分析结果[8],本试验选择水稻不同生育时期和组织器官中稳定性最好的 UBQ5 和在不同环境条件或者胁迫条件下稳定性较好的 Actin1 两个内参基因,实验结果取两组数据的平均值。重复样品等比例混合后提取总 RNA,重复两次。分别使用trizol 法和冷酚法提取水稻叶片和籽粒总 RNA,之后用 DNase I (K2101AA,TaKaRa) 和 RNase Inhibitor (K8101BA,TaKaRa) 对总 RNA 消化处理去除基因组 DNA。第 1 链 cDNA 合成使用 PrimeScriptTMII 1st Strand cDNA Synthesis Kit (RR019A,TaKaRa),以上产品均按照产品说明书进行操作。PCR 反应使用TaKaRa TaqTM(KA1601BA,TaKaRa) Taq 酶,控制扩增的循环数在 24~30 之间。扩增产物用 1.5% 的琼脂糖凝胶进行电泳。PCR 引物信息列于表 1。对合成的每对引物进行 PCR 检测。由图 1 引物检测结果可知,所有引物扩增的片段长度都符合设计引物时的理论长度,并且特异性很强,没有非特异性条带。
1.4 不同形态氮含量测定
样品全氮含量测定采用凯氏定氮法,铵态氮和硝态氮分别用 Berthelot 焰色反应法[9]和 Griess 法[10]测定。将叶片或籽粒称重计数,在预冷的提取液 [50 mmol/L Tris-HCL (pH = 7.0),10 mmol/L 咪唑,0.5% (w/v) β-巯基乙醇,] 中研磨成匀浆。匀浆 12000 g 4℃ 离心 20 min,取上清用于铵态氮和硝态氮测定。
1.5 数据分析
2014 年只测定抽穗后 10、20、30 d 的基因转录表达量和氮含量,结果与 2015 年基本一致,因此本论文只对 2015 年的数据进行分析。数据分析使用SPSS 和 Excel,胶片亮度分析使用 Quantity one 7.0.5软件。

表1 RT-PCR 目的基因引物Table 1 Accessions of gene and sequence of RT-PCR Primers

图1 RT-PCR 产物长度检测Fig. 1 RT-PCR production size test[注(Note):图中所用 marker 从上向下依次为 1000 bp、750 bp、500 bp、250 bp、100 bp The used marker from top to bottom are 1000 bp, 750 bp, 500 bp, 250 bp and 100 bp.]
2 结果与分析
2.1 供试品种间产量性状比较
比较两个供试品种的产量性状可知 (表 2),松粳6 号每穴穗数显著多于松粳 9 号,但穗粒数、千粒重和结实率显著低于松粳 9 号,显示两个供试品种间的产量性状不同,松粳 6 号是穗数型品种,而松粳 9号是穗重型品种。

表2 供试品种间产量性状比较Table 2 Comparison of yield traits among the tested cultivars
2.2 不同处理对水稻叶片和籽粒中不同形态氮含量的影响
由图 2 可见,在灌浆过程中水稻叶片全氮含量的变化动态 2 个品种和不同施氮处理都基本相似,随着灌浆进程先逐渐升高,达到峰值后又逐渐降低,呈单峰曲线变化,其中穗数型品种松粳 6 号峰值出现在抽穗后 20 d,穗重型品种松粳 9 号则出现在抽穗后 25 d;不同施氮处理的叶片中铵态氮含量变化动态是穗数型品种松粳 6 号是呈先升高后降低的单峰曲线变化,抽穗后 25 d 达到峰值,而穗重型品种松粳 9 号是一直呈上升的直线变化趋势;2 个品种和不同施氮处理的叶片中硝态氮含量变化动态都很相似,从抽穗后 5 d 开始一直呈下降趋势。2 个品种和不同施氮处理的籽粒中全氮含量是随着灌浆进程缓慢升高,硝态氮含量是随着灌浆进程 2 个品种的 T1 和 T2 处理是缓慢升高,而 T3 和 T4 处理是缓慢下降;铵态氮含量是 2 个品种和不同施氮处理都呈先升高后降低的单峰曲线变化,其中穗数型品种松粳 6 号是抽穗后 25 d 达到峰值,而穗重型品种松粳 9 号是抽穗后 30 d 达到峰值。随着分蘖肥施氮量的减少和穗肥施氮量的增加,灌浆过程中叶片和籽粒的全氮、硝态氮、铵态氮含量也都逐渐增加,其中 T1 和 T4 处理间始终表现显著的差异。说明灌浆过程中叶片和籽粒中铵态氮和硝态氮含量的变化动态并不相同,铵态氮和全氮含量的变化趋势基本一致,籽粒中硝态氮含量的变化趋势因施氮方法不同可增加或可减少,增加穗肥施氮量可增加籽粒中硝态氮含量,反之与此相反。
2.3 不同施氮处理对水稻叶片 Rubisco 基因 mRNA表达量的影响
由图 3 可见,供试的两个品种和不同施氮处理在灌浆过程中 OsRBCL 基因 mRNA 表达量变化动态基本相似,均呈先升高后降低的单峰曲线变化,其中穗数型品种松粳 6 号各处理都在抽穗后 15 d 表达量达到峰值,但灌浆过程中高表达量持续时间不同处理间有差异,其中 T1 和 T2 处理是抽穗后 10~25 d、T3 和 T4 处理是抽穗后 10~15 d 维持较高的表达水平;穗重型品种松粳 9 号表达量达到峰值时间分别为 T1、T2、T3 处理抽穗后 20 d,T4 处理是抽穗后 10 d;T1、T2、T3 处理是抽穗后 10~25 d,T4 处理是抽穗后 10~15 d 维持较高的表达水平。说明在灌浆过程中 OsRBCL 基因 mRNA 表达量变化动态不因品种或氮素营养不同而发生质的变化,增加灌浆成熟期氮素营养会延长该基因的高表达持续时间。
灌浆过程中两个品种和不同施氮处理的 OsRBCS2和 OsRBCS4 基因的转录表达量变化动态都呈随灌浆进程表达量逐渐上升,达到峰值后又缓慢下降的单峰曲线变化,其中穗数型品种松粳 6 号的 OsRBCS2和 OsRBCS4 基因转录表达量峰值分别出现在抽穗后10 d 和 15 d。在穗重型品种松粳 9 号中 OsRBCS2 基因的转录表达量峰值出现的时间 T1 和 T2 处理是抽穗后 15 d、T3 和 T4 处理是抽穗后 10 d,而 OsRBCS4基因的转录表达量峰出现的时间 T1 和 T2 处理是抽穗后 15 d、T3 和 T4 处理是抽穗后 20 d。OsRBCS3基因的转录表达量在抽穗后 5~30 d 一直呈快速下降趋势,但 OsRBCS5 基因的转录表达量在这段时间呈平缓下降趋势。说明在灌浆过程中 Rubisco 小亚基基因的各同工型基因的表达是彼此间相互独立,而且表达量变化动态不因品种或氮素营养不同而发生质的变化。

图2 不同蘖、穗肥施用比例水稻叶片及籽粒中各形态的氮素含量Fig. 2 Contents of different N in rice leaves and grains affected by the tillering and heading fertilizer input ratios[注(Note):柱上不同小写字母表示不同处理间差异达到 5% 显著水平Different small letters above the bars mean significant difference between the treatments at the 0.05 level.]
随着分蘖肥施氮量的减少和穗肥施氮量的增加,两个品种叶片 OsRBCL 基因的转录表达量均随之上调,其中 T1 和 T4 处理间的表达量差异达到显著水平。受到氮素处理的影响,Rubisco 小亚基基因家族各成员的转录表达量也不同程度地发生变化,两个品种 OsRBCS2 和 OsRBCS4 基因表达量都随着分蘖肥施氮量的减少和穗肥施氮量的增加大幅度上调,在穗数型品种松粳 6 号中 OsRBCS2 基因表达量 T1较 T4 上调约 1 倍,OsRBCS4 基因上调约 1.2 倍,在穗重型品种松粳 9 号中 OsRBCS2 基因的表达量 T1较 T4 上调约 0.6 倍,OsRBCS4 基因上调约 1 倍。两个品种 OsRBCS3 转录表达量上调幅度较小,但 T1和 T4 处理间差异仍然达到显著水平。OsRBCS5基因的转录表达量也上调,其中 T1 和 T4 处理间穗数型品种松粳 6 号是抽穗后 10~25 d、穗重型品种松粳 9 号是抽穗后 5~25 d 的表达量差异都达到显著水平。说明增加灌浆成熟期氮素营养会不同程度的上调 Rubisco 大亚基和小亚基基因的转录表达量,但不同基因对氮素营养的响应程度并不相同,其中OsRBCSL、OsRBCS2 和 OsRBCS4 基因受到氮素营养的 影 响 上 调 表 达 的 作 用 明 显 , 而 OsRBCS3 和OsRBCS5 受氮素营养的影响上调表达的作用较小。
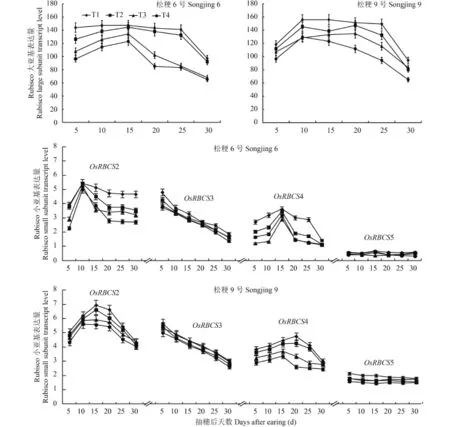
图3 不同蘖穗肥比例水稻叶片 rbcL 与 rbcS 转录表达量Fig. 3 Transcription levels of rbcL and rbcS in rice leaves affected by the tillering and heading fertilizer input ratios
2.4 不同施氮处理对水稻叶片和籽粒中谷氨酰胺合成酶同工型基因表达量的影响
由图 4 可见,在灌浆过程中两个品种和不同施氮处理的叶片中 OsGS1;1 基因转录表达量变化动态均呈单峰曲线变化,其中穗数型品种松粳 6 号的 T1和 T2 处理的转录表达量峰值出现在抽穗后 20 d,T3和 T4 处理的转录表达量峰值出现在抽穗后 15 d,穗重型品种松粳 9 号 T1 和 T2 处理的转录表达量峰值出现在抽穗后 25 d,T3 和 T4 处理的转录表达量峰值出现在抽穗后 20 d,而且两品种分别在抽穗后20~30 d 和 25~30 d 内差异增大,T1 处理的转录表达量显著高于 T4 处理。OsGS2 基因在两个品种和不同施氮处理的叶片中转录表达量变化动态也呈单峰曲线,在穗数型品种松粳 6 号中转录表达量峰值出现在抽穗后 20 d,在抽穗后 15~20 d 内维持较高的表达水平;在穗重型品种松粳 9 号中转录表达量峰值出现在抽穗后 15 d,而且两品种分别在抽穗后10~20 d 和 10~30 d 内差异增大,T1 处理的转录表达量显著高于 T4 处理。说明在灌浆过程中叶片谷氨酰胺合成酶各同工型基因的转录表达量变化动态不因品种或氮素营养不同而发生质的变化,增加灌浆成熟期氮素营养不仅会延长基因高表达持续时间,而且可提高基因的转录表达量。

图4 不同蘖穗肥比例对叶片谷氨酰胺合成酶基因转录表达量的影响Fig. 4 Transcription levels of glutamine synthetase gene in rice leaves affected by the tillering and heading fertilizer input ratios
由图 5 可见,在灌浆过程中不同类型品种籽粒OsGS1;1 基因的转录表达量变化动态因施氮处理不同而异,在 T3 和 T4 处理中转录表达量呈单峰曲线变化,抽穗后 25 d 转录表达量达到峰值后又下降,而在 T1 和 T2 处理中转录表达量呈直线上升的变化趋势,抽穗后 30 d 时表达量都最高。说明灌浆成熟期氮素营养会改变籽粒 OsGS1;1 基因的转录表达量变化动态。OsGS1;3 基因的转录表达量变化动态在不同类型品种和不同施氮处理间基本一致,抽穗后10~30 d 均呈直线上升趋势,抽穗后 30 d 的转录表达量最高。说明在灌浆过程中籽粒 OsGS1;3 基因的转录表达量变化动态不因品种类型和氮素营养不同而发生质的变化。
不同处理间基因转录表达量比较可知,OsGS1;1基因在穗数型品种松粳 6 号中抽穗后 10 d 时各处理间表达量差异不显著,但在抽穗后 15~30 d 内 T1 和T4 处理间差异较大,除抽穗后 25 d 外 T1 处理显著高于 T4 处理;在穗重型品种松粳 9 号中抽穗后10~20 d 时各处理间表达量差异并不显著,但在抽穗后 25~30 d 内 T1 和 T4 处理间差异较大,抽穗后30 d 时 T1 处理显著高于 T4 处理。不同类型品种籽粒中 OsGS1;3 基因转录表达量均随着穗肥氮素施用量的增加而增加,T1 处理的转录表达量显著高于 T4处理。说明增加灌浆成熟期氮素营养可提高灌浆中后期的籽粒 OsGS1;1 基因的转录表达量和整个灌浆过程中 OsGS1;3 基因的转录表达量。
2.5 不 同 形 态 氮 含 量 与Rubisco 和GS 基 因mRNA 表达量间相关性
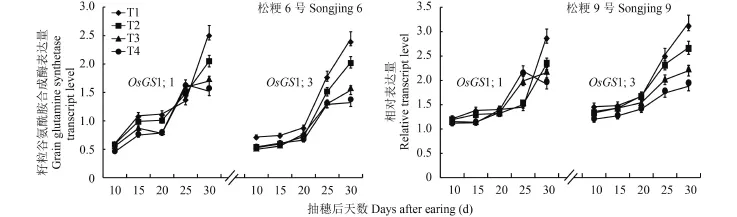
图5 不同蘖穗肥比例水稻籽粒中谷氨酰胺合成酶基因转录表达量Fig. 5 Transcription levels of glutamine synthetase gene in rice grains affected by the tillering and heading fertilizer input ratios
根据 2 个供试品种在不同施氮处理和灌浆时期的不同形态氮含量和基因转录表达量数据计算两者间的简单相关系数,其结果分别列于表 3 和表 4。
由表 3 可知,水稻叶片中 Rubisco 五个亚基基因的转录表达量与叶片 NH4+-N 含量间均呈不显著的正相关,与叶片 NO3--N 和全氮含量间均呈显著或极显著的正相关。说明叶片 Rubisco 各亚基基因的转录表达量高低与叶片 NO3--N 和全氮含量有密切关系,增加叶片 NO3--N 和全氮含量,可以显著提高 Rubisco基因的转录表达量,增加叶片 NH4+-N 含量虽然也能提高 Rubisco 基因的转录表达量,但效果不如 NO3--N明显。
由表 4 可知,叶片和籽粒中 GS 基因的转录表达量与 NH4+-N 和全氮含量间均呈显著或极显著的正相关,与叶片和籽粒的 NO3--N 含量间分别呈不显著的负相关和正相关。说明叶片和籽粒中 GS 基因的转录表达量与叶片和籽粒的 NH4+-N 和全氮含量高低关系很密切,增加灌浆成熟期叶片和籽粒的 NH4+-N 和全氮含量,可以显著提高叶片和籽粒的 GS 基因转录表达量。叶片和籽粒 NO3--N 含量高低对 GS 基因的转录表达量影响并不很明显。
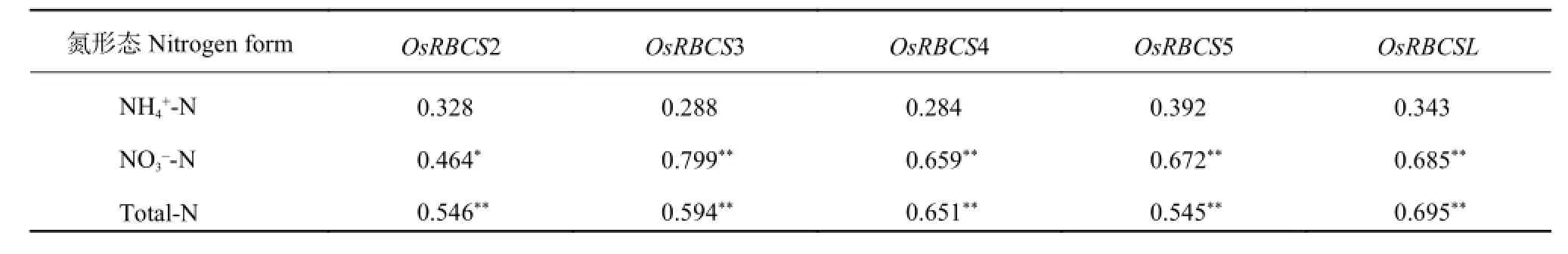
表3 Rubisco 基因转录表达量与叶片不同形态氮含量间的相关系数Table 3 Correlation coefficients between the transcription levels of Rubisco gene and different form nitrogen contents of leaves

表4 谷氨酰胺合成酶基因转录表达量与叶片和籽粒不同形态氮含量间的相关系数Table 4 Correlation coefficients between the transcription levels of glutamine synthetase gene and different form nitrogen contents in leaves and grain
3 讨论
RuBP 羧化酶是光合作用的关键酶之一,该酶的活性大小和含量高低是评价植物光合作用能力的重要指标。普遍认为叶片氮含量和光合作用能力之间呈现高度正相关[11-12],一定范围内增加氮素施用量会增加 RuBP 羧化酶的活性[13]。Miyazaki 等[14]的研究结果表明,硝酸铵可以不同程度的增加 RuBP 羧化酶各亚基基因的表达量。Parry 等研究认为 RuBP 羧化酶基因的表达量与酶含量之间在一定范围内呈正相关[11],提高 RuBP 羧化酶的活性可以增加光合产物的量[15]。由本试验结果又可知,水稻剑叶中 RuBP 羧化酶各亚基基因的转录表达量及叶片全氮和 NO3--N 含量都随着穗肥氮素施用量的增加而增加,并且 RuBP羧化酶各亚基基因的表达量与叶片全氮和 NO3--N 含量呈极显著的正相关。因此,增加氮素营养之所以能提高水稻叶片光合效率,是因为提高了叶片含氮量,进而提高 RuBP 羧化酶各亚基基因的转录表达量,致使提高 RuBP 羧化酶的含量,最终提高 RuBP羧化酶的活性,而且增加氮素营养还能延长 RuBP羧化酶基因转录表达峰值的持续时间,为进一步提高叶片光合效率提供了物质基础。NO3--N 对 RuBP羧化酶活性的调节作用主要是通过 RuBP 羧化酶基因转录水平的调控来实现。
Tabuchi 等[16]研究结果表明,GS1;1 对于水稻籽粒灌浆起非常关键的作用,OsGS1;1 缺失水稻突变体植株的灌浆速率和灌浆程度都严重降低,并且 OsGS1;3不能补偿 OsGS1;1 的功能。刘丽等[17]研究指出,谷氨酰胺合成酶活性的增加会增加籽粒的灌浆程度。在水稻灌浆成熟期增加植株谷氨酰胺合成酶的含量和活性将有利于水稻籽粒灌浆过程。Hye 等[18]、Cai等[19]研究结果表明,谷氨酰胺合成酶基因转录表达量的升高会显著增加组织内谷氨酰胺合成酶的含量。Cao 等[20]指出水稻组织内 NO3--N 含量的升高对谷氨酰胺合成酶的活性有正向调节作用。由本试验结果可知,穗肥氮素施用量的增加使水稻灌浆中后期叶片和籽粒中 GS 同工型基因的转录表达量明显升高,而且也提高 NO3--N 含量。因此,增加穗肥氮素施用量不仅可以提高 GS 基因的转录表达量为提高 GS 含量保证物质基础,而且 NO3--N 的累积还有利于提高其 GS 活性。OsGS1;1 和 OsGS1;3 含量及活性的增加会加快叶片中干物质向籽粒中运输,加快籽粒的灌浆速率[16]。而 OsGS2 活性的增加能够有效的保护光合组织受到高浓度 NH4+-N 破坏[21]。所以增加灌浆成熟期氮素营养无论对提高水稻叶片光合作用还是加快籽粒灌浆都非常有利。在水稻生产上以提高产量为目的的超高产栽培,齐穗期应适当施用氮肥,以提高灌浆成熟期叶片和籽粒的氮浓度,为提高叶片光合效率和加快籽粒灌浆进而提高粒重和成熟度提供物质基础。
由本试验结果可知,Rubisco 基因转录表达量与NH4
+-N 含量间、GS 基因转录表达量与组织内 NO3--N含量间相关性都不大,说明 NH4+-N 对 RuBP 羧化酶活性和 NO3--N 对 GS 活性的调节作用并不是通过基因转录水平上的调控,而是通过其它途径,因此进一步深入研究 NH4+-N 和 NO3
--N 对酶活性的调控机理,对有效控制该酶活性大小,进而提高水稻产量和改善稻米品质很有意义。
[1]金 正勋, 钱春 荣, 杨静等. 水稻灌浆成熟 期 籽粒谷氨酰胺 合成酶活性变化及其与稻米品质关系的初步研究 [J]. 中国水稻科学, 2007, 21(1): 103-106. Jin Z X, Qian C R, Yang J, et al. Changes of activity of glutamine synthetase during grain filling and its influence on rice grain quality[J]. Chinese Journal of Rice Science, 2007, 21(1): 103-106.
[2]Forde B G. Local and long-range signaling pathways regulating plant responses to nitrate [J]. Annual Review of Plant Biology, 2002, 53(53): 203-224.
[3]Sugiharto B, Sugiyama T. Effects of nitrate and ammonium on gene expression of phosphoenolpyruvate carboxylase and nitrogen metabolism in maize leaf tissue during recovery from nitrogen stress [J]. Plant Physiology, 1992, 98(98): 1403-1408.
[4]Oliveira I C, Coruzzi G M. Carbon and amino acids reciprocally modulate the expression of glutamine synthetase in arabidopsis [J]. Plant Physiology, 1999, 121(121): 301-310.
[5]Evans J R. Photosynthesis and nitrogen relationships in leaves of C 3 plants [J]. Oecologia, 1989, 78(1): 9-19.
[6]Koichi M, Tomoko H, Shuji M, et al. Unusual small subunit that is not expressed in photosynthetic cells alters the catalytic properties of rubisco in rice [J]. Plant Physiology, 2014, 164(1): 69-79.
[7]Suzuki Y, Ohkubo M, Hatakeyama H, et al. Increased rubisco content in transgenic rice transformed with “sense” rbcs gene [J]. Plant & Cell Physiology, 2007, 48(4): 626-637. [8]Jain M, Nijhawan A, Tyagi A K, et al. Validation of housekeeping genes as internal control for studying gene expression in rice by quantitative real-time pcr [J]. Biochemical & Biophysical Research Communications, 2006, 345(2): 646-651.
[9]Gordon S A, Fleck A, Bell J. Optimal conditions for the estimation of ammonium by the berthelot reaction [J]. Annals of Clinical Biochemistry, 1978, 15(5): 270-275.
[10]Oliveira I C, Timothy B, Knight T J, et al. Overexpression of cytosolic glutamine synthetase. Relation to nitrogen, light, and photorespiration [J]. Plant Physiology, 2002, 129(3): 1170-1180.
[11]Parry M A, Andralojc P J, Mitchell R A, et al. Manipulation of rubisco: The amount, activity, function and regulation [J]. Nature Medicine, 2013, 19(5): 536-538.
[12]Andersson I, Backlund A. Structure and function of rubisco[J]. Plant Physiology & Biochemistry, 2008, 46(3): 275-291.
[13]刚爽, 王敬国, 杨亮等. 氮素用量对寒地水稻氮代谢关键酶活性的
影响 [J]. 农业现代化研究, 2010, 31(2): 224-227.
Gang S, Wang J G, Yang L, et al. Effects of nitrogen level on key enzyme to nitrogen metabolism of rice in cold region[J]. Research of Agricultural Modernization, 2010, 31(2): 224-227.
[14]Miyazaki N, Ueno O, Saitou K. Effects of nitrogen on the expression of ribulose-1, 5-bisphosphate carboxylase/oxygenase small subunit multigene family members in rice (Oryza sativa L.) [J]. Plant Production Science, 2013, 16(1): 71-82.
[15]Parry M A, Andralojc P J, Scales J C, et al. Rubisco activity and regulation as targets for crop improvement [J]. Journal of Experimental Botany, 2013, 64(3): 717-730.
[16]Tabuchi M, Sugiyama K, Ishiyama K, et al. Severe reduction in growth rate and grain filling of rice mutants lacking osgs1;1, a cytosolic glutamine synthetase1;1 [J]. Plant Journal for Cell & Molecular Biology, 2005, 42(5): 641-651.
[17]刘丽, 邹德堂. 氮素用量对水稻籽粒谷氨酰胺合成酶活性及产量的
影响 [J]. 东北农业大学学报, 2009, 40(10): 1-4.
Liu L, Zou D T. Effect of nitrogen application on glutamine synthetase activity and yield of rice grain[J]. Journal of Northeast Agricultural University, 2009, 40(10): 1-4.
[18]Hye Jung L, Abdula S E, Dae Won J, et al. Overexpression of the glutamine synthetase gene modulates oxidative stress response in rice after exposure to cadmium stress [J]. Plant Cell Reports, 2013, 32(10): 1521-1529.
[19]Cai H M, Xiao J H, University H A. Co-suppressed glutamine synthetase2 gene modifies nitrogen metabolism and plant growth in rice [J]. Chinese Science Bulletin, 2010, 55(9): 823-835.
[20]Cao Y, Fan X R, Sun S B, et al. Effect of nitrate on activities and transcript levels of nitrate reductase and glutamine synthetase in rice [J]. Pedosphere, 2008, 18(5): 664-673.
[21]Vikas Dhikav M D, Gupta S, Dm K S A. Regulation of glutamine synthetase isoforms in two differentially drought-tolerant rice (Oryza sativa L.) cultivars under water deficit conditions [J]. Plant Cell Reports, 2013, 32(2): 183-193.
Expression response of Rubisco and GS isoform gene to the ratio of tillering and heading nitrogen fertilization at rice filling stage
ZHU Fang-xu, GUO Xue-dong, TONG La-ga, ZHANG Yu-lei, PAN Dong, LI Ming-yue,
LI Dan, ZHANG Zhong-chen, JIN Zheng-xun*
( College of Agronomy, Northeast Agricultural University, Harbin 150030, China )
【Objectives】Nitrogen nutrition affects the transcription level of ribulose 1, 5-bisphosphate carboxylase/oxygenase (Rubisco) and glutamine synthetase (GS) gene, and studying the relationship between the gene expression and nitrogen supply levels will help understanding mechanism of nitrogen nutrition on rice growth and nitrogen use efficiency at the molecular regulation level.【Methods】In a pot experiment, two rice cultivars of multi-panicle and high yield type and heavy panicle and super japonica cultivar in cold region were used as test materials. The N∶P2O5∶K2O input ratio was 1∶0.5∶1. Half of N fertilizer was basal applied, the left was divided into tillering fertilizer and panicle fertilizer, and four ratios of tillering to panicle fertilizers were designed, 10%∶40%, 20%∶30%, 30%∶20% and 40%∶10%. The transcription expression of Rubisco and GSgene and the accumulation of different forms of nitrogen in rice leaves at the filling stage were investigated.【Results】The results showed that the contents of total N, NO3--N and NH4+-N of leaves and grains of rice were significantly increased with the increase of the tillering fertilizer rate. Simultaneously, the expression levels of the large and small subunit genes of Rubisco were increased in different extents, among them the expression levels of OsRBCSL, OsRBCS2 and OsRBCS4 were up-regulated significantly, while those of OsRBCS3 and OsRBCS5 were up-regulated to some extent, and the high expression duration of Rubisco subunits gene were extended. The expression level of OsGS1;1 in leaves and grains was enhanced at the middle and late filling stage, while those of OsGS2 gene only showed high expression level in leaves at the middle and late filling stage, and those of OsGS1;3 gene exhibited high expression level during the whole filling stage. The expression levels of five rubisco subunit genes had significant or highly significant positive correlation with the contents of NO3--N and total nitrogen in leaves, and the expression levels of three glutamine synthetase isoenzyme gene had significant or highly significant positive correlation with the contents of NH4+-N and total nitrogen in leaves and grains.【Conclusions】The expression dynamic of OsRBCL and GS genes are not responded to different cultivars or nitrogen supply during the filling stage. High contents of NO3--N and total nitrogen in leaves significantly increased the amount of Rubisco gene transcriptional expression, and high contents of NH4+-N and total nitrogen in leaves and grains significantly increased the amount of GS gene transcriptional expression.
japonica rice; nitrogen; filling stage; Rubisco; GS; gene expression
2016-03-24 接受日期:2016-08-05
科技部“十三五”科技支撑计划项目(2015BAD23B05-11);东北农业大学学科团队建设项目;黑龙江省粮食产能提升协同创新中心资助。
朱方旭(1987—),男,黑龙江大庆人,硕士研究生,从事水稻遗传育种研究。E-mail:zhufangxu0109@163.com
* 通信作者 E-mail:zxjin326@hotmail.com
+-N 和全氮含量间均呈显著或极显著的正相关。【结论】在灌浆过程中 OsRBCL 基因和 GS 基因的转录表达量变化动态不因品种或氮素营养不同而发生质的变化,不同基因对氮素营养的响应程度并不相同,增加叶片 NO3--N 和全氮含量,可以显著提高 Rubisco 基因的转录表达量,增加灌浆成熟期叶片和籽粒的 NH4+-N 和全氮含量,可以显著提高叶片和籽粒的 GS 基因转录表达量。

