CCK-8对TNF-α诱导大鼠RSC-364细胞MMPs/TIMP-1的影响
徐锦荣,丛 斌,李淑瑾,金玉怀,赵占胜
(河北医科大学 1.法医系,河北省法医学重点实验室、3.病原学教研室,河北 石家庄 050017;2.第三医院免疫风湿科,河北 石家庄 050051)
CCK-8对TNF-α诱导大鼠RSC-364细胞MMPs/TIMP-1的影响
徐锦荣1,2,丛 斌1,李淑瑾1,金玉怀3,赵占胜1
(河北医科大学 1.法医系,河北省法医学重点实验室、3.病原学教研室,河北 石家庄 050017;2.第三医院免疫风湿科,河北 石家庄 050051)
目的 研究八肽胆囊收缩素(CCK-8)对TNF-α诱导的大鼠RSC-364细胞MMPs/TIMP-1的影响。方法 采用ELISA观察TNF-α作用下CCK-8对RSC-364 细胞MMP-3、-9、-1及TIMP-1分泌的影响,比较MMP-3、-9、-1和TIMP-1比值变化,用RT-PCR观察CCK-8对TNF-α作用下RSC-364 细胞MMP-3、-9 mRNA表达的影响。结果 静息和CCK-8单独孵育细胞后未检测到MMP-3和MMP-9,产生少量MMP-1和TIMP-1,表达MMP-3和MMP-9 mRNA甚微,CCK-8有抑制TNF-α诱导细胞MMP-3、-9、-1分泌和MMP-3、-9 mRNA表达的作用,并且降低TNF-α所致的MMPs/TIMP-1比值的上升。结论 CCK-8下调MMPs 基因表达,减少MMPs分泌,使MMPs与TIMP-1比值下降,从而降低MMPs活性,表明CCK-8能调节滑膜细胞分泌功能,提示CCK-8在类风湿关节炎发病过程中可能具有调控作用。
八肽胆囊收缩素;TNF-α;关节炎;成纤维样滑膜细胞;基质金属蛋白酶;金属蛋白酶组织抑制剂
八肽胆囊收缩素(cholecystokinin octapeptide,CCK-8)属于小分子肽类物质,近年研究表明具有抗炎和免疫调节作用[1-2]。类风湿关节炎(rheumatoid arthritis, RA)作为一种以关节病变为主的慢性全身免疫性疾病,有报道CCK-8通过调节神经生长因子分泌、炎性细胞因子释放及Th17反应,有减轻交叉胶和胶原诱导大鼠关节炎的炎症作用[3-4],提示CCK-8对RA这种慢性免疫性炎症可能具有潜在治疗价值。
炎性滑膜炎是RA的主要病理学基础,且该过程由多种细胞参与,其中滑膜衬里层成纤维样细胞(fibroblast-like synoviocytes,FLS)过度增殖和分泌,产生金属蛋白酶(matrix metalloproteinases,MMPs),MMPs 与MMPs组织抑制剂(tissue inhibitor of MMPs,TIMPs)系统失衡在RA关节骨与软骨破坏中具有重要作用,TNF-α是参与上述过程关键细胞因子之一[5-7],调节FLS增殖及分泌对RA意义重大。之前报道CCK-8对II型胶原性关节炎大鼠滑膜细胞增殖有抑制作用,CCK-8也能抑制TNF-α诱导正常大鼠滑膜细胞株RSC-364增殖[8],但CCK-8对滑膜细胞分泌MMPs/ TIMPs系统有何影响,后续未进一步报道,本文继续以RSC-364为研究对象,观察TNF-α作用下CCK-8对MMPs/TIMP-1系统的影响,探讨其在RA滑膜细胞中的调节作用。
1 材料与方法
1.1 主要试剂 重组大鼠TNF-α、硫酸化CCK-8为Sigma公司;大鼠MMP- 3、-9、-1及TIMP-1 ELISA 试剂盒为美国Market Inc;逆转录酶、随机引物为北京赛百盛基因技术公司,MMP-3和-9引物序列依据GenBank中大鼠MMP-3和-9序列用引物设计软件Primer5设计并由北京赛百盛生物公司合成;DMEM培养基为美国Gibco公司等。
1.2 RSC-364细胞的培养 RSC-364细胞由中国人民解放军总医院骨研所惠赠,培养于含10%胎牛血清的DMEM培养液中(含有青霉素105kU·L-1和链霉素100 mg·L-1),培养在37℃、5% CO2孵育箱中,每3 d换液1次,大约细胞铺满细胞瓶底70%~80%后传代。
1.3 ELISA法测定MMP-3、-9、-1及TIMP-1含量 实验时将处于对数生长期的细胞接种于24孔细胞培养板(8×107cell·L-1,每孔1.0 mL),37℃、5% CO2条件下培养过夜,细胞基本长成单层,然后分为以下4组:① 对照组;② TNF-α(50 μg·L-1)组;③ CCK-8(1 μmol·L-1)组;④ CCK-8+TNF-α组。上述各组细胞于培养箱孵育24 h,收集培养液并离心取上清,按照ELISA试剂盒说明书操作,最后用全自动酶标仪于450 nm波长处测定各孔的吸光度值代表其含量。
1.4 RT-PCR检测MMP-3、-9mRNA表达 实验时将处于对数生长期的细胞接种于培养瓶(5×109cells·L-1,10 mL/瓶), 37℃、5% CO2条件下培养过夜,细胞基本长成单层,然后分为以下4组:① 对照组;② TNF-α(50 μg·L-1)组;③ CCK-8(1 μmol·L-1)组;④ CCK-8+TNF-α组。上述各组细胞置培养箱孵育12 h,采用TRIzol法提取细胞总RNA(按说明书操作)。用紫外分光光度计测A260及A280,确定提取RNA的纯度及浓度,A260/A280>1.8者用于PCR扩增。取总RNA 2 μg,用随机引物进行逆转录,将逆转录产物进行PCR,GAPDH为内参对照。各引物序列见Tab 1。PCR条件: 94℃ 3 min;94℃ 45 s;54.3℃ 45 s(MMP-9),49.5℃ 45 s(MMP-3),52℃ 45 s(GAPDH);72℃ 45 s,28次循环,最后72℃延伸5 min。取10 μL PCR产物在1.5%琼脂糖凝胶(含0.5 mg·L-1溴化乙锭)上电泳分离,用Gel-Pro凝胶图像分析系统分析,用任意单位(AU)表示谱带面积×荧光强度值,MMP-3/GAPDH、MMP-9/GAPDH的AU比值代表mRNA相对表达水平。
2 结果
2.1 CCK-8对TNF-α诱导RSC-364细胞MMPs分泌的影响 对照组和单独CCK-8孵育细胞24 h用ELISA法检测细胞培养上清液中MMP-3和-9含量均低于其检测下限,可检测到低浓度的MMP-1,但二者比较差异无统计学意义(P>0.05)。TNF-α刺激细胞24 h后,RSC-364 细胞分泌MMP-1水平上升,MMP-3和MMP-9分泌水平明显上升,以MMP-3为著,与静息RSC-364组相比差异均具有显著性(P<0.01),CCK-8预孵育细胞则不同程度的抑制了TNF-α的上述效应。见Tab 2。

Tab 1 The primer sequence of RT-PCR
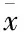
Tab 2 Effect of CCK-8 on secretion of MMP-1,-3,-9 and TIMP-1 in RSC-364(±s,n=6,μg·L-1)
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsTNF-α
2.2 在TNF-α作用下CCK-8对RSC-364细胞TIMP-1分泌及MMPs/TIMP-1比值的影响 对照组和单独CCK-8孵育细胞24 h可检测到低浓度TIMP-1,二者相比差异无统计学意义(P>0.05)。TNF-α刺激细胞24 h,RSC-364细胞TIMP-1分泌增加,与静息RSC-364组相比差异有统计学意义(P<0.05),且TNF-α增加MMP-3、-1、-9与TIMP-1的比值。CCK-8预孵育细胞,对TNF-α作用下RSC-364细胞TIMP-1分泌量有所增加,但与TNF-α组相比差异无统计学意义(P>0.05),却对TNF-α所致的MMPs/TIMP-1的比值上升有降低作用。见Tab 2、3。
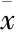
Tab 3 Effect of CCK-8 on the ratios of MMP-1, -3 and -9 to TIMP-1 in RSC-364(±s,n=6)
**P<0.01vscontrol;##P<0.01vsTNF-α
2.3 CCK-8对TNF-α诱导RSC-364 MMP-3、-9 mRNA表达的影响 静息和CCK-8处理RSC-364细胞表达MMP-3和-9 mRNA 甚微,TNF-α孵育RSC-364细胞12 h,MMP-3和-9 mRNA表达明显增加,与静息RSC-364细胞组比较差异有显著性(P<0.01)。TNF-α和CCK-8联合孵育细胞,CCK-8有降低MMP-3和-9 mRNA表达的作用(P<0.01,P<0.05)。见Tab 4,Fig 1、2。
3 讨论
MMPs在RA骨和软骨破坏过程中起重要作用,其中MMP-3、-1、-9及-2起主导地位。MMP-2和MMP-9为当前研究最深入的明胶酶,正常情况下MMP-1表达很低,MMP-3能激活MMP-1。在RA滑膜组织中发现MMP-9、MMP-3、MMP-1呈高表达,且主要定位于FLS中。RA FLS在体外可被传代数月,初始倍增速度快,可能是滑膜微环境的延续效应所致,而被传代十几次后,细胞活力明显下降,细胞可能处于静止状态,但在细胞因子作用下细胞又能活化。此外,正常FL3基本上也不能合成或产生很少的MMP-3和MMP-9,以及TNF-α、IL-1等促炎性细胞因子刺激下则可持续表达[2,9-10]。本文观察到:静息状态下正常来源大鼠成纤维样滑膜细胞株RSC-364 未检测到MMP-3和MMP-9的分泌,且MMP-1分泌量也低,在TNF-α作用下RSC-364分泌MMP-9、MMP-3、MMP-1明显增加,提示TNF-α可以刺激RSC-364 分泌行为。金玉怀等[11]用明胶酶谱法观察RSC-364 本身就表达MMP-2,而MMP-9却需要经过TNF-α剌激后表达,从上述MMPs分泌特性来看,刺激后的RSC-364可能具有与RA FLS类似的生物学特性。
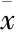
Tab 4 Effect of CCK-8 on expression of MMP-3,-9 mRNA in RSC-364(±s,n=3)
**P<0.01vscontrol;#P<0.05,##P<0.01vsTNF-α
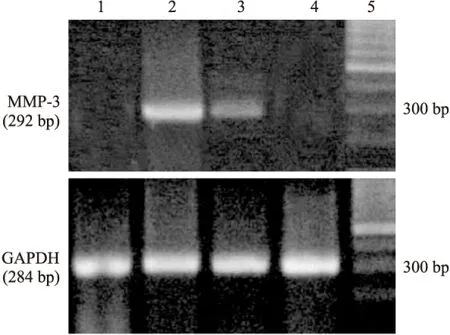
Fig 1 Effect of CCK-8 on MMP-3 mRNA expression in RSC-364
1:Control;2:TNF-α;3:TNF-α+CCK-8;4:CCK-8; 5:marker

Fig 2 Effect of CCK-8 on MMP-9 mRNA expression in RSC-364
1:marker;2:Control;3:TNF-α;4:TNF-α+CCK-8;5:CCK-8
近年来CCK-8在慢性免疫性疾病方面的作用研究倍受关注,前期体外实验观察到CCK-8抑制大鼠滑膜细胞增殖,明胶酶谱法初步发现CCK-8能抑制RSC-364 细胞分泌MMP-2和-9并降低酶活性[11],本实验中单独CCK-8孵育RSC-364细胞对MMP-1、MMP-3、MMP-9分泌并无作用,CCK-8预孵育细胞,却一定程度的逆转了TNF-α诱导细胞分泌MMP-3、-9、-1,提示CCK-8可调节滑膜细胞分泌行为。
不同种类的MMPs虽然可被不同的细胞因子所调节,却都受其特异性抑制剂TIMPs的调节,其中TIMP-1主要抑制MMP-3和MMP-9,TNF-α对TIMPs表达呈上调作用[3]。本实验观察静息状态下RSC-364产生TIMP-1少,TNF-α刺激后TIMP-1产生增多,升高的TIMP-1可能会影响其分泌的MMPs活性。比较MMP-3、MMP-9、MMP-1与TIMP-1比值时发现TNF-α使得MMPs与TIMP-1的比值均升高,原因是TNF-α虽然促进细胞产生TIMP-1,但更明显的是刺激RSC-364分泌MMPs,使得MMPs与TIMP-1的比值最终均呈升高状态。在RA滑膜组织中MMPs含量就远大于TIMPs,TIMPs不能发挥其有效抑制MMPs的行为,是MMPs /TIMPs的比例决定了MMPs活性。另外,RA患者关节液中MMPs与TIMPs比值比骨关节炎患者高的多(约为后者的5.2倍)[12],可见MMPs /TIMPs系统平衡紊乱在RA骨与软骨破坏过程中有重要意义。本实验中CCK-8对TNF-α作用下的细胞产生TIMP-1影响不大,这可能与CCK-8浓度也有关,但却对TNF-α所致的MMPs与TIMP-1的比值上升有降低作用,说明CCK-8除了直接调节MMPs分泌还可以通过改变MMPs/TIMP-1的比值来影响MMPs活性。
另外,MMPs活性的调节也发生在基因水平。RA滑膜细胞中MMP-1 mRNA表达3 h时开始升高,12 h时便达峰值,24 h时仍处于较高的水平;MMP-3、-9mRNA表达6 h时开始升高,并能持续到36 h[13-15]。本实验在观察RSC-364细胞MMP-3、-9mRNA表达时发现静息状态下细胞中MMP-3、-9 mRNA表达甚微,TNF-α刺激细胞12 h表达明显增加,CCK-8一定程度上有抑制TNF-α上述效应的作用,这与ELISA中MMP-3、MMP-9分泌结果也相符,提示CCK-8也从基因水平调节了MMPs活性。
综上所述,CCK-8通过3种途径调节MMPs活性:下调MMPs 基因表达,减少MMPs分泌,下降MMPs与TIMP-1的比值,提示CCK-8不仅能抑制滑膜细胞增殖,还能调节滑膜细胞分泌,对RA滑膜炎过程有潜在调控作用。但是参与滑膜细胞增殖及分泌的上游信号转导机制极其复杂,初步研究CCK-8能抑制p38MAPK通路活化对RSC-364增殖起到一定下调作用[8],也有报道转录因子NF-κB、活化蛋白-1参与滑膜细胞MMPs基因表达、增殖及炎症反应,环腺苷酸水平下降伴随着胶原性和佐剂性关节炎大鼠滑膜细胞过度增殖和MMPs表达增加等,那么CCK-8具体通过哪些信号转导机制来调控滑膜细胞的上述功能,则有待于进一步深入研究。
需指出:本实验依然采用的是正常来源大鼠滑膜细胞株,并且用一种细胞因子来激活细胞,而RA或关节炎动物模型中的滑膜细胞是在多种病理因素作用下的活化细胞,CCK-8对该种情况下的滑膜细胞分泌作用也有可能相反,因此CCK-8在RA中的调控地位及其对RA可能的治疗作用尚需再深入研究。
(致谢:本实验是本人在读博士期间在导师丛斌教授指导下在河北医科大学法医实验室完成,李淑瑾、金玉怀、赵占胜老师帮助指导、分析、完善实验,实验过程中有幸得到了韩冬艳、白洁两位硕士生无私帮助,RT-PCR方面得到姚玉霞老师无私指导,在此一并致以最诚挚的谢意!)
[1] Li S, Ni Z, Cong B,et al. CCK-8 inhibits LPS-induced IL-1beta production in pulmonary interstitial macrophages by modulating PKA, p38, and NF-kappaB pathway[J].Shock,2007, 27(6):678-86.
[2] 张雅静,文 迪,杨胜昌,等. 八肽胆囊收缩素及其受体拮抗剂对吗啡戒断大鼠脑内CaMK Ⅱ蛋白表达的影响[J]. 中国药理学通报,2016,32(3):327-31.
[2] Zhang Y J, Wen D, Yang S C, et al. Effects of CCK-8 and its receptor antagonists on CaMK Ⅱ expression of morphine withdrawal rats [J].ChinPharmacolBull,2016,32(3):327-31.
[3] Manni L, Lundeberg T, Tirassa P, et al. Role of cholecystokinin-8 in nerve growth factor and nerve growth factor mRNA expression in carrageenan-induced joint inflammation in adult rats[J].Rheumatology(Oxford),2002, 41:787-92.
[4] Li Q, Cong B, Shan B, et al. Cholecystokinin octapeptide exerts its therapeutic effects on collagen-induced arthritis by suppressing both inflammatory and Th17 responses[J].RheumatolInt,2011, 31(10):1291-8.
[5] Kaneko S, Kondo Y, Yokosawa M, et al. Rheumatoid arthritis and cytokines[J].NihonRinsho,2016, 74(6):913-8.
[6] Fiedorczyk M, Klimiuk P A, Sierakowski S,et al. Matrix metalloproteinases and tissue inhibitors of metalloproteinases in the pathogenesis of rheumatoid arthritis[J].PolMerkurLekarski,2006, 20(116):228-31.
[7] Fotopoulos V C, Tzinia A, Tzurbakis M,et al. Expression levels of matrix metalloproteinase(MMP)-9 and its specific inhibitor TIMP-1, in septic and aseptic arthritis of the knee[J].KneeSurgSportsTraumatolArthrosc,2012, 20(6):1159-67.
[8] 徐锦荣,丛 斌,李淑瑾,等. CCK-8对TNF-α诱导RSC-364细胞增殖及p38 MAPK活性的影响[J]. 基础医学与临床,2006,26(3):252-6.
[8] Xu J R, Cong B, Li S J, et al. CCK-8 decreases RSC-364 proliferation and p38 MAPK activation induced by TNF-α in rats[J].BasicClinMed,2006, 26(3): 252-6.
[9] Itoh Y. Metalloproteinases: potential therapeutic targets for rheumatoid arthritis[J].EndocrMetabImmuneDisordDrugTargets,2015, 15(3):216-22.
[10]Zhang W, Du Z, Zhu J, et al. Sprouty2 suppresses the inflammatory responses in rheumatoid arthritis fibroblast-like synoviocytes through regulating the Raf/ERK and PTEN/AKT signals[J].MolImmunol,2015, 67(2):532-9.
[11]金玉怀, 赵占胜, 丛 斌,等. 八肽胆囊收缩素对大鼠滑膜细胞株RSC-364基质金属蛋白酶-2和-9产生的影响[J]. 中华风湿病学杂志, 2005, 9(4):193-6.
[11]Jin Y H, Zhao Z S, Cong B, et al. Effect of cholecystokinin octapeptide-8 on the production of matrix metalloproteinases of rat fibroblast-like synovial cell line RSC-364[J].ClinJRheumatol,2005, 9(4):193-6.
[12]Yoshihara Y, Nakamura H, Obata K, et al. Matrix metalloproteinases and tissue inhibitor of metalloproteinases in synovial fluids from patients with rheumatoid arthritis or osteoarthritis[J].AnnRheumDis,2000, 59:455-61.
[13]Akiko S, Kan S, Yrjo T, et al. Hyaluronate inhibits the interleukin-1β-induced expression of matrix metalloproteinase(MMP)-1 and MMP-3 in human synovial cells[J].TohokuJExpMed,2004, 204:99-107.
[14]Ma M J, Liu H C, Qu X Q, et al. Matrix metalloproteinase-3 gene polymorphism and its mRNA expression in rheumatoid arthritis[J].GenetMolRes,2015, 14(4):15652-9.
[15]Zhai T, Gao C, Huo R,et al.Cyr61 participates in the pathogenesis of rheumatoid arthritis via promoting MMP-3 expression by fibroblast-like synoviocytes[J].ModRheumatol,2016, 9(1):1-10.
Effect of CCK-8 on expression of MMPs/TIMP-1 in TNF-α-induced RSC-364
XU Jin-rong1,2,CONG Bin1,LI Shu-jin1,JIN Yu-huai3,ZHAO Zhan-sheng1
(1.DeptofForensicMedicine,HebeiKeyLabofForensicMenicine,3.DeptofMicrobiology,HebeiMedicalUniversity,Shijiazhuang050017,China;2.DeptofRheumatologyandImmunology,theThirdHospitalofHebeiMedicalUniversity,Shijiazhuang050051,China)
Aim To observe the influence of CCK-8 on expression of MMPs/TIMP-1 in TNF-α-induced rat fibroblast-like synovial cell line RSC-364.Methods The secretion levels of MMP-1, MMP-3, MMP-9 and TIMP -1 were determined using ELISA; MMP-3 and MMP-9 mRNA expressions were detected by RT-PCR.Results MMP-3 and MMP-9 could not be examined in RSC-364 incubated with CCK-8 and unstimulated RSC-364, which was able to product a little MMP-1, TIMP-1 and express even less MMP-3, -9 mRNA. CCK-8 inhibited the increase in MMP-1, MMP-3, MMP-9 secretion and MMP-3, -9 mRNA expression in TNF-α-induced RSC-364. TIMP-1 production was also increased in TNF-α-induced RSC-364. CCK-8 had no effect on TIMP-1 production in TNF-α-induced RSC-364, but was able to reduce the ratios of MMP-1, MMP-3, MMP-9 to TIMP-1.Conclusion The inhibitory effect of CCK-8 on MMPs activity may be related to the decrease of MMPs mRNA expression, MMPs secretion and the ratios of MMPs to TIMP-1 in TNF-α-induced RSC-364, which indicates that CCK-8 might be a possible regulator in the pathogenesis of rheumatoid arthritis.
cholecystokinin-octapeptide; TNF-α; arthritis; fibroblast-like synoviocytes; matrix metalloproteinases; tissue inhibitors of metalloproteinases
时间:2017-3-13 8:38
http://kns.cnki.net/kcms/detail/34.1086.R.20170324.1247.046.html
2016-9-13,
2016-10-31
国家自然科学基金资助项目(No 30470679);河北省自然科学基金资助项目(No C2005000705)
徐锦荣(1976-),女,博士,主治医师,研究方向:结缔组织病,E-mail:xujinrong77762011@163.com; 丛 斌(1956-),男,博士,教授,中国工程院院士,博士生导师,研究方向:结缔组织病、CCK-8抗炎及免疫调节,通讯作者,E-mail:bincong@263.net
10.3969/j.issn.1001-1978.2017.04.023
A
1001-1978(2017)04-0567-05
R-322;R345.9;R593.22;R971.9;R975;R977.1

