高效液相色谱法同时测定枸橼酸苹果酸粉消毒剂中枸橼酸和苹果酸的含量
梁劲康,方炳虎,黎乃添,吴志玲,吴广辉,张桂君
(广东温氏大华农生物科技有限公司,广东云浮 527400)
高效液相色谱法同时测定枸橼酸苹果酸粉消毒剂中枸橼酸和苹果酸的含量
梁劲康,方炳虎,黎乃添,吴志玲,吴广辉,张桂君*
(广东温氏大华农生物科技有限公司,广东云浮 527400)
建立同时测定兽用消毒剂枸橼酸苹果酸粉中枸橼酸和苹果酸含量的高效液相色谱方法。采用Agilent Eclipse XDB-C18(250 mm×4.6 mm,5 μm)色谱柱,以乙腈-10 mL/L磷酸溶液(2.5∶97.5,V/V)为流动相进行洗脱,流速为1.0 mL/min,检测波长为210 nm,柱温为35℃,进样量为20 μL。枸橼酸和苹果酸色谱峰分离度良好。枸橼酸和苹果酸分别在100 μg/mL~1 000 μg/mL和50 μg/mL~500 μg/mL范围内线性关系良好。精密度、稳定性和重现性等考察结果的相对标准偏差(RSD)均小于1.0%;而平均回收率均在98%~101%之间,RSD均小于0.5%,符合方法学要求。6份供试品中枸橼酸和苹果酸的含量也均符合要求。建立的高效液相色谱法能够同时定量测定枸橼酸和苹果酸的含量,可用于枸橼酸苹果酸粉的质量控制。
枸橼酸;苹果酸;速可净;高效液相色谱法;含量测定
枸橼酸苹果酸粉是一种新型生态环保的复合有机酸消毒剂,其杀菌作用快速、持久,已经在畜牧业中广泛使用。研究表明,枸橼酸苹果酸粉稀释至一定浓度时能够完全杀灭大肠埃希菌、沙门菌和金黄色葡萄球菌等细菌以及H5N1亚型禽流感病毒、口蹄疫病毒等病毒[1-2]。枸橼酸苹果酸粉中的主要有效成分是枸橼酸(citric acid,含量约为40%)和苹果酸(malic acid,含量约为10%),这两种有机酸在水中均能够解离出大量的H+渗入细菌细胞内,改变细胞渗透压,使细胞质酸化和蛋白变性,从而杀灭细菌[1]。因此,枸橼酸和苹果酸的含量控制是枸橼酸苹果酸粉质量标准的关键。本文在参考相关文献[3-4]的基础上,建立了可同时测定枸橼酸和苹果酸含量的高效液相色谱法。该方法快速简便,结果准确可靠,可为枸橼酸苹果酸粉的质量标准评价方法提供一定的参考。
1 材料与方法
1.1 材料
1.1.1 仪器设备 Waters e2695高效液相色谱系统配置2489 UV/Vis检测器,美国Waters公司产品;CPA225D型电子天平,德国Sartorius公司产品;Milli-Q超纯水仪,美国Millipore公司产品;SHZ-D(Ⅲ)循环式真空泵,巩义市予华仪器有限责任公司产品;KQ-100E型超声波清洗器,昆山市超声仪器有限公司产品。
1.1.2 药品和试剂 枸橼酸和苹果酸对照品(批号分别为111679-200401和190013-201001),中国药品生物制品检定所产品;枸橼酸苹果酸粉(商品名:速可净),北京中农牧公司产品;乙腈(色谱纯),德国Merck公司产品;磷酸(分析纯),江苏强盛功能化学股份有限公司产品。
1.2 方法
1.2.1 色谱条件 色谱柱:Agilent Eclipse XDB-C18(250 mm×4.6 mm,5 μm);以乙腈-10 mL/L磷酸溶液(2.5∶97.5,V/V)为流动相;流速为1.0 mL/min;检测波长为210 nm;柱温为35℃;进样量为20 μL。以苹果酸和枸橼酸色谱峰计算,理论塔板数不得低于3 000。
1.2.2 对照品母液和供试品溶液的配制 精密称取25.20 mg枸橼酸对照品和12.49 mg苹果酸对照品,置于25 mL容量瓶中,加入适量超纯水使枸橼酸和苹果酸溶解后,补加超纯水至刻度,摇匀,制得枸橼酸和苹果酸混合对照品母液。另外,分别精密称取适量枸橼酸和苹果酸对照品,同法操作,分别配制枸橼酸对照品溶液和苹果酸对照品溶液。上述对照品溶液均经0.22 μm滤膜滤过,滤液用于液相检测。
精密称取0.1 g枸橼酸苹果酸粉样品于100 mL容量瓶中,加入适量超纯水后超声使样品全溶,补加超纯水至刻度,摇匀,制得供试品溶液。供试品溶液经0.22 μm滤膜滤过,滤液用于液相检测。
1.2.3 专属性试验 分别取空白溶液(水)、枸橼酸对照品溶液、苹果酸对照品溶液、枸橼酸和苹果酸混合对照品溶液以及供试品溶液,按1.2.1项下的色谱条件进样分析,记录色谱图。
1.2.4 最低检测限(LOD)和定量限(LOQ) 分别精密移取一定体积的枸橼酸和苹果酸混合对照品溶液于10 mL的容量瓶中,超纯水定容,进行逐级稀释。稀释液按1.2.1项下的色谱条件进样分析,以信噪比(S/N)≥3的检测量为LOD,以信噪比(S/N)≥10的检测量为LOQ。
1.2.5 苹果酸和枸橼酸线性关系 分别精密移取一定体积的1.2.2项下的混合对照品母液于10 mL的容量瓶中,超纯水稀释定容,摇匀,配得一系列质量浓度的混合对照品溶液,按1.2.1项下的色谱条件进样,测定枸橼酸和苹果酸的峰面积。
1.2.6 精密度试验 分别精密移取一定体积的1.2.2项下的混合对照品母液,用超纯水稀释至低、中、高3种浓度:枸橼酸的浓度分别为500、800、1 000 μg/mL,苹果酸的终浓度分别为250、400、500 μg/mL。3种浓度的混合对照品溶液按1.2.1项下的色谱条件,连续重复进样5针,记录峰面积。
1.2.7 稳定性试验 取1.2.6项下的低、中、高3
种混合对照品溶液,分别于0、2、4、6、8、12、16、18、24 h按1.2.1项下的色谱条件进样,记录峰面积。
1.2.8 回收率和加样回收率试验 按1.2.6项下方法配制低、中、高3种混合对照品溶液,每个浓度平行配制5份,按1.2.1项下的色谱条件进样,记录峰面积,依据标准曲线计算回收率。
精密移取5 mL已知浓度的供试品溶液于10 mL容量瓶中,平行制备5份,分别精密加入1 mL不同浓度的混合对照品母液,超纯水定容,摇匀后,按1.2.1项下的色谱条件进样,记录峰面积,依据标准曲线计算加样回收率。
1.2.9 重现性试验 同一批供试品称取5份,按1.2.2项下的供试品溶液的配制方法同法操作,所得样品溶液按1.2.1项下的色谱条件进行进样分析,记录峰面积,依据标准曲线计算枸橼酸和苹果酸的含量。1.2.10 样品含量测定 平行称取6份供试品,按1.2.2项下的供试品溶液的配制方法同法操作,所得供试品溶液按1.2.1项下的色谱条件进行进样分析,记录峰面积,依据标准曲线计算枸橼酸和苹果酸的含量。
2 结果
2.1 专属性试验
专属性试验结果可见图1~图5。从图中可以看出,空白溶液在该色谱条件下并不会干扰枸橼酸和苹果酸的吸收,而且枸橼酸和苹果酸的出峰时间分别约为3.54 min和2.73 min,分离度良好。
图1 空白溶液高效液相色谱图

图2 苹果酸对照品溶液高效液相色谱图
图3 枸橼酸对照品溶液高效液相色谱图

图4 枸橼酸对照品和苹果酸对照品混合溶液高效液相色谱图
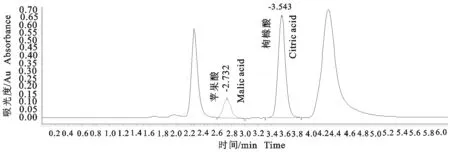
图5 供试品溶液高效液相色谱图
2.2 最低检测限和定量限
试验结果表明,枸橼酸的最低检测限(LOD)可达0.3 μg/mL,定量限(LOQ)则为0.5 μg/mL;而苹果酸的LOD可达0.4 μg/mL,LOQ则为0.5 μg/mL。
2.3 苹果酸和枸橼酸线性考察
利用1.2.1项下的高效液相色谱方法测得枸橼酸和苹果酸的峰面积后,分别以质量浓度C为纵坐标,峰面积A为横坐标,进行线性回归。结果表明,枸橼酸在100 μg/mL~1 000 μg/mL范围内线性关系良好,回归方程为C=0.000 77A-8.552 9(R2=0.999 8);苹果酸在50 μg/mL~500 μg/mL范围内线性关系良好,回归方程为C=0.001 04A-12.788(R2=0.999 7)。
2.4 精密度试验
试验结果表明,枸橼酸和苹果酸在低浓度时峰面积RSD分别为0.62%和0.12%;在中浓度时峰面积RSD分别为0.36%和0.42%;在高浓度时峰面积RSD分别为0.12%和0.13%,表明本方法精密度良好。
2.5 稳定性试验
试验结果表明,枸橼酸和苹果酸在低浓度时峰面积RSD分别为0.76%和0.64%;在中浓度时峰面积RSD分别为0.24%和0.43%;在高浓度时峰面积RSD分别为0.23%和0.46%,表明枸橼酸和苹果酸在24 h内稳定性良好。
2.6 回收率和加样回收率试验
试验结果表明,枸橼酸低、中、高3种浓度的回收率分别是100.48%±0.14%、101.46%±0.14%和100.29%±0.32%,RSD分别为0.11%、0.11%和0.26%;苹果酸低、中、高3种浓度的回收率分别是99.52%±0.12%、100.94%±0.19%和99.52%±0.12%,RSD分别为0.10%、0.15%和0.10%,均符合方法学要求。
加样回收率的试验结果见表1。结果显示,枸橼酸和苹果酸在3种水平浓度下的加样回收率均在98%~101%之间,RSD均小于0.5%,说明该方法准确度良好。

表1 加样回收率结果
2.7 重现性试验
试验结果表明,枸橼酸和苹果酸含量RSD分别为0.77%和0.14%,均符合方法学要求。
2.8 样品含量测定结果
枸橼酸苹果酸粉样品的含量测定结果见表2。结果表明,6份样品中枸橼酸和苹果酸的含量均在标示量的90.0%~110.0%范围内,因此,6份样品中枸橼酸和苹果酸的含量均符合要求。
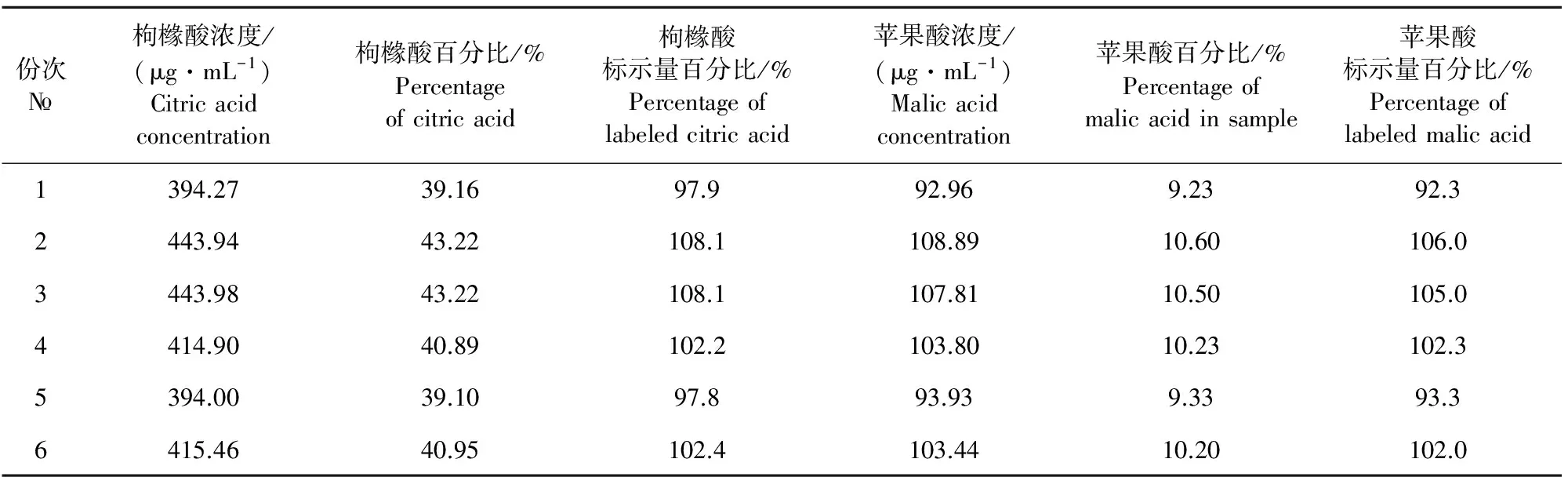
表2 速可净样品测定结果
3 讨论
枸橼酸和苹果酸是消毒剂枸橼酸苹果酸粉(商品名:速可净)中的主要有效成分,也是枸橼酸苹果酸粉质量标准控制的关键。枸橼酸苹果酸粉的原质量标准也是采用高效液相色谱法对枸橼酸和苹果酸的含量进行检测。与本文方法不同,原质量标准中选用了聚苯乙烯二乙烯苯树脂为填充剂的色谱柱。考虑到该色谱柱的成本价格较高以及其使用普遍性,本课题组设想利用十八烷基硅烷键合硅胶为填充剂的色谱柱代替聚苯乙烯二乙烯苯树脂为填充剂的色谱柱,是否也能达到理想的分离效果?本研究结果表明,C18色谱柱不仅能够有效将枸橼酸和苹果酸分离,也能够使枸橼酸和苹果酸的主峰和其他杂质峰分离。
目前,已有文献报道利用梯度淋洗离子色谱法同时测定烟草中的枸橼酸和苹果酸,但该方法需要梯度淋洗的过程,操作步骤相对繁琐[5]。而在利用高效液相色谱法同时检测多种有机酸的文献报道中,也多采用梯度洗脱的方式来将各种有机酸分离开来,但梯度洗脱的过程容易导致基线不稳,可能影响色谱峰的峰面积[6]。本文在参考相关文献[3-4]的基础上,建立了可同时测定枸橼酸和苹果酸的含量的等度洗脱的高效液相色谱方法。但是,由于检测波长(λ=210 nm)接近于紫外末端吸收,因此2.25 min和4.25 min处出现了两个溶剂峰。为了使枸橼酸和苹果酸的色谱峰能够与溶剂峰充分分离,本文选择了乙腈-10 mL/L磷酸溶液(2.5∶97.5,V/V)为流动相。一定比例的乙腈能够降低有机酸色谱峰的拖尾现象,而且也能够有效提高分离效果[7]。由于枸橼酸属于戊三酸,而苹果酸属于丁二酸,枸橼酸与C18色谱柱的亲和能力稍优于苹果酸,因此苹果酸更易于被洗脱出来。
本文建立的高效液相色谱法能够使枸橼酸和苹果酸充分分离,而且该方法简便有效,线性关系良好、重现性好,精确度和灵敏度高,可作为消毒剂枸橼酸苹果酸粉中枸橼酸和苹果酸的定量分析方法。
[1] 魏全意,董 强.速可净(SNUCOP)与猪场消毒[J].养殖与饲料,2007(10):35-37.
[2] 曾昭智,张锦红.三种消毒剂对屏障环境设施消毒效果观察[J].黑龙江畜牧兽医,2013(14):108-109.
[3] 吕兆林,林 西,邓文红,等.HPLC法测定苹果酒中苹果酸及乳酸含量[J].精细与专用化学品,2012,20(1):9-13.
[4] 唐慧慧,蔡清宇,毛 翼.HPLC法测定净乌梅及乌梅炭中柠檬酸和苹果酸的含量[J].中药材,2007,30(1):52-54.
[5] 吴玉萍,宋春满,雷丽萍,等.梯度淋洗离子色谱法测定烟草中的苹果酸、柠檬酸和阴离子[J].分析试验室,2006,25(7):31-34.
[6] 张 韵,傅 颖,吴霞红.五味子药材中苹果酸、柠檬酸的测定方法研究[J].中成药,2012,34(4):767-769.
[7] 刘森泉,阮 红,徐玲芬,等.反相高效液相色谱法测定发酵液中β-聚苹果酸含量[J].食品与发酵工业,2010,36(6):142-145.
Simultaneous Determination of Contents of Citric Acid and Malic Acid in Citric Acid and Malic Acid Powder by HPLC
LIANG Jin-kang,FANG Bing-hu,LI Nai-tian,WU Zhi-ling,WU Guang-hui,ZHANG Gui-jun
(GuangdongWenshiDahuanongBiotechnologicalCo.,Ltd.,Yunfu,Guangdong,527400,China)
To establish a HPLC method for simultaneous determination of citric acid and malic acid in citric acid and malic acid powder,the assay was conducted on an agilent eclipse XDB-C18 column(250 mm×4. 6 mm,5 μm) with acetonitrile-10 mL/L H3PO4solution (2.5∶97.5,V/V).The flow rate was 1.0 mL/min, the detection wavelength was 210 nm,the column temperature was 35℃ and the injection volume was 20 μL.The results showed good resolution for the chromatographic peaks of citric acid and malic acid.The correlation coefficient between concentration and chromatographic peak area was over 0.999 in the range of 100-1 000 μg/mL for citric acid and 50-500 μg/mL for malic acid,indicating the good linearity of the calibration curves.In the precision,stability and repeated experiments,the relative standard deviations of citric acid and malic acid were less than 1.0%,showing a satisfactory precision and stability of this method.In the spiked experiment of three levels,the average recovery of citric acid and malic acid was about 98%-101% and all the relative standard deviations were less than 0.5%,demonstrating that this method was considerably accurate.This HPLC method can be used for the quantitative determination of citric acid and malic acid simultaneously and the quality control in citric acid and malic acid powder.
citric acid;malic acid;Snucop;HPLC;content determination
2016-09-07
梁劲康(1990-),男,广东开平人,硕士,主要从事兽药新剂型与新技术研究。
S859.799.1
A
1007-5038(2017)04-0075-05
*通讯作者

