热水处理诱导西葫芦采后低温逆境抗冷性研究
朱赛赛,张 敏,艾文婷,李春晖
(上海海洋大学食品学院,上海 201306)
热水处理诱导西葫芦采后低温逆境抗冷性研究
朱赛赛,张 敏*,艾文婷,李春晖
(上海海洋大学食品学院,上海 201306)
为了研究热水处理诱导西葫芦果实抗冷性,从而减轻冷害。该实验以西葫芦为原料,将西葫芦在45 ℃及35 ℃热水中分别浸泡5 min及10 min,以室温(20±2) ℃下未经热水处理的西葫芦为对照,测定西葫芦果实在4 ℃低温下,不同贮藏时间(0、3、6、9、12、15 d)的可溶性糖含量、过氧化氢(H2O2)含量、过氧化氢酶(CAT)活性、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、丙二醛(MDA)含量、相对电导率及冷害指数等抗冷性相关指标。结果表明,与对照相比,热水处理显著增加了西葫芦果实可溶性糖含量(p<0.05),诱导果实在贮藏初期(0~3 d)H2O2含量短暂增加,而显著减少贮藏中后期(6~15 d)H2O2含量的积累(p<0.05),激发贮藏前期(0~6 d)CAT和SOD活性的升高,减轻贮藏后期(9~15 d)的活性下降,尤其是POD活性在贮藏中后期(6~15 d)显著升高(p<0.01),降低了MDA含量及相对电导率的升高,减少冷害指数的上升(6~15 d)(p<0.05),从而说明热水处理诱导西葫芦果实低温逆境下的抗冷性,有效减轻冷害,本实验中35 ℃热水处理10 min的效果更佳。
西葫芦,冷害,热水处理,低温逆境,抗冷性

1 材料与方法
1.1 材料与仪器
西葫芦 本实验以“法拉利”西葫芦为原料,于2015年11月9号采自上海市浦东新区书院镇果蔬种植园,选择色泽大小均一,单个平均质量为300 g,瓜条较直,瓜皮细腻,油亮翠绿的果实。选取入市销售完全成熟,采后立即送至实验室,无机械损伤及无病虫害的饱满果实为实验材料。
BPS-100CA型恒温恒湿箱 上海一恒科学仪器有限公司;HSWX-6000B3型电热恒温水浴箱 上海圣科仪器有限公司;TGL-20bR型高速冷冻离心机 上海安亭科学仪器厂;T6新世纪型紫外可见分光光度计 北京普析通用仪器有限责任公司;BCD-216SCM型冰箱 青岛海尔股份有限公司。
1.2 实验处理
将实验样品用清水冲洗并晾干后称重,热水处理果实置于恒温水浴箱中,根据前期预实验结果甄选以35 ℃热水浸泡10 min及45 ℃热水浸泡5 min,取出后适当拭干,对照组CK置于室温(20±2)℃中不做热处理,每3根为一组装入打孔过的0.03 mm厚的聚乙烯塑料袋中并分别贴好标签,每个处理设置3个重复,3组样品处理完后放入4 ℃(湿度为85%~90%)的恒温恒湿箱中进行低温贮藏,每3天取样测定,每个处理每次取3根为一组,每组重复3次,共计9根,分别在每个西葫芦样品的前中后段3个部位取去皮果实组织进行抗冷性相关指标测定。
1.3 测定方法
冷害指数测定:参照刘玲[10]和Al-Qurashi[11]的方法,略作修改。将果实从恒温恒湿箱中取出后转移至室温下24 h后,观察冷害症状,每个处理组取9个果实,3次重复,记录每个果实冷害等级。根据果面显现的冷害面积确定并将冷害程度分为5个级别,分别为0级:无冷害症状;1级:轻度冷害,冷害面积≤25%;2级:中度冷害,25%<冷害面积≤50%;3级:深度冷害,50%<冷害面积≤75%;4级:极度冷害,75%<冷害面积≤100%。计算如公式1所示:
西葫芦果实冷害指数=∑(冷害等级×该等级果实数目)/(最高冷害等级×果实总数)
式(1)
可溶性糖含量测定:参照曹建康[12]的方法,采用蒽酮比色法,计算每克西葫芦样品中可溶性糖的毫克数,以mg/g表示。可溶性固形物含量测定:参照曹建康[12]的方法,结果以%表示。过氧化氢H2O2含量测定:参照曹建康[12]的方法,结果以mmol/g表示。过氧化氢酶(catalase,CAT)活性测定,参照曹建康[12]的方法,结果以U·(min·g)-1表示。过氧化物酶(peroxidase,POD)活性测定,参照曹建康[12]的方法,采用愈创木酚法,结果以U·(min·g)-1表示。超氧化物歧化酶(superoxide dismutase,SOD)活性测定,采用氮蓝四唑(NBT)光化还原法,结果以U·(min·g)-1表示。丙二醛(MDA)含量测定,参考曹建康[12]的方法,采用硫代巴比妥酸法,结果以μmol/g表示。相对电导率测定,参照解越[13]等的方法,采用DDS-307电导率仪测定,结果以%表示。
1.4 数据统计
先用Excel(2014)软件计算各处理组实验数据平均值,随后用SPSS 21.0软件对数据进行差异性分析,p<0.05表示差异显著,p<0.01表示差异极显著,最后采用Origin Pro 8.0软件制图。
2 结果与分析
2.1 热水处理对西葫芦可溶性糖含量的影响
可溶性糖是植物在低温环境下的一种保护物质,可提高细胞液浓度,增加细胞持水组织中的非结冰水,降低冰点,缓解细胞质过度脱水,保护细胞质胶体不致遇冷凝固,与植物抗冷性密切相关[14]。4 ℃贮藏期间,热水处理对西葫芦可溶性糖含量的影响如图1所示,CK组西葫芦果实的可溶性糖含量呈波浪式,这可能与大分子物质降解和呼吸消耗综合影响有关[15],热水处理组西葫芦果实的可溶性糖含量呈先上升后下降趋势,在贮藏前期(0~6 d)可溶性糖含量急剧增加,热水处理促进了可溶性糖含量的提高,至贮藏第6 d到达峰值,45 ℃热水处理5 min、35 ℃热水处理10 min组的可溶性糖含量分为43.64 mg/g与49.27 mg/g,6 d以后热水处理抑制了可溶性糖含量的降低,且至贮藏结束,可溶性糖含量分别比初始值提高了23.81%和33.73%。在整个贮藏期间,热水处理的西葫芦的可溶性糖含量均高于对照,特别是35 ℃热水处理10 min组在第6、9、12、15 d均显著高于对照(p<0.05)。由此说明,热处理可以促进西葫芦在低温逆境下前期可溶性糖的生成并延缓贮藏后期可溶糖含量的下降,有效保持了西葫芦果实的营养品质。

图1 热水处理对西葫芦可溶性糖含量的影响Fig.1 Effects of hot water trearment on soluble sugar content of Cucurbita pepo
2.2 热水处理对西葫芦可溶性固形物含量的影响
可溶性固形物(TSS)含量是果实贮藏过程中物质变化的综合表现,也是衡量贮藏品质的重要指标。如图2所示,西葫芦果实的TSS含量在4 ℃贮藏期间均呈现先上升后下降趋势,热水处理的果实TSS含量均大于CK,尤其是35 ℃热水处理10 min组与CK呈显著差异(p<0.05)。各处理组TSS含量均在第6 d时达到峰值,随后开始明显下降,至15 d贮藏结束,热水处理的TSS含量明显高于对照,35 ℃热水处理10 min组为4.70%,45 ℃热水处理5 min组为4.54%,CK组为3.98%,较贮藏初始值分别下降了2.59%、5.80%及17.43%。进一步发现,贮藏期间热水处理可溶性糖含量与可溶性固形物趋势基本相同,且可溶性糖是可溶性固形物的主要组成成分。由此说明,热水处理对缓解果实贮藏中后期(6~15 d)TSS含量的下降,保持西葫芦品质有一定作用。

图2 热水处理对西葫芦可溶性固形物含量的影响Fig.2 Effects of hot water trearment on content TSS content of Cucurbita pepo
2.3 热水处理对西葫芦H2O2含量的影响
H2O2不仅是植物对外界环境迫使的感受、传导和适应过程的调节者,还可以在植物细胞中作为信号因子激活与逆境应答有关的基因表达。热水处理对H2O2含量的影响如图3所示,西葫芦在4 ℃贮藏过程中,H2O2含量呈现先上升后下降趋势。热水处理的西葫芦H2O2含量在贮藏前3 d迅速上升,并在第3 d达到峰值,之后缓慢下降。而CK组H2O2含量3 d以后仍持续增加,直至第9 d升至最高值(2.62 mmol/g)且高于两热水处理组的峰值(2.24 mmol/g和2.11 mmol/g),随后H2O2含量一直减少直到第15 d贮藏结束。两热水处理组间差异不显著,而与CK呈显著差异(p<0.05),除第3 d外,对照组的H2O2含量均高于热水处理组。表明热水处理诱导西葫芦果实H2O2含量在贮藏初期(0~3 d)短暂迅速升高,可能与激活抗氧化酶有关,而抑制以后H2O2含量的积累,从而减少自由基对膜的伤害,提高果实抗冷能力。

图3 热水处理对西葫芦H2O2含量的影响Fig.3 Effects of hot water trearment on H2O2 content of Cucurbita pepo
2.4 热水处理对西葫芦CAT活性的影响
CAT是植物体内活性氧清除系统中的重要保护酶,能够分解H2O2,减少活性氧自由基的积累,改善膜的功能,从而提高抗冷性[16]。贮藏期间,热水处理对西葫芦CAT活性的影响如图4所示,西葫芦果实在4 ℃低温贮藏期间的CAT活性总体呈先增大后减小趋势。CK组的CAT活性在贮藏初期(0~3 d)呈上升趋势且在第3 d出现峰值,3 d后便开始不断下降。分析其原因这是由于西葫芦通过自身防御机制做出应激反应,产生了一种在低温逆境下的抵御机制[10]。至15 d贮藏结束,35 ℃热水处理10 min组的CAT活性在整个贮藏期均高于CK且差异显著(p<0.05),在贮藏前期(0~6 d)西葫芦果实CAT活性呈递增趋势并在第6 d达到最高值,随后呈递减趋势,第15 d时热水处理45 ℃ 5 min与35 ℃ 10 min组的CAT活性均高于贮藏初始,分别增加4.4%和9.8%,而CK则下降22.7%。说明热水处理诱导西葫芦果实在贮藏前期(0~6 d)CAT活性快速升高,推迟其酶活高峰出现,并且减缓了贮藏中后期CAT活性的降低。

图4 热水处理对西葫芦CAT活性的影响Fig.4 Effects of hot water treatment on CAT activity of Cucurbita pepo
2.5 热水处理对西葫芦SOD活性的影响
SOD是防御超氧阴离子自由基对细胞产生伤害的抗氧化酶,它与POD在植物体内协调作用共同维持活性氧的平衡,保护细胞膜的稳定[17]。4 ℃贮藏期间,热水处理对西葫芦SOD活性的影响如图5所示,西葫芦果实在低温贮藏期间SOD活性呈先上升后下降趋势。CK在贮藏结束的酶活性较贮藏初始有轻微下降趋势,图上曲线平缓。热水处理组在贮藏前中期(0~9 d)SOD活性快速上升,至第9 d达到峰值,35 ℃热水处理10 min与45 ℃热水处理5 min分别为 3.19 U·(min·g)-1和3.47 U·(min·g)-1,之后在贮藏后期SOD活性缓慢下降,直至贮藏结束,SOD活性分别为初始值的1.38倍和1.08倍,而对照的SOD活性则下降了4.74%。同时在整个贮藏期热水处理35 ℃ 10 min组的SOD活性一直高于45 ℃ 10 min处理组,并且与CK呈显著性差异(p<0.05)。由此说明,热水处理诱导SOD活性增加明显,提高了果实清除自由基的能力,增强了西葫芦的抗冷性。

图5 热水处理对西葫芦SOD活性的影响Fig.5 Effects of hot water treatment on SOD activity of Cucurbita pepo
2.6 热水处理对西葫芦POD活性的影响
贮藏期间,热水处理对西葫芦POD活性的影响如图6所示,西葫芦果实在4 ℃贮藏期间,总体呈上升趋势,且显著高于对照(p<0.05)。CK组果实的POD活性呈波浪式上升,在贮藏前3 d表现微小下降趋势,贮藏3~9 d迅速上升,随后呈下降趋势,到12 d又再次上升直至15 d贮藏结束。分析其原因,这种波浪式上升趋势是由于低温逆境刺激了西葫芦果实内部的酶促反应,且POD可能参与了活性氧与自由基的清除。而热水处理组西葫芦果实POD活性随贮藏时间呈持续上升趋势,第3 d到第12 d为POD活性的主要增长期,热水处理35 ℃10 min组与45 ℃ 5 min组的增长量分别占整个贮藏期的77.61%和81.70%。贮藏至15 d,两个热水处理组的POD活性较CK增加极显著(p<0.01),分别为贮藏起始值的2.88倍及2.48倍,而CK为初始值的1.79倍。由此说明,热水处理对西葫芦果实低温逆境下诱导POD活性的提高具有一定作用。
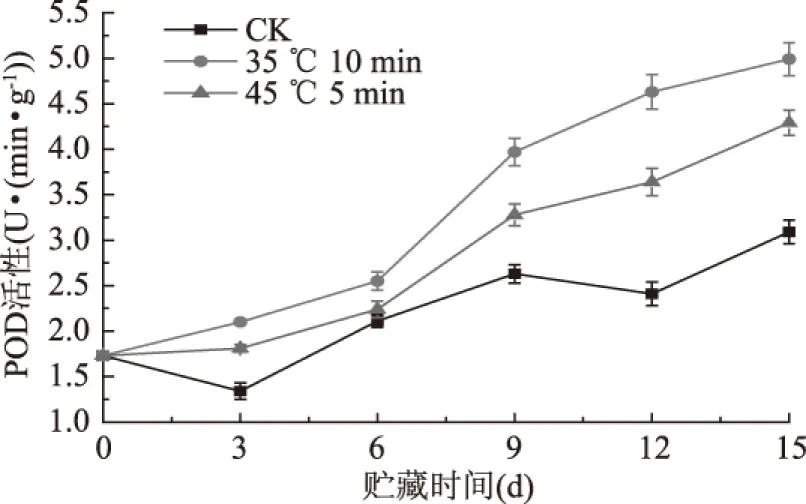
图6 热水处理对西葫芦POD活性的影响Fig.6 Effects of hot water treatment on POD activity of Cucurbita pepo
2.7 热水处理对西葫芦MDA含量的影响
MDA是膜脂过氧化作用的最终产物,是膜脂过氧化程度的度量,MDA的积累是活性氧毒害作用的表现[18]。贮藏期间,不同热水处理对西葫芦MDA含量的影响如图7所示,西葫芦果实在4 ℃低温贮藏期间的MDA含量在贮藏期间逐步增加,热水处组果实的MDA含量均低于CK(p<0.05),其中35 ℃热水处理10 min的果实的MDA含量总体水平较低。说明热水处理减轻了MDA含量的增加,有效缓解了低温逆境下细胞膜脂过氧化程度,降低膜内溶物外渗,维持了相对较好的细胞膜,对细胞膜结构与功能的稳定作用积极,对果实的抗冷性有一定程度提高。

图7 热水处理对西葫芦MDA含量的影响Fig.7 Effects of hot water treatment on MDA content of Cucurbita pepo
2.8 热水处理对西葫芦相对电导率含量的影响

图8 热水处理对西葫芦相对电导率的影响Fig.8 Effects of hot water treatment on membrane permeability of Cucurbita pepo
通过对果实的电导率的测定,可以用来判定细胞膜结构的完整性,同时电导率也是鉴定果实抗冷性的重要指标[19]。贮藏期间,不同热水处理对西葫芦电导率的影响如图8所示,西葫芦果实在4 ℃低温贮藏期间的电导率在贮藏期间随时间稳步上升,CK组果实的电导率均高于热处理组(p<0.05),在贮藏的前9 d,果实的电导率随贮藏时间增加缓慢,在贮藏的9~12 d电导率快速增加,且增加程度为35 ℃ 10 min组大于45 ℃ 5 min处理组,随后在贮藏末期(12~15 d)果实电导率又增加缓慢,至贮藏结束,CK果实的电导率为45 ℃ 5 min组的2.02倍。表明,热水处理能有效减少西葫芦果实在低温逆境下的电解质外渗率,提高细胞膜结构的稳定,提高果实的抗冷性。

表1 热水处理对西葫芦冷害指数变化的影响Table 1 Effects of hot water treatment on chilling injuty index of Cucurbita pepo
注:表中数据为各组样品“冷害指数平均值±标准差”(n≥6);同列的不同字母表示差异性显著(p<0.05)。
2.9 热水处理对西葫芦冷害指数的影响
贮藏期间,热水处理对西葫芦冷害指数的影响如表1所示,各组西葫芦在4 ℃贮藏6 d内无冷害症状。贮藏至第6 d起,对照与热水处理均开始出现冷害症状,且冷害指数呈持续上升趋势,这说明西葫芦的冷害现象随贮藏时间的延长不断加剧。从初期表皮出现失去光泽、表皮颜色由翠绿转黄、出现凹陷斑,到后期的瓜面皱缩严重,特别是CK组后期表皮大面积出现大小不一、凹凸状斑点,瓜体变软,组织蓬松。两个热水处理组的西葫芦第6 d的冷害指数均大于CK,45 ℃热水处理5 min的果实冷害指数最高,究其原因可能是热水处理诱导H2O2含量在贮藏前期出现短暂升高(如图3),从而激发CAT、SOD及POD活性的升高(如图4、图5及图6),进而有效清除积累的膜脂过氧化产物。到贮藏中后期(9~15 d)热水处理组的冷害指数均低于对照(p<0.05),尤其至贮藏第12 d和第15 d,热水处理果实的冷害指数极显著低于对照(p<0.01),POD活性明显升高(p<0.05),H2O2含量的增加被有效抑制,MDA含量及相对电导率下降,且贮藏15 d的35 ℃热水处理10 min的冷害指数小于45 ℃热水处理5 min的果实,分别为CK的52.00%和57.33%。由此说明,热水处理诱导西葫芦果实的抗冷性在其贮藏后期表现明显,至贮藏结束有效减轻冷害。
3 讨论
本实验中西葫芦的冷害症状随贮藏时间逐步表现出来,冷害现象与袁蒙蒙[1]等人的报道几乎一致。此外,热水处理的西葫芦的冷害症状与对照均在第6 d表现出来,热水处理诱导果实的抗冷性在贮藏的中后期(9~15 d)才表现出来,这可能与活性氧分子参与果实中后期的耐冷诱导有关,该现象与王静[20]等人对热处理哈密瓜的研究结果类似。
植物中的糖是细胞膜与蛋白质的保护剂,含糖量的多少与植物在低温贮藏下的抗冷性有直接关系,一般低温条件下可溶性糖含量会增加,则植物的抗寒性就越强[21-22]。本实验中,在整个低温贮藏期可溶性糖含量均高于对照,与前人通过热处理对黄桃[23]、梨[24]及龙眼[15]果实的研究结果基本一致。实验得出热水处理促进了贮藏前期西葫芦可溶性糖含量的增加,延缓了贮藏后期可溶性糖含量的下降。说明热水处理诱导对西葫芦的抗冷性具有一定作用。同时,热水处理有效缓解了贮藏中后期西葫芦TSS含量(6~15 d)的下降并于贮藏15 d显著高于对照,保持了西葫芦的贮藏品质,可能与热水处理抑制大分子物质降解的酶活性有关,与热水处理对番木瓜[25]、番茄[26]及晚蜜桃[27]的研究结果类似。
研究发现,H2O2可作为一种信号分子在植物耐冷诱导中起到重要调控作用,激活植物体内逆境胁迫下相关基因的表达[28-29]。本实验发现,热水处理的西葫芦H2O2含量在贮藏初期(0~3 d)高于对照,热水处理短时间内促进了H2O2含量的升高,与王静[20]等55 ℃热水浸泡哈密瓜3 min使得H2O2含量短暂上升的实验结果相同,与热激处理青椒[30]、茄子[31]后,H2O2含量先增加后减小的实验结论一致。还有研究发现,热激处理诱导果蔬内活性氧分子短暂升高主要是通过提高抗氧化酶体系活性,增强机体自由基清除能力,抑制膜脂过氧化,从而提高果蔬的抗冷性[25]。

植物细胞膜的流动性和完整性是维持整个生理活性的基础,也是对低温最为敏感的部位[36]。本实验中热水处理抑制了西葫芦果实的MDA含量和电导率的升高,与对冷害指数的研究结果趋势一致,热水处理也有效降低了柿子[37]、猕核桃[38]及芒果等果蔬的MDA含量和电导率。该实验现象可能与热水处理对膜脂脂肪酸量的调节起的积极作用有关,使得不饱和脂肪酸与饱和脂肪酸的比例发生了变化,从而减少膜内外的交流,降低了膜脂过氧化进程,减轻了低温逆境对细胞膜的破坏,进而提高了西葫芦的抗冷性[28]。
4 结论
西葫芦在45 ℃热水处理5 min及35 ℃热水处理10 min后在4 ℃低温贮藏过程中,促进了贮藏前期(0~6 d)可溶性糖含量的提高,抑制了贮藏后期(12~15 d)可溶性糖含量的降低,同时缓解了贮藏中后期(6~15 d)TSS含量的降低,诱导H2O2含量短期内(0~3 d)升高,而显著减少贮藏中后期(6~15 d)H2O2含量的积累,激发贮藏前期(0~6 d)CAT和SOD活性的升高,减轻贮藏后期(9~15 d)的活性下降,尤其是POD活性在贮藏中后期(6~15 d)显著升高(p<0.01),降低了MDA含量及相对电导率的升高,减少冷害指数的上升(6~15 d)(p<0.05),且35 ℃热水处理10 min效果更佳。由此说明,热水处理诱导了西葫芦采后低温逆境下的抗冷性,激发了抗氧化酶活性,提高了自由基清除能力,延缓了细胞膜脂过氧化进程,从而有效减轻冷害。
[1]袁蒙蒙,高丽朴,王清,等. 壳聚糖涂膜处理对西葫芦冷害的影响[J]. 河南农业科学,2012,41(10):114-117.
[2]尹海蛟,杨昭,陈爱强. 果蔬热处理传热过程的数值模拟及验证[J]. 农业工程学报,2010,26(11):344-348.
[3]Shadmani N,Ahmad S H,Saari N,et al. Chilling injury incidence and antioxidant enzyme activities of Carica papaya L. ‘Frangi’as influenced by postharvest hot water treatment and storage temperature[J]. Postharvest Biology and Technology,2015,99:114-119.
[4]Shao X,Tu K. Hot air treatment improved the chilling resistance of loquat fruit under cold storage[J]. Journal of Food Processing and Preservation,2014,38(2):694-703.
[5]Bassal M,El-Hamahmy M. Hot water dip and preconditioning treatments to reduce chilling injury and maintain postharvest quality of Navel and Valencia oranges during cold quarantine[J]. Postharvest Biology and Technology,2011,60(3):186-191.
[6]Zhang X,Shen L,Li F,et al. Arginase induction by heat treatment contributes to amelioration of chilling injury and activation of antioxidant enzymes in tomato fruit[J]. Postharvest Biology and Technology,2013,79:1-8.
[7]Wang H,Zhang Z,Xu L,et al. The effect of delay between heat treatment and cold storage on alleviation of chilling injury in banana fruit[J]. Journal of the Science of Food and Agriculture,2012,92(13):2624-2629.
[9]郑鄢燕,代晓霞,生吉萍,等. 热处理与内源 H2O2对黄瓜抗冷性和抗氧化酶活性的影响[J]. 食品科学,2012,33(22):314-318.
[10]刘玲,魏亚南,纪淑娟,等. 间歇升温对低温储藏青椒果实硬度及相关指标的影响[J]. 食品与发酵工业,2014,40(4):195-199.
[11]Al-Qurashi A D. Effect of pre-storage salicylic acid,calcium chloride and 2,4-dichlorophenoxyacetic acid dipping on chilling injury and quality of ‘Taify’cactus pear fruit during cold storage[J]. African Journal of Biotechnology,2014,11(24):6501-6509.
[12]曹建康,姜微波,赵玉梅. 果蔬菜后生理生化实验指导[M]. 北京:中国轻工业出版社,2007.
[13]解越,张敏,梁飞侠,等. 电导法配合 Logistic 方程鉴定西葫芦和黄瓜果实抗寒性[J]. 农业工程学报,2015,31(7):292-298.
[14]张宏亮. 低温胁迫下西葫芦转录组分析与 SSR 分子标记开发[D]. 晋中:山西农业大学,2015.
[15]赵云峰,林河通,王静,等. 热处理对龙眼果实采后生理和贮藏品质的影响[J]. 中国食品学报,2014(5):124-133.
[16]武彦霞,田建保,乔永胜,等. 低温胁迫下核桃叶片抗寒性生理生化指标分析[J]. 中国农学通报,2016,32(1):101-106.
[17]高元惠,刘凤娟,高丽朴,等. 1-MCP 处理对西葫芦采后生理及品质的影响[J]. 食品科技,2012(6):44-47.
[18]沈丽雯,刘娟,董红敏,等. 热激处理对黄瓜低温贮藏特性的影响[J]. 食品工业科技,2015,36(2):343-348.
[19]Zhang C,Ding Z,Xu X,et al. Crucial roles of membrane stability and its related proteins in the tolerance of peach fruit to chilling injury[J]. Amino Acids,2010,39(1):181-194.
[20]王静,茅林春,李学文,等. 热处理降低哈密瓜果实活性氧代谢减轻冷害[J]. 农业工程学报,2016,32(2):280-286.
[21]安飞飞,李庚虎,陈霆,等. 植物耐寒生理及蛋白质组学研究进展[J]. 中国农学通报,2015,31(14):96-101.
[22]马峰,张华锋,张怀友,等. 低温胁迫对不同西葫芦品种抗寒性生理特性的影响[J]. 安徽农学通报,2015,21(13):55-57.
[23]吴剑,褚伟雄,王晖. 热处理-冷藏对锦绣黄桃生理生化的影响及感官评价[J]. 食品科技,2015(10):314-319.
[24]Yu L,Liu H,Shao X,et al. Effects of hot air and methyl jasmonate treatment on the metabolism of soluble sugars in peach fruit during cold storage[J]. Postharvest Biology and Technology,2016,113:8-16.
[25]钟曼茜,黄绵佳,张史青,等. 热处理和钙处理对番木瓜果实保鲜效果的比较研究[J]. 中国食物与营养,2016,22(6):55-59.
[26]Zhao D Y,Shen L,Fan B,et al. Physiological and genetic properties of tomato fruits from 2 cultivars differing in chilling tolerance at cold storage[J]. Journal of Food Science,2009,74(5):C348-C352.
[27]范文祥. 热水处理对 ‘晚蜜桃’果实贮藏品质的影响[J]. 北方果树,2014(5):10-11.
[28]王海波,张昭其,邓鸿铃,等. 热处理提高采后果蔬抗冷性的机理分析[J]. 广东农业科学,2015,42(15):57-64.
[29]Pletjushkina O Y,Fetisova E K,Lyamzaev K G,et al. Hydrogen peroxide produced inside mitochondria takes part in cell-to-cell transmission of apoptotic signal[J]. Biochemistry(Moscow),2006,71(1):60-67.
[30]王慧,张艳梅,王大鹏,等. 热激处理对青椒耐冷性及抗氧化体系的影响[J]. 食品科学,2013,34(2):312-316.
[31]孙保娟,黎振兴,罗少波,等. 持续高温胁迫对茄子幼苗几个主要生理指标的影响[J]. 热带作物学报,2010(9):1528-1534.
[32]Zhang Z,Nakano K,Maezawa S. Comparison of the antioxidant enzymes of broccoli after cold or heat shock treatment at different storage temperatures[J]. Postharvest Biology and Technology,2009,54(2):101-105.
[33]王挥. 采后热处理对芒果贮藏特性影响及机理的研究[D]. 南宁:广西大学,2012.
[34]黄锐,安力,王强,等. 热处理对葡萄品质及保护性酶的影响[J]. 食品工业科技,2009,30(8):300-302.
[35]Wang Lei,Jin Peng,Wang Jing,et al. Hot air treatment induces resistance against blue mold decay caused by Penicillium expansum in sweet cherry(Prunus cerasus L.)fruit[J]. Scientia Horticulturae,2015,189:74-80.
[36]王海波,黄椿颖,庞学群,等. 茉莉酸甲酯诱导的采后香蕉果实耐冷性与活性氧信号的关系[J]. 中国农业科学,2008,41(4):1165-1171.
[37]罗自生,徐晓玲,蔡侦侦,等. 热激减轻柿果冷害与活性氧代谢的关系[J]. 农业工程学报,2007,23(8):249-252.
[38]马秋诗,饶景萍,李秀芳,等. 贮前热水处理对‘红阳’猕猴桃果实冷害的影响[J]. 食品科学,2014,35(14):256-261.
Study on hot water treatments for inducing cold tolerance of postharvestCucurbitapepoL. during low temperature stress
ZHU Sai-sai,ZHANG Min*,AI Wen-ting,LI Chun-hui
(College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
The effects of hot water treatment on chilling tolerance ofCucurbitapepoL. were investigated.CucurbitapepoL. were used as the object of this research. The fruits were fully immersed in hot water of 45 ℃and 35 ℃ for 5 min and 10 min,fruits without hot water treatment as the control,and then stored at 4 ℃ for 0,3,6,9,12,15 d. The chilling injury index,soluble sugar content,H2O2content,activities of catalase activity(CAT),superoxide dismutase(SOD)and peroxidase(POD),malondialdehyde(MDA)content and electric conductivity were measured as related indicaters during the storage period. The results showed that,compared with the control,soluble sugar content was increased(p<0.05),the content of H2O2in heat-treated fruits was higher than the control fruits within the first 3 d,and the treatment reduced the H2O2accumulation at middle and later period of storage(from the 6thto the 15th)(p<0.05). The activities of CAT and SOD were increased at pre-storage(from the 0thto the 6th),and decreased at middle and later period of storage(from the 9thto the 15th). Especially POD activity was increased significantly at the late stage of storage(from the 6thto the 15th)(p<0.01). The increase of MDA content and conductivity were inhabited,and chilling injury index was controled(from the 6thto the 15th)(p<0.05). These results suggested that the chilling tolerance of zucchini fruit can be induced by hot water treatment under low temperature stress,and chilling injury was reduced effectively,and in this experiment,35 ℃,10 min was the better hot water treatment.
CucurbitapepoL.;chilling injury;hot water treatment;low temperature stress;cold tolerance
2016-10-28
朱赛赛(1991-),女,硕士研究生,研究方向:果蔬低温贮藏保鲜,E-mail:zssquanquan@sina.com。
*通讯作者:张敏(1969-),女,博士,教授,研究方向:果蔬贮藏保鲜与热物性研究,E-mail:zhangm@shou.edu.cn。
国家自然科学基金资助项目(31371526)。
TS255.3
A
1002-0306(2017)07-0325-07
10.13386/j.issn1002-0306.2017.07.055

