皮状丝孢酵母产油脂的研究
柳 梦,郑 操,田 华,付 杰,陈 涛,何东平,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023; 2.中国科学院武汉病毒研究所,湖北武汉 430071)
皮状丝孢酵母产油脂的研究
柳 梦1,郑 操1,田 华1,付 杰1,陈 涛2,何东平1,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023; 2.中国科学院武汉病毒研究所,湖北武汉 430071)
本文对皮状丝孢酵母的生长发育和油脂合成进行了研究,监测和分析了酵母菌生长发育、油脂合成和脂肪酸成分及数量,检测了形态、OD值、糖氮代谢、pH、生物量、油脂含量和脂肪酸组分。结果表明:皮状丝孢酵母生长80 h左右时镜检测得菌细胞体内含油脂情况与80 h左右时实际提油获得的油脂量相一致,其油脂产量为3.66 g/L,含油率约为39.20%。皮状丝孢酵母生长0~6 h为适应期,此时糖氮的消耗明显,细胞数量缓慢增加;6~25 h为对数期,氮消耗非常显著,细胞数量急剧增加,细胞变大;25~120 h为稳定期,糖的消耗明显,消耗速度显然大于氮的消耗,细胞内开始慢慢积累油脂;之后为衰退期,氮的消耗基本趋于平稳。皮状丝孢酵母所产脂肪酸主要以C16、C18为主,此类脂肪酸适于进行脂交换制备生物柴油。
皮状丝孢酵母,脂肪酸成分分析,糖氮代谢
能源安全问题在国际上一直是个被高度重视的问题。随着石油资源逐渐减少以及石油燃烧产生的废气对环境生态的巨大影响,而带来的雾霾、二氧化碳增多使全球变暖等问题,促进了各国科学家企业家寻求新的能源,其中包括风能、日光能和生物柴油[1-2]。
生物柴油是一种由甘油三酯与乙醇通过甲基化得到的生物燃料,具有含硫物质和含芳香性物质量低、燃烧性能优良及生物可降解性等优点[3-4]。含有甘油三酯的油脂包括大豆油、棕榈油、菜籽油、乌桕油、襐籽油等植物油脂和猪油、牛油、羊油等动物油脂以及餐饮废弃油脂(地沟油)等[5]。
目前,用植物油脂和动物油脂来制备生物柴油已不能完全满足人们生活生产的需求,因此对微生物油脂这一新油脂资源的开发和研究越来越受到人们的关注[6-9]。微生物油脂又称单细胞油脂,是由细菌、酵母菌、丝状真菌和海洋微藻等微生物产生的油脂。它们利用碳源(糖)、氮源(蛋白质)以及微量元素(钠、铁等)等营养物质,在一定的条件下生长发育产生大量的菌(藻)体,同时进行合成油脂而积累于细胞内。然后收集菌(藻)体,提取油脂。微生物油脂是含有甘油三酯的脂肪酸,包括棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸(GLA、ALA)、花生四烯酸(ARA)和二十二碳六烯酸(DHA)等,其中一部分可作为人体的营养因子如ARA、DHA等,一部分可作为生物柴油的原料如棕榈酸、硬脂酸等。目前,主要集中在酵母菌和微藻产生油脂的研究[10-11]。皮状丝孢酵母(Trichosporoncutaneum)是一株高产油脂的菌株,其生长发育不受场地、季节等限制,发酵周期短[12-14],且所产脂肪酸成分与植物油脂脂肪酸成分相似,能为企业节约生产成本。
目前,国内外对皮状丝孢酵母产油脂的研究较少。本文选取皮状丝孢酵母作为研究对象,并对其生长发育和油脂的合成进行了研究。
1 材料与方法
1.1 材料与仪器
皮状丝孢酵母(Trichosporoncutaneum) 编号GIM2.68,广东省微生物菌种保藏中心;种子培养基组成(g/L) 蛋白胨5、葡萄糖10、酵母粉3、麦芽提取物3;发酵培养基组成(g/L) 蛋白胨15、葡萄糖80、酵母粉3、麦芽提取物3、金属离子混合物0.01,维生素混合物0.03。
葡萄糖(分析纯),氢氧化钾 天津市博迪化工股份有限公司;酵母粉 北京奥博星生物技术有限公司;麦芽提取物、正己烷(色谱级)、乙醚、石油醚、盐酸、甘油、50%三氯化硼 天津市科密欧化学试剂有限公司;蒸馏水,甲醇 天津市东丽区泰兰德化学试剂有限公司;无水乙醇 天津凯通化学试剂有限公司。
SW-CJ-1F单人双面净化工作台 苏州净化设备有限公司;YM75立式压力蒸汽灭菌器 上海三申医疗器械有限公司;RE-52C旋转蒸发器 上海亚荣生化仪器厂;TDL-5-A台式低速离心机 上海安亭科学仪器厂;AUY120电子天平 岛津国际贸易(上海)有限公司;HYQ-150S全温摇床 武汉汇诚生物科技有限公司;XSP-BM-2CA生物显微镜 上海上光新光学科学有限公司;GZX-9070MBE电热鼓风干燥箱、SPX-150C恒温恒湿箱 上海博讯实业有限公司医疗设备厂;BCD-197VCZ 冰箱 河南新飞电器有限公司;XB-K-25血球计数板 盐城市荣康玻璃仪器有限公司;安捷伦7890A-5975C气质色谱仪 安捷伦科技(中国)有限公司;色谱柱:SP-2560(100 m×25 μm×0.2 μm);紫外可见分光光度计 上海美谱达UV-3100PC)。
1.2 实验方法
1.2.1 菌种活化 将冻干的菌粉用液体培养基制成悬浮液,吸取悬浮液100 μL涂布与平板上。涂布完毕将平板置于恒温培养箱,在(28±2) ℃培养17 h转接到另一个平板上,依次传五代,获得菌种。
1.2.2 种子培养 从活化好的平板中挑取较大的单菌落接种到含有5 mL液体培养基的安瓿瓶中,置于摇床中固定好,在(28±2) ℃、180 r/min条件下培养17 h,取样检查。
1.2.3 发酵培养 将培养处于对数期的菌种子液接种于发酵摇瓶中,在(28±2) ℃、180 r/min条件下培养120 h,每隔24 h取样。用40倍高倍物镜观察皮状丝孢酵母发酵过程中生长形态的变化,并拍照片。
1.2.4 生长曲线测定 从种子液培养开始,每2 h从摇瓶中取100 μL菌液到96微孔板中,在紫外分光光度计600 nm波长下测定菌液的吸光度,并作好记录。菌液的吸光度可代表菌体的生长情况。
1.2.5 发酵过程中糖、氮代谢的测定 糖含量的测定采用蒽酮-硫酸法测定总糖[15],氮含量的测定采用凯氏定氮法[16]。
1.2.6 发酵过程中pH的测定 从加入发酵瓶开始,每隔5 h测一次取少量发酵液用pH计测发酵液的pH,并做好记录。
1.2.7 生物量的测定 分别取70、80、90、100、110、120 h的发酵液1 L于烧杯中,分别标记为1、2、3、4、5、6,在4000 r/min下离心,洗涤三次。收集菌泥置于称量好(记作M1,单位为g)的烧杯中,35 ℃干燥至恒重,称取重量(记作M2,单位为g)。
生物量的计算公式:
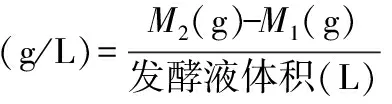
式(1)
1.2.8 油脂的提取 将1.2.7中菌粉按照每克8 mL盐酸(6 mol)的比例加入盐酸,振荡混匀室温静置1 h后,沸水浴中加热8 min,立即放入-20 ℃冰箱中冷冻30 min。此操作重复五次。用高倍显微镜涂片检测是否破壁完全。若破壁不完全,则继续重复上述操作直至破壁完全[17]。细胞破壁完全后,将菌液倒入分液漏斗中,按照20 mL/g无水乙醇、24 mL/g已醚、24 mL/g石油醚的顺序往分液漏斗中添加。摇匀静置一段时间后取上清液放在称量好重量(记作M3,单位为g)的旋蒸瓶中,60 ℃旋转蒸发,直至有机溶剂全部蒸发完毕旋蒸瓶内重量达到恒重,称取重量(记作M4,单位为g)。
油脂产量及含油率的计算公式:
油脂重量(g)=M4-M3
式(2)

式(3)

式(4)
1.2.9 脂肪酸成分测定
1.2.9.1 样品前处理 在样品中加入0.5 mol/L氢氧化钾-甲醇溶液1 mL,在60 ℃水浴锅内加热30 min,加热过程中不断振荡。然后50%三氟化硼-甲醇溶液1 mL,在60 ℃水浴锅内边振荡边加热30 min。加热完毕后加入5 mL正己烷混匀,静置后取上清液过滤,过滤好后注入进样瓶中,待测。
1.2.9.2 检测条件 升温程序:140 ℃保持1 min,以5 ℃/min升温至190 ℃,然后3 ℃/min升温至220 ℃保持2 min。载气(N2)流速25 mL/min,压力2.4 kPa,进样量1.8 μL,不分流[18]。
2 结果与分析
2.1 皮状丝孢酵母油脂积累
图1显示了皮状丝孢酵母四个不同时期显微镜下的形态,在72 h显微镜的图片上细胞较小,边缘清晰,胞内油脂含量较少,胞内色泽清亮透明;在80 h的时候酵母胞内绿色最深且色泽明亮,细胞也最大,胞内油脂聚集最多;从90、108 h的显微镜图片中发现酵母细胞没有增多,胞内油脂含量逐渐减少,细胞色泽变暗,由于酵母菌生长到一定阶段的时候出现衰老及培养中产生的一些溶解胞壁的酶,致使细胞壁出现溶解现象,所以出现了培养时间越长就会出现自溶现象。因此,认为发酵至80 h时细胞完整及胞内油脂含量较高,终止发酵。

图1 皮状丝孢酵母油脂积累显微图片(40倍)Fig.1 Oil accumulation micrograph of T. cutaneum
2.2 皮状丝孢酵母的生长曲线
从图2可知,皮状丝孢酵母在种子培养基中直接发酵和在利用种子培养液转接于发酵培养基中的发酵的生长曲线相似。0~6 h,生长缓慢,是皮状丝孢酵母的发酵适应期;6~25 h时,曲线呈上升趋势,此期间为皮状丝孢酵母的生长对数期;从25~65 h,菌体生长缓慢,生长曲线平稳增加,此期间为皮状丝孢酵母的稳定期;从65 h后,种子培养基直接发酵的菌体不再增加,生长曲线不再变化;而用种子液转接的发酵培养液中菌体还在继续缓慢增长;到120 h以后,菌体数量逐渐减少,说明皮状丝孢酵母到了衰退期。本实验的结果说明了皮状丝孢酵母有无种子转接的生长情况基本一致,这就为进行工业化一步法发酵生产提供了依据。
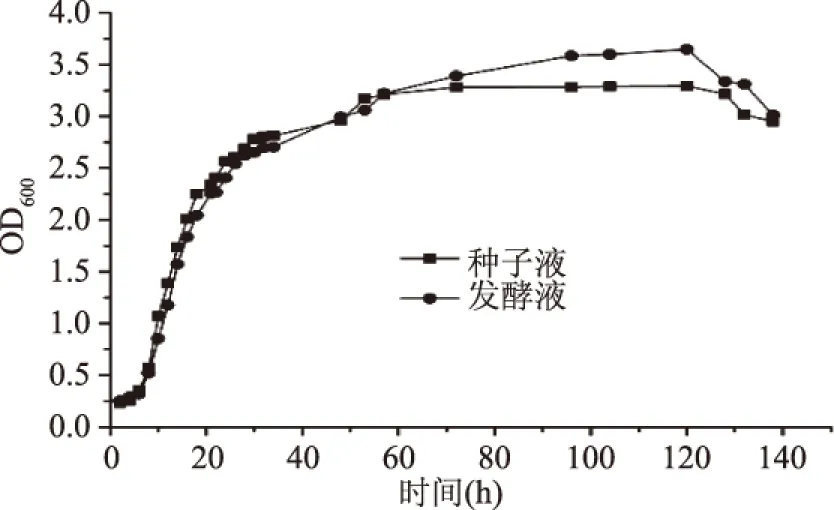
图2 皮状丝孢酵母生长曲线图Fig.2 The growth curve of T. cutaneum
2.3 糖氮代谢及pH的变化
从图3可以看出,随着发酵时间的延长,发酵液中pH在逐渐下降,到了第80 h之后,pH缓慢趋于稳定,在3.5之间徘徊,说明皮状丝孢酵母在发酵过程中产酸,发酵时需要实时调节pH稳定至中性。从图4、图5中可以看到,在对数期时,培养基中糖的浓度下降速度较低,而氮的浓度下降速度较快,说明细胞增长速度较快,耗氮速度快。到了稳定期时,发酵液中氮的浓度基本趋于稳定,说明菌体生长缓慢,基本不再消耗氮源,发酵液中糖的浓度下降明显,说明油脂在细胞内不断合成。在发酵到90 h以后,发酵液中糖与氮的浓度基本没有变化,发酵液中还有一部分的糖和氮剩余。由于油脂的产生需要糖来转化,培养基中糖的初始含量过高,也会影响氮的消耗,反之也会互相影响,最后导致微生物的生长和产油受到制约,所以后期优化培养基成分时,可以适当调整培养基中糖氮的比例来促进皮状丝孢酵母的产油量和糖氮利用。

图3 不同时期发酵液pHFig.3 pH of fermentation broth during different periods

图4 不同时期发酵液中糖浓度Fig.4 Sugar concentrations of fermentation broth during different periods
2.4 生物量及油脂产量
由图6可知,当皮状丝孢酵母发酵80 h时,含油量达到最高,含油量为3.66 g/L,得油率为39.20%。发酵90 h左右时得油率大幅度下降,所以皮状丝孢酵母最佳的发酵时间约为80 h左右。

表1 皮状丝孢酵母胞内油脂各组分质量分数Table 1 The content percentages of each fatty acid component in total lipid of T. cutaneum
2.5 皮状丝孢酵母胞内油脂脂肪酸组分测定

图5 不同时期发酵液中氮浓度Fig.5 Nitrogen concentrations of fermentation broth during different periods

图6 不同时期生物量和油脂产量 Fig.6 Biomass and oil productions during different periods
由总离子流图(图7)和表1可知,饱和脂肪酸占97%,棕榈酸含量最高占53.2%,其次为油酸占24.1%,不饱和脂肪酸的含量较低,这些脂肪酸成分与作为生物柴油原料的植物油料作物的脂肪酸成分相似。因此,皮状丝孢酵母的胞内油脂可作为制备生物柴油的原料。
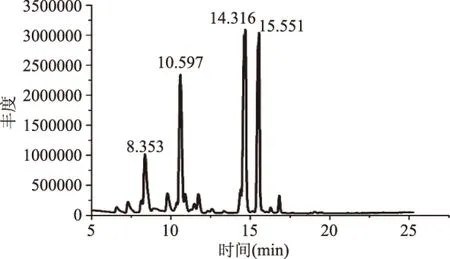
图7 皮状丝孢酵母胞内油脂脂肪酸的总离子流图Fig.7 Typical total ion chromatogram of total lipid of T. cutaneum
3 结论与讨论
皮状丝孢酵母为产油脂酵母,其含油量为3.66 g/L,含油率为39.20%,最佳的发酵时间为80 h。皮状丝孢酵母发酵至对数期时氮消耗较快,发酵至稳定期时糖消耗较快,并且在种子培养基中直接发酵和从种子培养液转接至发酵培养基中发酵,两者的生长曲线比较相似,表明皮状丝孢酵母可以进行一步法发酵;皮状丝孢酵母在发酵过程中pH从6下降至3.5左右,表明其在发酵过程中产酸。
实验数据还表明,皮状丝孢酵母的脂肪酸组成与植物油脂的脂肪酸组成相似,所产油脂的脂肪酸主要为饱和脂肪酸,如C16、C18,而这类脂肪酸又易于进行脂交换反应,可在甲酯化后获得硬脂酸甲酯、亚油酸甲酯,所以皮状丝孢酵母的胞内油脂可作为制备生物柴油的原料[19-24]。
[1]李为民,郑晓林,徐春明,等.固体碱法制备生物柴油及其性能[J].化工学报,2005,56(4):711-716.
[2]刘金胜,蔺建民,张建荣,等.新型酚酰胺抗氧剂AO-BIO的合成及在生物柴油中的应用[J].石油学报(石油加工),2013,29(3):404-408.
[3]吴伟光,仇焕广,徐志刚,等.生物柴油发展现状、影响与展望[J].农业工程学报,2009,25(3):298-302.
[4]胡芳华,殷福珊.产油酵母菌——可再生油脂的潜在资源[J].日用化学品科学,2009,32(4):12-13.
[5]岳金方,左春丽,黄琴,等.地沟油制备生物柴油的研究进展[J].广州化工,2010,38(12):84-85,130.
[6]里伟,杜伟,李永红,等.生物酶法转化酵母油脂合成生物柴油[J].过程工程学报,2007,7(1):137-140.
[7]Jia S S,Min J,Zhang F Q,et al. Study on single cell oil from inulin fermented byTrichosporoncutaneum[J]. Science & Technology of Food Industry,2012,33(15):174-177.
[8]Chen X F,Huang C,Xiong L,et al. Microbial oil production from corncob acid hydrolysate byTrichosporoncutaneum[J]. Biotechnology Letters,2012,34(6):1025-1028.
[9]Pirozzi D,Ausiello A,Yousuf A,et al. Exploitation of oleaginous yeasts for the production of microbial oils from agricultural biomass[J]. Chemical Engineering Transactions,2014,37(5):11-28.
[10]Shen J J,Fu-Chao L I,Yang Q L,et al. Fermentation of Spartina anglica acid hydrolysate byTrichosporoncutaneumfor microbial lipid production[J]. Marine Sciences,2007,31(8):38-41.
[11]汪伦记,纠敏,吉艳青,等.菊芋提取液的皮状丝孢酵母发酵产油脂实验研究[J].中国粮油学报,2014,29(9):52-56,64.
[12]陈韬,陈雪芳,杨小燕,等.阿魏酸对皮状丝孢酵母细胞生长与油脂积累影响的研究[J].广东化工,2013,(7):30-31.
[13]胡翠敏,王倩,龚志伟,等.皮状丝孢酵母同步利用葡萄糖/木糖的糖转运动力学[J].生物加工过程,2014,(1):18-22.
[14]贾闪闪,纠敏,张峰齐,等.皮状丝孢酵母菌发酵菊粉产油脂的研究[J].食品工业科技,2012,33(15):174-177.
[15]魏苑,张盛贵.蒽酮-硫酸法测定枸杞多糖含量的研究[J].食品工业科技,2011,(3):399-401.
[16]郑贤光,辛若竹.全自动凯氏定氮仪测定化肥中的含氮量[J].化学分析计量,2014,(5):41-43.
[17]易弋,容元平,程谦伟,等.不同破壁方法提取酵母菌总RNA的比较[J].食品科学,2011,32(11):161-164.
[18]王美珠,范琳,叶蕊芳,等.皮状丝孢酵母的高温驯化及细胞膜脂肪酸组成的测定[J].中国油脂,2014,(5):48-52.
[19]贾闪闪,纠敏,汪伦记,等.皮状丝孢酵母发酵菊粉产油脂培养基的优化[J].中国酿造,2012,31(5):63-67.
[20]Yuan J,Ai Z,Zhang Z,et al.Microbial oil production by Trichosporon cutaneum B3 using cassava starch[J]. Chinese Journal of Biotechnology,2011,27(3):453-460.
[21]沈珺珺,李富超,杨庆利,等.皮状丝孢酵母利用大米草水解液发酵生产微生物油脂[J].海洋科学,2007,31(8):38-41.
[22]李新社,易自力,陆步诗,等.复合诱变皮状丝孢酵母选育高产油脂菌株[J].中国油脂,2010,35(7):31-34.
[23]Kang J,Liu Y,Li M,et al. Fermentation by Trichosporon cutaneum IFFI01367 for bio-oil production from corn straw hydrolysate[J]. Journal of Pure & Applied Microbiology,2014,8(3):2031-2038.
[24]Kolomiets E I,Romanovskaya T V,Zdor N A. Physiological requirements ofTrichosporoncutaneumgrown on hydrolysed lignin.[J]. Mikrobiologicheskiiǐ Zhurnal,1990,5(5):34-36.
Study on production of oils fromTrichosporoncutaneum
LIU Meng1,ZHENG Cao1,TIAN Hua1,FU Jie1,CHEN Tao2,HE Dong-ping1,*
(1.College of Food Science and Engineering,Wuhan Polytechnic University,Wuhan 430023,China; 2.Wuhan Institute of Virus,Chinese Academy of Sciences,Wuhan 430071,China)
This study focused on the growth development and oil synthesis ofTrichosporoncutaneum. The morphology ofT.cutaneum,OD value,sugar and nitrogen concentrations,pH,oil content and the profile of the total fatty acid were individually measured and analyzed. The study demonstrated that the quantity of extracted oils fromT.cutaneumwas well agreed with its intracellular oils at 80 h,at this time the production and content of oil were 3.66 g/L and 39.20%,respectively. Meanwhile,results showed that the time from 0 h to 6 h was the lag phase,at which the consumptions of sugar and nitrogen were obvious,and the cell numbers was increased slowly. From 6 h to 25 h,the concentrations of sugar and nitrogen were rapidly decreased,and the cell numbers was largely increased,thus this period represented the logarithmic phase. From 25 h to 120 h,the consumption rate of sugar was higher than that of nitrogen,and the intracellular oils were gradually accumulated at this period,which named stationary phase. Thereafter,cells entered into decline phase,at which the concentrations of sugar and nitrogen were maintained constantly at low levels. More importantly,long chain saturated fatty acids were the most mainly fatty acid in total lipid ofT.cutaneum,giving a new source for the preparation of biodiesel.
Trichosporoncutaneum;analysis of the fatty acid composition;metabolism of sugar and nitrogen
2016-09-09
柳梦(1994-),女,硕士研究生,研究方向:微生物油脂,E-mail:13720325344@163.com。
*通讯作者:何东平(1957-),男,博士,教授,研究方向:粮食、油脂及植物蛋白,E-mail:hedp123456@163.com。
TS201.3
A
1002-0306(2017)07-0150-05
10.13386/j.issn1002-0306.2017.07.016

