醋酸泼尼松龙的合成
曾爱民

摘 要:本文以I为起始原料,通过双键溴化、还原脱溴、溴代和置换反应生成醋酸泼尼松龙。方法收率高,操作简单,适合工业生产。
关键词:醋酸泼尼松龙;合成;方法
中图分类号:R781 文献标识码:A
醋酸泼尼松龙是泼尼松龙的醋酸酯,英文名Prednisolone Acetate,化学名为:11β,17α,21-三羟基孕甾-1,4-二烯-3,20-二酮-21-醋酸酯,醋酸泼尼松龙为白色或类白色的结晶性粉末;无臭,味苦,在甲醇、乙醇或三氯甲烷中微溶,在水中几乎不溶。分子结构如图1所示。
醋酸泼尼松龙为糖皮质激素类药物,外用于治疗过敏性、非感染性皮肤病和一些增生性皮肤疾患。如皮炎、湿疹、神经性皮炎、脂溢性皮炎及瘙痒症等。用于过敏性与自身免疫性炎症疾病,胶原性疾病。如风湿病、类风湿性关节炎、红斑狼疮、严重支气管哮喘、肾病综合症、血小板减少性紫癜、粒细胞减少症、急性淋巴性白血病、各种肾上腺皮质功能不足症、剥脱性皮炎、无疱疮神经性皮炎、类湿疹等。目前有很多关于醋酸泼尼松龙复配制剂和新剂型的研究报道。同时,醋酸泼尼松龙还是合成泼尼松龙和其他甾体药物的重要中间体。
目前合成醋酸泼尼松龙的工艺有生物转化和化学合成两类方法,常见的路线主要为醋酸氢化可的松生物脱氢法,但生物转化法转化率较低,一般不超过80%,转化后提取纯化困难,生产周期长,影响因素多,结果不稳定。李金禄等报道了了一种合成醋酸泼尼松龙的方法,通过溴化、脱溴、上碘、置换合成了醋酸泼尼松龙。但是其中还原步骤使用了铬,造成重金属残留;另外,碘代的成本较高,中间体不稳定,容易分解,必须在氮气下避光保存;期间中间体多次进行分离,操作复杂,不利于大规模工业生产。
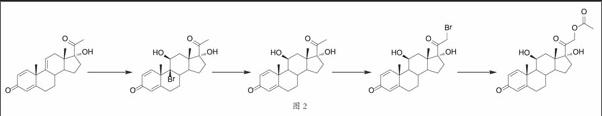
针对历史上醋酸泼尼松龙的合成方法上的不足,我们选择式(I)结构的化合物17α-羟基-1,4,9-三烯-孕甾-3,20-二酮为起始物,经过溴化、还原、溴代和置换反应,可以得到泼尼松龙醋酸酯。
反应方程式如图2所示。
1.实验部分
1.1 实验方法
向三口瓶中加入原料(I)10g和50mL丙酮、20mL冰醋酸,搅拌,降温至0℃,在30min内加入溶解了9g NBS的丙酮30mL,在5℃~10℃下反应2h。蒸出丙酮。然后加入30mL~50mL乙醚,缓慢加入锌粉,在室温下进行还原2h。TLC反应结束后继续搅拌15min。
向反应器1中加入0.2g催化剂AlCl3,-5℃~0℃下搅拌,30min内缓缓加入包含溴5.5g的乙醚溶液30mL;保持反应温度不变,反应2h。加入氢氧化钠调节pH到中性,则锌盐生成沉淀析出,将溶液过滤除去不溶物,以丙酮洗涤沉淀,向滤液中继续加入氢氧化钠14g、三乙胺3mL并加热回流反应3h。搅拌下以盐酸调节pH至中性,将反应物过滤,滤液倾入1200mL冰水中,过滤,洗涤,减压干燥后获得白色粉末11.0g,总收率89%,HPLC积分计算纯度为99.3%。
1.2 结果与讨论
以式I化合物为原料,进行溴化,制备式II化合物,所述溴化过程可以使用有机合成中溴化双键可以为二溴海因、N-溴代乙酰胺、N-溴代琥珀酰亚胺,优选N-溴代琥珀酰亚胺(NBS)。制备式III化合物,所述脱溴过程可以使用具有选择性的还原剂和还原条件,所述试剂和条件下羰基和羰基α位的双键不被还原。每步中甾体化合物都几乎定量地转化,副产物和其他试剂溶于水,产物醋酸泼尼松龙不溶于水,因此后处理工艺极为简单,只需调节反应液pH到中性,过滤。滤液加入水中,过滤,洗涤沉淀,即可获得醋酸泼尼松龙。本工艺反应步骤少,收率高,在同一反应器中即可完成,原料成本低,物料利用率高,无须分离纯化中间体,产品的分离纯化操作简单,适合工业生产。
参考文献
[1]李光辉.醋酸潑尼松龙结合维生素B12治疗神经性皮炎疗效观察.中国学校卫生,2011,32(6):761.
[2] Raphael Campagna, Eric Pessis, Henri Guerini, Antoine Feydy, Jean-Luc Drapé. Occurrence of coring after needle insertion through a rubber stopper: study with prednisolone acetate. European Radiology, 2013, 23(2): 424-427.
[3] Baraldi PG, Romagnoli R, Del Carmen Nu?ez M, Perretti M, Paul-Clark MJ, Ferrario M, Govoni M, Benedini F, Ongini E., Synthesis of Nitro Esters of Prednisolone, New Compounds Combining Pharmacological Properties of Both Glucocorticoids and Nitric Oxide,J. Med. Chem., 2004, 47 (3): 711–719.
[4] Bílková E, Imramovsk? A, Sedlák M., Recent advances in the design and synthesis of prednisolone and methylprednisolone conjugates.Curr Pharm Des. 2011, 17(32): 3577-3595.
[5] Hong D, Heiman AS, Kwon T, Lee HL, Synthesis of 6-(methoxycarbonyl)prednisolone and its derivatives as new antiinflammatory steroidal antedrugs. Journal of pharmaceutical sciences, 1994(83): 357-361.
[6]张文权,崔励,郑桂兰,等.生物转化法合成16α-羟基泼尼松龙的发酵工艺研究[J].生物技术,2012,22(3):81-86.
[7]路福平,别松涛,杜连祥,等.醋酸泼尼松龙的生产方法,CN101210259,2009.
[8]陈立营,陈松,赵琳.一种甾体药物中间体的生物脱氢制备方法,CN101760496A,2010.
[9]李金禄,李桢,赵友惠.泼尼松龙及其衍生物的制备,CN101397324,2009.

