枳壳发酵炮制前后的成分变化及工艺优化
张栋健,李 薇,梁之桃,简宏良,黄传奇,何钧恒[.广州中医药大学中药学院,广州 50405;.香港浸会大学中医药学院,香港中国;.余仁生(香港)有限公司,香港中国]
枳壳发酵炮制前后的成分变化及工艺优化
张栋健1*,李 薇1#,梁之桃2,简宏良1,黄传奇1,何钧恒3[1.广州中医药大学中药学院,广州 510405;2.香港浸会大学中医药学院,香港中国;3.余仁生(香港)有限公司,香港中国]
目的:比较枳壳发酵炮制前后的成分变化并优化其发酵炮制工艺。方法:采用超高效液相色谱法对同一批枳壳药材及其发酵炮制品进行比较,确定枳壳发酵炮制后的色谱特征峰;以4个色谱特征峰的峰面积和样品霉变性状为指标,以发酵温度、发酵湿度、发酵时间为因素,设计L9(34)正交试验优化枳壳发酵炮制工艺并进行验证。结果:枳壳经发酵炮制后明显产生2个单糖苷新成分;优化的枳壳发酵工艺为发酵温度30℃、发酵湿度70%、发酵时间7 d;验证试验结果显示,3次试验各指标的RSD均小于2.0%(n=3)。结论:发酵炮制可致枳壳发生明显的化学成分变化,优化的发酵炮制工艺可增加枳壳特征峰成分含量。
枳壳;发酵炮制;正交试验;超高效液相色谱法;色谱特征峰;霉变性状;工艺优化
枳壳是中医临床常用的一种药材。2015年版《中国药典》(一部)收载的枳壳为芸香科植物酸橙(Citrus aurantium L.)及其栽培变种的干燥未成熟果实,经洗净、润透后切薄片作饮片用,具有行气宽中、消食化痰之功效,可用于胸腹满闷胀痛、食积不化、痰饮、胃下垂、脱肛、子宫脱垂等的治疗[1]。
粤港地区的传统枳壳饮片炮制沿袭于文献[2]中记载的枳壳蒸切炮制方法,并收载于1984年版《广东省中药炮制规范》[3]中,即取原药材,去核及瓤,加水浸透,待发酵后蒸至紫褐色,切片即可。这种发酵后使用的枳壳饮片经实践证明疗效较好,故被临床医师延用至今。该发酵饮片有别于历版《中国药典》收载的炮制方法,是一种地方特色饮片。
目前对枳壳发酵炮制研究较少,虽然已有研究不同发酵时间对樟帮枳壳饮片质量影响的报道[4],并指出饮片色度差与柚皮苷、新橙皮苷有效成分存在显著相关性,但对枳壳发酵炮制前后的成分变化目前尚未见文献报道。发酵是微生物对有机物的一种分解过程,可产生丰富的次生代谢产物,应用于中药炮制有多方面的优势,如降低毒性、增强疗效、产生新的活性成分和提高有效成分萃取率及含量等[5-7]。因此,研究枳壳发酵炮制前后成分变化及优化其发酵炮制工艺具有较大的意义。本研究利用超高效液相色谱法(UPLC)[8]对同一批枳壳药材及其炮制品进行研究,探讨枳壳发酵炮制前后成分变化;并采用正交试验[9],以枳壳发酵炮制饮片的色谱特征峰和霉变性状为指标,优化枳壳发酵炮制工艺。本研究旨在为推进此项炮制工艺的规范化、饮片品质的稳定性提供参考,也为继承和发展此项具有地方特色的枳壳饮片炮制方法提供依据。
1 材料
1.1 仪器
Acquity UPLC仪(美国Waters公司);MT5电子天平(瑞士Mettler-Toledo公司);100B恒温恒湿培养箱(金坛市城西峥嵘实验仪器厂)。
1.2 药材、对照品与试剂
枳壳(四川新荷花中药饮片厂,批号:D1301099,产地:四川,经广州中医药大学李薇教授鉴定为芸香科植物酸橙的干燥未成熟果实);柚皮苷、橙皮苷、新橙皮苷对照品(中国食品药品检定研究院,批号分别为:110722-200610、110721-201115、111857-201102,纯度分别为:98%、95.3%、99.6%);甲醇、乙腈为色谱醇,乙醇、磷酸为分析纯,水为去离子蒸馏水。
2 方法与结果
2.1 样品的制备
2.1.1 枳壳原药材 取枳壳药材100 g磨粉,过20目筛。2.1.2 粤港枳壳饮片 取同批枳壳药材1 000 g,洗净,加水1 L浸透,装入麻袋,自然室温(温度约18~30℃,湿度约70%~90%)发酵至长满菌丝(约5 d),取出洗净,蒸3 h,闷12 h,至内部呈紫褐色时取出,切片,置于烘箱50℃干燥。取100 g磨粉过20目筛。
2.1.3 枳壳饮片对照品 取同批枳壳药材1 000 g,洗净,加水1 L浸透,从“蒸3 h”起,其余操作同“粤港枳壳饮片”。
2.2 对照品溶液的制备
精密称取对照品柚皮苷4.0 mg、橙皮苷2.4 mg、新橙皮苷3.0 mg,分别用甲醇溶解并定容,分别得0.4、0.24、0.3 mg/mL的对照品溶液。
2.3 供试品溶液的制备
精密称取样品粉末0.20 g,置于50 mL离心管中,加入50%乙醇20 mL,超声(240 W)30 min,离心5 min(3 000 r/min,离心半径为16 cm),用0.45 μm微孔滤膜滤过,即得。
2.4 UPLC色谱条件
色谱柱:Water Acquity UPLC BEH C18(50 mm×2.1 mm,1.7 μm);流动相:乙腈-0.1%磷酸溶液(15∶85,V/V);流速:0.7 mL/min;柱温:30℃;进样量:0.5 μL;检测波长:224 nm。
2.5 精密度试验
分别取“2.2”项下3种对照品溶液,连续进样5次,计算峰面积及保留时间的RSD。结果,峰面积的RSD均小于5.0%(n=5),保留时间的RSD均小于2.0%(n=5)。
2.6 重复性试验
按“2.3”项下方法制备5份粤港枳壳饮片的供试品溶液,进样、记录色谱图。以“2.7”项中图1B的1、2、3、4号峰为考察对象,计算峰面积及保留时间的RSD。结果,4个峰峰面积的RSD均小于5.0%(n=5),保留时间的RSD均小于2.0%(n=5)。
2.7 样品分析
取“2.1”项下3种样品制备的供试品溶液和“2.2”项下3种对照品溶液,进样、记录色谱图。以3种对照品为对照,对枳壳发酵炮制前后的成分进行比较,得到UPLC图谱见图1。
从图1可知,橙皮苷在枳壳色谱图中的峰很小,即含量较低。因此本研究采用图中的1、2、3、4号峰的峰面积为考察对象,比较枳壳发酵炮制前后成分的变化。结果显示,经过发酵后的炮制饮片(图1B),明显出现3、4号峰。
2.8 粤港枳壳饮片UPLC特征峰图谱建立
参考《香港中药材标准》附录Ⅻ指纹图谱的建立方法[10],根据参照峰的保留时间,标定各特征峰的相对保留时间。选定指标成分即柚皮苷(1号)峰为参照峰(峰面积最大),则各特征成分峰的保留时间除以参照峰保留时间,即得粤港枳壳饮片4个特征峰1、2、3、4号峰的相对保留时间平均值分别为1.00、1.65±0.01、0.84± 0.01、1.39±0.01(n=5)。
2.9 枳壳发酵炮制工艺优化
2.9.1 因素与水平的确定 粤港枳壳饮片发酵炮制常受自然环境温度、湿度和发酵时间的影响,通常发酵时间是3~7 d。在上述试验的基础上,以粤港枳壳饮片UPLC图谱中4个特征峰的峰面积、霉变性状为评价指标,以发酵温度(A,℃)、发酵湿度(B,%)、发酵时间(C,d)为因素,对枳壳传统发酵炮制工艺进行L9(34)正交试验。因素与水平见表1。
2.9.2 样品霉变性状评分标准的确定 粤港枳壳饮片传统发酵程度一般是通过直接观察样品霉变性状进行判断,以样品全部布满白色菌丝为最高分,再按霉变程度设定分值,具体评分标准见表2。
2.9.3 正交试验设计与结果 取枳壳1 000 g,洗净,加水1 L浸透,装入麻袋,依正交设计的因素、水平分别在恒温恒湿培养箱中对样品进行发酵处理后,取出洗净,蒸3 h,其余同“2.1”项下“粤港枳壳饮片”方法处理。再按“2.3”项下方法将饮片制备成供试品溶液,进样,记录色谱峰面积,结果见表3。方差分析结果见表4。
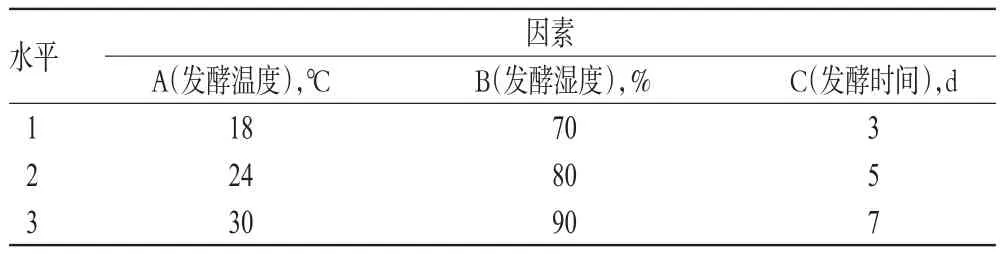
表1 因素与水平Tab 1 Factors and levels

表2 样品霉变性状评分标准Tab 2 Scoring criteria of samples’mildew characteristics

表3 正交试验设计与结果Tab 3 Design and results of orthogonal test
综合5个指标,从趋势及因素主次可见A因素对1、2、3号峰峰面积和霉变性状评分影响均最大,C因素对4号峰峰面积影响最大;A3在5个指标均最大,故A取A3。C3在1、2、3、4号峰峰面积4个指标中最大,虽在霉变性状分值中不是最大,但与最好的C2接近,故C确定为C3。B1在1、2、4号峰的峰面积中最大,虽在3号峰上不是最大,但与最好的B2接近,故B确定为B1。由此得出最优工艺条件为A3B1C3,即发酵温度30℃、发酵湿度70%、发酵时间7 d。
2.9.4 验证试验 对上述A3B1C3工艺进行3次验证试验,结果见表5。
由表5可见,4个峰的峰面积值均较大,提示特征峰成分的含量较高;同时,霉变性状分值较高;且5个指标的RSD均小于2.0%(n=3),表明优化的工艺稳定、可行。
3 讨论
通过对同一批次的枳壳药材及其炮制饮片的UPLC图谱进行比较,发现未发酵的枳壳饮片对照品未见3、4号峰,而经发酵后的粤港枳壳饮片明显产生了新成分3、4号峰,证明3、4号峰是枳壳经微生物发酵后产生的新成分,由此可提示粤港枳壳饮片的炮制方法是有物质基础的,可为其炮制机制的研究提供科学依据。
鉴于发酵炮制可使枳壳产生明显的化学成分变化,因此,优化枳壳发酵炮制工艺、提升其炮制质量,对此特色饮片的生产和临床使用有重要意义。故笔者利用恒温恒湿培养箱来控制发酵的温度和湿度,对发酵的炮制工艺进行了优化,最终认为发酵温度和时间对结果影响较大,而发酵湿度对结果影响不大。故在枳壳发酵炮制过程中要重点考虑发酵温度,其次考虑发酵时间。

表4 方差分析结果Tab 4 Variance analysis results
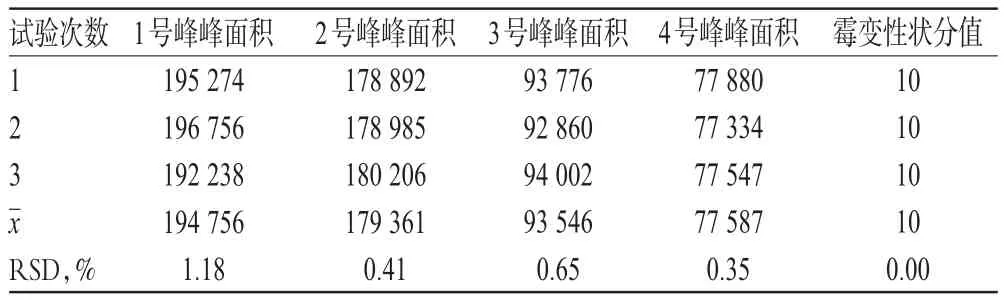
表5 验证试验结果Tab 5 Results of verification test
为进一步探讨粤港枳壳饮片的发酵炮制机制,笔者以采用最优发酵炮制工艺的炮制样品为基础,另采用UPLC附超高解析质量精确度四极杆飞行时间质谱仪分析比较其炮制前后成分的变化[11]。结果发现,枳壳经发酵炮制后,产生圣草酚-7-O-葡糖苷(单糖苷)、橙皮素-7-O-葡萄糖苷(单糖苷)、5-去甲基川陈皮素等3个新生成分,并可显著增加柚皮素(苷元)和橙皮素(苷元)成分,以及明显增加柠檬苦素、Sudachinoid A、黄柏酮酸、诺米林酸等柠檬苦素类衍生物成分的生成。推测本试验中的3、4号峰分别可能是圣草酚-7-O-葡萄糖苷和橙皮素-7-O-葡萄糖苷成分。
圣草酚-7-O-葡萄糖苷是新北美圣草苷脱去1个鼠李糖的单糖苷,橙皮素-7-O-葡萄糖苷是橙皮苷或新橙皮苷脱去1个鼠李糖的单糖苷。由于黄酮类糖苷在小肠中需要通过脱糖基化作用才能被吸收[12],故此发酵作用可将新北美圣草苷、橙皮苷和新橙皮苷这类黄酮类糖苷脱去糖基转化为单糖苷或苷元,可使其极性减小、脂溶性增加,利于通过小肠吸收进入血液循环,较快达到所需血药浓度并发挥其药效作用[13]。还有研究发现,橙皮苷经橙皮苷酶水解后产生的单糖苷和苷元可以改善橙皮苷的生物利用度[14]。综上,粤港枳壳饮片经发酵炮制后可能通过增加活性成分的生物利用度而增强了其临床疗效。
[1] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:246.
[2] 王孝涛.历代中药炮制法汇典:现代部分[M].南昌:江西科学技术出版社,1989:243.
[3] 广东省卫生厅.广东省中药炮制规范[S].1984:145.
[4] 方小华,谢一辉,姚冬琴,等.不同发酵时间对樟帮枳壳饮片质量的影响[J].中国实验方剂学杂志,2012,18(9):17-19.
[5] 张丽霞,高文远,王海洋.微生物技术在中药炮制中的应用[J].中国中药杂志,2012,37(24):3695-3699.
[6] 汪洋,汪德刚,张世新,等.中药微生态发酵技术研究进展与展望[J].中国动物保健,2014,16(9):22-25.
[7] 耿欣.微生物发酵中药功效浅析[J].中医药信息,2011,28(4):149-150.
[8] 石俊敏,李绍平,王一涛,等.超高效液相色谱在药物分析中的应用[J].药物分析杂志,2008,28(9):1583-1588.
[9] 高军,刘富春.正交试验优选枳实中柚皮苷的提取工艺[J].中国药房,2014,25(35):3291-3293.
[10] 香港卫生署.香港中药材标准:第四册[S].香港:香港卫生署,2012:A35.
[11]张栋健,李薇,何庆文,等.UHPLC-Q-TOF-MS分析枳壳前后成分变化[J].中国中药杂志,2016,41(11):2070-2080.
[12] Németh K,Plumb GW,Berrin JG,et al.Deglycosylation by small intestinal epithelial cell beta-glucosidases is a critical step in the absorption and metabolism of dietary flavonoid glycosides in humans[J].Eur J Nutr,2003,42(1):29-42.
[13] 徐萌萌,王建芳,徐春,等.微生物转化苷类中药的机理及应用[J].世界科学技术:中医药现代化,2006,8(2):24-26.
[14] Nielsen IL,Chee WS,Poulsen L.Bioavailability is improved by enzymatic modification of citrus flavonoid hesperidin in humans:a randomized,double-blind,crossover trial[J].J Nutr,2006,136(2):404-408.
(编辑:刘 萍)
Composition Changes of Aurantii Fructus before and after Fermentation Processing and Its Technology Optimization
ZHANG Dongjian1,LI Wei1,LIANG Zhitao2,JIAN Hongliang1,HUANG Chuanqi1,HE Junheng3[1.School of Pharmacy,Guangzhou University of Chinese Medicine,Guangzhou 510405,China;2.School of Chinese Medicine,Hong Kong Baptist University,Hong Kong,China;3.Eu Yan Sang(Hong Kong)Ltd.,Hong Kong,China]
OBJECTIVE:To compare the composition changes of Aurantii fructus before and after fermentation processing and optimize its fermentation processing technology.METHODS:UPLC was conducted to compare the raw and fermentation processed products of same batch of Aurantii fructus,and ensure the chromatographic peaks after fermentation processing.Using peak areas of 4 chromatographic peaks and mildew characteristics of samples as index,fermentation temperature,humidity and time as factor,L9(34)orthogonal test was designed to optimize the fermentation processing technology,and verified it.RESULTS:After fermentation processing,Aurantii fructus obviously showed 2 new monosaccharide glycosides components;the optimized fermentation technology was as follows as fermentation temperature of 30℃,humidity of 70%and time of 7 d;verification test results showed RSD of each indicator of decoction pieces prepared by optimized fermentation technology in 3 tests were lower than 2.0%(n=3). CONCLUSIONS:Fermentation processing may lead obvious chemical composition changes in Aurantii fructus;the optimized fermentation processing technology can increase the contents of characteristic peaks.
Aurantii fructus;Fermentation processing;Orthogonal test;UPLC;Characteristic peak;Mildew characteristic;Technology optimization
R283
A
1001-0408(2017)07-0971-04
2016-06-26
2016-08-27)
*博士研究生。研究方向:中药品种鉴定、中药饮片质量控制。电话:00852-96557640。E-mail:tkcheungtony@gmail.com
#通信作者:教授,博士生导师,博士。研究方向:中药鉴定及品质评价。E-mail:liwei-li@163.com
DOI10.6039/j.issn.1001-0408.2017.07.31

